2. 南方医科大学 南方医院妇产科生殖医学中心,广东 广州 510515
2. Reproductive Medical Center, Department of Obstetrics and Gynecology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
艾滋病(AIDS)由人类免疫缺陷病毒(HIV)引起的一种免疫能力丧失的传染性疾病,严重威胁着人们的生命和健康。根据2016年联合国艾滋病规划署的报告,2015年全球仍有约3700万人处在HIV感染携带状态,约210万人新感染HIV [1],其中80%新感染病例来自性传播,性传播已成为HIV最主要的传播途径[2]。在性传播中,精液淀粉样纤维能显著地增强HIV的感染[3-7]。这些淀粉样纤维主要由精液中天然存在的多肽聚合形成,其中由前列腺酸性磷酸酶(PAP)裂解的第248-286位氨基酸组成的多肽片段(PAP248-286) 自我组装形成的淀粉样纤维,是最主要的成分,PAP248-286聚合形成的淀粉样纤维也被称为精液来源的病毒增强因子(SEVI)。精液中含有大量能够形成淀粉样纤维的游离多肽(约30 μg/mL),它们会不断地自我组装形成淀粉样纤维。若能抑制游离多肽形成淀粉样纤维,就能减少精液中淀粉样纤维的含量,减弱精液促进病毒感染的作用,这在HIV性传播过程中是很关键的。虽然性传播是感染HIV的主要途径,但异性传播的感染率却很低,200~2000次性交才有1次机会感染HIV[8-9]。阴道分泌液(VS)呈酸性(pH3.7~4.5),可保护女性阴道,抵御包括HIV在内的各种感染病原体的入侵,其产生的乳酸(LA)是主要成分[10]。乳酸在生理浓度能特异性杀灭HIV,其活性并不依赖其酸度,在HIV性传播起保护作用[10-13]。
我们前期研究表明,阴离子化合物如ADS-J1通过静电相互作用,可结合带正电荷的多肽PAP248-286,从而抑制淀粉样纤维的形成并拮抗其介导的增强HIV-1的能力[7]。带有羧酸根的乳酸分子很有可能通过静电作用结合多肽PAP248-286,从而抑制精液淀粉样纤维的形成。为此,本课题将探讨具有抗病毒活性的乳酸其抑制精液淀粉样纤维形成的作用,为预防HIV性传播提供新思路。本研究采用多种生物物化方法,如硫磺素T法、刚果红染色法、圆二色谱法、透射电镜观察法及病毒感染实验,从不同角度全方位地揭示乳酸对多肽PAP248-286形成淀粉样纤维SEVI的影响。
1 材料和方法 1.1 材料 1.1.1 细胞与质粒TZM-bl细胞株由本实验室保存;感染性克隆病毒CCR5受体嗜性的SF162质粒、CXCR4受体嗜性的NL4-3质粒和双嗜性的NL4-3 and 81A质粒由乌尔姆大学Jan Münch教授惠赠。
1.1.2 试剂乳酸(美国阿拉丁公司);多肽PAP248-286 (纯度大于95%)(北京中科亚光生物科技有限公司);刚果红试剂、硫磺素T (Sigma);电镜碳膜铜网(上海主流贸易有限公司);3%磷钨酸(上海君瑞生物技术有限公司);转染试剂聚乙烯亚胺(PEI)(上海起福生物科技有限公司);细胞裂解液和荧光素酶检测试剂盒(Promega)。
1.1.3 实验仪器Thermomixer恒温震荡仪(德国Eppendorf公司);圆二色谱仪(JASCO);透射电子显微镜(日本日立公司);Genios Pro型酶标仪(Tecan);生物安全柜(新加坡ESCO公司);PlexArray HT (V3版)分子相互作用分析仪(Plexera)。
1.2 实验方法 1.2.1 阴道分泌液样本的采集健康的志愿女性用月经杯获取阴道分泌液,将月经杯置入离心管中,2000 r/min室温离心15 min,收集离心下来的分泌液,分装,-20 ℃保存备用[14]。
1.2.2 硫磺素T (ThT)染色法硫磺素T工作液的制备:硫磺素T溶解到磷酸缓冲液(PBS)中,配成1 mmol的母液,0.22 μm滤膜过滤,分装,用PBS稀释成50 μmol的工作液使用。多肽PAP248-286(2 mg/mL)和不同浓度的乳酸/阴道分泌液混匀,置于37 ℃振荡器中在1400 r/min转速下反应,不同时间点(2、4、24、48 h)取样10 μL;与190 μL硫磺素T工作液在暗处混匀,立即用荧光酶标仪测定荧光强度,激发波长为440 nm,发射波长为482 nm。
1.2.3 刚果红染色法多肽PAP248-286 (2 mg/mL)和不同浓度的乳酸/阴道分泌液混匀,置于37 ℃振荡器中在1400 r/min转速下反应,不同时间点(2、4、24、48 h)取样10 μL;样品与90 μL刚果红工作液混合均匀,暗处孵育2 min;10 000 r/min室温离心5 min,彻底吸干上清,沉淀用50 μL DMSO溶解,然后转移至96半孔板,测定吸光度(测量波长A490 nm,参比波长A650 nm)。
1.2.4 圆二色谱法多肽PAP248-286(2 mg/mL)和乳酸(0、0.25、1 mg/mL)混匀,置于37 ℃振荡器中在1400 r/min转速下反应,在48 h取样;利用圆二色谱仪采集样品数据,数据采集过程:首先将样品稀释至300 μg/mL,加入到专用比色皿中,比色皿光路为0.1 cm,扫描波长设定为200~280 nm,波长间隔0.2 nm,扫描速度为100 nm/min,平均扫描3次,样品图谱减去PBS溶液空白图谱。
1.2.5 透射电子显微镜(TEM)观察法多肽PAP248-286 (2 mg/mL)和乳酸(0、0.25、1 mg/mL)混匀,置于37 ℃振荡器中在1400 r/min转速下反应,在48 h取样;用PBS稀释样品至300 μg/mL,滴于铜网上,2 min后用滤纸吸去多余液体,磷钨酸(3%,pH7.0) 染色2 min,用滤纸吸去多余液体并用超纯水洗1次,铜网自然干燥,用电镜观察淀粉样纤维形成情况。
1.2.6 病毒感染实验 1.2.6.1 感染性克隆病毒的制备293TX细胞接种于平皿,接种密度为3×105/mL,37 ℃培养至80%密度;转染前1 h更换新鲜含10% FBS的DMEM培养基,采用PEI转染试剂转染R5嗜性、X4嗜性及X4R5嗜性的3种克隆病毒质粒,质粒与PEI按1:3 (质量与体积比)在空白培养基中混合均匀,室温孵育30 min,然后慢慢滴加到细胞中;转染16 h后,更换新鲜含10% FBS的DMEM培养基;24 h后,收集细胞上清,过滤,分装,置于-80 ℃冰箱,备用。
1.2.6.2 病毒滴度测定TZM-bl细胞接种于96孔板,1× 104/孔,100 μL/孔,37 ℃培养过夜;空白培养基2倍倍比稀释病毒液6个浓度,50 μL/孔加到细胞中,每孔补加50 μL空白培养基,以细胞孔作为空白对照,培养48 h后,利用荧光素酶检测试剂盒检测病毒滴度:弃细胞培养上清,用PBS清洗1次,加入50 μL/孔细胞裂解液,裂解20 min,取30 μL/孔细胞裂解液至96孔白色平底荧光素酶检测板中,每孔加入50 μL荧光素酶底物,立即用酶标仪测定荧光值。
1.2.6.3 SEVI增强病毒感染能力的测定多肽PAP248-286 (2 mg/mL)和不同浓度的乳酸混匀,置于37 ℃振荡器中,在1400 r/min转速下反应,不同时间点(2、4、24、48 h)取样;TZM-bl细胞接种于96孔板,37 ℃培养过夜;样品5000 r/min室温离心10 min,弃上清,空白培养基重悬样品,60 μL病毒(12 ng/孔,以p24计算)与60 μL样品混合,室温放置5 min,将100 μL混合液加入细胞中,感染3 h后更换新鲜培养基;48 h后,弃去培养基,PBS洗涤1次,利用荧光素酶检测试剂盒检测化学发光,计算病毒感染增强倍数。
1.2.7 表面等离子共振(SPR)5 mmol乳酸固定在3D光交联芯片上;不同浓度多肽PAP248-286 (12.5、25、50、100 μmol)作为流动相,缓冲液为PBS,多肽PAP248-286以2 μL/s速度进样,结合温度为25 ℃,结合时间300 s;结合完后解离300 s,实验完成后对芯片进行重生,重生液为Glycine Glycine Glycine Glycine Glycine-HCl (PH=2.0),重生液流速3 μL/s,重生时间300 s;实验数据采用PlexeraDE软件进行分析。
2 结果 2.1 乳酸抑制多肽PAP248-286形成淀粉样纤维SEVI刚果红和硫磺素T是最常用的两个特异性与淀粉样纤维结合的分子探针,刚果红与淀粉样纤维结合后吸光值增强,而硫磺素T与淀粉样纤维结合后荧光增强,两个染料与多肽或寡聚体均不结合。利用这两种探针可以观察淀粉样纤维的生长曲线,我们分别利用刚果红(图 1A)和硫磺素T (图 1B)两种小分子探针检测乳酸对多肽PAP248-286纤维化过程的影响。两种小分子探针实验结果表明,浓度为2 mg/mL的多肽PAP248-286约在3 h吸光度/荧光强度开始增加,并且随着时间的增加吸光度/荧光强度逐渐增加,说明多肽PAP248-286逐渐形成淀粉样纤维,并且淀粉样纤维的量逐渐增加。48 h内,吸光度/荧光强度曲线呈S型。当加入不同浓度的乳酸后,结果显示纤维的吸光度/荧光强度随乳酸剂量依赖性地减少,0.5 mg/mL乳酸处理的多肽PAP248-286,在48 h,吸光度/荧光强度接近本底值。硫磺素T和刚果红染色法的结果基本一致,乳酸可剂量依赖性地抑制PAP248-286纤维化的过程。
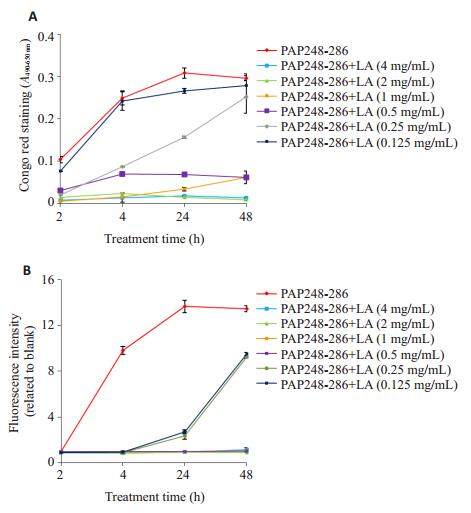
|
图 1 乳酸抑制PAP248-286纤维化的量效关系曲线 Figure 1 Dose-effect curve of the inhibition of fibril formation of PAP248-286 mediated by lactic acid (LA) (n=3, Mean±SD). |
淀粉样纤维以β-片层结构为主,其在圆二色谱220 nm处有一个特征吸收负峰,我们通过圆二色谱法考察乳酸是否抑制PAP248-286形成β-片层结构。结果表明(图 2),在48 h时,单纯PAP248-286组和低浓度乳酸组(0.25 mg/mL)在220 nm附近有明显的圆二色谱信号,表明样品中已形成含β-片层结构的淀粉样纤维SEVI,而在1 mg/mL乳酸的情况下,220 nm附近未出现吸收峰,没有形成β-片层结构,即未形成淀粉样纤维SEVI。上述结果说明,乳酸可抑制PAP248-286形成β-片层结构,即抑制了淀粉样纤维SEVI的形成。
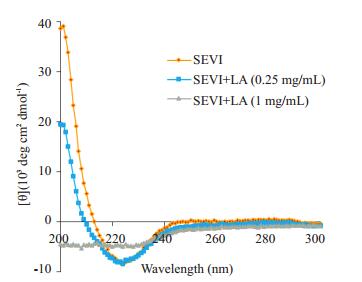
|
图 2 圆二色谱法观察乳酸对PAP248-286 β-片层结构形成的影响 Figure 2 β-sheet structure formation of PAP248-286 in the presence of lactic acid measured by CD spectra. |
采用TEM对纤维形态进行观察。在48 h时,单纯多肽PAP248-286已经纤维化,镜下满视野都能看到大团的淀粉样纤维,0.25 mg/mL乳酸处理的多肽PAP248-286仅形成很少的细短的纤维,1 mg/mL乳酸处理的多肽PAP248-286未纤维化,在视野里完全观察不到淀粉样纤维(图 3)。
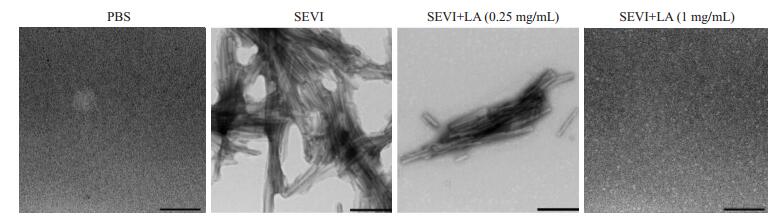
|
图 3 乳酸抑制PAP248-286形成淀粉样纤维的透射电镜图 Figure 3 Transmission electron microscopic analysis of inhibition of lactic acid on Fibril formation of PAP248-286 (Original magnification: ×20 000). |
单纯PAP248-286的样品中,其增强HIV-1SF162感染能力随时间增加而逐渐增强,增强倍数从2 h时的2~3倍增加至48 h时的150倍,也即说明多肽PAP248-286随着时间的增加,逐渐形成了淀粉样纤维,而且随着时间的推移,淀粉样纤维的量不断增多;但加入不同浓度的乳酸后,PAP248-286的样品中,其增强HIV-1SF162感染能力同样随时间增加而增强,但增强倍数浓度依赖性地减少,说明了乳酸浓度依赖性的抑制淀粉样纤维的形成,0.5 mg/mL乳酸处理的PAP248-286样品,在48 h内增强倍数接近零,说明该样品几乎没有形成淀粉样纤维(图 4),在另外两株不同嗜性的HIV-1中得到相似的结果,而且检测浓度范围内的乳酸,均对TZM-bl细胞不显毒性作用。
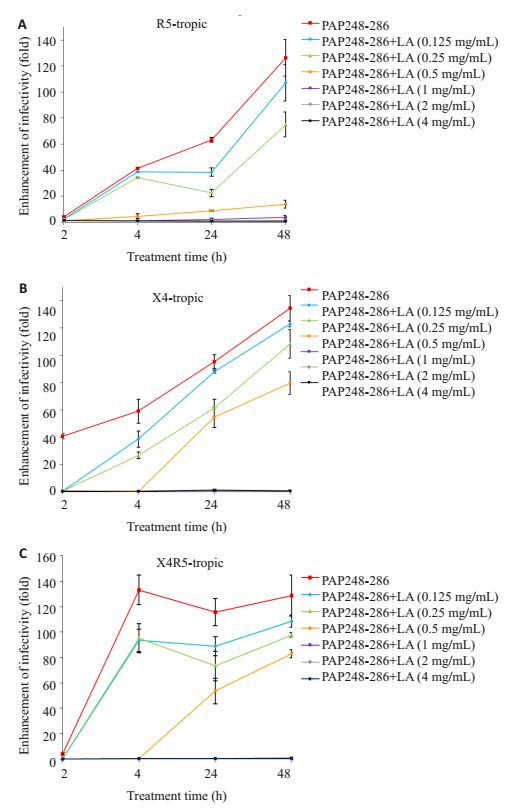
|
图 4 不同浓度乳酸存在下SEVI促进病毒感染的能力 Figure 4 Enhancing effect of SEVI formed in different concentrations of lactic acid on infection by R5 tropic HIV-1SF162 (n=3, Mean±SD). |
我们采用表面等离子共振技术(SPR)观察两者是否有相互结合。实验结果如图 5所示,12.5 μmol的多肽PAP248-286进样250 s后出现了响应信号,信号值达300 RU,并且快速达到了平衡,说明乳酸和PAP248-286发生了结合并快速达到了平衡;当缓冲溶液代替样品溶液流过芯片表面,结合在芯片表面的PAP248-286逐渐的被解离,响应信号逐渐回到基线位置。我们利用PlexeraDE软件对实验结果进行数据拟合,得到结合速率常数ka=246 L·mol/s,解离速率常数kd=7.43×10-3/s,亲和常数KD=2.38×10-5 mol/L,表明乳酸和多肽PAP248-286有较高的亲和性,同时乳酸和多肽PAP248-286结合的信号强度随多肽浓度的增加而增强,提示两者相互作用具有一定的特异性。
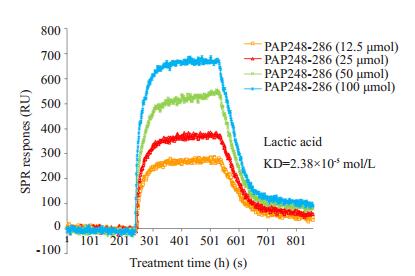
|
图 5 SPR检测乳酸和多肽PAP248-286的相互作用 Figure 5 Interaction between lactic acid and PAP248-286 detected by SPR. |
采集3位志愿的健康女性的阴道分泌液,其基本形状均为无色透明黏状液,呈酸性,pH3.8~4.1。我们把3份分泌液混合均匀,我们分别利用刚果红和硫磺素T两种小分子探针检测阴道分泌液对多肽PAP248-286纤维化过程的影响。刚果红实验(图 6A)结果表明,浓度为2 mg/mL的多肽PAP248-286约在2 h后开始有吸光度,并且随着时间的推移吸光度逐渐增加,24 h后吸光度出现平台期,并且达最大值。说明多肽PAP248-286逐渐形成淀粉样纤维,并且淀粉样纤维的量逐渐增加,24 h形成了最大量的淀粉样纤维。当加入不同量的阴道分泌液后,纤维的吸光度呈剂量依赖性地减少,含67%阴道分泌液的多肽PAP248-286的吸光度接近本底值,说明该处理组的多肽PAP248-286几乎没有形成淀粉样纤维。硫磺素T实验得到了类似的结果(图 6B)。以上两个结果表明,阴道分泌液能抑制多肽PAP248-286纤维化,从而抑制了淀粉样纤维的形成,并且具有量效关系。
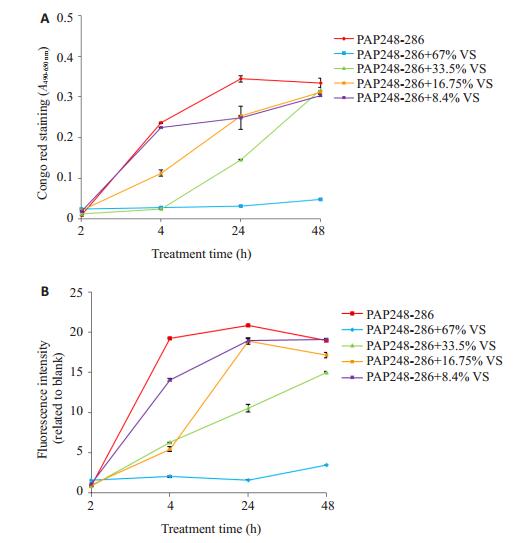
|
图 6 阴道分泌液抑制PAP248-286纤维化的量效关系曲线 Figure 6 Dose-effect curve of inhibition of fibril formation of PAP248-286 mediated by vaginal secretion (n=3, Mean±SD). |
在性传播过程中,精液淀粉样纤维能够显著促进HIV的感染[5, 15],增加HIV性传播的风险,因此本文探究了乳酸体外对精液淀粉样纤维形成的影响。我们采用刚果红染色法、硫磺素T染色法、透射电子显微镜观察法、圆二色谱法及病毒感染实验进行研究,结果显示0.5~1 mg/mL的乳酸能抑制2 mg/mL多肽PAP248-286形成淀粉样纤维SEVI,并使SEVI失去促进病毒感染的能力。在阴道分泌液中,乳酸的生理浓度约为56 mmol (约5 mg/mL) [16],说明正常生理情况下阴道分泌液中的乳酸含量是可以抑制淀粉样纤维的形成。我们也在临床女性的阴道分泌液样本中进行了验证,阴道分泌液能有效抑制多肽PAP248-286形成淀粉样纤维SEVI,其抑制效果随阴道分泌液含量的增加而增强。
在圆二色谱实验中,我们发现1 mg/mL乳酸处理的多肽PAP248-286,β-片层结构的吸收峰220 nm附近并没有出现信号,表明乳酸抑制了PAP248-286形成β-片层结构。Tang等人的研究中,乳酸通过抑制两个相对分子质量为43 000亚基的聚集使得肌酸激酶无法形成天然构象的蛋白质结构,使其失活[11, 17]。通常来说,单体多肽PAP248-286聚集形成二级结构中的β-片层结构才能形成淀粉样纤维,因此,乳酸抑制淀粉样纤维形成很有可能是因为乳酸与单体多肽PAP248-286结合,改变其构象,使其不能正常自我组装形成淀粉样纤维,在SPR实验中我们发现乳酸和多肽PAP248-286的结合具有一定的特异性,但具体作用机制有待进一步证明。
阴道分泌液可以减少性传播疾病的发生,在性交时作为润滑剂最大程度减少上皮的物理损伤,更重要的是作为第一防线抵御HIV等病原体的入侵:它可以粘附HIV,阻碍病毒的扩散;所含的乳酸可特异性地杀灭HIV [11, 18-19]。罹患阴道炎的女性和性工作者,由于致炎菌的生长,女性阴道优势菌群乳酸杆菌减少,乳酸分泌量降低,导致阴道分泌液的pH值较健康女性的高[20-21]。阴道分泌液pH值增大,HIV可更快地穿过稀薄的分泌液,到达上皮组织,增大感染靶细胞的几率[18, 22-23],同时由于乳酸可特异性地杀灭HIV,乳酸含量的减少降低了其杀HIV的能力,因此,阴道炎及性工作者等女性群体是HIV感染的高危人群[24-26]。基于本研究的结果,我们从新的角度解释高危女性人群为何会有更高的HIV感染风险。女性阴道内乳酸含量减少,导致在性交过程中阴道内淀粉样纤维生成相应增加,促进了HIV感染,最终增加HIV性传播的几率。我们结果提示,在性交前后,维持阴道分泌液低pH值和高浓度乳酸的措施,可以减少精液淀粉样纤维的生成,从而减少HIV的感染。
乳酸作为女性生殖道的一个自身保护因子,既具有特异性的抗病毒作用,又能抑制精液淀粉样纤维的形成,具有很大的前景开发成能预防HIV性传播的杀微生物剂。杀微生物剂是一类含抗HIV成分的凝胶、乳脂、栓剂、药膜或海绵,在性交前植入阴道或肛门内,通过直接灭活HIV、阻止HIV粘附及侵入阴道或直肠粘膜内的靶细胞、抑制HIV在靶细胞内的复制等作用机理,预防HIV和其它性传播病原体的传播。阴道防御增强剂是杀微生物剂的一种,通过增强或维持女性阴道天然酸性环境来抵抗HIV等病原体。BufferGelTM就是其中一种,它是ReProtect和LLC公司联合研发的,虽然在临床试验中证明是安全的,但是因其不能显著降低HIV感染率,最后以失败告终[27]。它是一种pH值为3.7~4.5的水溶性凝胶,缓冲剂是聚羧乙烯974 [28],基于本研究的结果,在未来杀微生物剂研发中,我们可将乳酸代替聚羧乙烯974作为缓冲剂,联合其它抗病毒药物,使乳酸在发挥缓冲液作用的同时还抑制精液淀粉样纤维的形成,协同发挥抗HIV的效果,可能会有更好的疗效。
乳酸除了可开发成杀微生物剂外,还可用于杀微生物剂的辅料或载体。聚乳酸(PLA)是一类绿色、环保的生物可降解高分子材料,它是由乳酸聚合而成,现已被广泛应用于生物医学领域中的缓控释药物的载体、手术缝合线及骨骼固定材料等[29-31]。PLA可作为缓控释型杀微生物剂的载体,控制药物长期缓慢或恒速地释放到阴道中,降低用药频率,减少对阴道的损伤,同时载体PLA降解产生的乳酸可直接杀灭HIV,抑制淀粉样纤维形成,降低HIV感染,残留的PLA最终也会被水解成能够被人体排出体外的二氧化碳和水[32]。PLA作为一种环境友好型绿色材料,良好的可吸收性、生物兼容性、可降解性和安全性,使其在阴道用杀微生物剂或辅料的应用具有很好的开发前景。
| [1] | http://www.unaids.org/. |
| [2] | Buvé A, Bishikwabo-Nsarhaza K, Mutangadura G. The spread and effect of HIV-1 infection in sub-Saharan Africa[J]. Lancet, 2002, 359(9322): 2011-7. DOI: 10.1016/S0140-6736(02)08823-2. |
| [3] | Münch J, Rücker E, St?ndker L, et al. Semen-derived amyloid fibrils drastically enhance HIV infection[J]. Cell, 2007, 131(6): 1059-71. DOI: 10.1016/j.cell.2007.10.014. |
| [4] | Zirafi O, Kim KA, Roan NR, et al. Semen enhances HIV infectivity and impairs the antiviral efficacy of microbicides[J]. Sci Transl Med, 2014, 6(262): 262ra157. DOI: 10.1126/scitranslmed.3009634. |
| [5] | Allen SA, Carias AM, Anderson MR, et al. Characterization of the influence of Semen-Derived enhancer of virus infection on the interaction of HIV-1 with female reproductive tract tissues[J]. J Virol, 2015, 89(10): 5569-80. DOI: 10.1128/JVI.00309-15. |
| [6] | Roan NR, Müller JA, Liu H, et al. Peptides released by physiological cleavage of semen coagulum proteins form amyloids that enhance HIV infection[J]. Cell Host Microbe, 2011, 10(6): 541-50. DOI: 10.1016/j.chom.2011.10.010. |
| [7] | Xun T, Li W, Chen J, et al. ADS-J1 inhibits semen-derived amyloid fibril formation and blocks fibril-mediated enhancement of HIV-1 infection[J]. Antimicrob Agents Chemother, 2015, 59(9): 5123-34. DOI: 10.1128/AAC.00385-15. |
| [8] | Gray RH, Wawer MJ, Brookmeyer R, et al. Probability of HIV-1 transmission per coital act in monogamous, heterosexual, HIV-1-discordant couples in Rakai, Uganda[J]. Lancet, 2001, 357(9263): 1149-53. DOI: 10.1016/S0140-6736(00)04331-2. |
| [9] | Liebenberg LJ, Masson L, Arnold KB, et al. Genital-systemic chemokine gradients and the risk of HIV acquisition in women[J]. J Acquir Immune Defic Syndr, 2016, 74(3): 318-25. |
| [10] | Miller EA, Beasley DE, Dunn RR, et al. Lactobacilli dominance and vaginal pH: why is the human vaginal microbiome unique[J]. ? Front Microbiol, 2016, 7(1936): 1936. |
| [11] | Aldunate M, Tyssen D, Johnson A, et al. Vaginal concentrations of lactic acid potently inactivate HIV[J]. J Antimicrob Chemother, 2013, 68(9): 2015-25. DOI: 10.1093/jac/dkt156. |
| [12] | Witkin SS, Linhares IM. HIV inhibition by lactobacilli: easier in a test tube than in real Life[J]. MBio, 2015, 6(5): e01415-85. |
| [13] | Dezzutti CS, Verstraelen H, Vervaet C, et al. Rationale and safety assessment of a novel intravaginal Drug-Delivery system with sustained DL-Lactic acid release, intended for Long-Term protection of the vaginal microbiome[J]. PLoS One, 2016, 11(4): e0153441. DOI: 10.1371/journal.pone.0153441. |
| [14] | Boskey ER, Moench TR, Hees PS, et al. A self-sampling method to obtain large volumes of undiluted cervicovaginal secretions[J]. Sex Transm Dis, 2003, 30(2): 107-9. DOI: 10.1097/00007435-200302000-00002. |
| [15] | Münch J, St?ndker L, Forssmann WG, et al. Discovery of modulators of HIV-1 infection from the human peptidome[J]. Nat Rev Microbiol, 2014, 12(10): 715-22. DOI: 10.1038/nrmicro3312. |
| [16] | Masfari AN, Duerden BI, Kinghorn GR. Quantitative studies of vaginal bacteria[J]. Genitourin Med, 1986, 62(4): 256-63. |
| [17] | Tang HM, Ou WB, Zhou HM. Effects of lactic acid and NaCl on creatine kinase from rabbit muscle[J]. Biochem Cell Biol, 2003, 81(1): 1-7. DOI: 10.1139/o02-168. |
| [18] | Nunn KL, Wang YY, Harit D, et al. Enhanced trapping of HIV-1 by human cervicovaginal mucus is associated with lactobacillus crispatus-Dominant microbiota[J]. MBio, 2015, 6(5): e01015-84. |
| [19] | Witkin SS, Ledger WJ. Complexities of the uniquely human vagina[J]. Sci Transl Med, 2012, 4(132): 132fs11. |
| [20] | Atashili J, Poole C, Ndumbe PM, et al. Bacterial vaginosis and HIV acquisition: a meta-analysis of published studies[J]. AIDS, 2008, 22(12): 1493-501. DOI: 10.1097/QAD.0b013e3283021a37. |
| [21] | Silvestri G, Zevin AS, Xie IY, et al. Microbiome composition and function drives Wound-Healing impairment in the female genital tract[J]. PLoS Pathog, 2016, 12(9): e1005889. DOI: 10.1371/journal.ppat.1005889. |
| [22] | Boskey ER, Telsch KM, Whaley KJ, et al. Acid production by vaginal flora in vitro is consistent with the rate and extent of vaginal acidification[J]. Infect Immun, 1999, 67(10): 5170-5. |
| [23] | Lai SK, Wang YY, Wirtz D, et al. Micro-and macrorheology of mucus[J]. Adv Drug Deliv Rev, 2009, 61(2): 86-100. DOI: 10.1016/j.addr.2008.09.012. |
| [24] | Alcendor DJ. Evaluation of health disparity in bacterial vaginosis and the implications for HIV-1 acquisition in African American women[J]. Am J Reprod Immunol, 2016, 76(2): 99-107. DOI: 10.1111/aji.2016.76.issue-2. |
| [25] | Alcaide ML, Rodriguez VJ, Brown MR, et al. High levels of inflammatory cytokines in the reproductive tract of women with BV and engaging in intravaginal douching: a Cross-Sectional study of participants in the women interagency HIV study[J]. AIDS Res Hum Retroviruses, 2017, 33(4): 309-17. DOI: 10.1089/aid.2016.0187. |
| [26] | Simoes JA, Hashemi FB, Aroutcheva AA, et al. Human immunodeficiency virus type 1 stimulatory activity by Gardnerella vaginalis: relationship to biotypes and other pathogenic characteristics[J]. J Infect Dis, 2001, 184(1): 22-7. DOI: 10.1086/jid.2001.184.issue-1. |
| [27] | Guffey MB, Richardson B, Husnik M, et al. HPTN 035 phase II/IIb randomised safety and effectiveness study of the vaginal microbicides BufferGel and 0.5% PRO 2000 for the prevention of sexually transmitted infections in women[J]. Sex Transm Infect, 2014, 90(5): 363-9. DOI: 10.1136/sextrans-2014-051537. |
| [28] | 张维娜, 陆荣建, 黄明宪, 等. 杀微生物剂研究进展[J]. 重庆理工大学学报:自然科学, 2012, 26(3): 38-45. |
| [29] | Zhang Q, Du Y, Jing L, et al. Infra Red Dye and Endostar Loaded Poly Lactic Acid Nano-Particles as a Novel Theranostic Nanomedicine for Breast Cancer[J]. J Biomed Nanotechnol, 2016, 12(3): 491-502. DOI: 10.1166/jbn.2016.2022. |
| [30] | Frounchi M, Shamshiri S. Magnetic nanoparticles-loaded PLA/PEG microspheres as drug carriers[J]. J Biomed Mater Res A, 2015, 103(5): 1893-8. DOI: 10.1002/jbm.a.v103.5. |
| [31] | Tyler B, Gullotti D, Mangraviti A, et al. Polylactic acid (PLA) controlled delivery carriers for biomedical applications[J]. Adv Drug Deliv Rev, 2016, 107: 163-75. DOI: 10.1016/j.addr.2016.06.018. |
| [32] | 黄嘉琪. 绿色可降解材料--聚乳酸[J]. 医药前言, 2016, 6(27): 341-2. |
 2017, Vol. 37
2017, Vol. 37

