2. 东莞市第三人民医院心血管内科, 广东 东莞510515;
3. 中山大学 附属第一医院黄埔院区儿科, 广东广州 510080;
4. 中山大学 附属第一医院黄埔院区内科, 广东广州 510080;
5. 中山医学院生理学教研室, 广东广州 510080;
6. 广东省人民医院//广东省医学科学院//广东省老年医学研究所东病区内分泌科, 广东 广州 510080
2. Department of Cardiology, Third People's Hospital of Dongguan, Dongguan 510515, China;
3. Department of Pediatrics, Zhongshan Medical College, Sun Yat-sen University, Guangzhou 510080, China;
4. Department of Internal Medicine, Huangpu Division of First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080, China;
5. Department of Physiology, Zhongshan Medical College, Sun Yat-sen University, Guangzhou 510080, China;
6. Department of Endocrinology, East Ward of Guangdong Geriatric Institute/ Guangdong Academy of Medical Sciences/Guangdong General Hospital, Guangzhou 510080, China
糖尿病心肌病(DCM)是糖尿病的并发症之一,其发病率高,危险性大,与糖尿病患者心血管疾病的高发生率与高死亡率密切相关。目前,尽管报道氧化应激、瘦素、丝裂原激活蛋白激酶通路、线粒体损伤、炎症[1-4]等因素参与糖尿病的心肌损伤,但是,其病理生理机制尚未完全明了,特别是与渗透压相关的离子通道在DCM发生中的作用迄今未明。因此,深入探讨离子通道在高血糖对心肌损伤中的作用及机制很有必要。在心血管系统中,ClC-3通道参与多种的心血管疾病的病理生理过程。有研究证实心律失常和心肌缺血再灌注损伤的发生常伴有ClC-3通道蛋白表达增多[5-7]。王晓明等[8]进一步证实,氯离子通道阻断剂和氯通道抑制剂能抑制缺血再灌注诱导的心肌细胞凋亡。
鉴于ClC-3通道在缺氧缺血心肌损伤发生发展中的作用,因此,近年ClC-3通道与糖尿病心血管并发症(如糖尿病心肌病)的关系引起学者们的重视。尽管目前相关的报道甚少,但是,有报道糖尿病大鼠的主动脉平滑肌、肾脏及脑组织的ClC-3通道蛋白表达水平显著升高[9]。氯通道阻断剂通过抑制容积敏感外向整流Cl-通道抑制高糖引起的心肌细胞凋亡[10]。这些结果提示进一步探讨ClC-3通道在糖尿病心肌损伤中的作用及其机制对提高防治该疾病的效果具有重要的临床意义。
Ang-(1-7) 能减轻糖尿病的心血管损伤[11-14]。Ang-(1-7) 可通过减轻脂中毒和炎症改善糖尿病心肌病与舒张功能失调[15-16]。Ang-(1-7) 通过抑制NF-κβ通路保护心肌细胞对抗高糖诱导的损伤[17]。值得注意的是,血管紧张素系统与ClC-3通道存在密切的关系,ClC-3基因敲除可保护内皮祖细胞对抗Ang-Ⅱ引起的凋亡[16]。但是,Ang-(1-7) 能否通过调控ClC-3通道保护心肌细胞对抗高糖引起的损伤国内外尚未见报道。
为此,本研究在H9c2心肌细胞建立高糖损伤模型[11],旨在探讨:(1) ClC-3通道在高糖损伤心肌细胞中的作用;(2) Ang-(1-7) 能否通过调控ClC-3通道对抗高糖引起的心肌损伤,为深入探讨糖尿病心肌病的发病机制及Ang-(1-7) 的心肌保护机制提供新颖的实验依据,为防治高血糖对心肌损伤提供新的治疗策略。
1 材料和方法 1.1 材料与试剂抗ClC-3抗体购自Cell Signaling(USA);Ang-(1-7)、双氯荧光素(DCFH-DA)、罗丹明123 (Rh123) 和超氧化物歧化酶(SOD)检测试剂盒购自Sigma-Aldrich (USA);特级胎牛血清(FBS)购自Gibco BRL (USA);细胞计数试剂盒(CCK-8) 购自Dojindo Lab(Japan);DMEM培养基购自HyClone (USA);H9c2心肌细胞由中山大学实验动物中心细胞库提供。
1.2 细胞培养及实验分组H9c2心肌细胞在5% CO2、37 ℃的条件下培养于含有10% FBS的DMEM F12培养基中。
实验分为6组:(1) 正常对照(control)组:DMEM培养心肌细胞24 h;(2) 高糖(HG)损伤组:35 mmol/L葡萄糖处理心肌细胞24 h;(3) Ang-(1-7) +HG组: 1 μmol/L Ang-(1-7) 与HG共处理心肌细胞24 h;(4) ClC-3通道抑制剂(NPPB) +HG组:100 μmol/L NPPB与HG共处理心肌细胞24 h;(5) Ang-(1-7) 组:1 μmol/L Ang(-1-7) 与DMEM共处理心肌细胞24 h;(6) NPPB组:100 μmol/L NPPB与DMEM共处理心肌细胞24 h。
1.3 Western blot法检测ClC-3通道蛋白的表达H9c2心肌细胞接种于60 mm培养皿中,生长至约80%融合度时,给予不同处理后,加入细胞裂解液作用30 min,14 000×g高速离心10 min,对上清采用BCA法进行蛋白质含量测定。等量蛋白经SDS-PAGE电泳分离后,转移到PVDF膜上。用5%脱脂奶粉封闭60 min,加入ClC-3或β-actin抗体(浓度均为1:1000),4 ℃作用过夜,然后用TBST洗10 min 3次,加入Ⅱ抗稀释液室温孵育90 min,然后再用TBST洗10 min 3次。ECL发光液将PVDF膜显色,暗室曝光到X线片上,凝胶成像系统扫描分析结果。实验重复3次。
1.4 CCK-8测定细胞存活率根据CCK-8试剂盒说明书检测H9c2心肌细胞活力。将H9c2心肌细胞以每孔5000细胞的密度接种于96孔板,当细胞生长80%时,给予上述不同处理。处理结束后,每孔加入无血清培养基稀释的CCK-8工作液100 μL,37 ℃孵育2 h,使用酶标仪检测各孔吸光度(A)值,波长设定为450 nm。按公式:细胞存活率(%) =处理组A/对照组A×100%,求出处理组细胞存活率,重复3次。
1.5 细胞线粒体膜电位(MMP)的测定将H9c2心肌细胞接种于24孔培养板中,贴壁生长至大约80%时,给予各实验组不同的处理因素,弃培养液,用PBS冲洗3次,风干。将H9c2心肌细胞与10 μg/L Rh 123于37 ℃避光孵育30 min,弃去,再用PBS冲洗3次,风干。在荧光显微镜下随机地选取5个不重复区摄片,用ImageJ 1.41软件分析各视野平均荧光强度。
1.6 细胞内活性氧(ROS)含量的检测将H9c2心肌细胞接种于24孔培养板中,当细胞生长贴壁生长至80%时,给予各实验组不同的处理因素后,弃培养液,PBS冲洗3次,风干。将H9c2心肌细胞与10 μmol/L DCFH-DA于37 ℃孵育30 min,弃去,再用PBS冲洗3次,风干。在荧光显微镜下随机选取5个不重复区摄片,采用ImageJ 1.41软件分析各视野平均绿色荧光强度。
1.7 超氧化物歧化酶SOD活性的检测按照上述实验分组处理H9c2心肌细胞,作用24 h后,用预冷的PBS洗2次,加入50 μL细胞裂解液于培养皿内,4 ℃静置30 min,14 000×g离心10 min,取上清,根据Sigma-Aldrich(USA)提供的SOD活性试剂盒说明书的操作步骤,检测SOD对超氧化物的抑制率。
1.8 细胞凋亡的测定将H9c2心肌细胞接种于24孔培养板中,当细胞生长贴壁生长至80%时,给予各实验组不同的处理因素后,弃培养液,PBS冲洗3次,然后用4%多聚甲醛于4 ℃环境中固定10 min,加入含5 mg/L Hoechst 33258试剂,于37 ℃温箱孵育30 min,在荧光显微镜下摄片,鉴别正常的心肌细胞和凋亡的心肌细胞,随机选取视野在荧光显微镜下摄片。实验重复5次。
1.9 统计学处理实验数据用SPSS17.0软件进行统计分析,所有结果以均数±标准误表示,组间比较采用单因素方差分析,用SNK-q检验进行均数之间的两两比较,以P<0.05为差异有统计学意义。
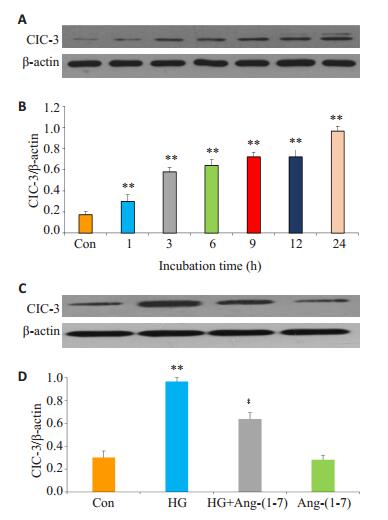
2 结果 2.1 Ang-(1-7) 抑制高糖对心肌细胞ClC-3通道蛋白表达的上调作用图 1A和B显示,35 mmol/L葡萄糖(高糖,HG)作用于H9c2心肌细胞1 h引起ClC-3通道蛋白的表达水平明显升高,与正常对照组比较,差异具有统计学意义(P<0.01),随着作用时间的延长,在3~24 h范围内,HG对ClC-3通道蛋白表达的促进作用更大,其中24 h达到高峰(P>0.05)。
|
图 1 Ang-(1-7) 抑制高糖对H9c2心肌细胞ClC-3通道蛋白表达的上调作用 Figure 1 Angiotensin-(1-7) [Ang-(1-7)] attenuates high glucose(HG)-induced up-regulation of ClC-3 chloride channel protein in H9c2 cardiac cells. A: Cells were treated with 35 mmol/L glucose for 1-24 h; B: Co-treatment of the cells with 1 μmol/L Ang-(1-7) and HG for 24 h. **P < 0.01 vs control group; ‡P < 0.01 vs HG group (n=3). |
另方面,图 1C和D显示,当1 μmol/L Ang-(1-7) 与高糖共处理心肌细胞24 h,能明显抑制HG对ClC-3通道蛋白表达的上调作用,与HG损伤组比较,差异非常明显(P<0.01)。1 μmol/L Ang-(1-7) 本身作用心肌细胞24 h对ClC-3通道蛋白的基础表达水平无明显影响。
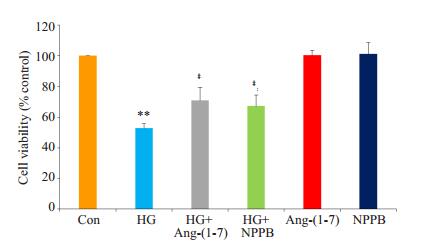
2.2 Ang-(1-7) 和ClC-3通道抑制剂对抗高糖引起的心肌细胞毒性图 2显示,高糖处理H9c2心肌细胞24 h,可诱导明显的细胞毒性,表现为细胞存活率明显降低,与正常对照组(con组)比较,差异有统计学意义(P<0.01)。但是,1 μmol/L Ang-(1-7) 或100 μmol/L ClC-3通道抑制剂NPPB分别与高糖共处理心肌细胞24 h能抑制高糖引起的心肌毒性,使细胞存活率明显升高,与高糖处理组分别比较,差异非常显著(P<0.01)。然而单独用Ang-(1-7) 或NPPB处理心肌细胞24 h对细胞存活率无明显的影响。
|
图 2 Ang-(1-7) 和氯通道抑制剂(NPPB)抑制高糖引起的心肌细胞毒性 Figure 2 Co-treatment of H9c2 cardiac cells for 24 h with 1 μmol/L Ang-(1-7) or 100 μmol/L NPPB, an inhibitor of chloride channel, reduces HG-induced cytotoxicity. **P < 0.01 vs control group; ‡P < 0.01 vs HG group (n=6). |
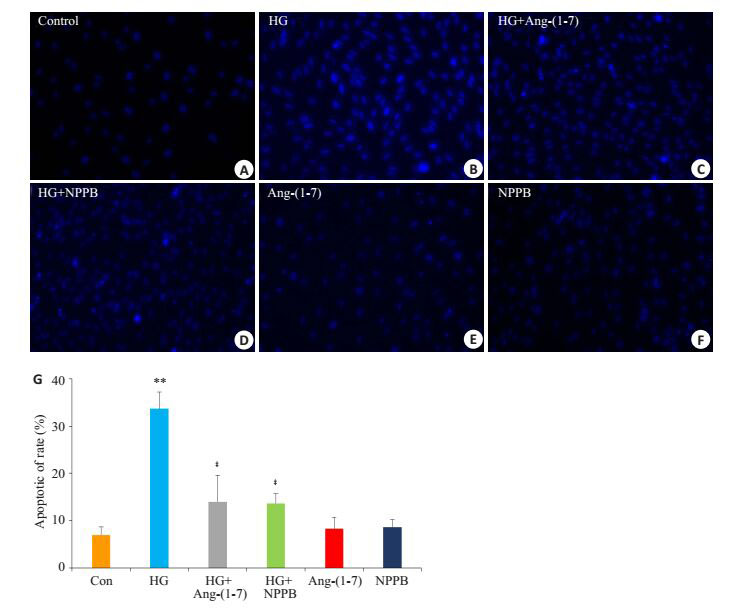
图 3的Hoechst染色荧光显微镜照相术的检测结果显示,正常H9c2心肌细胞呈现为散在的低密度荧光(图 3A),凋亡细胞核则呈现浓缩致密的固缩形态或颗粒荧光。35 mmol/L葡萄糖处理心肌细胞24 h后,使凋亡细胞的数量显著增多(图 3B)。但是,1 μmol/L Ang(-1-7) (图 3C)或100 μmol/L NPPB (图 3D)与高糖共处理心肌细胞24 h分别能保护心肌细胞对抗HG的致凋亡作用,使凋亡细胞数量减少。单独应用Ang-(1-7) 或NPPB处理心肌细胞24 h不引起细胞凋亡(图 3E,F)。图 3G为应用ImageJ 1.41软件对A、B、C、D、E和F的结果进行统计分析的数据。
|
图 3 Ang-(1-7) 和氯通道抑制剂保护心肌细胞对抗高糖引起的凋亡 Figure 3 Ang-(1-7) and NPPB protect cardiac cells against HG-induced apoptosis. A-F: Morphological changes of apoptotic cells observed by fluorescent microscopy with Hoechst 33258 nuclear staining. G: Percentages of apoptotic cells in different groups analyzed using a cell counter and ImageJ 1.41 software. **P < 0.01 vs control group; ‡P < 0.01 vs HG group. |
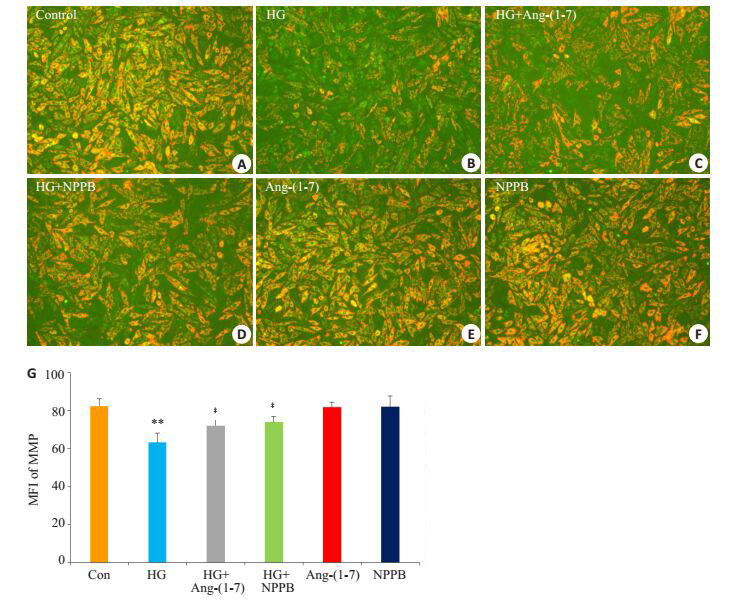
图 4B和G显示,35 mmol/L葡萄糖处理心肌细胞24 h使胞内的平均荧光强度(MFI,为反映MMP大小的指标)明显降低,与正常对照组(图 4A,G)比较,差异有统计学意义(P<0.01)。然而,1 μmol/L Ang-(1-7)(图 4C,G)或100 μmol/L ClC-3通道抑制剂NPPB (图 4D,G)与HG共处理心肌细胞24 h能明显抑制HG对MMP的损伤作用,分别使MFI升高,与HG组比较,差异显著(P<0.01)。单独应用Ang-(1-7) 或NPPB处理心肌细胞24 h对MMP无明显的影响(图 4E~G)。
|
图 4 Ang-(1-7) 和氯通道抑制剂保护心肌细胞对抗高糖对MMP的损伤作用 Figure 4 Ang-(1-7) and NPPB protect H9c2 cardiac cells against HG-induced dissipation of MMP. A-F: MMP assessed by using the fluorescent dye Rh123. G: Quantitative analysis of fluorescence intensity in different groups. **P < 0.01 vs control group; ‡ P < 0.01 vs HG group. |
图 5B,G显示,应用35 mmol/L葡萄糖处理心肌细胞24 h使胞内DCF的荧光强度(是ROS生成水平的指标,荧光强度增大,表示ROS生成增多)明显增多,与正常对照组(图 5A,G)比较,差异有统计学意义(P<0.01)。然而,1 μmol/L Ang-(1-7)(图 5C,G)或100 μmol/L NPPB(图 5D,G)与HG共处理心肌细胞24 h能明显减少胞内DCF的荧光强度,与HG组分别比较,差异显著具有统计学意义(P<0.01)。Ang-(1-7) 或NPPB本身不影响ROS生成(图 5E~G)。
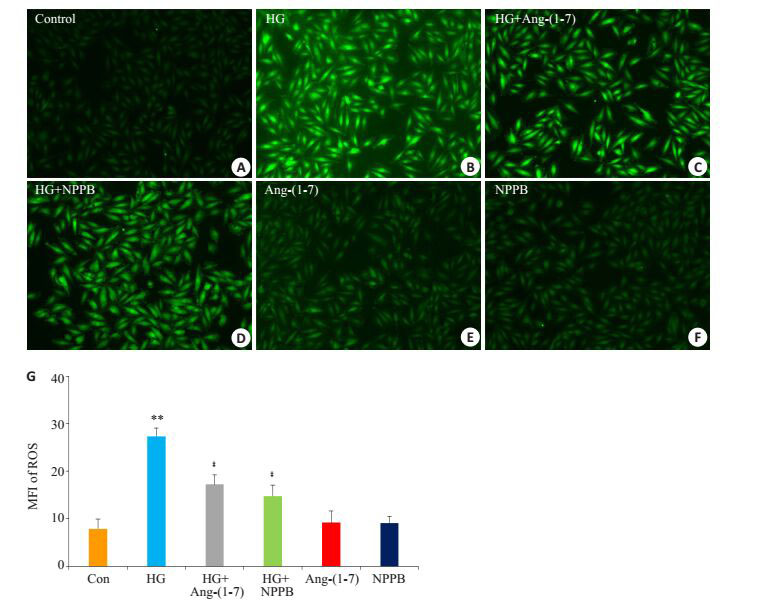
|
图 5 Ang-(1-7) 和氯通道抑制剂保护心肌细胞对抗高糖引起的心肌细胞内ROS生成增多 Figure 5 Ang-(1-7) and NPPB protect H9c2 cardiac cells against HG-induced increase in reactive oxygen species (ROS) production. A-F: Intracellular ROS production level detected using the redox-sensitive fluorescent dye DCFH-DA. G: Quantitative analysis of ROS production in different groups. **P < 0.01 vs control group; ‡P < 0.01 vs HG group. |
应用35 mmol/L葡萄糖处理心肌细胞24 h使SOD活性明显减弱,与正常对照组比较,差异有统计学意义(P<0.01,图 6)。但是,Ang-(1-7) 或NPPB与HG共处理心肌细胞24 h能明显地阻断HG对SOD活性的抑制作用(P<0.01)。Ang-(1-7) 或NPPB本身对SOD的基础活性无明显的影响。
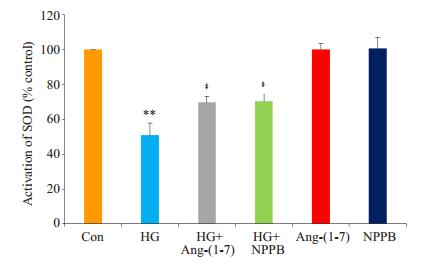
|
图 6 Ang-(1-7) 和氯通道抑制剂阻断高糖对心肌细胞SOD活性的抑制作用 Figure 6 Ang-(1-7) and NPPB block the inhibitory effect of HG on SOD activity in H9c2 cardiac cells. **P < 0.01 vs control group; ‡P < 0.01 vs HG group. |
Cl-通道是体内重要的阴离子通道,ClC-3是ClC氯通道基因家族的重要成员之一,在心肌、血管平滑肌及内皮细胞均有ClC-3通道分布。不少的研究证实,ClC-3通道参与心血管损伤的病理生理过程。例如,ClC-3通道可通过激活JNK/p38 MAPK通路引起动脉粥样硬化[18],敲除ClC-3基因可抑制高血压小鼠的氧化应激及降低血压[19-20]。ClC-3通道还在缺血缺氧性心肌损伤中起着重要的作用[5-8, 21]。值得注意的是,有研究指出,糖尿病大鼠的主动脉平滑肌、肾脏及脑组织的ClC-3通道蛋白表达显著升高[9];应用氯通道抑制剂DIDS能抑制高糖引起的心肌细胞凋亡[10]。在高糖损伤H9c2心肌细胞模型,本研究进一步证实,高糖能促进ClC-3通道蛋白的表达;进一步的研究发现,氯通道阻断剂NPPB能明显地抑制高糖引起的心肌细胞多种损伤,表现为细胞存活率升高、凋亡细胞数量减少、氧化应激反应减弱(包括ROS生成减小、SOD活性增高)及MMP丢失减轻,提示ClC-3通道可能介导高糖引起的心肌细胞毒性、凋亡、氧化应激及线粒体损伤,证实我们有关ClC-3通道参与高血糖引起的心肌损伤的推断。值得注意的是,有报道指出,ROS可激活容积敏感性氯通道[22-23]。而本研究证实,ClC-3通道被阻断后可引起ROS生成减少,结合上述结果及本研究结果,提示ROS与ClC-3之间可能存在正相互作用,对此尚需作进一步的研究。另方面,DIDS可抑制超氧阴离子引起的内皮细胞的MMP丢失及细胞凋亡,支持本文的结果[24]。
近年,Ang-(1-7) 在减轻糖尿病心血管损伤的作用日益受到重视。例如,有报道,伴有心功能障碍的糖尿病患者其血浆Ang-(1-7) 的水平较低[25]。此外,在糖尿病患者,与Ang-(1-7) 生成有关的血管紧张素转化酶2 (ACEI)的表达水平也降低[26]。Ang-(1-7) 能减弱糖尿病大鼠由缺血再灌注引起的心肌损伤,并抑制糖尿病的血管对去甲肾上腺素、Ang-Ⅱ等的异常反应[11]。最近,我们证实Ang-(1-7) 能通过抑制ROS激活的瘦素-p38 MAPK/ERK1/2通路对抗高糖引起的心肌细胞损伤[2]。在此研究基础上,本研究观察到,Ang-(1-7) 在抑制高糖引起的上述的多种心肌细胞损伤的同时,能明显地阻断高糖对心肌细胞ClC-3通道蛋白表达水平的上调作用,提示通过调控ClC-3通道活动可能是Ang-(1-7) 保护心肌细胞对抗高糖引起的损伤的一个重要的保护机制。
综上所述,本研究在离体心肌细胞证实,ClC-3通道介导高糖引起的损伤,Ang-(1-7) 可通过抑制ClC-3通道对抗高糖引起的心肌损伤,这为深入阐明糖尿病心肌损伤机制及Ang-(1-7) 的心肌保护作用机制提供了新颖的实验依据,并为防治糖尿病心肌病提供了新的治疗靶点及治疗策略。
| [1] | Xu W, Chen J, Lin J, et al. Exogenous H2S protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting the activation of the NF-κB and IL-1β pathways[J]. Int J Mol Med, 2015, 35(1): 177-86. |
| [2] | Lei Y, Xu Q, Zeng B, et al. Angiotensin-(1-7) protects cardiomyocytes against high glucose-induced injuries through inhibiting reactive oxygen species-activated leptin-p38 mitogenactivated protein kinase/extracellular signal-regulated protein kinase 1/2 pathways, but not the leptin-c-Jun N-terminal kinase pathway in vitro[J]. J Diabetes Investig, 2016, 29(11): 12603. |
| [3] | Xu WM, Wu W, Chen JF, et al. Exogenous Hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J]. Int J Mol Med, 2013, 32(4): 917-25. |
| [4] | Fuentes-Antrás J, Ioan AM, Tuáón J, et al. Activation of toll-like receptors and inflammasome complexes in the diabetic cardiomyopathy-associated inflammation[J]. Int J Endocrinol, 2014(6): 847827. |
| [5] | Verkerk AO, Veldkamp MW, Bouman LN, et al. Calcium-activated Cl(-) current contributes to delayed afterdepolarizations in single Purkinje and ventricular myocytes[J]. Circulation, 2000, 101(22): 2639-44. DOI: 10.1161/01.CIR.101.22.2639. |
| [6] | Bozeat ND, Xiang SY, Ye LL, et al. Activation of volume regulated chloride channels protects myocardium from ischemia/reperfusion damage in second-window ischemic preconditioning[J]. Cell Physiol Biochem, 2011, 28(6): 1265-78. DOI: 10.1159/000335858. |
| [7] | 邱少波, 梁燕, 刘萍. 冠心康对大鼠缺血再灌注损伤心肌氯通道ClC-2, ClC-3, CFTR表达的影响[J]. 中西医结合心脑血管病杂志, 2013, 11(12): 1482-5. DOI: 10.3969/j.issn.1672-1349.2013.12.038. |
| [8] | 王晓明, 张卫卫, 龚卫琴, 等. 氯离子通道阻滞剂DIDS和NPPB对缺血再灌注诱导心肌细胞凋亡保护作用的研究[J]. 中华老年心脑血管病杂志, 2008(10): 765-7. DOI: 10.3969/j.issn.1009-0126.2008.10.014. |
| [9] | 王晓香, 朱邦豪, 高蓉, 等. ClC-3在糖尿病大鼠主动脉平滑肌, 肾脏及脑组织中的表达及其变化[J]. 中山大学学报:医学科学版, 2007, 28(6): 613-6. |
| [10] | Wang L, Shen M, Guo X, et al. Volume-sensitive outwardly rectifying chloride channel blockers protect against high glucoseinduced apoptosis of cardiomyocytes via autophagy activation[J]. Sci Rep, 2017, 7(2): 44265. |
| [11] | Benter IF, Yousif MH, Cojocel C, et al. Angiotensin-(1-7) prevents diabetes-induced cardiovascular dysfunction[J]. Am J Physiol Heart Circ Physiol, 2007, 292(1): H666-72. |
| [12] | Singh K, Singh T, Sharma PL. Beneficial effects of angiotensin (1-7) in diabetic rats with cardiomyopathy[J]. Ther Adv Cardiovasc Dis, 2011, 5(3): 159-67. DOI: 10.1177/1753944711409281. |
| [13] | Al-Maghrebi M, Benter IF, Diz DI. Endogenous angiotensin-(1-7) reduces cardiac ischemia-induced dysfunction in diabetic hypertensive rats[J]. Pharmacol Res, 2009, 59(4): 263-8. DOI: 10.1016/j.phrs.2008.12.008. |
| [14] | Liu CX, Hu Q, Wang Y, et al. Angiotensin-converting enzyme (ACE) 2 overexpression ameliorates glomerular injury in a rat model of diabetic nephropathy: a comparison with ACE inhibition[J]. Mol Med, 2011, 17(1/2): 59-69. |
| [15] | Mori J, Patel VB, Abo Alrob O, et al. Angiotensin 1-7 ameliorates diabetic cardiomyopathy and diastolic dysfunction in db/db mice by reducing lipotoxicity and inflammation[J]. Circ Heart Fail, 2014, 7(2): 327-39. DOI: 10.1161/CIRCHEARTFAILURE.113.000672. |
| [16] | Gava E, Samad-Zadeh A, Zimpelmann J, et al. Angiotensin-(1-7) activates a tyrosine phosphatase and inhibits glucose-induced signalling in proximal tubular cells[J]. Nephrol Dial Transplant, 2009, 24(6): 1766-73. DOI: 10.1093/ndt/gfn736. |
| [17] | 梁伟杰, 陈景福, 宋明才, 等. 血管紧张素-(1-7)/M as受体轴通过调控NF-κB通路保护心肌细胞对抗高糖诱导的损伤[J]. 中国病理生理杂志, 2015(2): 267-73. |
| [18] | Tao J, Liu CZ, Yang J, et al. ClC-3 deficiency prevents atherosclerotic lesion development in ApoE-/-mice[J]. J Mol Cell Cardiol, 2015, 87(8): 237-47. |
| [19] | Liu YJ, Wang XG, Tang YB, et al. Simvastatin ameliorates rat cerebrovascular remodeling during hypertension via inhibition of volume-regulated chloride channel[J]. Hypertension, 2010, 56(3): 445-52. DOI: 10.1161/HYPERTENSIONAHA.110.150102. |
| [20] | Shi XL, Wang GL, Zhang Z, et al. Alteration of volume-regulated chloride movement in rat cerebrovascular smooth muscle cells during hypertension[J]. Hypertension, 2007, 49(6): 1371-7. DOI: 10.1161/HYPERTENSIONAHA.106.084657. |
| [21] | Mizoguchi K, Maeta H, Yamamoto A, et al. Amelioration of myocardial global ischemia/reperfusion injury with volumeregulatory chloride channel inhibitors in vivo[J]. Transplantation, 2002, 73(8): 1185-93. DOI: 10.1097/00007890-200204270-00002. |
| [22] | Shimizu T, Numata T, Okada Y. A role of reactive Oxygen species in apoptotic activation of volume-sensitive Cl(-) channel[J]. Proc Natl Acad Sci USA, 2004, 101(17): 6770-3. DOI: 10.1073/pnas.0401604101. |
| [23] | Duan DD. The ClC-3 chloride channels in cardiovascular disease[J]. Acta Pharmacol Sin, 2011, 32(6): 675-84. DOI: 10.1038/aps.2011.30. |
| [24] | Hawkins BJ, Madesh M, Kirkpatrick CJ, et al. Superoxide flux in endothelial cells via the chloride channel-3 mediates intracellular signaling[J]. Mol Biol Cell, 2007, 18(6): 2002-12. DOI: 10.1091/mbc.E06-09-0830. |
| [25] | Hao PP, Chen YG, Liu YP, et al. Association of plasma angiotensin-(1-7) level and left ventricular function in patients with type 2 diabetes mellitus[J]. PLoS One, 2013, 8(5): e62788. DOI: 10.1371/journal.pone.0062788. |
| [26] | Reich HN, Oudit GY, Penninger JM, et al. Decreased glomerular and tubular expression of ACE2 in patients with type2 diabetes and kidney disease[J]. Kidney Int, 2008, 74(12): 1610-6. DOI: 10.1038/ki.2008.497. |
 2017, Vol. 37
2017, Vol. 37

