2. 中国人民解放军总医院南楼临床部 呼吸内科,北京 100853
2. Department of Nanlou Respiratory Diseases, General Hospital of PLA, Beijing 100853, China
肺癌是临床常见的肿瘤类型,已成为全球范围内发病率和死亡率最高的癌种。2015年我国统计显示,在75岁以上男性和60岁以上女性中,肺癌是最常见肿瘤[1],因此肺癌属于老年性疾病。慢性阻塞性肺病(COPD)是老年人呼吸系统多发疾病,据统计,在全世界范围内,每年死于COPD的患者超过250万例,是世界第四大致死性疾病[2-3]。这两种疾病均与吸烟密切相关,吸烟可以导致支气管上皮组织发生改变,包括化生,发育异常,腺瘤样增生,最终进展至原位癌。COPD患者长期的慢性炎症,肺基质重构,均是导致肺癌的重要诱因[4]。COPD与肺癌的关系,如同肥胖与2型糖尿病的关系,一种疾病的潜在致病原因,是与另一种疾病密切相关的[5]。
诸多研究显示COPD是肺癌不良预后的独立预测因子[6-7],Zhai等[6]回顾性研究早期(ⅠA~ⅢB)非小细胞肺癌合并COPD患者术后的远期生存,他们发现合并COPD患者的5年PFS (50.1%)和OS (54.4%)均显著低于不合并COPD的患者,前者的死亡风险和疾病进展风险均显著增加,其中男性和鳞癌两个因素与更差的生存相关性最强。但同样也有相反结论的研究报道,认为COPD与肺癌预后无关[8-9]。Lee等[8]应用倾向评分匹配的方法回顾性分析一组Ⅰ~Ⅳ的非小细胞肺癌,无论是单因素分析还是多因素分析,他们发现合并COPD这一因素与患者的预后无关,不能作为患者生存的预测因子。
COPD与非小细胞肺癌(NSCLC)的危险因素及潜在关联至今仍不明确,虽然基础研究较多,但临床研究结论相悖的也很多,针对老年NSCLC合并COPD的研究却相对较少。因此,本研究通过回顾性分析我院老年病房COPD合并NSCLC患者的临床资料,深入探讨此组患者的临床特征,以期为临床工作提供详实、可靠的研究数据。
1 资料和方法 1.1 临床资料通过查阅解放军总医院老年病房自2000年1月1日~2015年6月30日电子存档病历及病案管理科纸质存档病历,收集符合条件的住院患者完整病历资料,共得到301例组织学或细胞学明确诊断为NSCLC的患者。按照排除标准,一共排除194例NSCLC患者,其中失访病例21例,无基线肺功能资料者80例,基线肺功能水平正常者93例。
1.2 数据收集107例NSCLC合并COPD患者的病历资料,包括性别,年龄,吸烟史,吸烟指数,肺功能数据,病理类型,TNM分期,主诉症状,合并疾病,肺癌初始治疗方法,血清癌胚抗原(CEA)及D2聚体水平。COPD诊断依据全球慢性阻塞性肺疾病防治创议2017版指南的诊断及分级标准[10]。所有肺癌患者均有病理学诊断,其病理学分类和TNM分期标准采用2004年世界卫生组织对肺癌分类的修正方案。
搜集COPD治疗后3个月内任意一次肺功能检查报告,如Gold1度患者维持基线水平,Gold2~4度患者比基线水平改善1度以上,则视为治疗有效。肺源性心脏病诊断依据超声心动图诊断标准:右心室流出道内径≥30 mm,右心室内径≥20 mm,右心室前壁的厚度,左、右心室内径比值<2,右肺动脉内径≥18 mm,肺动脉干≥20 mm。
1.3 统计学分析采用SPSS 22.0软件进行分析,计数资料比较采用Pearson χ2分析,正态分布的计量资料使用独立样本的方差分析,组内两两比较采用Tukey HSD法,Bonferroni法加以验证。OS是指从诊断为肺癌至死亡的时间,非肿瘤死因、至观察截止日期仍存活者为截尾数据。生存率计算以寿命表法,用Kaplan-Meire评价生存期和中位生存期,组间比较采用Log-Rank检验。应用COX比例风险回归模型进行多因素分析。在单因素分析中以P<0.01视为差异有统计学意义,并纳入多因素COX回归模型,对于具有0、1、2或3个因子的患者,通过多因素分析鉴别独立的OS预测因素,以P<0.05为差异有统计学意义。
2 结果 2.1 NSCLC合并COPD患者一般统计资料全组共107例NSCLC合并COPD患者纳入统计分析(表 1),平均年龄78.6±9.05岁(范围:60~101岁),年龄在75岁上者占73.8%,有吸烟史及重度吸烟患者居多,平均FEV1/FVC (59.75±8.3) %,FEV1占预计值百分比为(72.12±20.98) %,平均FEV1 1.61±0.58 L,FVC 2.64±0.80 L。Gold分级以轻度和中度为主,分别占44.9%与36.4%。治疗后3个月内肺功能明显改善的患者占72.0%。确诊慢性肺心病患者占20.6%。虽然大多数患者TNM分期较早(Ⅰ期53.3%),但仍有57.9%的患者ECOG PS评分≥2,一般状况较差,并有31.8%的患者既往有第二原发肿瘤病史。全组患者以手术(29.0%)和放疗(29.9%)为起始治疗为主,化疗患者比例较低(10.3%)。平均CEA水平及D2聚体水平高于正常范围,分别为34.5±300.2 ng/mL和0.9±1.5 μg/mL。
| 表 1 患者人口统计学及临床特征 Table 1 Demographic and clinical characteristics of the patients |
本组COPD合并NSCLC患者的临床表现及合并疾病呈现多样化。其中,咳嗽或咳嗽性状的改变(15.0%)、呼吸困难或胸闷气短(11.2%),咳血或血痰(9.3%)是最常见的临床表现,其他还包括发热,胸痛,存在神经系统症状,疲劳。但需要注意的是,全组共有45例(42.1%)患者是在健康查体中发现肺部病变,并进一步确诊为NSCLC,这部分患者无不适症状或主诉。本组患者在NSCLC及COPD的基础上,最常见的合并疾病为心血管疾病(65.4%),其中有32例既往行冠状动脉支架植入术,其次是高血压(60.7%),2型糖尿病(35.5%)和脑血管疾病(35.5%)。同样值得关注的是有36例患者(33.6%)在确诊NSCLC之前的5年内有手术史,这其中包含18例患者因第二原发癌行手术切除,包括前列腺癌6例,胃癌5例,结肠癌4例,膀胱移形细胞癌1例,肾透明细胞癌1例,食道鳞癌1例。
2.2 不同病理类型患者肺功能比较及生存分析在检出的107例NSCLC合并COPD患者中,病理类型主要为鳞癌,腺癌,还有17例可明确为NSCLC,但经免疫组化等方法未能明确鉴别为何种类型,根据2015版WHO肺癌分类标准,将其命名为NSCLCNOS,另有10例其他NSCLC类型(大细胞癌n=6,肉瘤样癌n=4)。肺功能相关指标中,FEV1.0/FVC和FEV1.0% pred全组比较无显著差异(P=0.401与P= 0.066)。而FEV1绝对值和FVC绝对值组内两两比较中,腺癌与NSCLC-NOS比较差异显著(分别为1.73± 0.57 vs 1.24±0.46,P=0.012;2.78±0.80 vs 2.11±0.58,P= 0.013,表 2)。
| 表 2 不同病理类型肺功能比较 Table 2 Comparison of pulmonary functions among patients with NSCLC of different histological subtypes (Mean±SD) |
截止2016年6月30日,全组患者中位随访时间38.7月,79(73.8%)例死亡,其中12例死于非肺癌原因。全组患者中位生存时间(mOS)为45.8个月,其中1年,3年,5年,10年生存率分别为80.4%,55.4%,41.0%和20.0%。
依据患者肺功能Gold分级进行分层后的生存分析,Ⅰ度,Ⅱ度及Ⅲ/Ⅳ度COPD患者的中位生存时间分别为51.7月,43.1月与16.9月,Log Rank (Mantel-COX)成对比较,轻度与中度之间无统计学差异,P=0.996,而轻度与(极)重度或中度与(极)重度之间对比,均有统计学显著差异,P=0.020和P=0.043。生存曲线见图 1。
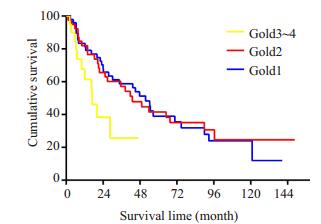
|
图 1 NSCLC合并COPD患者 Figure 1 Overall survival of patients with NSCLC complicated by COPD (n=107) stratified by Gold grade. |
利用建立COX比例风险回归模型的方法,对本研究中全组患者的生存结局具有潜在影响的各个因素分步进行单变量及多变量COX回归,仅在单变量统计中对生存结局有显著统计学差异的变量纳入多因素分析,如表 3所示,单因素COX比例风险回归分析显示:年龄越大,ECOG PS≥2,较低的FEV1绝对值和FVC绝对值,较差的Gold分级,治疗3个月内Gold未改善,较差的TNM分期,鳞癌,非手术的起始治疗,主诉症状为咳嗽,神经系统症状,非查体发现疾病,伴随高血压,5年内有手术史,较高的血清CEA指标,均是较短生存的预测因子。
| 表 3 影响生存时间的单因素及多因素分析 Table 3 Univariate and multivariate analysis of prognostic factors for overall survival of the patients |
将上述因子纳入COX多因素分析,发现年龄越大,(极)重度Gold分级,治疗3个月内Gold未改善,TNM分期为Ⅲ或Ⅳ期,鳞癌,非手术的起始治疗,主诉症状为咳嗽和较高的血清CEA指标,对生存的影响有统计学意义(P<0.05),为可影响本组患者生存预后的独立危险因素。
3 讨论对本组临床背景复杂的NSCLC合并COPD患者的研究显示,随着患者年龄增大,Gold分级越重,TNM分期越晚,病理类型为鳞癌,起始治疗非手术,以及主诉症状为咳嗽和较高的血清CEA指标是影响生存预后的独立危险因子。
COPD和肺癌的发病由多种复杂机制决定,环境和基因因素相互作用,共同影响疾病的过程。目前认为,遗传背景以及慢性炎症反应是COPD合并肺癌的关键因素。COPD是一种慢性炎症性疾病,COPD的严重程度与炎症细胞浸润程度有关,通常认为烟草暴露是导致肺部慢性炎症的最主要原因,而肺部慢性炎症可能促进肺癌的发生。Vagulienė等[11]研究发现,患者血清C反应蛋白(CRP)在肺癌合并COPD患者中的水平明显高于单纯COPD或健康对照人群。COPD和NSCLC均被视为老年性疾病,本研究纳入的是我院老年病区的患者,该人群中有吸烟史患者的比例较大,在排除不合格病例后的200例患者中,确诊为COPD的比例为53.5%,有吸烟史和吸烟指数>20包年的患者分别占70.1%和58.9%。从上述数据可以看出,吸烟、炎症、COPD、肺癌存在一定的内在联系。但有研究显示,有长期吸烟史的群体中只有7%~10%会引发肺癌[12],所以吸烟并非是导致肺癌产生的唯一原因,从本研究的结论来看,本组NSCLC合并COPD的患者,吸烟指数并非是独立的预后因素,这可能是本研究缺乏非COPD对照组或健康对照组的结果。这可在以后的随访研究中加以完善。
FEV1.0/FVC、FEV1.0% pred是诊断COPD和肺功能分级评估的主要指标。荟萃分析表明FEV1.0降低的吸烟者与FEV1.0正常的吸烟者相比,肺癌发病率增加[13],其中,男性肺癌发病率是FEV1.0正常者2.23倍,女性则是3.97倍。然而FEV1.0与肺癌发病率并非完全呈正相关,有研究发现,肺癌发病率在GOLD1/2度COPD患者明显高于3/4度患者,有学者认为这可能与生存效应有关[14]。我们的研究显示1~2度COPD患者占到80%以上,肺癌发病率确实远远大于Gold 3/4度患者,从生存分析上来看,Gold 1,2度患者的中位生存时间比3/4度患者显著延长,分别是51.7个月,43.1个月与16.9个月,在COX回归模型中,无论是单因素,还是多因素分析,Gold 1度患者比3/4度可显著降低死亡风险,1度和2度比较,P值接近0.05 (P=0.052)。从我们的研究结果可以看出,肺功能Gold分级可以作为NSCLCOPD患者的生存预测因子。Qin等的研究结论与我们的一致[15],他们入组206例老年NSCLC-COPD患者,在多因素分析中发现肺功能Gold分度是可以判断患者预后的独立预测因子(OR=0.455,P=0.011)。本研究进一步分析了COPD控制水平对该组患者生存预后的影响,我们发现给予正规治疗的COPD患者,如3个月内肺功能Gold分级改善,是良好预后的独立因子之一。肺癌的积极治疗是建立在良好的肺功能储备之上的,对治疗决策起到决定性作用,外科或放疗科医生对肺功能较差的患者或许更愿意采取保守的治疗态度。
肺叶切除并纵膈淋巴结清扫是Ⅰ~Ⅲa期NSCLC的标准治疗模式,对不能耐受手术的早期患者,通常会选择放疗,近些年以射波刀(Cyberknife)为主的立体定向外科技术进展迅速,已使部分患者,尤其是老年NSCLC从中获益[16-19]。因本组患者整体年龄偏大并确诊COPD,病理分期为Ⅲa的患者太少,且无Ⅲa期接受手术的患者,所以统一划分为Ⅲ期。本研究中Ⅰ~Ⅱ期患者占56.1%,起始治疗为手术或放疗的占58.9%,但有部分起始放疗的患者是分期较晚的姑息性放疗,如阻塞性肺炎,癌性疼痛,病情进展致放疗计划未完成等。相对于放疗,化疗及BSC,仅有起始接受手术治疗的患者获益是最大的,当然,这与患者TNM分期具有相关性,本研究同样也发现分期越早,生存预后良好。
通过对本组NSCLC合并COPD患者的生存分析,发现本研究观察对象与整体NSCLC人群的生存预后有相似之处,比如年龄越大,TNM分期越晚,病理类型为鳞癌,血清CEA指标越高等,均被视为不良预后的因素[20-23]。其中鳞癌作为预后较差的风险因子,主要是近些年以来,以EGFR-TKI和ALK-TKI为代表的分子靶向药物在EGFR基因活化突变和ALK基因融合重排患者中取得了惊人的疗效[24-26],而这些驱动基因的改变在肺腺癌中发生率较高,而在鳞癌中突变率则很低[27-29],肺鳞癌的治疗仍然是以化疗为主的治疗模式,有效率较低,预后不良。血清CEA水平是临床中最常用的肿瘤标记物之一,多项回顾性研究报道CEA水平是判断NSCLC病理分期[23],EGFR突变亚型预后[30]及NSCLC伴脑转移预后[31]的独立预测因子,本研究与之有相似结论。
肺癌本身引起的症状总体来说并不特异,常见的有:(1) 咳嗽,在初期易被误认为是呼吸道感染;(2) 由于癌组织血管丰富,约21%以上的肺癌患者有咯血;(3) 由于肿瘤阻塞气道,或出现胸腔积液,肺叶压缩性不张,常引起呼吸困难,喘鸣,胸闷,气短。在诸多类似研究中,很少有研究者把患者主诉症状纳入对生存预后的分析当中,但本课题组的前期研究发现[32],有肺癌相关症状患者的整体预后要劣于无主诉症状的肺癌患者,在本研究中,因上述3种症状而就诊的患者占35.5%,其中咳嗽是最常见症状,也是本研究发现的影响预后的独立因子之一。
总而言之,COPD与NSCLC的发病之间存在诸多危险因素。本研究纳入老年病房确诊NSCLC合并COPD的患者,吸烟患者,TNMⅠ/Ⅱ期患者,Gold1/2度患者比例较高,Gold 1,2度患者的中位生存时间比3/4度患者显著延长,COX比例风险回归模型显示,随着患者年龄增大,Gold分级越重,TNM分期越晚,病理类型为鳞癌,起始治疗非手术,以及主诉症状为咳嗽和较高的血清CEA指标是影响本组患者生存预后的独立危险因子。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-32. DOI: 10.3322/caac.21338. |
| [2] | Qaseem A, Wilt TJ, Weinberger SE, et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the american college of physicians, american college of chest physicians, american thoracic society, and european respiratory society[J]. Ann Intern Med, 2011, 155(3): 179-91. DOI: 10.7326/0003-4819-155-3-201108020-00008. |
| [3] | Vestbo J, Hurd SS, Agusti AG, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease Gold executive summary[J]. Am J Respir Crit Care Med, 2013, 187(4): 347-65. DOI: 10.1164/rccm.201204-0596PP. |
| [4] | Potton E, Mccaughan F, Janes S. Chronic obstructive pulmonary disease and lung cancer[J]. Res Med: COPD Update, 2009, 5(2): 34-7. DOI: 10.1016/j.rmedu.2009.07.001. |
| [5] | Young RP, Hopkins RJ. How the genetics of lung cancer may overlap with COPD[J]. Respirology, 2011, 16(7): 1047-55. DOI: 10.1111/res.2011.16.issue-7. |
| [6] | Zhai R, Yu X, Shafer A, et al. The impact of coexisting COPD on survival of patients with early-stage non-small cell lung cancer undergoing surgical resection[J]. Chest, 2014, 145(2): 346-53. DOI: 10.1378/chest.13-1176. |
| [7] | Sekine Y, Yamada Y, Chiyo M, et al. Association of chronic obstructive pulmonary disease and tumor recurrence in patients with stage IA lung cancer after complete resection[J]. Ann Thorac Surg, 2007, 84(3): 946-50. DOI: 10.1016/j.athoracsur.2007.04.038. |
| [8] | Lee SJ, Lee J, Park YS, et al. Impact of chronic obstructive pulmonary disease on the mortality of patients with non-small-cell lung cancer[J]. J Thora Oncol, 2014, 9(6): 812-7. DOI: 10.1097/JTO.0000000000000158. |
| [9] | Gullon JA, Suarez I, Medina A, et al. Role of emphysema and airway obstruction in prognosis of lung cancer[J]. Lung Cancer, 2011, 71(2): 182-5. DOI: 10.1016/j.lungcan.2010.05.018. |
| [10] | Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease[EB/OL][2017-05-31]. http://Goldcopd.org/Gold-2017-global-strategy-diagnosis-managementprevention-copd. |
| [11] | Vaguliene N, Zemaitis M, Miliauskas SA, et al. Comparison of C-reactive protein levels in patients with lung cancer and chronic obstructive pulmonary disease[J]. Medicina (Kaunas), 2011, 47(8): 421-7. |
| [12] | Divo M, Cote C, de Torres JP, et al. Comorbidities and risk of mortality in patients with chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2012, 186(2): 155-61. DOI: 10.1164/rccm.201201-0034OC. |
| [13] | Wasswa-Kintu S, Gan WQ, Man SF, et al. Relationship between reduced forced expiratory volume in one second and the risk of lung cancer: a systematic review and meta-analysis[J]. Thorax, 2005, 60(7): 570-5. DOI: 10.1136/thx.2004.037135. |
| [14] | de Torres JP, Marín JM, Casanova C, et al. Lung cancer in patients with chronic obstructive pulmonary disease-incidence and predicting factors[J]. Am J Respir Crit Care Med, 2011, 184(8): 913-9. DOI: 10.1164/rccm.201103-0430OC. |
| [15] | Qin JW, Li GS, Zhou JM. Characteristics of elderly patients with COPD and newly diagnosed lung cancer, and factors associated with treatment decision[J]. Int J Chron Obstruct Pulmon Dis, 2016, 11(4): 1515-20. |
| [16] | Timmerman R, Paulus R, Galvin J, et al. Stereotactic body radiation therapy for inoperable early stage lung cancer[J]. JAMA, 2010, 303(11): 1070-6. DOI: 10.1001/jama.2010.261. |
| [17] | Verstegen NE, Oosterhuis JW, Palma DA, et al. Stage I-II nonsmall-cell lung cancer treated using either stereotactic ablative radiotherapy (SABR) or lobectomy by video-assisted thoracoscopic surgery (VATS): outcomes of a propensity score-matched analysis[J]. Ann Oncol, 2013, 24(6): 1543-8. DOI: 10.1093/annonc/mdt026. |
| [18] | Palma D, Visser O, Lagerwaard FJ, et al. Treatment of stage I NSCLC in elderly patients: a population-based matched-pair comparison of stereotactic radiotherapy versus surgery[J]. Radiother Oncol, 2011, 101(2): 240-4. DOI: 10.1016/j.radonc.2011.06.029. |
| [19] | Wang P, Zhang D, Guo XG, et al. A propensity-matched analysis of surgery and stereotactic body radiotherapy for early stage non-small cell lung cancer in the elderly[J]. Medicine, 2016, 95(52): e5723. DOI: 10.1097/MD.0000000000005723. |
| [20] | Ramalingam SS, Dahlberg SE, Langer CJ, et al. Outcomes for elderly, advanced-stage non-small-cell lung cancer patients treated with bevacizumab in combination with carboplatin and paclitaxel: analysis of eastern cooperative oncology group trial 4599[J]. J Clin Oncol, 2008, 26(1): 60-5. DOI: 10.1200/JCO.2007.13.1144. |
| [21] | Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26(21): 3543-51. DOI: 10.1200/JCO.2007.15.0375. |
| [22] | Shim HS, Park IK, Lee CY, et al. Prognostic significance of visceral pleural invasion in the forthcoming (seventh) edition of TNM classification for lung cancer[J]. Lung Cancer, 2009, 65(2): 161-5. DOI: 10.1016/j.lungcan.2008.11.008. |
| [23] | Kawachi R, Suzuki K, Kunitoh H, et al. Prognosis of lung cancer patients with high preoperative carcinoembryonic antigen (CEA) level: Are they surgical candidates[J]. J Clin Oncol, 2004, 22(14, S): 661S. |
| [24] | Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutationpositive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12(8): 735-42. DOI: 10.1016/S1470-2045(11)70184-X. |
| [25] | Wu YL, Zhou CC, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15(2): 213-22. DOI: 10.1016/S1470-2045(13)70604-1. |
| [26] | Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer[J]. N Engl J Med, 2014, 371(23): 2167-77. DOI: 10.1056/NEJMoa1408440. |
| [27] | Thatcher N, Chang A, Parikh P, et al. Gefitinib plus best supportive care in previously treated patients with refractory advanced nonsmall-cell lung cancer: results from a randomised, placebocontrolled, multicentre study (Iressa Survival Evaluation in Lung Cancer)[J]. Lancet, 2005, 366(9496): 1527-37. DOI: 10.1016/S0140-6736(05)67625-8. |
| [28] | Chang A, Parikh P, Thongprasert S, et al. Gefitinib (IRESSA) in patients of Asian origin with refractory advanced non-small cell lung cancer: subset analysis from the ISEL study[J]. J Thorac Oncol, 2006, 1(8): 847-55. DOI: 10.1016/S1556-0864(15)30415-9. |
| [29] | Solomon B, Varella-Garcia M, Camidge DR. ALK gene rearrangements a new therapeutic target in a molecularly defined subset of non-small cell lung cancer[J]. J Thorac Oncol, 2009, 4(12): 1450-4. DOI: 10.1097/JTO.0b013e3181c4dedb. |
| [30] | Jiang R, Wang X, Li K. Predictive and prognostic value of preoperative serum tumor markers is EGFR mutation-specific in resectable non-small-cell lung cancer[J]. Oncotarget, 2016, 7(18): 26823-36. DOI: 10.18632/oncotarget.v7i18. |
| [31] | Wei HP, Su M, Lin RF, et al. Prognostic factors analysis in EGFR mutation-positive non-small cell lung cancer with brain metastases treated with whole brain-radiotherapy and EGFR-tyrosine kinase inhibitors[J]. Oncol Lett, 2016, 11(3): 2249-54. |
| [32] | 王鹏. 老年非小细胞肺癌患者临床特点及预后因素分析[D]. 北京: 中国人民解放军医学院, 2012. http://cdmd.cnki.com.cn/Article/CDMD-90030-1012432679.htm |
 2017, Vol. 37
2017, Vol. 37

