2. 蚌埠医学院第一附属医院 骨科,安徽 蚌埠 233004;
3. 蚌埠医学院第一附属医院 消化科,安徽 蚌埠 233004
2. Department of Orthopedics, First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China;
3. Department of Gastroenterology, First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
鼻咽癌(NPC)是最常见的恶性肿瘤之一,为耳鼻喉科常见的恶性肿瘤,发病率有逐年上升趋势,且预后较差,主要是由于其发生的分子机制不清楚及患者易出现耐药状况。因此,加强鼻咽癌的基础和临床研究意义重大。目前临床上鼻咽癌的首选疗法是放疗,但这种疗法仅局限于早期的原位癌,且患者的5年生存率较低。放疗联合化疗可明显提高鼻咽癌的治愈率,但化疗中出现的毒副作用和耐药性等问题制约了其临床应用[1]。近年来,发现新的治疗靶点是鼻咽癌治疗的热点之一。单羧酸转运蛋白(MCT)是一类跨膜转运蛋白,其主要参与调控乳酸、丙酮酸等酸性产物的跨膜转运,进而维持机体内环境的动态平衡。研究发现人类MCT家族已发现有14个成员,其中,MCT1在大多数肿瘤细胞的细胞膜上异常高表达,且具有保护细胞产生耐药的作用,影响治疗和预后[2-4],但是MCT1在鼻咽癌耐药中的研究则未见报道。因此,本研究拟采用siRNA转染技术沉默鼻咽癌细胞HNE1/DDP中MCT1的表达,观察其对顺铂(cisplatin, DDP)诱导凋亡敏感性的影响,并对其机制进行初步探讨,以期为鼻咽癌的临床治疗提供新的靶点。
1 材料和方法 1.1 细胞株和细胞培养人鼻咽癌细胞HNE1、HNE1/DDP均购于中南大学湘雅医学院,蚌埠医学院生化药理研究室保存。培养于含10%胎牛血清的RPMI 1640培养液中,置37 ℃、饱和湿度、5% CO2的细胞培养箱中培养。
1.2 主要试剂RPMI 1640培养基、胎牛血清、胰蛋白酶:美国Gibco公司;DDP:齐鲁制药有限公司;二甲基亚砜(DMSO)、MTT、碘化丙啶(PI):Sigma公司;线粒体膜电位检测试剂盒(JC-1):碧云天生物技术有限公司;LipofectamineTM 2000:Invitrogen公司;兔抗人MCT1抗体:Millipore公司;兔抗人Mcl-1、Bak、Bcl-2、Bax、β-actin抗体:Santa Cruz公司;山羊抗兔IgG:Abcam公司;MCT1 siRNA:上海吉玛制药技术有限公司(序列:表 1)
| 表 1 MCT1 siRNA的序列 Table 1 Sequences of MCT1 siRNAs |
将对数生长期的HNE1/DDP细胞接种于6孔板,每孔1×105细胞,待细胞生长至70%汇合时按照最佳转染比例进行转染。根据siRNA试剂盒说明书进行操作,siRNA与脂质体LipofectamineTM 2000的比例为1pmol: 0.1 μL,置于37 ℃、饱和湿度、5% CO2培养箱中继续培养4~6 h后,更换为含10%胎牛血清的培养液。加药组在转染24 h后加8 μmol/L DDP处理细胞。所有实验组均在转染后48 h收集细胞。
1.4 MTT法检测细胞存活率取对数生长期、经MCT1 siRNA转染成功前后的HNE1/DDP细胞接种于96孔板中,每孔5×103细胞,培养24 h后,用不同浓度的DDP (2、4、8、16、32 μmol/L)处理,同时设阴性对照组和空白对照组(含培养基不含药物与细胞),每组设5个复孔。继续培养24 h后每孔各加入15 µL MTT (以PBS配成5 g/L)的溶液孵育4 h,弃去培养液,每孔加入DMSO溶液150 μL,置37 ℃烘箱内孵育30 min,用微量振荡器振荡10 min使结晶物充分溶解,酶标仪在490 nm波长下检测每孔的吸光度(A)。计算细胞存活率/%:细胞存活率/%= (实验组A-空白对照组A) (/阴性对照组A-空白对照组A) ×100%。实验重复3次。
1.5 PI染色检测细胞凋亡将对数生长期的HNE1/DDP细胞接种于6孔板,每孔1×105细胞,待细胞生长至70%~90%时按照试验设计进行转染,分为加药组、转染组及两者合用组,加药组在转染24 h后加8 μmol/L DDP,继续培养24 h后收集经不同处理的HNE1/DDP细胞,冰冷PBS洗涤2遍,加入70%乙醇固定于4 ℃保存24 h后,经PI染色,流式细胞仪检测细胞凋亡情况,具有亚G1期DNA含量的细胞比例,代表凋亡细胞数。以上实验重复3次。
1.6 JC-1染色检测线粒体膜电位变化细胞处理方法同上。配制JC-1染色工作液(参照试剂盒说明书操作),每孔加入0.5 mL,充分混匀后于37 ℃孵育20 min,再用预冷的JC-1染色缓冲液(1×)洗涤2次,冰冷保存。荧光显微镜检测并分别拍照(尽量在30 min内完成检测)。以上实验重复3次。
1.7 Western blot检测蛋白表达收集经不同处理的HNE1/DDP细胞,用蛋白裂解液(碧云天生物技术有限公司)冰上裂解30 min,4℃ 12 000 r·min-1离心30 min提取细胞总蛋白,BCA蛋白定量法(参照试剂盒说明书操作)测定各组蛋白浓度。根据测出的蛋白浓度将其进行稀释配平,然后分别与2×上样缓冲液1:1混合,100 ℃煮沸5 min使蛋白质变性。每组取40 μg蛋白,12% SDS-PAGE电泳(70 V,30 min;120 V,90 min);转膜(50 V,150 min)至PVDF膜;Western封闭液室温封闭2 h;一抗1:1000室温孵育2 h (或4 ℃过夜);二抗1:2000室温孵育2 h;ECL发光试剂盒暗室发光、显影、定影;Bio-Rad凝胶成像系统获取图像。
1.8 统计学方法实验数据以均数±标准差表示,采用SPSS 19.0统计软件对数据进行方差分析及Dunnette-t检验,以P<0.05为差异有统计学意义。
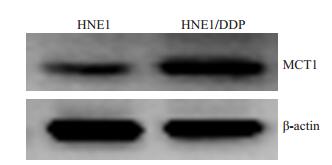
2 结果 2.1 MCT1在HNE1和HNE1/DDP细胞中的表达与鼻咽癌亲本细胞HNE1相比,HNE1/DDP细胞中MCT1的表达水平明显提高(0.4±0.09 vs 1.10±0.12,P<0.05),提示MCT1可能在DDP耐药鼻咽癌细胞中发挥了重要的作用(图 1)。
|
图 1 MCT1在HNE1和HNE1/DDP细胞中的表达 Figure 1 Expression of MCT1 in HNE1 and HNE1/DDP cells. |
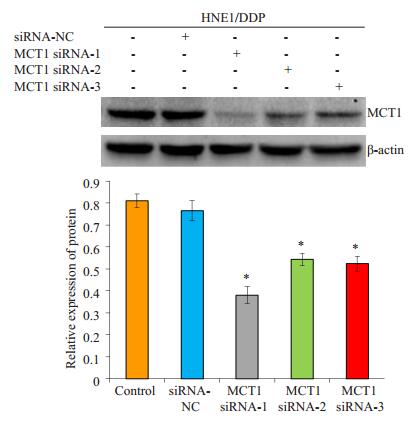
在HNE1/DDP细胞中转染MCT1 siRNA 48 h后,Western blot结果显示,与对照组比,3种MCT1的siRNA均能导致HNE1/DDP细胞中MCT1的表达水平降低(图 2)。其中,MCT1 siRNA-1的干扰效果最显著,被选用于后续实验。
|
图 2 MCT1 siRNA对HNE1/DDP细胞中MCT1蛋白表达的影响 Figure 2 Effects of 3 MCT1 siRNAs on the expression of MCT1 protein in HNE1/DDP cells detected by Western blotting. *P < 0.05 vs control or siRNA-NC group. |
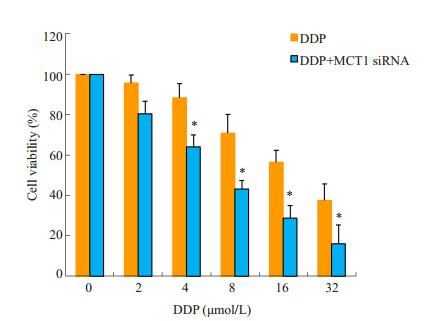
经MCT1 siRNA转染成功前后的HNE1/DDP细胞,用不同浓度的DDP (2、4、8、16、32 μmol·L-1)处理。MTT结果显示,与DDP组相比,MCT1 siRNA联合DDP组增加HNE1/DDP细胞对顺铂的敏感性,细胞的存活率明显降低(图 3,P<0.05)。提示MCT1能够介导鼻咽癌细胞对DDP的耐药,抑制MCT1的表达可部分逆转鼻咽癌细胞对DDP的耐药。
|
图 3 DDP对转染MCT1 siRNA后HNE1/DDP细胞存活率的影响 Figure 3 Effects of different concentrations of DDP on viability of HNE1/DDP cells transfected with MCT1 siRNA. *P < 0.05 vs DDP group. |
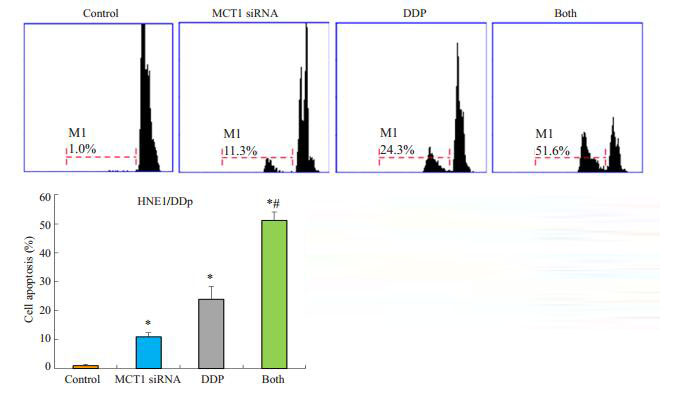
收集经不同处理的HNE1/DDP细胞,采用流式细胞仪检测细胞凋亡情况。PI染色法结果显示,DDP (8 μmol/L)作用于HNE1/DDP细胞的凋亡率为(23.86± 4.40) %,MCT1 siRNA组的凋亡率为(10.95±1.39) %,与对照组相比差异具有统计学意义(图 4,P<0.05);MCT1 siRNA联合DDP组的凋亡率为(51.23±2.86) %,与对照组和单独处理组相比差异具有统计学意义(图 4,P<0.05),提示MCT1 siRNA可增强鼻咽癌细胞HNE1/ DDP对DDP诱导凋亡的作用。
|
图 4 MCT1 siRNA、DDP及两者合用对HNE1/DDP细胞凋亡的影响 Figure 4 Effects of MCT1 siRNA, DDP, either alone or in combination, on apoptosis of HNE1/DDP cells. *P < 0.05 vs control group; #P < 0.05 vs the other 3 groups. |
JC-1是一种广泛用于检测线粒体膜电位的荧光探针,通过JC-1从红色荧光到绿色荧光的转变作为细胞早期凋亡的一个检测指标。荧光显微镜观察可见,MCT1 siRNA联合DDP作用于HNE1/DDP细胞后,红色荧光减弱,而绿色荧光增强,较对照组和单独处理组变化明显(图 5),提示MCT1 siRNA联合DDP作用于细胞后,细胞发生了早期凋亡。
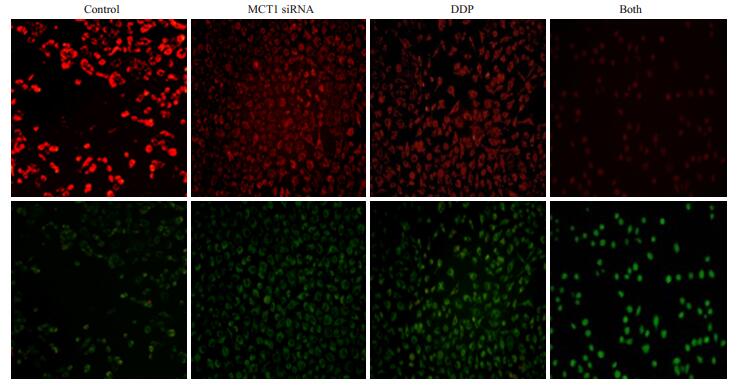
|
图 5 MCT siRNA、DDP及两者合用对HNE1/DDP细胞线粒体膜电位的影响 Figure 5 Effects of MCT1 siRNA and DDP, either alone or in combination, on mitochondrial membrane potential of HNE1/ DDP cells (Original magnification: ×200). |
MCT1 siRNA、DDP及二者联合作用于HNE1/DDP细胞后,Western blot检测Mcl-1、Bcl-2、Bax、Bak蛋白的表达。结果显示,与对照组和单独处理组相比,MCT1 siRNA联合DDP能够下调抗凋亡蛋白Mcl-1、Bcl-2的表达,上调促凋亡蛋白Bax的表达,而对促凋亡蛋白Bak的表达无明显影响(图 6),提示MCT1 siRNA对HNE1/DDP细胞中DDP诱导凋亡与下调Mcl-1、Bcl-2和上调Bax有关。
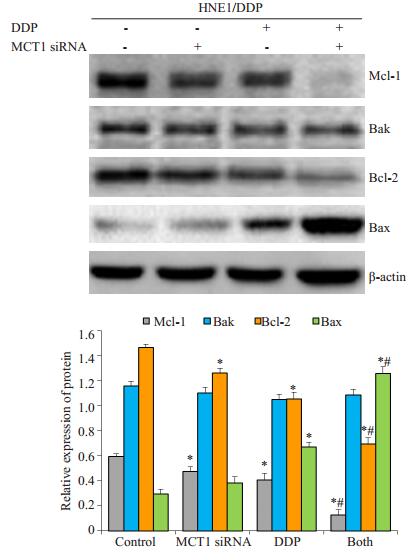
|
图 6 MCT siRNA、DDP及两者合用对HNE1/DDP细胞Mcl-1、Bak、Bcl-2、Bax蛋白表达的影响 Figure 6 Effects of MCT1 siRNA and DDP, either alone or in combination, on the expression of Mcl-1, Bak, Bcl-2, and Bax in HNE1/DDP cells. *P < 0.05 vs control group; #P < 0.05 vs the other 3 groups. |
肿瘤化疗耐药是临床上制约肿瘤化疗疗效的关键性难题。究其原因,主要是不同的患者对化疗药物的敏感性不同,所有肿瘤(包括鼻咽癌)对临床上的化疗药物均可以产生多药耐药(MDR);它既是肿瘤治疗的主要障碍,也是肿瘤复发的主要因素[5]。因此,为了提高NPC的治愈率,我们选择DDP耐药细胞(HNE1/DDP细胞)作为本实验的研究对象,从而阐明NPC耐药的分子机制并建立新的治疗策略以克服耐药。
肿瘤细胞主要生长在一种相对缺氧的环境中,糖酵解是其获取能量的一种主要方式。利用肿瘤细胞对糖酵解产生ATP高度依赖性,肿瘤组织酸性微环境特征以及肿瘤MDR相关ABC蛋白家族成员依赖ATP供能的共性,糖酵解旺盛的肿瘤细胞生长较快、侵袭性强、容易复发,导致其预后较差[6-8]。由于糖酵解会产生大量的乳酸、丙酮酸等酸性产物,将造成乳酸等底物的蓄积而反馈抑制糖酵解,同时导致细胞内酸化,抑制细胞生长。为了获得较高的糖酵解速率,使细胞快速生长,必须将乳酸等转运出细胞,主要通过一类跨膜转运蛋白(如MCT1) 来进行的。MCT1在大多数肿瘤细胞的细胞膜上异常高表达,如人结肠癌、乳腺癌、头颈癌、肺癌、胃癌等[9-11],这种异常高表达赋予了肿瘤细胞高糖酵解表型和酸抵抗表型。一方面,MCT1既能将细胞糖酵解代谢产生的乳酸排出胞外,又能促进对胞外乳酸的摄取,使乳酸作为能源物质加以代谢;另一方面,MCT1通过介导乳酸、丙酮酸等的跨膜转运来维持肿瘤微环境处于弱酸化状态,这种特殊的酸性微环境,不仅直接影响着肿瘤生长、微血管形成、浸润及转移,也密切参与了肿瘤细胞MDR的形成[12-14]。抑制MCT1的表达后,肿瘤细胞对乳酸的摄取减少,将降低细胞内的pH值,从而影响肿瘤细胞的增殖及转移,并导致细胞凋亡[15]。更重要的是,抑制MCT1的表达会增强肿瘤细胞对化疗药物的敏感性[16]。可见,MCT1与肿瘤之间存在密切的联系,且在肿瘤的发生发展中扮演重要角色。从某种意义上讲,肿瘤细胞这种独特的能量代谢模式为解决肿瘤MDR的难题提供了契机。本实验研究发现,MCT1在DDP耐药NPC细胞HNE1/DDP中高表达,提示MCT1可望作为NPC治疗的潜在靶标,抑制MCT1的表达可增加HNE1/DDP细胞对顺铂的敏感性,部分逆转鼻咽癌细胞对DDP的耐药。此外,抑制MCT1的表达可增强鼻咽癌细胞HNE1/DDP对DDP诱导凋亡的作用。
近年来研究发现,死亡受体途径和线粒体途径是主要的细胞凋亡通路,而JC-1是一种广泛用于检测线粒体膜电位∆Ψm的理想荧光探针[17]。在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物(J-aggregates),可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体状态,可以产生绿色荧光。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件[18]。通过JC-1从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,同时也可以用JC-1从红色荧光到绿色荧光的转变作为细胞凋亡早期的一个检测指标[19]。本实验研究发现,MCT1 siRNA联合DDP后,红色荧光减弱,而绿色荧光增强,较对照组和单独处理组变化明显,说明细胞发生了早期凋亡。同时,Bcl-2家族成员,包括抗凋亡蛋白Mcl-1、Bcl-2和促凋亡蛋白Bak、Bax,与线粒体介导的细胞凋亡通路密切相关,当细胞受到外界刺激被激活后,能够促进线粒体膜通透性增加[20]。Mcl-1和Bcl-2在结构和功能上相似,具有保护线粒体膜的完整性,并在肿瘤(包括鼻咽癌)的发生发展和MDR中发挥重要作用[21-23]。然而,Bak和Bax在线粒体凋亡途径中主要通过调控各种凋亡诱导因子来发挥作用,如细胞色素C、凋亡诱导因子(AIF)等[24-26]。为了进一步阐明细胞凋亡的分子机制,本实验研究发现,与对照组和单独处理组相比,MCT1 siRNA联合DDP能够下调抗凋亡蛋白Mcl-1、Bcl-2的表达,上调促凋亡蛋白Bax的表达,而对促凋亡蛋白Bak的表达无明显影响。提示MCT1 siRNA增强鼻咽癌细胞HNE1/DDP对DDP诱导的凋亡可能与Mcl-1和Bcl-2的下调和Bak上调有关。
综上所述,靶向MCT1的基因治疗是逆转肿瘤的化疗耐药的新方法之一,本研究证明了MCT1 siRNA可增强鼻咽癌HNE1/DDP细胞对DDP诱导凋亡的敏感性,其机制可能是通过下调Mcl-1和Bcl-2的表达和上调Bax的表达,但其具体的分子机制有待于进一步研究。
| [1] | Zhang P, Hong H, Sun X, et al. MicroRNA-10b regulates epithelial-mesenchymal transition by modulating KLF4/Notch1/ E-cadherin in cisplatin-resistant nasopharyngeal carcinoma cells[J]. Am J Cancer Res, 2016, 6(2): 141-56. |
| [2] | De Saedeleer CJ, Porporato PE, Copetti T, et al. Glucose deprivation increases monocarboxylate transporter 1 (MCT1) expression and MCT1-dependent tumor cell migration[J]. Oncogene, 2014, 33(31): 4060-8. DOI: 10.1038/onc.2013.454. |
| [3] | Caruso JP, Koch BJ, Benson PD, et al. pH, lactate, and hypoxia: reciprocity in regulating high-affinity monocarboxylate transporter expression in glioblastoma[J]. Neoplasia, 2017, 19(2): 121-34. DOI: 10.1016/j.neo.2016.12.011. |
| [4] | Hu KY, Wang de G, Liu PF, et al. Targeting of MCT1 and PFKFB3 influences cell proliferation and apoptosis in bladder cancer by altering the tumor microenvironment[J]. Oncol Rep, 2016, 36(2): 945-51. |
| [5] | Jamshed A, Hussain R, Iqbal H. Gemcitabine and cisplatin followed by chemo-radiation for advanced nasopharyngeal carcinoma[J]. Asian Pac J Cancer Prev, 2014, 15(2): 899-904. DOI: 10.7314/APJCP.2014.15.2.899. |
| [6] | Miranda-Goncalves V, Honavar M, Pinheiro CA, et al. Monocarboxylate transporters (MCTs) in gliomas: expression and exploitation as therapeutic targets[J]. Neuro Oncol, 2013, 15(2): 172-88. DOI: 10.1093/neuonc/nos298. |
| [7] | Li L, Kang L, Zhao W, et al. miR-30a-5p suppresses breast tumor growth and metastasis through inhibition of LDHA-mediated warburg effect[J]. Cancer Lett, 2017, 400: 89-98. DOI: 10.1016/j.canlet.2017.04.034. |
| [8] | Cappelli E, Cuccarolo P, Stroppiana G, et al. Defects in mitochondrial energetic function compels fanconi anaemia cells to glycolytic metabolism[J]. Biochim Biophys Acta, 2017, 1863(6): 1214-21. DOI: 10.1016/j.bbadis.2017.03.008. |
| [9] | Curry JM, Tuluc M, Whitaker-Menezes DA, et al. Cancer metabolism, stemness and tumor recurrence: MCT1 and MCT4 are functional biomarkers of metabolic symbiosis in head and neck cancer[J]. Cell Cycle, 2013, 12(9): 1371-84. DOI: 10.4161/cc.24092. |
| [10] | Amorim R, Pinheiro C, Miranda-Gon?alves V, et al. Monocarboxylate transport inhibition potentiates the cytotoxic effect of 5-fluorouracil in colorectal cancer cells[J]. Cancer Lett, 2015, 365(1): 68-78. DOI: 10.1016/j.canlet.2015.05.015. |
| [11] | Liu Z, Sun Y, Hong H, et al. 3-bromopyruvate enhanced daunorubicin-induced cytotoxicity involved in monocarboxylate transporter 1 in breast cancer cells[J]. Am J Cancer Res, 2015, 5(9): 2673-85. |
| [12] | Gray AL, Coleman DT, Shi R, et al. Monocarboxylate transporter 1 contributes to growth factor-induced tumor cell migration independent of transporter activity[J]. Oncotarget, 2016, 7(22): 32695-706. DOI: 10.18632/oncotarget.v7i22. |
| [13] | Shen C, Chen R, Qian Z, et al. Intestinal absorption mechanisms of MTBH, a novel hesperetin derivative, in Caco-2 cells, and potential involvement of monocarboxylate transporter 1 and multidrug resistance protein 2[J]. Eur J Pharm Sci, 2015, 78: 214-24. DOI: 10.1016/j.ejps.2015.07.022. |
| [14] | Yan C, Yang F, Zhou C, et al. MCT1 promotes the cisplatinresistance by antagonizing fas in epithelial ovarian cancer[J]. Int J Clin Exp Pathol, 2015, 8(3): 2710-8. |
| [15] | Bola BM, Chadwick AL, Michopoulos F, et al. Inhibition of monocarboxylate transporter-1 (MCT1) by AZD3965 enhances radiosensitivity by reducing lactate transport[J]. Mol Cancer Ther, 2014, 13(12): 2805-16. DOI: 10.1158/1535-7163.MCT-13-1091. |
| [16] | Doherty JR, Yang CY, Scott KE, et al. Blocking lactate export by inhibiting the Myc target MCT1 disables glycolysis and glutathione synthesis[J]. Cancer Res, 2014, 74(3): 908-20. DOI: 10.1158/0008-5472.CAN-13-2034. |
| [17] | Mo XQ, Wei HY, Huang GR, et al. Molecular mechanisms of apoptosis in hepatocellular carcinoma cells induced by ethanol extracts of solanum lyratum thumb through the mitochondrial pathway[J]. World J Gastroenterol, 2017, 23(6): 1010-7. DOI: 10.3748/wjg.v23.i6.1010. |
| [18] | Li Y, Liu B, Yang F, et al. Lobaplatin induces BGC-823 human gastric carcinoma cell apoptosis via ROS-mitochondrial apoptotic pathway and impairs cell migration and invasion[J]. Biomed Pharmacother, 2016, 83: 1239-46. DOI: 10.1016/j.biopha.2016.08.053. |
| [19] | Pinkhien T, Maiuthed A, Chamni S, et al. Bishydroquinone renieramycin M induces apoptosis of human lung cancer cells through a mitochondria-dependent pathway[J]. Anticancer Res, 2016, 36(12): 6327-33. DOI: 10.21873/anticanres. |
| [20] | Liu M, Li SJ, Xin YN, et al. Ferric nitrilotriacetate (FeNTA)-induced reactive oxidative species protects human hepatic stellate cells from apoptosis by regulating Bcl-2 family proteins and mitochondrial membrane potential[J]. Int J Clin Exp Med, 2015, 8(10): 18074-81. |
| [21] | Pal MK, Jaiswar SP, Srivastav AK, et al. Synergistic effect of piperine and paclitaxel on cell fate via cyt-c, Bax/Bcl-2-caspase-3 pathway in ovarian adenocarcinomas SKOV-3 cells[J]. Eur J Pharmacol, 2016, 791: 751-62. DOI: 10.1016/j.ejphar.2016.10.019. |
| [22] | Kim S, Kim DE, Kwon TK, et al. The multi-target drug BAI induces apoptosis in various human cancer cells through modulation of Bcl-xL protein[J]. Int J Oncol, 2016, 49(6): 2620-8. |
| [23] | Su CH, Kuo CL, Lu KW, et al. Fisetin-induced apoptosis of human oral cancer SCC-4 cells through reactive oxygen species production, endoplasmic reticulum stress, caspase-, and mitochondria-dependent signaling pathways[J]. Environ Toxicol, 2017, 32(6): 1725-41. DOI: 10.1002/tox.v32.6. |
| [24] | Liang J, Yu Y, Wang B, et al. Ginsenoside Rb1 attenuates oxygen-glucose deprivation-induced apoptosis in SH-SY5Y cells via protection of mitochondria and inhibition of AIF and cytochrome c release[J]. Molecules, 2013, 18(10): 12777-92. DOI: 10.3390/molecules181012777. |
| [25] | Kwak GH, Kim TH, Kim HY. Down-regulation of MsrB3 induces cancer cell apoptosis through reactive oxygen species production and intrinsic mitochondrial pathway activation[J]. Biochem Biophys Res Commun, 2017, 483(1): 468-74. DOI: 10.1016/j.bbrc.2016.12.120. |
| [26] | Bénit P, Pelhaître A, Saunier E, et al. Paradoxical inhibition of glycolysis by pioglitazone opposes the mitochondriopathy caused by AIF deficiency[J]. EBioMedicine, 2017, 17: 75-87. DOI: 10.1016/j.ebiom.2017.02.013. |
 2017, Vol. 37
2017, Vol. 37

