2. 清远市妇幼保健院外科,广东 清远 511500
2. Department of Surgery, Qingyuan Maternal and Child Health Hospital, Qingyuan 511500, China
核仁素(nucleolin,又称C23) 是目前发现的271种核仁蛋白质中含量最多的一种,约占核仁蛋白质总量的10%。核仁素是一种穿梭蛋白,也是一种DNA/RNA结合蛋白,在不同类型的细胞,它可能存在于不同部位[1-4]。核仁素有广泛的生物学功能,据文献报道[5-11],Nucleolin可调控核糖体的生物合成与成熟,调控细胞增殖、生长、胞质分裂、染色质复制与核仁的发生,促进细胞增殖,抗细胞凋亡,影响病毒复制及协助病原体侵袭等,核仁素还作为一种穿梭蛋白和细胞表面受体,参与细胞核与细胞浆之间的物质转运以及细胞核功能的细胞外调节[12-13]。
有研究显示[14],Nucleolin可调控胚胎干细胞的增殖、分化与凋亡。神经干细胞(NSCs)和胚胎干细胞一样,具有自我更新和多向分化潜能。那么核仁素对NSCs的作用是否和胚胎干细胞一样,能影响其增殖、分化、凋亡,关于这方面的研究目前未见文献报道。本研究构建针对大鼠nucleolin基因的siRNA重组腺病毒载体,将其转导入大鼠NSCs中,沉默其nucleolin基因的表达,了解nucleolin对NSCs分化的影响并初步探讨其机制。
1 材料和方法 1.1 材料 1.1.1 动物实验用新生1~3 d的Sprague-Dawley大鼠,由广东省医学实验动物中心提供。
1.1.2 主要试剂RNA提取试剂TRIzol购自Invotrigen;M-MLV反转录酶购自Promega;Phusion、Q5 DNA聚合酶、T4 DNA Ligase、限制性内切酶购自NEB;DNA相对分子质量Marker购自TaKaRa;质粒小量提取试剂盒、DNA凝胶纯化试剂盒购自天根公司;质粒大提试剂盒购自Qiagen;大肠杆菌DH5a、DH12S感受态细胞由本实验室保存;小鼠C23单克隆抗体、兔Wnt3多克隆抗体购自Santa Cruz;PCNA抗体购自BD Biosciences;小鼠Nestin抗体、小鼠β-actin抗体、兔β-catenin抗体、兔NSE抗体、兔GFAP抗体购自武汉博士德公司;Cy3标记羊抗兔IgG,FITC标记羊抗兔IgG,HRP标记的羊抗兔IgG,HRP标记的羊抗小鼠IgG,Cy3标记羊抗小鼠IgG均购自武汉博士德公司;DMEM/F12 (1:1) 培养基购自Hyclone;B27、碱性成纤维生长因子(bFGF)、表皮生长因子(EGF)购自Gibco BRL;胎牛血清购自杭州四季青生物工程公司。
1.1.3 质粒pShuttle质粒、pAdEasy质粒购自溯源精微科技有限公司。
1.2 方法 1.2.1 重组腺病毒载体的构建根据GenBank中的nucleolin (Gene ID: 25135,Genbank ID:NM_ 012749.2) 基因序列,设计3个干扰序列,用BLAST比对分析后,未发现有同源序列。并根据干扰序列设计并合成编码shRNA序列的DNA (表 1),分别命名为shRNAl、shRNA2、shRNA3。用BamHⅠ和HindⅢ酶切pshutlle质粒,回收质粒DNA大片段,将两条模板链退火,退火后1:200稀释,用T4DNA连接酶将其定向克隆至pshutlle质粒U6启动子后构建成重组质粒。将重组质粒转化入大肠埃希菌DH5a感受态细胞,进行LB抗性单克隆培养。抽提质粒(按照天根质粒提取试剂盒说明书提取),EcoRⅠ酶切鉴定、DNA序列分析。用PmeⅠ对含有目的片段的pShuttle质粒经进行线性化,回收纯化后与pAdEasy质粒一起共转染BJ5183感受态细胞,用带有卡那霉素(50 μg/mL)的LB平板进行筛选同源重组的质粒,进行PacⅠ酶切鉴定。
| 表 1 shRNA序列 Table 1 siRNA template DNA sequences |
重组腺病毒载体经过PacⅠ线性化后,转染HEK293A细胞。转染后每天观察细胞形态,细胞可出现明显的细胞病变(CPE),观察到90%以上细胞出现CPE现象后,回收细胞进行裂解,收集病毒,即为原代病毒上清。将原代病毒上清按照MOI=10的量加入融合度为95%的HEK293A细胞中,48~72 h后待90%以上细胞出现CPE现象后,收集细胞,进行浓缩纯化处理。病毒扩增后进行的滴度测定。实验前24 h传HEK293A细胞于96孔板中,每孔细胞数约104;将待测病毒用2% FBS-DMEM培养基稀释为101、102、103、104、105、106、107浓度梯度。稀释完毕后,吸取每个浓度梯度的病毒液100 μL分别加入到检测板中,用同一组无病毒培养基组作为阴性对照。继续培养48 h后观察每孔细胞的CPE情况;以10%以上细胞漂起,90%以上细胞肿胀变圆的孔作为滴度计算孔;估算公式:滴度结果(PFU/ML) = (接种细胞数×稀释度×10) /加入病毒的体积。
1.2.3 新生鼠脑皮质NSCs分离取材和培养取出生3 d内的新生SD大鼠,10%水合氯醛腹腔麻醉处死后,75%乙醇浸泡消毒5 min,分离脑皮质组织,仔细剥除脑膜和表面血管,剪碎,加入0.25%胰蛋白酶,37 ℃下消化15 min,终止消化并反复吹打制成单细胞悬液,200目筛网过滤,200 g离心5 min,弃上清液后,用DMEM/F12培养基(含20 μL/mL B27,10 ng/mL bFGF,20 ng/mL EGF)重悬,接种至培养瓶,在37 ℃、5% CO2培养箱中培养,每3~4 d半量换液1次,7 d传代1次。
1.2.4 免疫细胞化学将细胞去除培养液,PBS洗涤2次后,4%多聚甲醛固定40 min,用0.5% Trition X-100处理10 min,2% BSA处理60 min。加入一抗,4 ℃冰箱过夜。去除一抗,加入荧光标记的二抗,湿盒中孵育60 min。去除二抗后,加Hoechst 33258,室温孵育20 min,50%缓冲甘油封片,荧光显微镜下观察。
1.2.5 免疫印迹分析将蛋白与2×SDS加样缓冲液100 mmol/L Tris-HCl pH6.8,4% SDS,20%甘油,200 mmol/L DTT,0.2%溴酚蓝)混合,100 ℃煮沸5 min。样品经10%SDS-聚丙烯酰胺凝胶电泳分离后,经电转移法转移到硝酸纤维素膜上。室温下封闭4 h后,分别加入小鼠C23单克隆抗体(1:1000稀释),小鼠Nestin抗体(1:100稀释),兔Wnt3多克隆抗体(1:1000稀释),兔β-catenin抗体(1:100稀释),4 ℃过夜,洗膜液洗3次;再加入相应辣根过氧化物酶偶联的羊抗小鼠IgG或羊抗兔IgG (1:500稀释),室温孵育1 h后,再次洗膜;随后用DAB显色,扫描到电脑,记录试验结果。同时检测β-Actin或PCNA,作为上样对照。
1.3 统计学分析采用SPSS 17.0软件进行统计学分析,数据以均数±标准差表示,两组间比较用t检验,多组间比较用单因素方差分析,以P<0.05为有差异统计学意义。
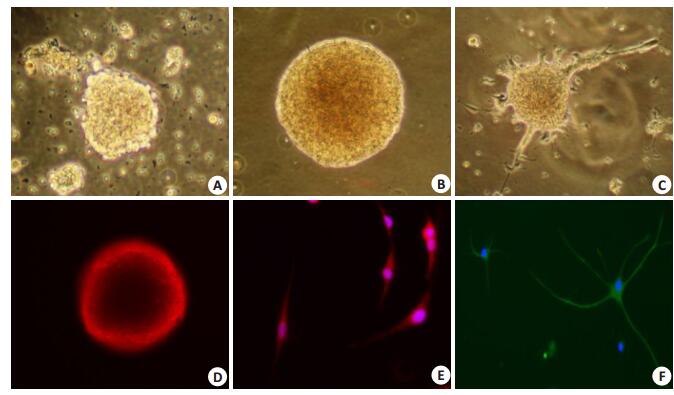
2 结果 2.1 NSCs的培养和鉴定原代培养的细胞在无血清的培养基中悬浮生长,48 h后就可以见到大部分细胞死亡,但能见到由2~3个细胞组成的小细胞团,即原代克隆,随着培养时间的增加,细胞团逐渐增大、增多,7 d时生长为数十个至数百个细胞的克隆,呈球形悬浮生长,形态不规则,折光性强,周围可见混杂的其他细胞(图 1A)。原代克隆的形成率在20%~30%之间。传代后出现与原代培养相同的大量次代克隆,并逐渐增大,7 d后可再次传代。连续传代3次后,可见细胞团仍呈悬浮生长,形态规则,折光性强,无突起生长,周围无明显混杂细胞(图 1B)。NSCs在体外传代培养后,已分化成熟的细胞会逐渐贴壁死亡,而NSCs则在培养基中悬浮生长,因此利用传代培养的方法可以纯化所培养的NSCs。
|
图 1 SD大鼠NSCs的体外培养与鉴定 Figure 1 In vitro culture and identification of neural stem cells (NSCs) from SD rats (Original magnification: ×100). A, B: The first and fourth passages of neonatal rat NSCs, respectively; C: Differentiated NSCs; D: Nestin-positive NSCs labeled with CY3 (red); E: NSE-positive NSCs double labeled with CY3 (red) and Hoechst 33258 (blue); F: GFAP-positive NSCs double labeled with FITC (green) and Hoechst 33258 (blue). |
将NSCs接种至已用明胶或多聚赖氨酸包被的六孔板中,一部分仍然用含20 μL/mL B27,10 ng/mL bFGF,20 ng/mL EGF的DMEM/F12培养基培养2 h后,行nestin免疫荧光染色;另一部分加入含10%胎牛血清的DMEM/F12培养基诱导分化,绝大多数细胞在24 h内会贴壁,并从细胞团的边缘伸出突起(图 1C)。随着培养时间的延长,越来越多的细胞从细胞团中爬行出来,伸出长长的突起,有时会交织成网。
免疫细胞化学发现:NSCs标记蛋白nestin在各级克隆中都有表达(图 1D);在用10%胎牛血清的DMEM/ F12培养基诱导7 d后,可见神经元细胞的标记物NSE (图 1E)和神经胶质细胞的标记物GFAP (图 1F)在诱导7 d的细胞中表达,而且诱导后的细胞大部分为GFAP阳性的胶质细胞。
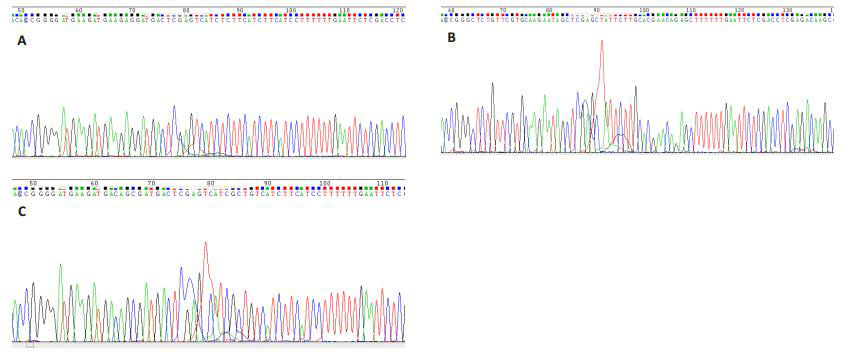
2.3 Nucleolin siRNA载体的鉴定经测序证实重组质粒中插入的shRNA片段的碱基序列与设计序列完全一致(图 2)。
|
图 2 测序鉴定3个nucleolin -siRNA表达载体的插入序列 Figure 2 Sequencing results of the inserts of 3 different nucleolin siRNA. A: shRNAl; B: shRNA2; C: shRNA3. |
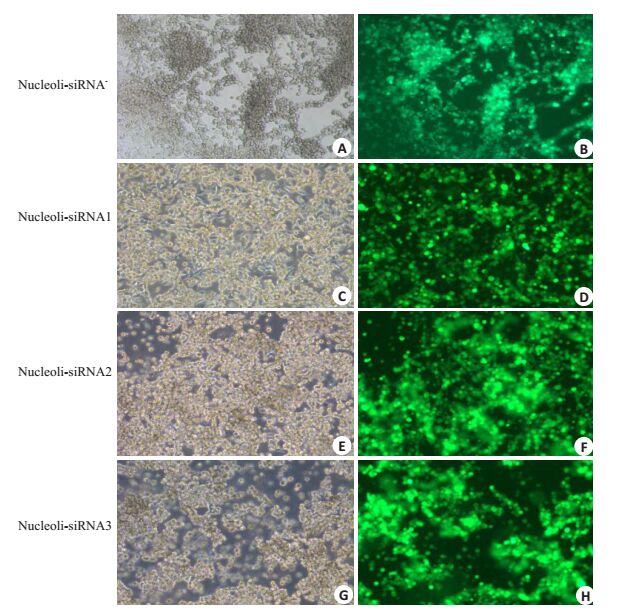
重组腺病毒质粒转染HEK293A细胞,培养5~7 d后出现细胞病变(CPE),表现为贴壁细胞变圆,肿胀,并逐渐从壁上脱落下来;转染10~12 d后可见圆形细胞呈葡萄串状从集分布于正常的HEK293A细胞上,并出现病毒空斑。由于腺病毒载体携带了GFP报告基因,可用荧光显微镜观察。收集包装成功的病毒裂解液,转导HEK293A细胞可观察到同样的结果(图 3)。
|
图 3 重组腺病毒感染HEK293A细胞 Figure 3 Nucleolin-siRNA recombinant adenovirus transduced in HEK293A cells (× 100). A, C, E, G: HEK293A cells infected by siRNA-or nucleolin-siRNA1-3 recombinant adenovirus (invert contrast microscopy, × 100); B, D, F, H: HEK293A cells infected by siRNA-or nucleolin-siRNA1-3 recombinant adenovirus (fluorescence microscopy, ×100). |
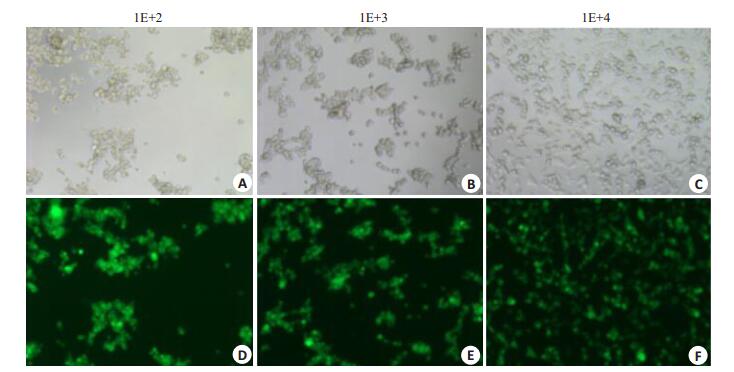
将待测病毒稀释为101、102、103、104、105、106、107浓度梯度,培养48 h后观察每孔细胞的CPE情况;以10%以上细胞漂起,90%以上细胞肿胀变圆的孔作为滴度计算孔;估算公式:滴度结果(PFU/ML) = (接种细胞数×稀释度×10) /加入病毒的体积。本次实验估算的稀释度为103,得出的病毒滴度为1E+9 PFU/mL。部分结果(图 4)。
|
图 4 不同滴度病毒感染HEK293A细胞的情况 Figure 4 HEK293A cells infected by the recombinant adenovirus at different titers (× 100). A, B, C: Invert contrast microscopy; D, E, F: Fluorescence microscopy. |
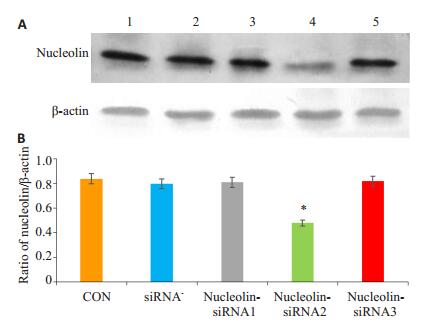
Western blot分析显示大鼠NSCs分别转染3种重组腺病毒nucleolin-siRNA后,转染nucleolin-siRNA2的细胞nucleolin表达明显受到抑制,Nucleolin-siRNA1和nucleolin-RNA3未见明显的抑制效果(图 5)。
|
图 5 Western blot检测重组腺病毒nucleolin-siRNA对nucleolin表达的影响 Figure 5 Western blot analysis of the expressions of nucleolin and β-actin in NSCs infected with nucleolin-siRNA recombinant adenovirus. A: Western blotting results; B: Quantitative analysis of Western blotting results (Mean±SD, n=3). *P < 0.05 vs the other groups. CON: No treatment; siRNA-: siRNA- recombinant adenovirus-infected NSCs; Nucleolin-siRNA1-3: NucleolinsiRNA1-3 recombinant adenovirus-infected NSCs, respectively. |
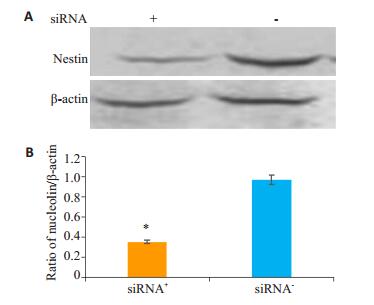
将nucleolin-siRNA2转染NSCs,96 h后提取总蛋白,Western-blot检测nestin蛋白的表达。结果显示,沉默nucleolin后,Nestin的表达明显减少(图 6)。
|
图 6 Western blot检测重组腺病毒nucleolinsiRNA对Nestin表达的影响 Figure 6 Western blot analysis of the expression of Nestin and β-actin in NSCs infected with Nucleolin-siRNA recombinant adenovirus. A: Nestin and β-Actin detected by Western blotting; B: Quantitative analysis of Western blotting results (Mean±SD, n=3). *P < 0.05 vs the siRNA- group. |
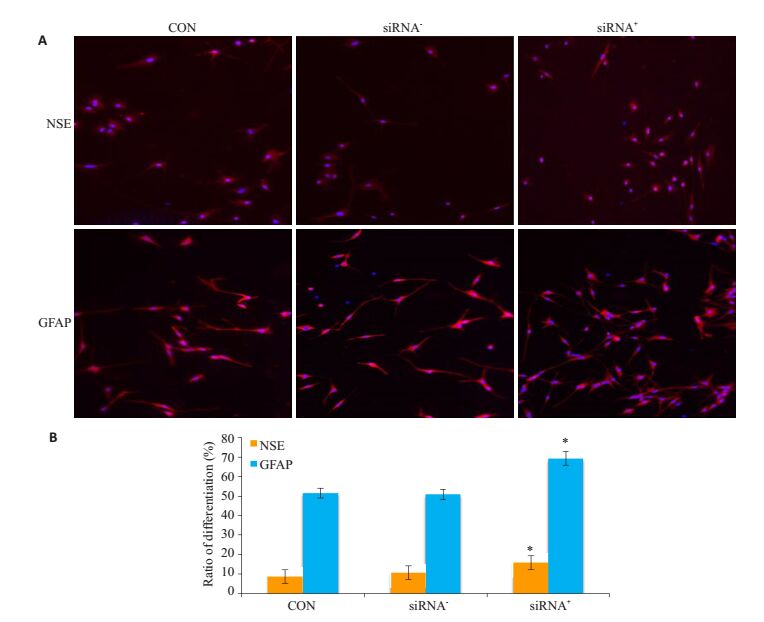
将NSCs分为3组:(1) CON组:未做任何处理;(2) siRNA-组:siRNA阴性对照腺病毒转染NSCs细胞;(3) siRNA+组:Nucleolin-siRNA2腺病毒转染NSCs细胞。将3组细胞在同一时间行免疫荧光染色,分别进行NSE、GFAP染色,显微镜下计数NSCs分化为NSE阳性细胞、GFAP阳性细胞的百分率。结果发现:siRNA+组NSCs分化为NSE阳性细胞和GFAP阳性细胞的分化率明显比CON组、siRNA-组增加,且差异具有统计学意义(P<0.01,图 7)。
|
图 7 重组腺病毒nucleolin-siRNA对NSCs的分化的影响 Figure 7 Differentiation of NSCs infected by nucleolin-siRNA recombinant adenovirus (× 100). A: Differentiated NSCs double labeled with CY3 (red) and Hoechst 33258 (blue). siRNA+ promotes NSC differentiation into neurons and astrocytes; B: Differentiation rates of the cells in different groups (Mean±SD, n=6). *P < 0.01 vs CON and siRNA- group. |
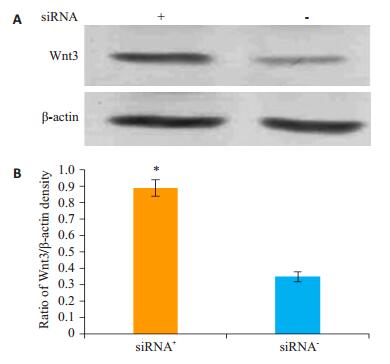
将nucleolin-siRNA2转染NSCs,96 h后提取总蛋白,Western-blot检测Wnt3蛋白的表达。结果发现:siRNA+组Wnt3蛋白的表达明显比siRNA-组增加,且两组之间的差异有统计学意义(P<0.05,图 8)。
|
图 8 重组腺病毒nucleolin-siRNA对对Wnt3活化的影响 Figure 8 Western blot analysis of the expression of Wnt3 and β-actin in NSCs infected with nucleolin-siRNA recombinant adenovirus. A: Wnt3 and β-actin detected by Western blotting; B: Quantitative analysis (Mean±SD, n=3). *P < 0.05 vs siRNA- group. |
将nucleolin-siRNA2转染NSCs,96 h后分别提取核蛋白和胞浆蛋白。Western blot检测β-catenin蛋白的表达。结果发现:siRNA+组、siRNA-组β-catenin胞浆蛋白的表达无明显差异,无统计学意义(P>0.05);而β-catenin核蛋白的表达则siRNA+组明显比siRNA-组增加,且两组之间的差异有统计学意义(P<0.05,图 9)。
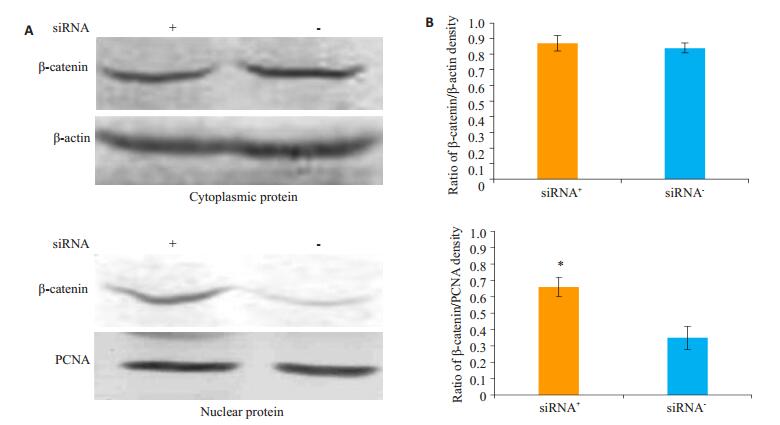
|
图 9 重组腺病毒nucleolin-siRNA对β-catenin入核的影响 Figure 9 Western blot analysis of the expression of β-catenin, β-actin and PCNA in NSCs infected with nucleolin-siRNA recombinant adenovirus. A: β-catenin, β-actin and PCNA detected by Western blotting; B: Quantitative analysis (Mean±SD, n=3). *P < 0.05 vs siRNA- group. |
NSCs是指来源于中枢神经系统的多能干细胞,终身具有自我更新的能力,并能分化成神经系统的各类细胞[15]。本实验成功地从新生SD大鼠的脑皮质组织中分离培养出了NSCs,通过培养和鉴定,充分说明培养的NSCs具有不断增值和多向分化的潜能,为NSCs在细胞水平的研究奠定了基础。
Nucleolin约占核仁蛋白质总量的10%,主要有3个结构域:N端结构域存在核定位信号,富含酸性残基,含有酪蛋白激酶2和细胞周期蛋白依赖性激酶1的多个磷酸化位点;中央域包含4个RNA识别基序,又称为RNA结合结构域;C-末端富含甘氨酸和精氨酸[11, 16-19]。nucleolin的结构特点赋予其多种配体结合活性,从而发挥了广泛的生物学功能。有研究显示[14],Nucleolin可调控胚胎干细胞的增殖与分化,敲除nucleolin可诱导胚胎干细胞分化,且胚胎干细胞的增殖减少,凋亡增加。NSCs和胚胎干细胞一样,具有自我更新和多向分化潜能。那么nucleolin对NSCs的作用是否和胚胎干细胞一样,能影响其增殖、分化、凋亡,我们拟RNA干扰nucleolin,了解nucleolin对神经干细胞转归的影响,寻求nucleolin影响神经干细胞转归的机制。
在本研究中,我们以pShuttle为穿梭载体,采用细菌内同源重组AdEasy系统,通过siRNA技术,成功构建了针对大鼠nucleolin基因的siRNA重组腺病毒载体,包装成腺病毒颗粒后,转染原代神经干细胞,并利用Western blot法筛选出对NSCs有抑制效果的siRNA表达载体。
体外培养的NSCs在经过增殖后去除有丝分裂原,NSCs可出现分化;或者在培养基中添加其他因子,也可以诱导NSCs向其他细胞分化。分化后的细胞可以用针对神经元和星形胶质细胞特异性抗原来鉴定。Nestin,属第Ⅳ类中间丝蛋白,它的表达起始于神经胚形成时,在神经板皮层细胞即开始表达,当神经细胞的迁移基本完成后nestin蛋白的表达量开始下降,并随神经细胞分化的完成而停止表达。一旦神经前体细胞朝向终末方向分化成神经元和胶质细胞(如星形胶质细胞)时,Nestin蛋白便停止表达[20]。因此nestin中间丝蛋白,系早期原始神经细胞的标志,已被广泛用于NSCs的鉴定。在本实验中我们将nucleolin-siRNA腺病毒表达载体转染至NSCs,Western blot检测Nestin蛋白的表达。结果显示,敲除nucleolin后,Nestin的表达明显减少,证明沉默nucleolin的表达可诱导NSCs的分化。同时我们检测了NSCs分化成神经元和星形胶质细胞的分化率,NSE可以在早期神经前体细胞中表达,一直持续至神经元成熟,GFAP是星形胶质细胞的标记。我们发现沉默nucleolin的表达后,NSCs分化成神经元和星形胶质细胞的分化率明显比对照组增加,近一步说明沉默nucleolin的表达可诱导NSCs的分化。那么nucleolin影响NSCs分化的机制是什么呢?研究发现胚胎期神经干细胞的发育与BMP、Wnt、Shh等信号系统有密切联系,特别是Wnt信号通路对于神经干细胞发育和分化的精密调节格外受到重视[21]。Wnt信号转导通路是因其启动蛋白为Wnt蛋白而得名,研究已经发现Wnt信号转导通路与神经发生及干细胞的增殖密切相关[22-23]。当细胞外信号激活细胞膜上Wnt的受体Frz,在胞外与Wnt结合后,将信号通过跨膜结构作用于胞质内的Dsh,Dsh能阻断β-catenin降解复合体的形成,切断β-catenin的降解途径,使细胞质内的β-catenin增多,增多的β-catenin进入细胞核,与LEF/TCF结合,特异性的启动激活下游靶基因的转录[24-25]。那么nucleolin影响NSCs的分化是否也是通过Wnt信号通路起作用的呢?Wnt3蛋白是Wnt信号通路的起始蛋白,Wnt3蛋白的表达增加可激活Wnt信号通路[26]。基于这一研究思路,我们提取了总蛋白检测Wnt3蛋白的表达。结果发现,沉默nucleolin能诱导Wnt3蛋白的表达。为了近一步验证沉默nucleolin可以启动Wnt信号转导通路,我们提取了胞浆蛋白及核蛋白,分别检测β-catenin的表达。结果发现,沉默nucleolin,β-catenin核蛋白的表达明显增加,而胞浆蛋白的表达无变化。β-catenin向细胞核内转移是Wnt途径活化的标志[27],这就是说细胞受到了刺激,细胞外信号激活细胞膜上Wnt的受体Frz,β-catenin进入细胞核,Wnt信号转导通路被激活,特异性的启动激活下游靶基因的转录,促使NSCs向神经元和胶质细胞分化。我们从中可以得出,nucleolin影响NSCs分化的机制可能与Wnt信号转导通路的激活有关。
| [1] | Hirano K, Miki Y, Hirai Y, et al. A multifunctional shuttling protein nucleolin is a macrophage receptor for apoptotic cells[J]. J Biol Chem, 2005, 280(47): 39284-93. DOI: 10.1074/jbc.M505275200. |
| [2] | Tayyari F, Marchant D, Moraes TJ, et al. Identification of nucleolin as a cellular receptor for human respiratory syncytial virus[J]. Nat Med, 2011, 17(9): 1132-5. DOI: 10.1038/nm.2444. |
| [3] | Hovanessian AG, Soundaramourty C, El Khoury D, et al. Surface expressed nucleolin is constantly induced in tumor cells to mediate calcium-dependent ligand internalization[J]. PLoS One, 2010, 5(12): e15787. DOI: 10.1371/journal.pone.0015787. |
| [4] | Perry RB, Rishal I, Doron-Mandel E, et al. Nucleolin-Mediated RNA localization regulates neuron growth and cycling cell size[J]. Cell Rep, 2016, 16(6): 1664-76. DOI: 10.1016/j.celrep.2016.07.005. |
| [5] | Tajrishi MM, Tuteja R, Tuteja N. Nucleolin: the most abundant multifunctional phosphoprotein of nucleolus[J]. Commun Integr Biol, 2011, 4(3): 267-75. DOI: 10.4161/cib.4.3.14884. |
| [6] | Mongelard F, Bouvet P. Nucleolin: a multiFACeTed protein[J]. Trends Cell Biol, 2007, 17(2): 80-6. DOI: 10.1016/j.tcb.2006.11.010. |
| [7] | Visalli G, Paiardini M, Chirico C, et al. Intracellular accumulation of cell cycle regulatory proteins and nucleolin re-localization are associated with pre-lethal ultrastructural lesions in circulating T lymphocytes: the HIV-induced cell cycle dysregulation revisited[J]. Cell Cycle, 2010, 9(11): 2130-40. DOI: 10.4161/cc.9.11.11754. |
| [8] | Tosoni E, Frasson I, Scalabrin M, et al. Nucleolin stabilizes Gquadruplex structures folded by the LTR promoter and silences HIV-1 viral transcription[J]. Nucleic Acids Res, 2015, 43(18): 8884-97. DOI: 10.1093/nar/gkv897. |
| [9] | Saxena A, Rorie CJ, Dimitrova D, et al. Nucleolin inhibits Hdm2 by multiple pathways leading to p53 stabilization[J]. Oncogene, 2006, 25(55): 7274-88. DOI: 10.1038/sj.onc.1209714. |
| [10] | Mi Y, Thomas SD, Xu X, et al. Apoptosis in leukemia cells is accompanied by alterations in the levels and localization of nucleolin[J]. J Biol Chem, 2003, 278(10): 8572-9. DOI: 10.1074/jbc.M207637200. |
| [11] | Abdelmohsen K, Gorospe M. RNA-binding protein nucleolin in disease[J]. RNA Biol, 2012, 9(6): 799-808. DOI: 10.4161/rna.19718. |
| [12] | Canton J, Neculai D, Grinstein S. Scavenger receptors in homeostasis and immunity[J]. Nat Rev Immunol, 2013, 13(9): 621-34. DOI: 10.1038/nri3515. |
| [13] | Miki Y, Tachibana Y, Ohminato Y, et al. Nucleolin Acts as a scavenger receptor for acetylated Low-Density lipoprotein on macrophages[J]. Biol Pharm Bull, 2015, 38(9): 1420-4. DOI: 10.1248/bpb.b15-00260. |
| [14] | Yang A, Shi G, Zhou C, et al. Nucleolin maintains embryonic stem cell self-renewal by suppression of p53 protein-dependent pathway[J]. J Biol Chem, 2011, 286(50): 43370-82. DOI: 10.1074/jbc.M111.225185. |
| [15] | Mckay R. Stem cells in the central nervous system[J]. Science, 1997, 276(5309): 66-71. DOI: 10.1126/science.276.5309.66. |
| [16] | Abdelmohsen K, Tominaga K, Lee EK, et al. Enhanced translation by Nucleolin via G-rich elements in coding and non-coding regions of target mRNAs[J]. Nucleic Acids Res, 2011, 39(19): 8513-30. DOI: 10.1093/nar/gkr488. |
| [17] | Ginisty H, Amalric F, Bouvet P. Two different combinations of RNA-binding domains determine the RNA binding specificity of nucleolin[J]. J Biol Chem, 2001, 276(17): 14338-43. DOI: 10.1074/jbc.M011120200. |
| [18] | Ishimaru D, Zuraw L, Ramalingam S, et al. Mechanism of regulation of bcl-2 mRNA by nucleolin and A + U-rich elementbinding factor 1 (AUF1[J]. J Biol Chem, 2010, 285(35): 27182-91. DOI: 10.1074/jbc.M109.098830. |
| [19] | Riordan DP, Herschlag D, Brown PO. Identification of RNA recognition elements in the Saccharomyces cerevisiae transcriptome[J]. Nucleic Acids Res, 2011, 39(4): 1501-9. DOI: 10.1093/nar/gkq920. |
| [20] | Lendahl U, Zimmerman LB, Mckay RD. CNS stem cells Express a new class of intermediate filament protein[J]. Cell, 1990, 60(4): 585-95. DOI: 10.1016/0092-8674(90)90662-X. |
| [21] | Lie DC, Colamarino SA, Song HJ, et al. Wnt signalling regulates adult hippocampal neurogenesis[J]. Nature, 2005, 437(763): 1370-5. |
| [22] | Huang GH, Yang XT, Chen K, et al. Porf-2 inhibits neural stem cell proliferation through Wnt/β-Catenin pathway by its GAP domain[J]. Front Cell Neurosci, 2016, 10(4): 85. |
| [23] | Cui Y, Han J, Xiao Z, et al. The miR-20-Rest-Wnt signaling axis regulates neural progenitor cell differentiation[J]. Sci Rep, 2016, 6(3): 23300. |
| [24] | Leung AW, Murdoch B, Salem AF, et al. WNT/β-catenin signaling mediates human neural crest induction via a pre-neural border intermediate[J]. Development, 2016, 143(3): 398-410. DOI: 10.1242/dev.130849. |
| [25] | Seto ES, Bellen HJ. The ins and outs of wingless signaling[J]. Trends Cell Biol, 2004, 14(1): 45-53. DOI: 10.1016/j.tcb.2003.11.004. |
| [26] | Lutolf MP, Gilbert PM, Blau HM. Designing materials to direct stem-cell fate[J]. Nature, 2009, 462(7272): 433-41. DOI: 10.1038/nature08602. |
| [27] | Luo Y, Cai J, Xue H, et al. SDF1alpha/CXCR4 signaling stimulates beta-catenin transcriptional activity in rat neural progenitors[J]. Neurosci Lett, 2006, 398(3): 291-5. DOI: 10.1016/j.neulet.2006.01.024. |
 2017, Vol. 37
2017, Vol. 37
