2. 南方医科大学南方医院//第一临床医学院妇产科生殖中心,广东 广州 510515
2. Reproductive Medicine Center, Department of Obstetrics and Gynecology, Nanfang Hospital/First School of Clinical Medicine, Southern Medical University, Guangzhou 510515, China
膀胱尿路上皮癌(膀胱癌)是最常见的泌尿系统恶性肿瘤。但是,根治性全膀胱切除术后2年内仍约有50%的患者会发生膀胱癌复发、转移,并最终死于肿瘤[1]。膀胱癌术后容易复发、转移的原因可能是膀胱癌的“肿瘤干细胞”(CSCs)没有被清除或消灭。CSCs具有自我更新和分化成不同肿瘤细胞的能力,具有无限增殖潜能且能在动物体内形成肿瘤的能力,并在启动肿瘤形成和生长,维持肿瘤的恶性增殖、侵袭、转移、复发和耐药等方面中起着决定性的作用[2-3]。因为膀胱癌干细胞是膀胱癌出现转移、复发和耐药的重要原因,如何消灭膀胱癌干细胞就成为目前研究的热点。目前对肿瘤干细胞起源及其分子机制尚不清楚,还不能针对其特殊靶位或信号通路进行针对性治疗。因此,寻找膀胱癌干细胞潜在的治疗靶点显得尤为重要。
近年来,相对和绝对定量的等量异位标签(iTRAQ)多重标记-串联质谱技术发展迅速。在前期研究成功分离筛选出MB49膀胱癌干细胞[4-7]后,本研究运用iTRAQ技术发现S100A4蛋白为MB49膀胱癌细胞与MB49膀胱癌干细胞表达差异的蛋白质,并且对S100A4蛋白进行验证。S100A4在多种肿瘤组织中高表达提示其可能参与了肿瘤的发生、发展以及浸润转移[8-9]。据我们所知,目前尚未有膀胱癌干细胞进行相关研究报道,现报道如下。
1 材料和方法 1.1 膀胱癌干细胞培养MB49小鼠膀胱癌细胞株由本实验室提供,来源于通过致癌物诱发C57BL/6雄性小鼠的膀胱移行细胞癌。细胞培养基为1640溶液内加10%的胎牛血清,37 ℃、5% CO2及饱和湿度培养箱内进行培养。配制最佳无血清培养基即RPMI 1640 + EGF(20 ng/mL)+bFGF(20 ng/mL) +LIF(20 ng/mL) +B27(20 µl/mL) +BSA(4 µg/mL);用有限稀释法从MB49细胞中获得MB49膀胱癌干细胞(MCSCs)。
1.2 鉴定MCSCs的肿瘤干细胞特性根据前期研究方案[4-7],采用CCK8方法和软琼脂克隆形成实验方法鉴定比较MCSCs的无限增殖特性,Transwell方法鉴定比较MCSCs的迁移和侵袭能力,CCK8方法鉴定比较MCSCs的抗化疗药物特性,裸鼠成瘤鉴定比较MCSCs的高致瘤特性。
1.3 iTRAQ技术筛选差异蛋白 1.3.1 蛋白提取、定量收集膀胱癌干细胞和膀胱癌肿瘤细胞,加入Disolution buffer,吸取裂解液,1×106细胞加入100 μL蛋白抽提液的比例,根据M-PER®Mammalian蛋白抽提试剂说明书抽提细胞总蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度。
1.3.2 iTRAQ标记及检测按照iTRAQ试剂盒说明书方法,取细胞蛋白各100 μg,加入变性试剂1 μL和还原试剂2 μL,60 ℃反应1 h;再加入半胱氨酸封闭试剂1 μL室温封闭10 min,之后按样品:蛋白酶质量比5:1比例加入蛋白酶,37 ℃恒温摇匀过夜。iTRAQ试剂中加入乙醇70 μL,样品分别加入对应的核素标签114和115,膀胱癌干细胞标记114,膀胱癌肿瘤细胞标记115,混匀后室温反应1 h;每管加入超纯水10 μL,室温反应10 min,终止反应。将2个样品合并,用脱盐柱对样品进行脱盐处理,真空浓缩仪浓缩,置于-20 ℃冰箱中保存备用。
1.3.3 LC/MS/MS分析(1) 强阳离子交换:Buffer A液含10 mmol/L KH2PO4和25% ACN,pH3.0;Buffer B液含10 mmol/L KH2PO4、350 mmol/L KCl和25% ACN,pH3.0。将冻干样品溶解于80 μL Buffer A液并全部上样,紫外检测波长为214 nm/280 nm,流速为200 μL/min,进行线性梯度洗脱。根据峰形和时间共收取20个梯度,真空离心浓缩后,每馏分用50 μL反相液相色谱的A相溶解,进样量20 μL;(2) 反相液相色谱分离:Solvent A液为0.1% TFA和25% ACN,Solvent B液为0.1% TFA和95% ACN。RPLC柱线性梯度洗脱;(3) 质谱鉴定:采用美国Applied Biosystems公司生产的4800 PlusMALDI TOF/TOF蛋白质分析仪进行多肽的串联质谱鉴定和相对定量分析。MS扫描范围400~1800 m/z,一个谱图选择4个最强的母离子进行串级扫描,MS/MS扫描范围100~2000 m/z。检测模式为正离子模式,离子喷雾电压保持在2.0 kV,信息为基础的获取模式下得到iTRAQ标记样品的质谱。
1.3.4 生物信息学分析通过ProteinPilot3.0软件检索SwissProt数据库,种属选择为Rat,根据软件对鉴定到的蛋白质打分,软件依据同位素报告基团的相对含量进行蛋白质定量,选择差异显著(P≤0.05) 的结果报告。使用Cluster3.0软件进行分层聚类分析蛋白的表达模式。所得串级质谱数据通过DAVID Bioinformatics Resources 6.7对上调和下调的蛋白进行生物信息学分析,分别从生物学进程、细胞成分和分子功能三个方面进行基因显著性分析。
1.4 MCSCs内S1000A4的含量 1.4.1 Western blot膀胱癌干细胞和膀胱癌肿瘤细胞蛋白分别上样,20 μg/孔,进行配胶8% SDS-PAGE,将电泳分离后的蛋白电转移至硝酸纤维素膜上。以5%脱脂牛奶室温封闭2 h,加入1:200稀释的鼠抗人S1000A4单克隆抗体,于4 ℃反应过夜。PBST洗膜3次,加入1:4000稀释的羊抗兔IgG二抗,置于摇床室温反应2 h,PBST洗膜3次;采用Super Signal WesternBlotting Kit化学发光底物发光,胶片曝光、显影和定影。应用Quantity one软件,以目的蛋白条带的灰度值与内参照蛋白条带的灰度值的比值表示目的蛋白的相对表达水平。
1.4.2 实时定量基因扩增荧光检测系统(qPCR)TRIzol试剂提取细胞总RNA,根据Prime Script RTReagent Kit和SYBR Premix ExTaqTM Ⅱ试剂盒说明书,反转录成cDNA,并以此cDNA为模板在7500Real-Time PCR仪进行PCR扩增,以GAPDH作为内参照,S1000A4的引物序列
F:5-TGGCTCCTCGGCTTTGACAGAGT-3
R:5-TGGGTGCCCCAGCTTCACAGA-3。反应条件:95 ℃ 10 s,95 ℃变性5 s,60 ℃退火31 s,共40个循环。
1.5 S100A4 siRNA的合成及转染根据S100A4基因字GenBank中的序列设计相对应的2对siRNA,同时合成阴性对照siRNA。干扰片段1:5-TGTAACGAATTCTTTGAAG-3
干扰片段2:5-ACGAATTCTTTGAAGGCTT-3
阴性对照:5-UUCUCCGAACGUGUCACGUTT-3
转染操作按LipofectamineTM 2000试剂说明书进行,分为空白对照组、阴性对照组及siRNA转染组。
3组S1000A4的蛋白及mRNA表达量比较分别采用Westernblot和qPCR实验方法。
1.6 S100A4 siRNA的体内外功能比较 1.6.1 体外细胞增殖能力(CCK8实验)收集3组细胞分别消化,计数,使其数目为5×103/mL。取200 mL加入96孔板内,培养基用最佳无血清培养基,培养箱培养。培养后第1,2,3,4,5,6,7天固定时间,加入10 µL CCK-8试剂,然后继续培养培养4 h。最后上机检测吸光度值。
1.6.2 体内细胞成瘤实验收集3组细胞消化,吹匀,计数。裸鼠麻醉后,在左腹股沟部位,注射剂量为0.1 mL,细胞为1×104。定期观察裸鼠成瘤情况,记录瘤体大小变化。瘤体大小计算公式为:0.5×长度×宽度2。
1.7 统计学方法应用SPSS13.0进行数据处理,各组数据以均数±标准差表示,两组间比较采用单因素方差分析,检验水准为α=0.05,P<0.05为差异有统计学意义。
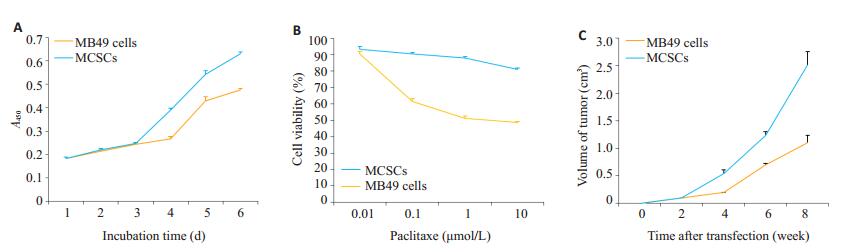
2 结果 2.1 MCSCs培养与鉴定通过联合运用最佳无血清培养基与有限稀释法,获得MCSCs。体外细胞增殖能力(CCK8实验)结果显示,在培养的第4,5,6天,MCSCs增殖曲线要高于MB49cells,二者之间具有统计学意义(P<0.05),表现出更强的增殖能力(图 1A)。软琼脂克隆实验结果显示,MCSCs形成的克隆球数目为89.67±1.52,多于MB49cells所形成的克隆球32.33±2.52,表现出更强的增殖能力(P<0.05)。体外细胞侵袭性能力(Transwell小室实验)结果显示,MCSCs穿过小室的细胞数目为76.40±4.39,多于MB49 cells穿过小室的细胞数45.00±4.12,表现出更强的侵袭能力(P<0.05)。体外细胞对化疗药物紫杉醇的耐受能力结果显示,纵向比较,随着药物浓度的增加趋势相同;横向比较,当浓度为0.1,1,10 μmol/L时,MCSCs细胞存活率高于MB49 cells,二者之间具有统计学意义,表现出更强的抵抗能力(图 1B)。体内细胞成瘤实验结果显示,在第4,6,8周时,MCSCs瘤体曲线要显著大于MB49 cells,二者之间具有统计学意义,表现出更强的致瘤能力(图 1C)。
|
图 1 MB49膀胱癌干细胞的鉴定 Figure 1 Characteristics of MB49 bladder cancer stem cells (MCSCs) and MB49 cells. A: Comparison of the proliferative abilities. The cellproliferation growth curve using CCK-8 shows that MCSCs had a higher absorbance value on days 4, 5, and 6; B: Comparison ofresistance to chemotherapy using CCK-8 assay. Compared to MB49 cells, MCSCs showed a higher cell viability after treatment withdifferent concentrations of paclitaxel; C: Comparison of tumorigenic abilities in vivo. MCSCs resulted in obviously greater tumorvolumes in nude mice than MB49 cells. |
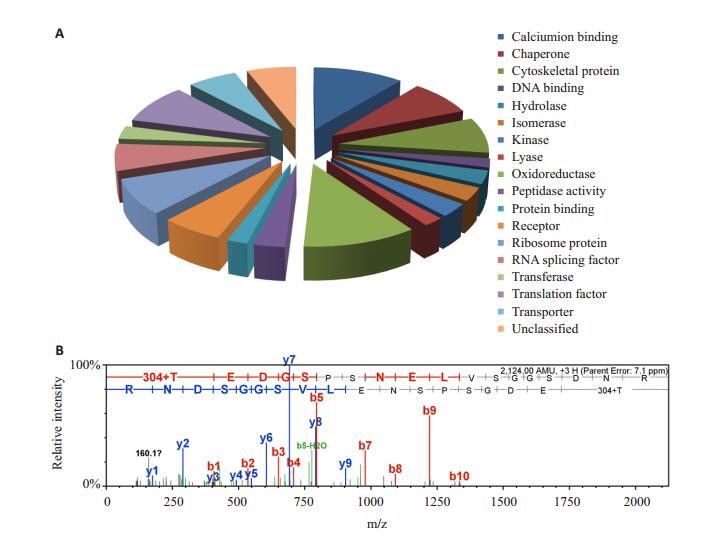
通过iTRAQ核素标记结合LC/MS/MS分析,共鉴定出差异蛋白共65个,共有29种蛋白质在膀胱癌干细胞组中出现显著的表达上调(上调≥2.0见表 1),主要参与代谢进程、基因表达、细胞骨架蛋白、同源蛋白和酶相结合等生物过程为主,36种出现显著下调(下调≤0.4见表 1),以代谢进程、生长发育和细胞定位相关蛋白为主。利用PANTHER软件将这些蛋白分类,分类结果见图 2A。其中,S100A4在基因表达水平差异最显著,它在细胞鉴定的相对和标准化的质谱图见图 2B。
| 表 1 膀胱癌干细胞和膀胱癌肿瘤细胞差异蛋白的iTRAQ分析 Table 1 iTRAQ analysis of differentially expressed proteins between bladder cancer stem cells and bladder cancer cells |
|
图 2 差异蛋白分析及S100A4质谱鉴定 Figure 2 Analysis of differentially expressed proteins. A: Pie chart showing the variousfunctional categories as a percentage of the 65 differentially expressed proteins; B: Arepresentative spectrum showing the peptides from S100A4. |
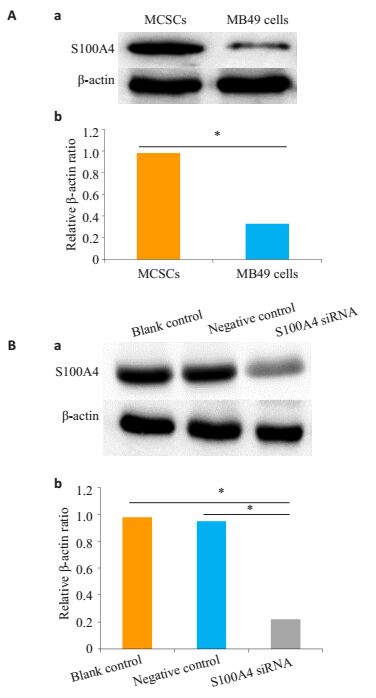
采用Western blot、qPCR分别对MCSCs和MB49cells进行S100A4含量鉴定。Western blot结果显示,S100A4蛋白的相对表达水平在MCSCs要显著高于MB49 cells (图 3A)。qPCR结果显示:S100A4的mRNA表达量在MCSCs显高于MB49 cells (P<0.05)。
|
图 3 S100A4在转染前后MCSCs中的表达 Figure 3 Expression of S100A4 in MCSCs andMCSCs transfected with shRNA expressingvector. A: Western blot analysis showing lowS100A4 expression in MB49 cells but highexpression in MCSCs; B: Western blot analysisshowing S100A4 knock down in S100A4 siRNAgroup. *P < 0.05. |
Western blot结果显示,siRNA转染组S100A4蛋白的相对表达水平明显低于空白对照组和阴性对照组(图 3B)。qPCR结果显示:siRNA转染组S100A4的mRNA表达量,明显低于空白对照组和阴性对照组(P<0.05)。
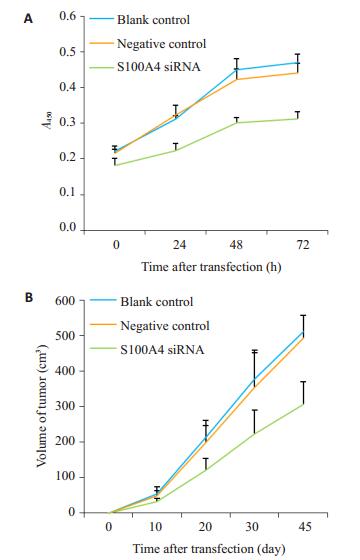
2.5 转染后膀胱癌干细胞的体外细胞增殖能力CCK8实验结果显示,在相同的初始条件下,各组细胞增殖速度相近,但24 h后siRNA转染组细胞增殖速度减慢,空白对照组与阴性对照组细胞增殖速度相近。结果表明,siRNA干扰S100A4表达后,膀胱癌干细胞生长明显受到抑制(图 4A,P<0.05)。
|
图 4 转染后MCSCs体内、外功能实验 Figure 4 Changes of biological behaviors of MCSCstransfected with the shRNA-expressing vector. A:CCK-8 assay showing lowered proliferative ability ofthe cells transfected with S100A4 siRNA vs S100A4siRNA (P < 0.05); B: Transfection with S100A4 siRNAreduced the tumor volume formed by MCSCscompared with those in blank control group andnegative control group (P < 0.05). |
采用裸鼠实验分别对转染组、空白组、对照组在体内条件下,比较三者的体内细胞成瘤能力。结果瘤体曲线显示,siRNA转染组要小于空白组、对照组。结果表明,siRNA干扰S100A4表达后,膀胱癌干细胞体内成瘤能力受到抑制(图 4B,P<0.05)。
3 讨论膀胱癌是泌尿系统威胁人类健康最常见的恶性肿瘤之一[10],发率高、预后差[1]。有关膀胱癌发生机制的研究报道较多,如微小RNA-34a通过靶向CD44调节膀胱癌细胞周期[11],SCF/c-Kit信号促进膀胱癌细胞侵袭[12],稳定低表达DNA甲基转移酶3b基因抑制膀胱癌细胞的生长,诱导凋亡[13],等等。膀胱癌治疗后容易复发的原因可能是膀胱癌的“肿瘤干细胞”没有被清除。只有彻底杀灭或清除肿瘤干细胞才有可能治愈肿瘤[14]。目前已经在多种肿瘤中成功分离并鉴定出了肿瘤干细胞[3],我们运用有限稀释法联合无血清培养法,成功从小鼠MB49膀胱癌细胞株中分离筛选出MB49膀胱癌干细胞。这些细胞也具有无限增殖、不同分化、高致瘤性及强耐药性等肿瘤干细胞特性[4]。
尽管如此,目前对肿瘤干细胞起源及其分子机制尚不清楚,研究尚处在起始阶段,还不能针对其特殊靶位或信号通路进行针对性治疗。从蛋白质组水平研究膀胱癌是目前研究的重要趋势[15],蛋白质组学技术可以发现疾病特异性的靶点和标记物,可以提供广泛的诊断及预后信息。运用iTRAQ技术[16-17]发现S100A4蛋白为MB49膀胱癌细胞与MB49膀胱癌干细胞表达差异的蛋白质。
S100A4蛋白,是钙离子结合蛋白家族成员之一,是由101个氨基酸组成的多肽,相对分子质量大小约为11.5000。近年研究表明,该蛋白与细胞分化以及肿瘤的发生、转移、耐药密切相关,其表达水平也与多种恶性肿瘤的预后密切相关,可以作为恶性肿瘤判断预后的指标[18-20]。本研究通过iTRAQ核素标记结合LC/MS/MS分析总共鉴定出65个差异蛋白,其中S100A4在基因表达水平差异最显著,提示S100A4蛋白可能是针对性治疗膀胱癌干细胞的目标蛋白。
随后,我们通过转染S100A4检验其对膀胱癌干细胞的影响。本实验设计合成2对针对S100A4基因不同位点的siRNA序列,脂质体介导转染入膀胱癌干细胞中,PCR和Westernblot检测结果显示,2对siRNA在膀胱癌干细胞对S100A4 mRNA和蛋白的表达均有不同程度的抑制作用。CCK8实验结果显示,转染siRNA组的增殖能力明显下降,说明在膀胱癌干细胞中抑制S100A4基因的表达可有效抑制细胞的增殖能力。裸鼠体内成瘤结果显示,转染siRNA组的成瘤能力下降,说明在膀胱癌干细胞中抑制S100A4基因的表达可有效抑制细胞的成瘤能力。同时,其它研究发现抑制S100A4能够使Hep-2喉癌细胞生长速度减慢,促进其凋亡[21]。S100A4蛋白水平的高低与膀胱癌的临床分级及预后也相关,认为可能在病理生理信号通路中起着重要作用[22-24]。由此我们推测S100A4可能在膀胱癌的复发、转移过程中起到关键作用,S100A4可能成为消灭膀胱癌干细胞,治疗膀胱癌的分子靶标。
综上所述,膀胱癌干细胞中S100A4表达与膀胱癌的复发、转移有关,S100A4蛋白可能成为消灭膀胱癌干细胞,治疗膀胱癌的分子靶标。
| [1] | Hussain SA, James ND. The systemic treatment of advanced and metastatic bladder cancer[J]. Lancet Oncol, 2003, 4(8): 489-97. DOI: 10.1016/S1470-2045(03)01168-9. |
| [2] | Clarke MF, Dick JE, Dirks PB, et al. Cancer stem cells--perspectives on current status and future directions: AACR Workshop on cancer stem cells[J]. Cancer Res, 2006, 66(19): 9339-44. DOI: 10.1158/0008-5472.CAN-06-3126. |
| [3] | 刘亚辉, 朱永通, 罗荣城. 膀胱癌肿瘤干细胞筛选方法的研究进展[J]. 肿瘤防治研究, 2014, 41(11): 1251-5. DOI: 10.3971/j.issn.1000-8578.2014.11.020. |
| [4] | Zhu YT, Lei CY, Luo Y, et al. A modified method for isolation of bladder cancer stem cells from a MB49 murine cell line[J]. BMC Urol, 2013, 13: 57. DOI: 10.1186/1471-2490-13-57. |
| [5] | Zhu YT, Pang SY, Luo Y, et al. A modified method by differential adhesion for enrichment of bladder cancer stem cells[J]. Int Braz J Urol, 2016, 42(4): 817-24. DOI: 10.1590/S1677-5538.IBJU.2015.0409. |
| [6] | Zhu YT, Pang SY, Lei CY, et al. Development of a therapy against metastatic bladder cancer using an interleukin-2 surface-modified MB49 bladder cancer stem cells vaccine[J]. Stem Cell Res Ther, 2015, 6: 224. DOI: 10.1186/s13287-015-0211-1. |
| [7] | Zhu YT, Zhao Z, Fu XY, et al. The granulocyte macrophage-colony stimulating factor surface modified MB49 bladder cancer stem cells vaccine against metastatic bladder cancer[J]. Stem Cell Res, 2014, 13(1): 111-22. DOI: 10.1016/j.scr.2014.04.006. |
| [8] | 张红燕, 郑献召, 轩小燕, 等. S100A4在食管鳞癌中的表达及与浸润转移的关系[J]. 南方医科大学学报, 2010, 30(7): 1541-4. |
| [9] | 陈香丽, 王连才, 张王刚, 等. S100A4和MMP9在非小细胞肺癌中的表达及与浸润、转移和预后的关系[J]. 南方医科大学学报, 2008, 28(7): 1254-8. |
| [10] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-32. DOI: 10.3322/caac.21338. |
| [11] | 余淦, 许凯, 许世安, 等. 微小RNA-34a通过靶向CD44调节膀胱癌细胞J82周期[J]. 南方医科大学学报, 2015, 35(7): 935-40. |
| [12] | 郭术俊, 陶象男, 汪忆梦, 等. SCF/c-Kit信号促进膀胱癌T24细胞侵袭作用[J]. 南方医科大学学报, 2014, 34(4): 507-10. |
| [13] | 陈柯, 李炳坤, 许凯, 等. 稳定低表达DNA甲基转移酶3b基因对膀胱癌细胞生长和凋亡的影响[J]. 南方医科大学学报, 2015, 35(11): 1524-9. DOI: 10.3969/j.issn.1673-4254.2015.11.02. |
| [14] | Hanahan D, Weinberg R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-74. DOI: 10.1016/j.cell.2011.02.013. |
| [15] | Li F, Chen DN, He CW, et al. Identification of urinary Gc-globulin as a novel biomarker for bladder cancer by two-dimensional fluorescent differential gel electrophoresis (2D-DIGE)[J]. J Proteomics, 2012, 77: 225-36. DOI: 10.1016/j.jprot.2012.09.002. |
| [16] | Evans C, Noirel J, Ow SY, et al. An insight into iTRAQ: where do we stand now[J]. ? Anal Bioanal Chem, 2012, 404(4): 1011-27. DOI: 10.1007/s00216-012-5918-6. |
| [17] | Rideau A, Besson D, Boissard A, et al. Two-step OFFGEL approach for effective peptide separation compatible with iTRAQ labeling[J]. Proteomics, 2013, 13(22): 3261-6. DOI: 10.1002/pmic.v13.22. |
| [18] | Mencia N, Selga E, Rico I, et al. Overexpression of S100A4 in human cancer cell lines resistant to methotrexate[J]. BMC Cancer, 2010, 10: 250. DOI: 10.1186/1471-2407-10-250. |
| [19] | 吴爱国, 马雷, 纪术峰, 等. 短发夹RNA沉默S100A4基因表达对乳腺癌MCF-7细胞生长和侵袭能力的影响[J]. 肿瘤, 2009, 29(8): 715-20. |
| [20] | 马雷, 吴爱国, 纪术峰, 等. 短发夹RNA沉默S100A4基因对乳腺癌MCF-7细胞体外增殖和迁移力的抑制[J]. 肿瘤防治研究, 2010, 37(4): 402-6. |
| [21] | Liu J, Fu S, Xu Y, et al. RNA interference targeting inhibition of S100A4 suppresses cell growth and promotes apoptosis in human laryngeal carcinoma Hep2 cells[J]. Mol Med Rep, 2014, 10(3): 1389-94. |
| [22] | Tsumura H, Matsumoto K, Sato Y, et al. Abnormal expression of multiple proteins predicts cancer-specific mortality in patients with high-grade non-muscle-invasive bladder cancer treated with transurethral resection[J]. Mol Clin Oncol, 2013, 1(3): 473-9. |
| [23] | Agerbaek M, Alsner J, Marcussen N, et al. Focal S100A4 protein expression is an independent predictor of development of metastatic disease in cystectomized bladder cancer patients[J]. Eur Urol, 2006, 50(4): 777-85. DOI: 10.1016/j.eururo.2006.02.027. |
| [24] | 孙明, 赵文嫣, 詹运洪, 等. 沉默S100A4基因对人膀胱癌T-24细胞生物学特性的影响[J]. 现代肿瘤医学, 2015, 23(22): 3232-6. DOI: 10.3969/j.issn.1672-4992.2015.22.007. |
 2017, Vol. 37
2017, Vol. 37

