2. 南方医科大学中西结合医院,广东 广州 510315;
3. 南方医科大学珠江医院,广东 广州 510282
2. Traditional Chinese Medicine-Integrated Cancer Center of Southern Medical University, Guangzhou 510315, China;
3. Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China
鼻咽癌是源自于人鼻咽部上皮组织的恶性肿瘤,主要在北非和东南亚流行,其中我国华南地区最为常见,俗称“广东癌”,发病率为20/10万~40/10万[1]。鼻咽癌是一种多病因的疾病[2-3],目前它的治疗主要采用同步放化疗方案(CCRT)。早期鼻咽癌患者对CCRT敏感,治疗效果好,但毒副作用大,加之部分晚期鼻咽癌患者对该方案并不敏感,治疗后复发率高,容易发生远处转移,因此患者5年生存率仍较低[4-6]。寻找新的治疗方法以改善鼻咽癌的预后是当前医学研究的热点[7-9]。
既往研究表明,化香树果序水煎物对鼻咽癌CNE2细胞的生长有较强抑制作用,但具体作用机制尚不明确[10]。本课题组也通过前期体外实验发现化香树果序乙醇提取物(PSZ)能抑制裸鼠体内鼻咽癌细胞CNE1、CNE2增殖,MTT法用0.25、0.5、1.0、1.5、2.0 mg/mL 5个浓度梯度分别作用于CNE1、CNE2后,结果示PSZ对CNE1、CNE2细胞增殖有明显的抑制作用,且呈时间-浓度依赖性,浓度为1.0 mg/mL时,对CNE1、CNE2细胞的增殖抑制率明显高于阳性对照组(P < 0.05)。Methuosis死亡是一种非凋亡细胞死亡方式[11-12],国内外对其作用机制仍未有明确的阐述[13-14]。本研究旨在探讨PSZ诱导鼻咽癌细胞发生methuosis死亡的相关信号通路,并初步筛选关键作用靶点,为鼻咽癌的防治提供新思路,同时为中药抗肿瘤药理、资源开发等研究思路和方法提供借鉴。
1 材料和方法 1.1 试剂胎牛血清、1640培养基(Biological Industries),人抗兔H-Ras(Cell Signaling, USA),人抗兔Rac1(Millipore, German),GAPDH抗体(Proteintech Group),EHT 1864(Med Chem Express),甲醇等试剂(广州永津生物公司)。实验用化香树果序于2015年10月采摘于陕西商洛地区,由南方医科大学刘传明副教授鉴定为胡桃科化香树属植物化香树果序。其标本保存于南方医科大学中医药学院分子生物学实验室。
1.2 方法 1.2.1 化香树果序有效成分的提取取生药材化香树果序4.5 kg,60%乙醇回流方法提取,旋转蒸发仪浓缩干燥,HPLC、GC-MS分析主要单体成分。
1.2.2 倒置显微镜和透射电镜观察CNE1、CNE2形态变化CNE1、CNE2形态变化将生长状况良好的CNE1、CNE2细胞接种于6孔培养板(1.2×105 cells/mL,2 mL/孔),37 ℃,5% CO2培养箱中培养24 h后分组进行药物处理,观察培养4、8、12、24、48 h后各组细胞的形态变化。待药物处理细胞24 h后,脱水、包埋、切片、干燥后日立H-7650透射电子显微镜观察并拍照。
1.2.3 RT-qPCR实验使用TRIzol裂解各组细胞,提取总RNA。GAPDH、Rac1基因PCR引物采用Pubmed网站设计(https://www.ncbi.nlm.nih.gov/tools/primer-blast/),经blast比对,所有引物序列均特异并跨内含子。相关基因及引物序列见表 1。
| 表 1 引物序列 Table 1 Primer sequences |
PSZ(1.0 mg/mL)处理细胞24 h后,提取蛋白,BCA法测定蛋白浓度。10% SDS-聚丙烯酰胺凝胶电泳,湿转至PVDF膜,ECL发光液曝光,ChemiDocTMXRS+成像仪(Bio-Rad公司)检测并保存结果。Image Lab software 3.0.1软件扫描所得条带,计算目的蛋白与GAPDH的灰度比值。
1.2.5 Rac1抑制剂将生长状况良好的CNE1、CNE2细胞接种于6孔培养板(1.2×105 cells/mL,2 mL/孔),37 ℃,5% CO2培养箱中培养24 h后,实验组分别加1.0 mg/mL PSZ、1.0 mg/mL PSZ+EHT 1864 20 μm,EHT 1864 20 μm,对照组加入0.25% DMSO培养液处理细胞24 h后,倒置显微镜观察培养4、8、12、24、48 h后各组细胞的形态变化。
1.2.6 统计学分析用IBM SPSS Statistics 20统计软件进行数据分析,计量资料以均数±标准差表示,比较两组如果方差齐用t检验,方差不齐用秩和检验。P < 0.05为差异有统计学意义。
2 结果 2.1 PSZ提取、主要成分分析取生药材化香树果序4.5 kg,得PSZ 180 g,出膏率为4.0%,水蒸气蒸馏法提取挥发油,提取率为0.12%,GC-MS分析结果表明化香挥发油的主要化合物是倍半萜。通过高效液相色谱技术(HPLC)对PSZ进行分析,结果发现PSZ中的主要成分为酚酸或黄酮类成分,已鉴定主要化合物有没食子酸、槲皮素、鞣花酸、3,3-二甲氧基鞣花酸(图 1)。
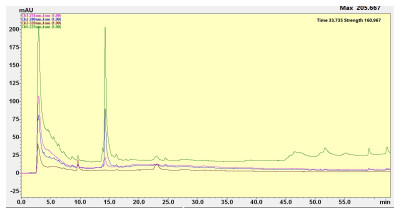
|
图 1 PSZ的HPLC图 Figure 1 HPLC diagram of the ethanol extract of PSZ. |
用1.0 mg/mL的PSZ分别作用于CNE1、CNE2后发现,随着药物作用时间的延长,细胞膜相互融合,细胞质可见大量空泡,空泡相互融合,不断增大,最后细胞膜破裂,细胞核没有发生明显的变化(图 2)。透射电镜下可观察到药物处理组胞浆中充满大量空泡聚集于细胞核周围,细胞核无明显变化,没有发现核染色体DNA片段的破碎,证明实验组细胞发生了methuosis死亡(图 3)。
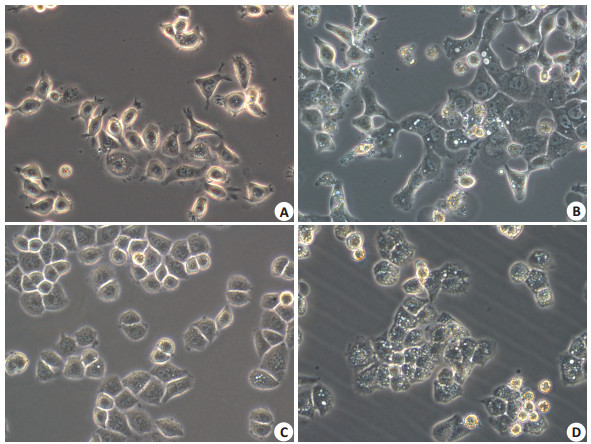
|
图 2 CNE1、CNE2细胞形态学变化 Figure 2 Morphology of CNE1 and CNE2 cells under inverted microscope (Original magnification: × 400). A: CNE1 control group; B: CNE1+PSZ (1 mg/mL, 24 h); C: CNE2 control group; D: CNE2+ PSZ (1 mg/mL, 24 h). |
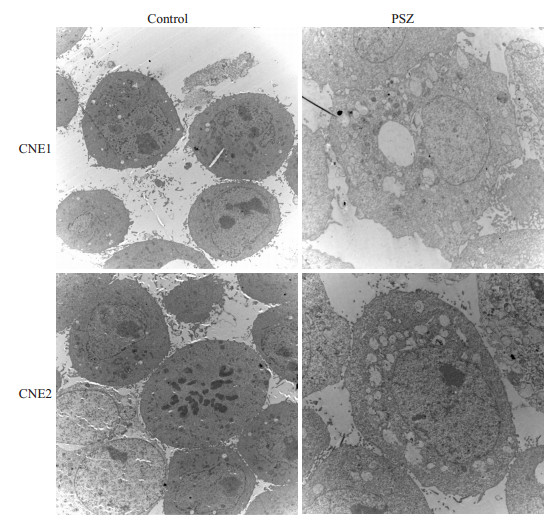
|
图 3 PSZ处理组电镜结果 Figure 3 Morphological change of CNE cells treated with 1.0 mg/mL PSZ for 24 h observed with electron microscopy (×8000). |
PCR结果显示1.0 mg/mL PSZ处理CNE1、CNE2细胞24 h后,Rac1基因表达增加(P < 0.05,图 4)。
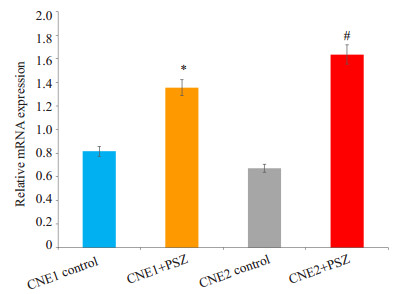
|
图 4 荧光定量PCR检测Rac1 mRNA表达情况 Figure 4 Rac1 mRNA expression detected by fluorescent real-time PCR in CNE1 cells. *P < 0.05 vs CNE1 control group, #P < 0.05 vs CNE2 control group. |
1.0 mg/mL PSZ处理CNE1、CNE2细胞,24 h后检测发现Rac1蛋白表达量增加,趋势与RT-qPCR改变相同(P < 0.05,图 5)。
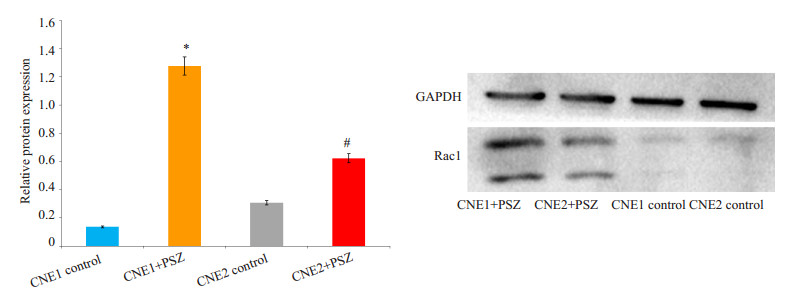
|
图 5 PSZ作用后CNE1、CNE2细胞Rac1蛋白表达水平变化 Figure 5 Expression Rac1 in CNE1 and CNE2 cells after PSZ treatment. A: The bands of Western blotting; B: Ratio of the expression of Rac1. *P < 0.05 vs CNE1 control group, #P < 0.05 vs CNE2 control group. |
用PSZ(1.0 mg/mL)、PSZ(1.0 mg/mL)+EHT 1864 20 μm、EHT 1864 20 μm、0.25% DMS的培养液分别处理细胞,24 h后倒置显微镜下可以发现,加入了PSZ的实验组发生了明显的methuosis死亡,而PSZ(1.0 mg/mL)+ EHT1864的实验组虽然细胞形态发生改变,但并未见methuosis死亡现象(图 6)。
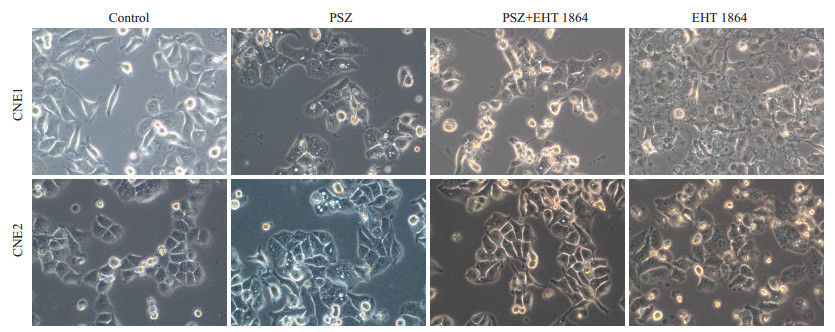
|
图 6 EHT1864干预后CNE1、CNE2细胞形态学变化 Figure 6 Morphology of CNE1 and CNE2 cells under inverted microscope with PSZ (1 mg/mL) and/or EHT1864 (20 μm) treatment for 24 h (×400). |
本实验通过HPLC对PSZ进行分析,结果发现PSZ中的主要成分为酚酸或黄酮类成分,已鉴定主要化合物有没食子酸、槲皮素、鞣花酸、3,3-二甲氧基鞣花酸。贾晓妮等[15]采用多种色谱方法分离纯化化香树果序生药材,通过光谱分析鉴定化合物结构,从化香树果序的氯仿部位和乙酸乙酯部位分离鉴定了11个化合物,分别为:正三十二烷、2,5,8-三羟基-3-甲氧基-1,4-萘醌、3,3'-二甲氧基鞣花酸、熊果酸、鞣花酸、β-谷甾醇、胡萝卜苷、4'-羟基异黄酮-7-O-β-D-半乳糖苷、3,3'-二甲氧基鞣花酸-4'-O-β-D-木糖苷、二十六烯、没食子酸,与本实验所得成分有3种相同,其余不同的化学成分的出现考虑主要因提取方法不同,导致最终有效成分存在一定的差异。现代药理研究显示,黄酮类化合物对多种常见癌症如鼻咽癌、肺癌、乳腺癌、结肠癌、前列腺癌、肝癌、白血病、宫颈癌、胃癌等都有一定的治疗效果,同时其无明显细胞毒性作用,不会损伤正常组织[16]。其中黄酮类化合物槲皮素对人鼻咽癌HEN1细胞株具有明显的抑制增殖作用,其效果存在明显的剂量-效应关系和时间-效应关系,随着槲皮素浓度升高,凋亡细胞和坏死细胞比例增加,细胞特异性地阻滞在G2/M期,出现凋亡峰,其机制可能与增强凋亡相关蛋白caspase-3活性有关[17]。
本实验通过倒置显微镜和投射电镜发现,CNE1和CNE2细胞在1.0 mg/mL浓度的PSZ作用下,出现了细胞增大,细胞膜相互融合,细胞质内出现大小不一的空泡,细胞核无明显改变的现象,这种改变符合methuosis死亡现象的细胞形态改变,证明PSZ能够导致CNE1和CNE2发生methuosis现象,同时也是国内外首次发现NPC能够发生methuosis死亡。此前研究证实,异位过表达H-Ras癌基因蛋白[18]、小分子黄酮类化合物3(-2-甲基-1H-吲哚-3-基)-1-(4-吡啶基)-2-丙烯-1-酮(3-(2-methyl-1H-indol-3-yl)-1(-4-pyridinyl)-2-propen-1-one,(MIPP)[19]和小分子物质3(-5-甲氧基,2-甲基-1H-吲哚-3-基)-1(-4-吡啶基)-2-丙烯-1-酮(MOMIPP)[20]刺激肿瘤细胞等途径均能诱导肿瘤细胞发生methuosis死亡。但此前无文献报道传统中药能诱导肿瘤细胞发生methuosis死亡。因为中药价格低廉,急性毒副作用少,已成为肿瘤治疗方案中的常见辅助治疗药物,进一步研究PSZ的作用机制具有一定的市场开发价值。
PCR和Western blotting结果显示,PSZ诱导CNE1、CNE2发生methuosis死亡后,Rac1在DNA水平和蛋白表达水平上均出现增高趋势。Bhanot等[21]研究证明,Rac1过表达可以通过激活Arf6-GAP、GIT-1蛋白,使Arf6-GTP蛋白功能减弱或消失,最终Arf6蛋白失活,巨胞饮小体不能回到细胞膜。Overmeye等[18]研究则证明多西环素能够激活H-Ras(G12V),从而使Rac1表达升高,导致细胞内出现大量液泡。同时,AS1411能通过激活EGFR、Rac1,使之过表达,导致癌细胞系DU145,MDA-MB-468,A549,LNCaP发生methuosis死亡,下调Rac1后methuosis死亡消失[22]。Manara等[23]研究表明,CD99介导的IGF-1R/Ras/Rac1复合物能够进入具有胞吞作用的RAB5阳性空泡内,此后IGF-1R会通过循环作用回到细胞膜,而CD99和Ras/Rac1会依次进入到LAMP-1阳性的空泡内,这些空泡不断累积就会导致骨尤文肉瘤(EWS)细胞发生methuosis死亡。结合本实验的结果推测,Rac1的过表达可能是PSZ作用机制的关键。因此,后续实验用Rac1抑制剂EHT 1864 [24]干扰PSZ的作用。实验结果证明,阻断Rac1家族蛋白活性methuosis死亡消失,提示Rac1可能是PSZ诱导CNE1、CNE2发生methuosis死亡的关键靶点。
在过去的30年期间,许多非凋亡的细胞死亡方式被陆续发现,它们在肿瘤治疗方面有着巨大的潜力。通过对PSZ治疗鼻咽癌机制的研究,我们今后可以通过将PSZ与放、化疗治疗方案相结合,提高对放、化疗产生不敏感的鼻咽癌患者的治疗效果。同时,通过对methuosis死亡关键靶点的筛选,可以设计针对该靶点的分子靶向药物[25],诱导鼻咽癌细胞发生methuosis死亡,精准打击鼻咽癌细胞,提高5年生存率。
| [1] | Wang HY, Chang YL, To KF, et al. A new prognostic histopathologic classification of nasopharyngeal carcinoma[J]. Chin J Cancer, 2016, 35(1): 30-45. DOI: 10.1186/s40880-016-0086-2. |
| [2] | Hildesheim A, Wang CP. Genetic predisposition factors and nasopharyngeal carcinoma risk: a review of epidemiological association studies, 2000-2011: Rosetta Stone for NPC: genetics, viral infection, and other environmental factors[J]. Semin cancer biol, 2012, 22(2): 107-16. DOI: 10.1016/j.semcancer.2012.01.007. |
| [3] | Shen Y, Zhang S, Sun R, et al. Understanding the interplay between host immunity and Epstein-Barr virus in NPC patients[J]. Emerg Microbes Infect, 2015, 4(3): e20. DOI: 10.1038/emi.2015.20. |
| [4] | Pan XB, Huang ST, Chen KH, et al. Concurrent chemoradiotherapy degrades the quality of life of patients with stage Ⅱ nasopharyngeal carcinoma as compared to radiotherapy[J]. Oncotarget, 2017, 8(8): 14029-38. |
| [5] | Su Z, Mao YP, Tang J, et al. Long-term outcomes of concurrent chemoradiotherapy versus radiotherapy alone in stage Ⅱ nasopharyngeal carcinoma treated with IMRT: a retrospective study[J]. Tumour Biol, 2016, 37(4): 4429-38. DOI: 10.1007/s13277-015-4266-5. |
| [6] | Cao SM, Yang Q, Guo L, et al. Neoadjuvant chemotherapy followed by concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: A phase Ⅲ multicentre randomised controlled trial[J]. Eur J Cancer, 2017, 75: 14-23. DOI: 10.1016/j.ejca.2016.12.039. |
| [7] | Arboretti R, Bordignon P, Corain L, et al. Statistical tests in medical research: traditional methods vs. multivariate NPC permutation tests[J]. Urologia, 2015, 82(2): 130-6. DOI: 10.5301/uro.5000117. |
| [8] | Alfieri S, Lacovelli NA, Marceglia S, et al. Circulating pre treatment Epstein-Barr virus DNA as prognostic factor in locally-advanced nasopharyngeal cancer in a non-endemic area[J]. Oncotarget, 2017. |
| [9] | Ma Q1, Zeng LL, Qin J, et al. Radiation-induced cerebellar-cerebral functional connectivity alterations in nasopharyngeal carcinoma patients[J]. Neuroreport, 2017. |
| [10] | Li YP, Mo ZX, Cao LY. Inhibition of infructescence of plotytarya strohilacea Sieb. et Zucc onEB virus antigen expression and its cytotoxicity[J]. Pharmacy Today, 2014, 24(2): 93-5. |
| [11] | Maltese WA, Overmeyer JH. Non-apoptotic cell death associated with perturbations of macropinocytosis[J]. Front Physiol, 2015, 6: 38. |
| [12] | Diederich M, Cerella C. Non-canonical programmed cell death mechanisms triggered by natural compounds[J]. Semin Cancer Biol, 2016, 40-41: 4-34. DOI: 10.1016/j.semcancer.2016.06.001. |
| [13] | Sander P, Mostafa H, Soboh A, et al. Vacquinol-1 inducible cell death in glioblastoma multiforme is counter regulated by TRPM7 activity induced by exogenous ATP[J]. Oncotarget, 2017, 8(21): 35124-37. |
| [14] | Mbah NE, Overmeyer JH, Maltese WA. Disruption of endolysosomal trafficking pathways in glioma cells by methuosisinducing indole-based chalcones[J]. Cell biol toxicology, 2017, 33(3): 263-82. DOI: 10.1007/s10565-016-9369-2. |
| [15] | 贾晓妮, 王军宪, 成昱霖, 等. 化香树果序化学成分研究[J]. 中药材, 2016, 39(8): 1786-8. |
| [16] | 杨楠, 贾晓斌, 张振海, 等. 黄酮类化合物抗肿瘤活性及机制研究进展[J]. 中国中药杂志, 2015, 40(3): 373-81. |
| [17] | 张峰, 崔永华, 曹平. 槲皮素对人鼻咽癌HEN1细胞系增殖抑制和诱导凋亡作用的研究[J]. 临床耳鼻咽喉头颈外科杂志, 2007, 21(24): 1136-9. |
| [18] | Overmeyer JH, Kaul A, Johnson EE, et al. Active Ras triggers death in glioblastoma cells through hyperstimulation of macropinocytosis[J]. Mol Cancer Res, 2008, 6(6): 965-77. DOI: 10.1158/1541-7786.MCR-07-2036. |
| [19] | Kaul A, Overmeyer JH, Maltese WA. Activated Ras induces cytoplasmic vacuolation and non-apoptotic death in glioblastoma cells via novel effector pathways[J]. Cell Signal, 2007, 19(5): 1034-43. DOI: 10.1016/j.cellsig.2006.11.010. |
| [20] | Robinson MW, Overmeyer JH, Young AM, et al. Synthesis and evaluation of Indole-Based chalcones as inducers of methuosis, a novel type of nonapoptotic cell death[J]. J Med Chem, 2012, 55(5): 1940-56. DOI: 10.1021/jm201006x. |
| [21] | Bhanot H, Young AM, Overmeyer JH. Induction of nonapoptotic cell death by activated Ras requires inverse regulation of Rac1 and Arf6[J]. Mol Cancer Res, 2010, 8(10): 1358-74. DOI: 10.1158/1541-7786.MCR-10-0090. |
| [22] | Reyes-Reyes EM, Salipur FR, Shams MA, et al. Mechanistic studies of anticancer aptamer AS1411 reveal a novel role for nudeolin in regulating Rac1 activation[J]. Mol Oncol, 2015, 9(7): 1392-405. DOI: 10.1016/j.molonc.2015.03.012. |
| [23] | Manara MC, TerraccianoM, Mancarella C, et al. CD99 triggering induces methuosis of Ewing sarcoma cells through IGF-1R/RAS/ Rac1 signaling[J]. Oncotarget, 2016, 7(48): 79925-42. |
| [24] | Onesto C, Shutes A, Picard V, et al. Characterization of EHT 1864, a novel small molecule inhibitor of Rac family small GTPases[J]. Methods Enzymol, 2008, 439: 111-29. DOI: 10.1016/S0076-6879(07)00409-0. |
| [25] | Ke BW, Tian M, Li JJ, et al. Targeting programmed cell death using Small-Molecule compounds to improve potential cancer therapy[J]. Med Res Rev, 2016, 36(6): 983-1035. DOI: 10.1002/med.2016.36.issue-6. |
 2017, Vol. 37
2017, Vol. 37

