2. 中山大学附属第一医院神经内科,广东 广州 510080
2. Department of Neurology, First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510080, China
缺血性脑梗死是导致人类死亡的第2大病因,死亡率和致残率高[1]。其病理生理机制包括神经元死亡、钙离子失衡、氧自由基形成,炎症与凋亡和兴奋性毒性等[2],至今仍缺乏有效的临床治疗药物[1]。最近研究发现,表观遗传学机制DNA甲基化,组蛋白去乙酰化和miRNA等在缺血性脑梗死的病理机制中起到重要的作用[3],其中对于组蛋白去乙酰化酶(HDACs)在神经系统疾病中的作用研究较多[4]。在动物脑梗死模型上多种组蛋白去乙酰化酶抑制剂也被证实具有神经保护作用,能有效抑制炎症反应与凋亡通路,从而减少脑卒中范围、改善神经缺损的症状,但具体机制仍不清楚[5-9]。HDACs家族具有多个亚型,不同亚型其作用与机制也并不相同[6],深入了解各亚型在脑梗死中的作用具有研究价值,可进一步揭示缺血性脑梗死的病理生理机制。如今部分亚型的作用与机制已被探讨,如HDACs(HDAC3/6)在脑梗死模型的表达是升高的,敲除基因或者使用其抑制剂后,梗死后的神经损伤作用明显减弱[10];另一亚型的组蛋白去乙酰化酶HDAC4在动物线栓法大脑中动脉阻塞(MCAO)模型和细胞糖氧剥夺模型(OGD)中的表达是升高的,但参与突触的重建,促进神经修复[11-12]。其中组蛋白去乙酰化酶9(HDAC9)在脑梗死中的作用尚未深入研究。最近基因组相关性研究发现,组蛋白去乙酰化酶9(HDAC9)变异型基因可能与大动脉性卒中密切相关[13-14],这提示HDAC9也可能参与缺血性脑梗死的病理生理过程。因此,本课题选择HDAC9作为研究的对象,通过观察HDAC9在脑梗死后表达的情况,探索其与脑梗死发生的关系,从而进一步了解HDACs在缺血性脑卒中的相关机制,这有助于发现可改善脑梗死预后的关键靶点及药物,对脑卒中的防治具有重要意义。
1 材料和方法 1.1 实验动物与分组健康C57BL/6小鼠21只(购自南方医科大学动物实验中心),体质量20~25 g,均为雄性,SPF级。将小鼠随机分为2组,假手术组9只,手术组12只。假手术组只进行颈部正中纵行剖开后缝合;手术组予MCAO处理,并参照Longa评分标准评估造模是否成功,评分为2~3分小鼠纳入MCAO组。本实验术后评分2~3分小鼠为10只,随机选取9只进入MCAO组。术后3 d,取假手术组和MCAO组各3只小鼠脑组织用于免疫荧光检测,每组的另6只小鼠脑组织分别用于Western blot、实时荧光定量PCR检测。
1.2 建立MCAO模型小鼠麻醉后(0.1%戊巴比妥钠腹腔麻醉,0.1 mL/10 g)取仰卧位,固定于手术台。颈部正中纵行剖开,游离左侧颈总动脉、颈内动脉和颈外动脉,结扎颈总动脉近心端与颈外动脉,颈动脉叉近端处取一小切口,将线栓(从广州佳灵公司购买,型号L1800,线栓头直径= 0.18 mm)插入,缓慢推进,微遇阻力即止,缚紧线栓以防滑出。手术过程中室温保持25 ℃,术后动物置于清洁垫料中,自由饮水、进食[15]。
1.3 Zea-Longa神经缺损评分[16]0分:无神经功能缺失症状;1分:轻度局灶性神经功能缺失,不能完全伸展右侧前肢;2分:中度局灶性神经功能缺失,向右侧转圈;3分:重度局灶性神经功能缺失,向右侧倾倒;4分:不能自发行走,意识水平降低。
1.4 脑组织切片制备分别用生理盐水、4%多聚甲醛从小鼠心脏进行灌注,灌注完毕后开颅取脑,4%多聚甲醛溶液固定24 h后,对组织进行脱水、石蜡包埋及修制。行层厚为5 μm的连续冠状切片,取含梗死灶区的切片行免疫荧光染色。
1.5 取材部位用生理盐水从小鼠心脏进行灌注,至肝脏颜色变白,冰上断头取脑。MCAO组小鼠取左侧梗死灶及周围脑组织(梗死区+缺血半暗带区),右侧大脑皮质与小脑组织;假手术组取左侧大脑皮质与小脑组织。后续冰上提取蛋白与RNA,所提取物质分别用于Western blot与RT-PCR检测。
1.6 Western blot分析用RIPA(强)裂解液(购自碧云天)冰上裂解脑组织,BCA法测蛋白浓度。50 μg待测蛋白在10%的聚丙烯酰胺SDS-PAGE进行电泳分离,电泳条件为浓缩胶80 V 30 min、分离胶100 V 1 h,然后在250 V条件下湿转膜1.5 h,室温5% BSA封闭1 h,一抗(anti-HDAC9兔抗购自ABclonal,anti-GAPDH兔抗购自Proteintech)4 ℃孵育过夜(anti-HDAC9稀释比例1:1000,antiGAPDH稀释比例1:5000),洗膜,二抗室温1 h,洗膜,ECL显影。用Image Pro-plus软件进行条带的灰度分析。
1.7 实时荧光定量PCR检测HDAC9 mRNA表达水平采用Troil法提取各组组织的总RNA,逆转录得到cDNA,进行RT-PCR(罗氏L480实时荧光定量PCR仪,瑞士Roche)。引物序列如下:HDAC9 mRNA的正向引物为:5'-GCTCTGGAAGGAGGACATGA-3',反向引物为:5'-ATTCACGGACTGGTGGAGAG-3';GAPDH mRNA正向引物为:5'-ATGTGTCCGTCGTGGATCT GA-3',反向引物为:5'-ATGCCTGCTTCACCACCTT CT-3'。引物由上海生工生物技术有限公司设计与合成。PCR反应条件为95 ℃ 5 min,随后95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s重复35个循环。采用2-ΔΔCT法分析目的基因的相对表达量。各组均设置3个复孔,实验重复3次。
1.8 免疫荧光(1)烤片:60 ℃烤箱烘烤1 h,室温备用;(2)常规脱蜡至水,蒸馏水泡洗5 min后3%过氧化氢室温下处理10 min;(4)抗原修复:微波加热法(0.01 mol/L柠檬酸盐缓冲液,pH6.0),自然冷却至室温,PBS漂洗5 min×3次;(5)封闭液:加10%山羊血清(购自中杉金桥),10 min后吸干液体;(6)滴加一抗(anti-HDAC9:sc-398003,购自Santa Cruz,稀释比例1:100),4 ℃过夜,PBS漂洗5 min×3次;(7)避光条件下滴加荧光二抗(goat anti-mouse IgM-FITC:sc-2082,购自Santa Cruz,稀释比例1:200),室温孵育1 h,漂洗5 min×3次;(8)滴加DAPI染核,甘油封片,荧光显微镜(日本Nikon公司)暗室下观察。
1.9 统计学分析使用SPSS 20.0软件进行统计学分析,计量资料以均数±标准差表示,多组间的均数比较采用One-way ANOVA,进一步两两比较采用Bonferrroni法(方差齐)或Dunnett T3法(方差不齐)检验,以P < 0.05为差异具有统计学意义。
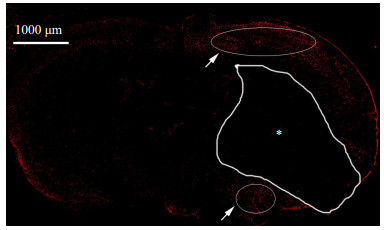
2 结果 2.1 免疫荧光染色检测HDAC9表达梗死灶周围的脑组织HDAC9的荧光强度明显增强。梗死灶一侧的荧光强度较对侧明显增强(图 1),主要集中在梗死灶周围(图 1白色箭头),显示HDAC9的表达主要在梗死灶周围脑组织,且HDAC9染色阳性的细胞大多位于大脑皮层。
|
图 1 免疫荧光染色检测HDAC9表达 Figure 1 Immunofluorescence for detecting HDAC9 in MCAO group (scale bar: 1000 μm). *: Infarct; Arrow: Periphery regions of the infarct. |
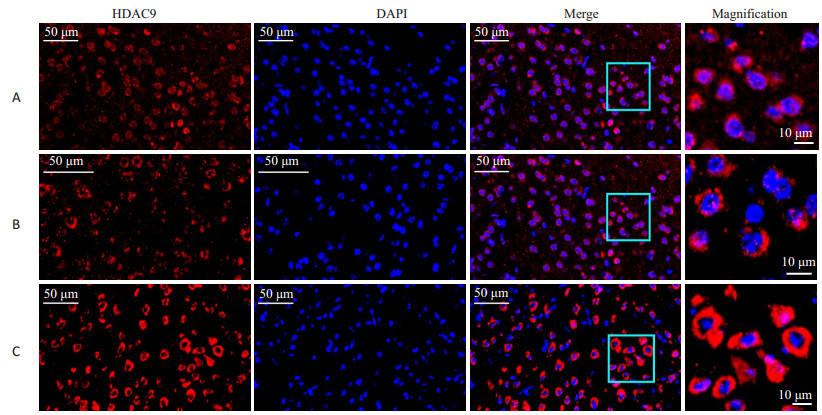
缺血性脑梗死后HDAC9胞浆内表达增多,核内表达减少。高倍镜下可见,假手术组HDAC9在核内与胞浆内均有分布(图 2A,HDAC9与胞核存在共定位);MCAO后,梗死侧与对侧HDAC9核内表达减少(图 2B,C,HDAC9与胞核共定位减少),而梗死侧胞浆内表达增多,且表达强度均较对侧与假手术组的高(对比图 2A~C)。
|
图 2 缺血性脑梗死前后HDAC9细胞内表达的改变 Figure 2 Changes in cellular expressions of HDAC9 in mice after cerebral infarction. A: Sham group; B: Contralesional cortex in MCAO group; C: Ipsilesional cortex in MCAO group. |
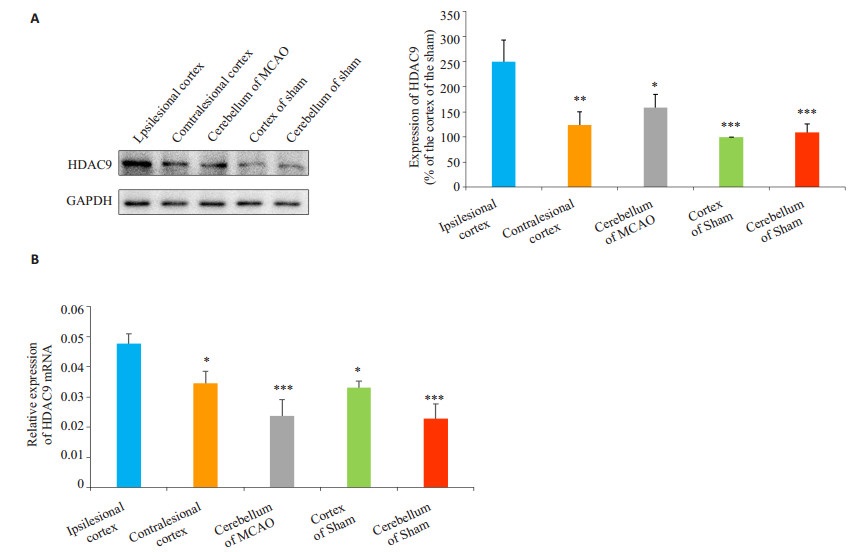
梗死侧脑组织HDAC9蛋白表达水平显著升高,且蛋白表达与mRNA表达是相一致的(图 3)。MCAO组与假手术组各部位脑组织(MCAO组梗死侧/对侧皮层/小脑,假手术组皮层/小脑)的HDAC9表达水平进行对比,结果显示MCAO组梗死侧脑组织HDAC9的表达水平较对侧皮层脑组织有显著升高、较假手术组皮层脑组织也有显著升高,差异有统计学意义。对侧皮层脑组织较假手术组皮层脑组织HDAC9的表达有增高的趋势但没有显著的统计学差异(P > 0.05),MCAO组小脑部位的表达情况也较假手术组有增高的趋势(P > 0.05)。
|
图 3 Western印迹法/qRT-PCR检测HDAC9的表达 Figure 3 Expression of HDAC9 in different brain regions in MCAO group and sham-operated group. A: Western blot analysis of HDAC9 protein; B: HDAC9 mRNA expression detected by qRT-PCR. *P < 0.05, **P < 0.01, ***P < 0.001 vs the ipsilesional cortex. |
HDACs的生理作用是使核小体中的组蛋白去乙酰化,去乙酰化后的染色质聚合浓缩、DNA封闭,抑制细胞基因的表达,从而调节细胞转录活动[6],并参与机体的各种生理与病理的过程[17]。现在较多研究发现,部分亚型的HDACs参与介导缺血性脑卒中的病理生理过程(如HDAC3、-4、-5)[18-19],其抑制剂在体内与体外实验中被证实对脑梗死损伤具有神经保护作用[9]。HDAC9属于IIa类的组蛋白去乙酰化酶(还包括HDAC4, -5, -7),在大脑组织内有广泛的表达,对神经系统的发育[20]与维持其正常功能[21-22]发挥重要的作用。但是关于HDAC9在脑梗死中作用的研究较少。已有的相关研究发现,部分变异型HDAC9基因可增高脑卒中的发病风险[23],但对于HDAC9在缺血性脑卒中发病与进展过程中的确切作用与机制并不了解。本实验发现,小鼠脑梗死后梗死灶周围脑组织的HDAC9的表达增强,这提示HDAC9可能对缺血性脑卒中的病理进程有着一定的影响。从组蛋白去乙酰化酶的功能进行分析,当HDAC9被激活,表达上调,某些基因的表达可能出现异常,打破了原来生理条件下的平衡状态,诱导脑梗死后各种的生理病理效应,参与其病理生理过程。
HDAC9除了可在胞核内抑制基因转录,还可在核内与胞浆内相互穿梭[17]。当HDAC9从核内运出后,抑制的基因重新转录,转移到胞浆后可去乙酰化非组蛋白的基团,产生不同的生物学效应[24]。在本实验我们发现梗死灶周围的细胞胞浆内HDAC9的表达增强,但核内的表达减弱,这提示在缺血性脑梗死时,HDAC9被激活,合成增多,也可能出现从核内向胞浆内转移的情况,这提示HDAC9在脑梗死损伤过程中涉及的机制可能较复杂。根据本实验结果及相关文献,我们推测HDAC9在缺血性脑梗死的病理生理过程的作用与机制可能有两种。
一是参与神经损伤。有文献提到胞质内聚集的Ⅱa类HDACs常参与疾病的发生发展,如神经退行性疾病亨廷顿舞蹈症[25]。在小鼠癫痫模型上,癫痫诱发剂注射侧的海马区神经元出现神经变性,并伴有HDAC9的表达上调[26]。HDAC4在肝脏缺血再灌注模型中也出现从核内向胞浆内转移的现象,促进了炎症因子的释放,诱导炎症损伤的发生[27]。神经元上的HDAC5也被发现在可卡因作用下出现类似情况[28]。因此我们推测,当脑组织发生梗死时,各种信号分子释放并诱导HDAC9合成增多,并逐渐从细胞核内转移到胞浆内,核内组蛋白去乙酰化程度减弱,DNA解聚,可能导致凋亡、炎症相关基因被激活,启动细胞的凋亡途径[3]与炎症反应[27],同时HDAC9在胞浆内的表达升高,可进一步催化胞浆中的某些非组蛋白基团,使细胞进一步发生损伤,通过核内与胞浆内两个途径的共同作用导致了神经元的变性。
二是促进神经修复,有研究发现在神经元发育过程中,HDAC9转运到胞浆内,使核内c-fos基因激活,促进神经突触的形成[29],因此不能排除缺血缺氧条件下HDAC9转移到胞浆后,也可能使c-fos基因激活,促进突触形成,参与神经损伤的修复过程。
综上所述,本实验发现脑梗死后梗死灶周围脑组织HDAC9表达出现上调,以胞浆内表达增强、核内的表达减弱为主,这提示HDAC9与缺血性脑卒中密切相关,可能参与其病理生理过程,且机制复杂。但现在对于其确切的作用与机制尚不明确,后续可结合HDAC9干预、行为学改变、突触变化、双光子观察HDAC9在培养细胞中的穿梭等实验,可揭示HDAC9在缺血性脑梗死中的部分作用与机理。
| [1] | Hankey GJ. Stroke[J]. The Lancet, 2017, 389(10069): 641-54. DOI: 10.1016/S0140-6736(16)30962-X. |
| [2] | Brouns R, De Deyn PP. The complexity of neurobiological processes in acute ischemic stroke[J]. Clin Neurol Neurosurg, 2009, 111(6): 483-95. DOI: 10.1016/j.clineuro.2009.04.001. |
| [3] | Picascia A, Grimaldi V, Iannone C, et al. Innate and adaptive immune response in stroke: Focus on epigenetic regulation[J]. J Neuroimmunol, 2015, 289: 111-20. DOI: 10.1016/j.jneuroim.2015.10.013. |
| [4] | Gomazkov OA. Epigenetic enzymes as therapeutic targets for treating brain disorders[J]. Eksp Klin Farmakol, 2015, 78(11): 35-44. |
| [5] | Ganai SA, Ramadoss M, Mahadevan V. Histone Deacetylase (HDAC) Inhibitors-emerging roles in neuronal memory, learning, synaptic plasticity and neural regeneration[J]. Curr Neuropharmacol, 2016, 14(1): 55-71. DOI: 10.2174/1570159X13666151021111609. |
| [6] | Aune S E, Herr DJ, Kutz CJ, et al. Histone deacetylases exert classspecific Roles in conditioning the brain and heart against acute ischemic injury[J]. Front Neurol, 2015, 6: 145. |
| [7] | Langley B, Brochier C, Rivieccio MA. Targeting histone deacetylases as a multifaceted approach to treat the diverse outcomes of stroke[J]. Stroke, 2009, 40(8): 2899-905. DOI: 10.1161/STROKEAHA.108.540229. |
| [8] | Kim HJ, Rowe M, Ren M, et al. Histone deacetylase inhibitors exhibit anti-inflammatory and neuroprotective effects in a rat permanent ischemic model of stroke: multiple mechanisms of action[J]. J Pharmacol Exp Therapeut, 2007, 321(3): 892-901. DOI: 10.1124/jpet.107.120188. |
| [9] | Park MJ, Sohrabji F. The histone deacetylase inhibitor, sodium butyrate, exhibits neuroprotective effects for ischemic stroke in middle-aged female rats[J]. J Neuroinflam, 2016, 13(1): 300. DOI: 10.1186/s12974-016-0765-6. |
| [10] | Chen Y, Zang X, Pan J, et al. Expression patterns of histone deacetylases in experimental stroke and potential targets for neuroprotection[J]. Clin Exp Pharmacol Physiol, 2012, 39(9): 751-8. DOI: 10.1111/j.1440-1681.2012.05729.x. |
| [11] | Kassis H, Shehadah A, Chopp M, et al. Stroke induces nuclear shuttling of histone deacetylase 4[J]. Stroke, 2015, 46(7): 1909-15. DOI: 10.1161/STROKEAHA.115.009046. |
| [12] | Yuan H, Denton K, Liu L, et al. Nuclear translocation of histone deacetylase 4 induces neuronal death in stroke[J]. Neurobiol Dis, 2016, 91: 182-93. DOI: 10.1016/j.nbd.2016.03.004. |
| [13] | Qingxu G, Yan Z, Jiannan X, et al. Association Between the Gene Polymorphisms of HDAC9 and the Risk of Atherosclerosis and Ischemic Stroke[J]. Pathol Oncol Res, 2016, 22(1): 103-7. DOI: 10.1007/s12253-015-9978-8. |
| [14] | Azghandi S, Prell C, van der Laan SW, et al. Deficiency of the stroke relevant HDAC9 gene attenuates atherosclerosis in accord with allele-specific effects at 7p21.1[J]. Stroke, 2015, 46(1): 197-202. DOI: 10.1161/STROKEAHA.114.007213. |
| [15] | Jiang T, Xu RX, Zhang AW, et al. Effects of transcranial direct current stimulation on hemichannel pannexin-1 and neural plasticity in rat model of cerebral infarction[J]. Neuroscience, 2012, 226: 421-6. DOI: 10.1016/j.neuroscience.2012.09.035. |
| [16] | Yang LX, Zhang X, Zhao G. Ginsenoside Rd attenuates DNA damage by increasing expression of DNA glycosylase endonuclease Ⅷ-like Proteins after focal cerebral ischemia[J]. Chin Med J (Engl), 2016, 129(16): 1955-62. DOI: 10.4103/0366-6999.187851. |
| [17] | Parra M. Class Ⅱa HDACs-new insights into their functions in physiology and pathology[J]. 2015, 282(9): 1736-44. |
| [18] | Yang X, Wu Q, Zhang L, et al. Inhibition of histone deacetylase 3 (HDAC3) mediates ischemic preconditioning and protects cortical neurons against ischemia in rats[J]. Front Mol Neurosci, 2016, 9: 131. |
| [19] | Yuan H, Denton K, Liu L, et al. Nuclear translocation of histone deacetylase 4 induces neuronal death in stroke[J]. Neurobiol Dis, 2016, 91: 182-93. DOI: 10.1016/j.nbd.2016.03.004. |
| [20] | Sugo N, Yamamoto N. Visualization of HDAC9 spatiotemporal subcellular localization in primary neuron cultures[J]. Methods Mol Biol, 2016, 1436: 119-27. DOI: 10.1007/978-1-4939-3667-0. |
| [21] | Lang B, Alrahbeni TM, Clair DS, et al. HDAC9 is implicated in schizophrenia and expressed specifically in post-mitotic neurons but not in adult neural stem cells[J]. Am J Stem Cells, 2012, 1(1): 31-41. |
| [22] | Aizawa S, Teramoto K, Yamamuro Y. Histone deacetylase 9 as a negative regulator for choline acetyltransferase gene in NG108-15 neuronal cells[J]. Neuroscience, 2012, 205: 63-72. DOI: 10.1016/j.neuroscience.2011.12.024. |
| [23] | Zhou X, Guan T, Li S, et al. The association between HDAC9 gene polymorphisms and stroke risk in the Chinese population: A meta-analysis[J]. Sci Rep, 2017, 7: 41538. DOI: 10.1038/srep41538. |
| [24] | Mathias RA, Guise AJ, Cristea IM. Post-translational modifications regulate class Ⅱa histone deacetylase (HDAC) function in health and disease[J]. Mol Cell Proteomics, 2015, 14(3): 456-70. DOI: 10.1074/mcp.O114.046565. |
| [25] | Mielcarek M, Landles C, Weiss A, et al. HDAC4 reduction: a novel therapeutic strategy to target cytoplasmic huntingtin and ameliorate neurodegeneration[J]. PLoS Biol, 2013, 11(11): e1001717. DOI: 10.1371/journal.pbio.1001717. |
| [26] | Jagirdar R, Drexel M, Bukovac A, et al. Expression of class Ⅱ HDACs in two mouse models of temporal lobe epilepsy[J]. J Neurochem, 2015, 136(4): 717-30. |
| [27] | Evankovich J, Cho SW, Zhang R, et al. High mobility group box 1 release from hepatocytes during ischemia and reperfusion injury is mediated by decreased histone deacetylase activity[J]. J Biol Chem, 2010, 285(51): 39888-97. DOI: 10.1074/jbc.M110.128348. |
| [28] | Dietrich J B, Takemori H, Grosch-Dirrig S, et al. Cocaine induces the expression of MEF2C transcription factor in rat striatum through activation of SIK1 and phosphorylation of the histone deacetylase HDAC5[J]. Synapse, 2012, 66(1): 61-70. DOI: 10.1002/syn.v66.1. |
| [29] | Sugo N, Oshiro H, Takemura M, et al. Nucleocytoplasmic translocation of HDAC9 regulates gene expression and dendritic growth in developing cortical neurons[J]. Eur J Neurosci, 2010, 31(9): 1521-32. |
 2017, Vol. 37
2017, Vol. 37

