2. 陆军总医院附属八一儿童医院儿童SPICU,北京 100700
2. Affiliated Bayi Children's Hospital of General Hospital of Beijing Military Region, Beijing 100700, China
急性肺损伤(ALI)是以肺部炎症和微血管通透性增加为特征的临床综合征,可以由体外循环、脓毒血症、严重创伤等引起。肿瘤坏死因子-α(TNF-α)是炎症反应过程中最早期的炎症因子,在ALI发生发展过程中具有重要作用[1-3],TNF-α是体外循环(CPB)诱发炎性反应的一个关键因素[4]。目前认为,CPB所致的炎症反应是造成肺损伤的主要原因,而TNF-α促进CPB所致的炎症反应[5]。随着心脏外科技术进步,体外循环设备的不断完善,心内直视手术术后并发症和死亡率明显下降,但CPB导致缺血再灌注损伤心肌顿抑、急性肺损伤发病率仍居高不下。为深入研究体外循环机体病理生理变化及心肺保护需要更接近临床手术的体外循环可靠的模型方案。而目前CPB动物模型中采用大动物,如猪、羊和犬等多见[6-8],其操作难度相对简单,但对人员、设备和经济条件等各方面的要求较高,在基础研究中的应用和推广受到很大限制[9]。而采用大鼠[10]、家兔[11-13]等小型动物作为实验对象,虽然容易管理,费用少,而且越来越受到大家的重视和认可[14-15],但存在以下两点不足,首先是手术操作难度较大,无法阻断主动脉使心脏停跳,从而完全模拟术中实际情况。其次,目前大部分小动物体外循环实验采取同种异体血,但同种异体输血可能存在输血免疫反应,影响实验结果。甚至部分实验采用无血预充[16],无血预冲使得血液稀释最大化,进一步加重微循环灌注障碍[17],加重组织损伤,另外CPB期间红细胞压积(HCT)值每下降百分点AKI的相对风险增加7% [18]。因此,应当尽可能的减轻血液稀释的程度,减轻组织损伤。为克服小动物体外循环实验存在的以上两点不足,我们对兔CPB模型做出进一步的改进,采取自体血预充方案,并改良手术操作方案和插管方式实现术中主动脉阻断心脏停跳,模拟实际手术情况。
1 材料和方法 1.1 实验动物及设备器材 1.1.1 实验动物纯种新西兰兔10只(体质量3.25± 0.31 kg)雄性,由北京海淀区兴隆动物饲养中心[SCXK2011-0006]提供。本实验采取自体血预充方案,于术前1月,经兔耳中央动脉抽取45~50 mL/次,间隔12~15 d,再次采血,将血液保存于输血袋中,冷藏备用。术前6 h禁食,2 h禁水。
1.1.2 设备器材体外循环机(Terumo Cardiovascular Systems Corporation、型号System 1),呼吸机(STEPHAN、型号F120 Mobil),婴儿型膜肺(Terumo Cardiovascular Systems Corporation、型号RX05RW),变温水浴箱(Sarns Temperature Control and Monitor System、型号TCM Ⅱ),动脉导管(Medtronic、型号6F),静脉引流管(宁波菲拉尔医疗用品有限公司、型号14F),气管导管(Mallinckrodt、型号3.0~3.5 mm),动脉灌注管(BD Angiocath、型号22GA),监护仪(Philips IntelliVue、型号MP30),转换接头(东莞科威医疗器械有限、型号6×4)。
1.1.3 实验药物戊巴比妥钠(北京普诺欣生物科技有限公司);咪达唑仑注射液(江苏恩华药业股份有限公司);枸橼酸芬太尼注射液(宜昌人福药业有限责任公司);罗库溴铵注射液(Organon);5%碳酸氢钠(回音必集团江西东亚制药有限公司);肝素钠(上海上药第一生化药业有限公司);利多卡因(北京益民药业有限公司);葡萄糖酸钙(天津金耀药业有限公司);鱼精蛋白(北京悦康凯悦制药有限公司);Thomas心脏停搏液(自配);乳酸林格(石家庄四药有限公司),琥珀酰明胶注射液(贝朗医疗苏州有限公司);苏木精和伊红(北京普诺欣生物科技有限公司);Rabbit TNF-α ELISA Ki(t北京普诺欣生物科技有限公司)。
1.2 体外循环模型建立的方法 1.2.1 预充预充液由新西兰兔自体血100 mL,琥珀明胶10 mL,乳酸林格10 mL,碳酸氢钠注射液10 mL,葡萄糖酸钙5 mL组成,共135 mL。
1.2.2 麻醉实验兔术前禁食禁饮6 h,术前1 h腹腔注射3.5%戊巴比妥钠1 mL/kg,备皮并固定,穿刺耳缘静脉,建立静脉通道,穿刺兔股动脉动脉,监测动脉血压。颈部以利多卡因局麻,切开皮肤,钝性分离神经血管,T字形切开气管,置入气管导管(内径3.0~3.5 mm),呼吸机辅助呼吸,呼吸频率40~45次/min,潮气量8~10 mL/kg。追加咪达唑仑0.5 mg/kg,芬太尼2~3 μg/kg,罗库溴铵注射液0.6 mg/kg,术中酌情追加维持麻醉深度。
1.2.3 体外循环模型的建立沿胸骨正中开胸,骨蜡封闭暴露的骨髓腔,减少出血,主动脉根部、右心房荷包缝合,肝素2 mg/kg静脉推注,待ACT达到300 s以上,分别经主动脉插入6F动脉导管,导管末端沿降主动脉方向;经右心房插入14F静脉引流管,收紧荷包,妥善固定(图 1)。转流开始,转流量100~120 mL/(kg·min),阻断钳完全夹闭主动脉、肺动脉,于阻断钳近心端插入22GA动脉穿刺针置管,灌注Thomas心脏停搏液(20~ 25 mL/kg)。进行性降温,维持肛温33 ℃。心脏停搏30 min后,开放主、肺动脉,体外转流辅助10~15 min,待生命体征稳定后,终止体外转流,给予鱼精蛋白中和肝素,监测生命体征,观察4 h。
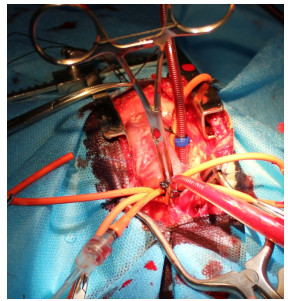
|
图 1 兔体外循环心脏置管 Figure 1 Cardiopulmonary bypass in a rabbit model. |
监测心率(HR)、平均动脉压(MAP)、肛温,监测术前、术中血气,评估灌注情况。终止体外转流4 h后,呼吸、血压、心率稳定,即视为模型成功,随后注射10 mL KCl注射液处死。
1.4 ELISA检测血清TNF-α表达水平分别于体外循环转流前(T2)、体外循环结束后1 h(T5)、体外循环结束后4 h(T6)取动脉血,抗凝处理后2500 r/min离心10 min,吸取血清。采用ELISA法检测兔血TNF-α水平。具体步骤参考ELISA试剂盒说明书。
1.5 HE染色从右侧下肺叶收集组织样本,用10%中性福尔马林固定液固定24 h,洗去固定液,彻底脱水,石蜡包埋。用切片机将石蜡包埋的组织块切成厚度为4 μm薄片。用苏木精(Hematoxylin)和伊红(Eosin)染色,光学显微镜观察。
1.6 统计学方法采用SPSS 20.0统计软件,统计数据以均数±标准差表示,实验前后不同时间点的比较和组间对照采用单因素方差分析,任意两时间点之间差异比较采用LSD,CPB前后的差异比较采用配对t检验,以双侧P < 0.05为差异有统计学意义。
2 结果 2.1 生命体征本实验中模型成功率90%,成功建立9只CPB模型,1只动物失败。失败的主要原因为主动脉插管穿透血管后壁,大量出血导致建模失败。CPB开始后,HR开始明显下降,这可能是由于血液稀释、低温。MAP略有下降,MAP保持在55 mmHg以上。主肺动脉阻断期间,肛温维持在33 ℃。术中模型的血流动力学监测结果(表 1)。
| 表 1 兔体外循环模型生命体征结果分析 Table 1 Vital signs changes in the rabbit models of cardiopulmonary bypass (n=9, Mean±SD) |
尽管采用有血预充,体外转流前后HCT依然显著下降。血浆乳酸浓度在重新开放主肺动脉终止体外循环时明显增加,并T6时刻达到12.76±1.76mmol/L。CPB前后,血浆PH略有下降,但无显著差异。相较于CPB开始前T2,T4氧分压(PaO2)显著增加,可能归因于膜肺高效的氧合效果,而血液的稀释并没有降低氧分压,T6氧分压较T2明显下降(P < 0.05)。T6氧合指数(PaO2/FiO2)比T2明显下降(P < 0.05)。动脉血电解质基本正常。术中模型的血流动力学监测结果(表 2)。
| 表 2 兔体外循环模型动脉血气分析结果 Table 2 Results of arterial blood gas analysis in the cardiopulmonary bypass models (n=9, Mean±SD) |
体外循环前后兔血TNF-α水平为:体外循环前T2(280.02 ± 38.66)pg·L-1;体外循环结束后1 h(T5)(914.96 ± 41.93)pg·L-1;体外循环结束后4 h(T6)(1360.55±53.71)pg ·L-1。与体外循环前T2比较,体外循环后T5、T6 TNF-α水平显著升高(P < 0.05)。
2.4 病理学结果病理显示,经过体外循环缺血再灌注的肺受到明显损伤,微血栓毛细闭塞血管,肺泡和间质水肿,肺泡腔破裂融合增多、塌陷、脱落的上皮细胞和炎性细胞浸润增加(图 2、3)。
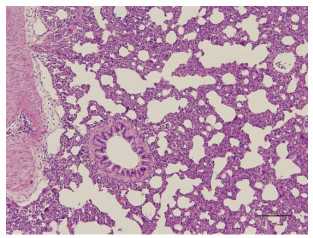
|
图 2 兔肺组织病理改变 Figure 2 Pathological examination of lung tissue of a rabbit (HE staining, original magnification: ×100). |
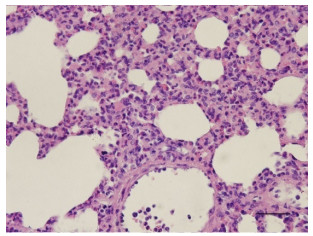
|
图 3 兔肺组织病理改变 Figure 3 Pathomophology of lung tissue of a rabbit (HE staining, ×400). |
本研究以新西兰兔为实验对象,成功建立体外循环术后急性肺损伤模型,成功率90%。具有以下几点优点:(1)利用兔建立CPB模型,资金需求少,管理容易;(2)采用兔自体血预冲,避免同种异体输血可能存在输血免疫反应;(3)实现主动脉完全阻断,心脏停跳;(4)终止体外转流后,心脏复跳成功率高,循环系统和呼吸功能恢复良好,建模成功率高。
目前体外循环动物模型多采用犬、猪、羊等大型动物, 而兔等小型实验动物CPB模型研究较少。大动物手术操作相对简单,能较好地模仿心脏外科手术中的CPB过程,但设备和经济要求较高。兔CPB模型动脉置管以腹主动脉、颈动脉、股动脉[19]及锁骨下动脉置[20]管多见,而这四种插管方式在临床心脏外科手术中几乎不再采用,一方面因为无法充分满足全身重要器官血液灌注的需求,另一方面因为无法实现全流量体外循环模式。本实验选择主动脉置管,完全阻断主肺动脉后,灌注心肌保护液,心脏停跳,建立兔全流量体外循环模型,能完全模拟心脏外科手术中的CPB过程,更加符合临床CPB中生理学与血流动力学改变,从而更加适合用于研究体外循环对机体器官功能的影响。
本实验模型血流动力学稳定相对稳定,MAP维持在55~90 mmHg(表 1);电解质、血气各项指标都在可以接受的范围(表 2),符合CPB标准。采用兔自体血预冲,实现主动脉完全阻断,心脏停跳,改良了经右心房引流,主动脉灌注的兔CPB急性肺损伤模型,完全可为体外循环缺血再灌注损伤方向的基础研究提供稳定可靠的研究模型。
3.2 动物模型肺损伤和炎症反应评价本研究中HE染色发现肺泡和间质明显水肿,肺泡腔破裂融合增多、塌陷、脱落的上皮细胞和炎性细胞浸润,体外循环术后急性肺损伤的发生导致T6氧合指数281.64 ± 55.76明显低于体外循环前T2(P < 0.05)。TNF-α表达水平存在显著差异,与体外循环前T2比较,体外循环后T5、T6 TNF-α水平显著升高(P < 0.05),可能的原因:(1)CPB期间接触激活,白细胞与CPB管道异物接触,刺激白细胞生成和聚集,诱导TNF-α的释放[21-23];(2)CPB期间组织器官局部贫血,主肺动脉开放后,再灌注增加补体激活,促进白细胞产生TNF-α [24-25]。Qi等[26]在建立的CPB模型中,也观察到体外循环术后TNF-α表达水平升高。YU等[3]发现降低血液中TNF-α的水平,能减轻肺水肿和组织的损伤。
3.3 兔CPB模型建立的难点与技术关键预充液采用非全血预充,将不可避免的造成血液稀释,为了最大限度的减轻血液稀释的程度,降低血液稀释对实验的影响,本研究采取了一下措施:(1)选用RXW05婴儿型膜肺,合理使用转换接头(4×6),尽可能选用4号管路,尽可能减少预充量;(2)自体血100 mL预充,与其他少量预充液组成135 mL的混合预充液,一方面既可以避免同种异体血预充的影响,另外一方面竟可能提高自体血在预充液中的比例;(3)另用一个滚压泵头回收手术过程中切口的出血,减少血液的丢失。
动脉置管部位选择主动脉,兔的升主动脉暴露长度很短约1.2~1.5 cm,管壁脆弱[5],对插管技术要求较高。选用6F动脉插管,插管手法要轻柔,控制插管的方向和力度,动脉插管成功与否事关实验成败,如有不慎,可导致主动脉破裂,无法修补,大量出血,导致建模失败。静脉置管选择右心房,选用14F静脉引流管,保证充分的静脉引流。动静脉插管、管路、膜肺与心脏构成完成的回路,在滚压泵的驱动下维持体外转流。体外转流过程中及时调整引流管的位置和方向,充分引流心房血液。本次实验中最流量维持在100~120 mL/(kg· min),平均动脉压MAP维持在55 mmHg以上,保证有效灌注压,血流动力学稳定。另外,血液稀释后血红蛋白偏低,有不同程度酸中毒,应注意血红蛋白的补充和酸中毒的纠正。
总之,本研究克服了前人工作的不足,采用兔自体血预冲,实现主动脉完全阻断,心脏停跳,改良了经右心房引流,主动脉灌注,有血预充的兔CPB急性肺损伤模型,进一步优化了CPB建模方案,与临床应用更加贴近,对研究体外循环引起急性肺损伤具有重要的意义。体外循环术后急性肺损伤的高发病率,急需有效的预防和治疗措施,以此模型为基础,可进一步研究肺损伤的分子机制,以及如何减少TNF-α的释放,从而减轻体外循环术后急性肺损伤。
| [1] | Atabai K, Matthay MA. The pulmonary physician in critical care. 5: Acute lung injury and the acute respiratory distress syndrome: definitions and epidemiology[J]. Thorax, 2002, 57(5): 452-8. DOI: 10.1136/thorax.57.5.452. |
| [2] | Gao M, Xie B, Gu C, et al. Targeting the proinflammatory cytokine tumor necrosis factor-α to alleviate cardiopulmonary bypassinduced lung injury(Review)[J]. Mol Med Rep, 2015, 11(4): 2373-8. |
| [3] | Jeon CM, Shin IS, Shin NR, et al. Clausena anisata-mediated protection against lipopolysaccharide-induced acute lung injury in mice[J]. Int J Mol Med, 2016, 37(4): 1091-8. |
| [4] | Yu Y, Gao MX, Li HT, et al. Pulmonary artery perfusion with Anti-Tumor necrosis factor alpha antibody reduces cardiopulmonary Bypass-Induced inflammatory lung injury in a rabbit model[J]. PLoS One, 2013, 8(12): e83236. DOI: 10.1371/journal.pone.0083236. |
| [5] | Luan ZG, Zhang J, Yin XH, et al. Ethyl pyruvate significantly inhibits tumour necrosis factor-a, interleukin-1b and high mobility group box 1 releasing and attenuates sodium taurocholate-induced severe acutepancreatitis associated with acute lung injury[J]. Clin Exp Immunol, 2013, 172: 417-26. DOI: 10.1111/cei.2013.172.issue-3. |
| [6] | Chen Y, Liu J, Wang S, et al. Early changes in cerebral oxidative stress and apoptotic neuronalinjury after various flows for selective cerebral perfusion in piglets[J]. Perfusion, 2012, 27: 419-25. DOI: 10.1177/0267659112446524. |
| [7] | 袁海云, 周成斌, 陈寄梅, 等. 胎羊体外循环通过microRNAs导致胎心功能失调[J]. 中国体外循环杂志, 2016, 14(3): 177-81. |
| [8] | 朱艳平. 经股动静脉置管犬体外膜肺氧合模型的建立[J]. 中华普通外科学文献:电子版, 2016, 10(1): 19-23. |
| [9] | 莫文魁, 何良勇, 陈群清, 等. 兔脑栓塞急性期体外循环模型的建立及临床意义[J]. 南方医科大学学报, 2013, 33(11): 1652-5. |
| [10] | 朱耀斌, 李志强, 范祥明, 等. 深低温停循环大鼠大脑缺氧诱导因子-1α和信号转导分子2表达情况[J]. 中华实用诊断与治疗杂志, 2016, 31(12): 1162-5. |
| [11] | Salameh A, Halling M, Seidel T, et al. Effects of minocycline on parameters of cardiovascular recovery after cardioplegic arrest in a rabbit Langendorff heart model[J]. Clin Exp Pharmacol Physiol, 2015, 42(12): 1258-65. DOI: 10.1111/1440-1681.12485. |
| [12] | Pan X, Sun L, Ma W, et al. Overactivation of poly(adenosine phosphate-ribose) polymerase 1 and molecular events in neuronal injury after deep hypothermic circulatory arrest: study in a rabbit model[J]. J Thorac Cardiovasc Surg, 2007, 134: 1227-33. DOI: 10.1016/j.jtcvs.2007.05.062. |
| [13] | Yu L, Gu T, Zhang G, et al. The deep hypothermic circulatory arrest causes more kidney malfunctions based on a novel rabbit model[J]. Ann Saudi Med, 2014, 34(6): 532-40. DOI: 10.5144/0256-4947.2014.532. |
| [14] | Schnoering H, Arens J, Detering SM, et al. Development of a rabbit animal model for miniaturized heart-lung machines[J]. ASAIO J, 2013, 59(2): 152-6. DOI: 10.1097/MAT.0b013e3182857990. |
| [15] | Schnoering H, Arens J, Detering SM, et al. Expression of inflammation in myocardial tissue of rabbits: Comparison of two miniaturized heart-lung machines[J]. Artif Organs, 2013, 37(6): 541-8. DOI: 10.1111/aor.2013.37.issue-6. |
| [16] | 宋志鸿, 石缨, 唐跃, 等. 闭胸无血预充兔体外循环模型的建立[J]. 中西医结合心脑血管病杂志, 2011, 9(12): 1493-4. DOI: 10.3969/j.issn.1672-1349.2011.12.049. |
| [17] | Koning NJ, de Lange F, Vonk AB, et al. Impaired microcirculatory perfusion in a rat model of cardiopulmonary bypass: the role of hemodilution[J]. Am J Physiol Heart Circ Physiol, 2016, 310(5): H550-8. DOI: 10.1152/ajpheart.00913.2015. |
| [18] | Ranucci M, Aloisio T, Carboni G, et al. Acute kidney Injury and hemodilution during cardiopulmonary bypass: a changing scenario[J]. Ann Thorac Surg, 2015, 100(1): 95-100. DOI: 10.1016/j.athoracsur.2015.02.034. |
| [19] | 袁茂溪, 伍火志, 罗常进, 等. 改良兔体外循环模型的建立[J]. 安徽医药, 2009, 13(3): 250-2. |
| [20] | Zou L, Liu J, Zhang H, et al. A rabbit model of antegrade selective cerebra perfusion with cardioplegiarrest[J]. Perfusion, 2016, 31(4): 327-33. DOI: 10.1177/0267659115599835. |
| [21] | Clark SC. Lung injury after cardiopulmonary bypass[J]. Perfusion, 2006, 21(4): 225-8. DOI: 10.1191/0267659106pf872oa. |
| [22] | Shen Y, Wu H, Wang C, et al. Simvastatin attenuates cardiopulmonary bypass-induced myocardial inflammatory injury in rats by activating peroxisome proliferator-activated receptor γ[J]. Eur J Pharmacol, 2010, 649: 255-62. DOI: 10.1016/j.ejphar.2010.08.058. |
| [23] | Huffmyer JL, Groves DS. Pulmonary complications of cardiopulmonary bypass[J]. Best Pract Res Clin Anaesthesiol, 2015, 29(2): 163-75. DOI: 10.1016/j.bpa.2015.04.002. |
| [24] | Shan NG, Tulapurkar ME, Damarlam, et al. Febrile-range hyperthermia augments reversible TNF-α-induced hyperpermeability in human microvascular lung endothelial cells[J]. Int J Hyperther, 2012, 28(7): 627-35. DOI: 10.3109/02656736.2012.690547. |
| [25] | Zhang Y, Li D, Luo J, et al. Pharmacological postconditioning with sevoflurane activates PI3K/AKT signaling and attenuates cardiopulmonary bypass-induced lung injury in dog[J]. Life Sci, 2017, 37(6): 541-8. |
| [26] | Qi D, Gao M, Y Yu, et al. Intratracheal antitumor necrosis factor-α antibody attenuates lung tissue damage following cardiopulmonary bypass[J]. Artificial Organs, 2013, 37(2): 142-9. DOI: 10.1111/aor.2013.37.issue-2. |
 2017, Vol. 37
2017, Vol. 37

