目前,我国是世界上宫颈癌发病率第二高发的国家,宫颈癌正日益威胁着我国广大妇女的健康。F10基因可能是一种与葡萄胎的恶变及妇科恶性肿瘤的发生有关的新基因。它(GenBank号:AB196290)是本课题组探讨葡萄胎发病机制时从葡萄胎与正常早孕绒毛的差异cDNA文库中筛选出的一条功能未知的新基因[1]。我们前期研究显示,F10基因不仅在葡萄胎、侵蚀性葡萄胎和绒癌中呈阳性表达且依次增强[2],在卵巢癌、子宫内膜癌等妇科肿瘤中亦呈阳性表达,但在正常子宫内膜及宫颈上皮组织中呈阴性表达。因此,F10基因作为一种与葡萄胎恶变及妇科肿瘤发生相关的新基因,研究其在宫颈癌等肿瘤发生发展过程中的作用,可为宫颈癌的治疗提供新思路。已有的研究成果中,尚未涉及对F10基因在宫颈癌组织中的表达分析的研究。为研究F10基因在宫颈癌组织中的表达情况,进一步明确F10基因与宫颈癌的关系,本研究使用RT-PCR和免疫组织化学的方法,定性和半定量地检测F10基因在癌组织和癌旁组织中的表达差异。
1 资料和方法 1.1 材料 1.1.1 临床标本来源收集南方医院妇产科2015年10月~2016年7月部分宫颈癌患者手术切除标本,与病理科取材相同部位,并经病理诊断证实。取材后RT-PCR标本立即置于液氮中保存,免疫组织化学标本立即置于10%甲醛固定。宫颈癌癌旁组织为局灶性肿瘤癌旁组织或因良性病变行全子宫切除术患者宫颈组织(以下统称为癌旁组织),共有30对配对的宫颈癌及癌旁组织。F10编码蛋白的单克隆抗体为先期实验制得[3],已检验得知此抗体效价高,特异性强,可用于F10基因的一步研究[4]。
1.1.2 试剂及仪器RNA分离试剂Trizol、mRNA逆转录及荧光定量PCR试剂盒(SYBR® PrimeScriptTMmRNA RT-PCR Kit)购自中国宝生生物(TAKARA)公司。F10基因及内参mRNA逆转录引物购自英潍捷基(上海)贸易有限公司(Invitrogen)。NanoDropND-1000微量核酸定量仪购自Thermo公司;9700型PCR仪购自ABI公司;罗氏lightCycler480II荧光定量PCR仪器为瑞士罗氏公司产品。F10单克隆抗体(上海康成公司);超敏三步法免疫组织化学试剂盒及DAB显色试剂盒(中山金桥公司)。
1.1.3 RT-PCR法检测F10的引物序列通过PCR引物设计软件Primer Premier5.0设计F10的引物序列,并由Invitrogen公司合成。
F10上游:5'-TCCAAAACAGCCGCTCTTCA G-3';F10下游:5'-ATGAGGCTGCTGAGGATGTC-3'引物干粉离心后用DEPC水配置成20 μmol/L,置于-0 ℃冰箱备用。
1.2 方法 1.2.1 RNA的提取与纯化剪刀剪取约80 mg组织,用液氮将组织充分研磨成粉末,待液氮挥发后,立刻加入Trizol提取液,每80 mg组织加入约600 mL Trizol。超声粉碎仪使组织充分裂解。加入总体积1/5的氯仿剧烈振荡混匀15 s室温放置10 min。4 ℃,12 000 r/min离心10 min,转移上清到新的2 mL的离心管,加入等体积的异丙醇(1:1体积),充分混匀,室温放置10 min沉淀。4 ℃,12 000 r/min离心10 min,去除上清,沉淀中加入1 mL 75%的乙醇洗涤RNA沉淀2次,4 ℃,8000 r/min离心15 min。去上清,小心不要搅动沉淀,RNA空气中晾干约10~15 min,加入100 μL的RNase-free水充分溶解(可放于-80 ℃长期保存)。
1.2.2 RT-PCR检测F10基因在宫颈癌中的转录表达情况从宫颈癌组织及癌旁组织或正常组织中分别提取总RNA,按宝生物公司逆转录及荧光定量PCR试剂盒说明书,经逆转录形成cDNA,根据SYBR Green法进行荧光定量PCR,采用△△CT法对荧光定量PCR结果进行定量分析,根据各样本的Ct值,以2-△△Ct表示基因的相对表达水平。
1.2.3 免疫组织化学法检测F10蛋白在宫颈癌癌组织及癌旁组织中的表达情况每组标本均经10%甲醛固定,24 h内取材,石蜡包埋,4 μm厚连续切片,按照超敏SP法免疫组化试剂盒说明书操作。标本脱蜡、水化,微波抗原修复,10% H2O2-甲醇封闭内源性过氧化物酶10 min。30 μL正常非免疫动物血清封闭,室温下封闭30 min;加F10一抗稀释液30 μL,4 ℃过夜;次日加生物素二抗30 μL,室温下孵育30 min;加链霉菌抗生物素-过氧化酶溶液30 μL,室温下孵育30 min;DAB显色,苏木精复染,中性树胶封固。Olympus显微镜下400×随机选取5个不连续的高倍视野,Image-Pro Plus(Version 6.0, USA)软件分析图像,平均光密度值代表表达强度。
1.3 数据处理统计学处理RT-PCR所有数据均为3组独立重复试验的结果。免疫组化数据采用Image-Pro Plus(Version 6.0, USA)软件分析图像,平均光密度值代表表达强度。样本中癌组织及相应癌旁组织及正常组织中表达的比较采用两配对样本t检验,采用SPSS19.0软件对数据进行统计学分析。数值大小以均数±标准差表示。P < 0.05为差异具有统计学意义。
2 结果 2.1 F10基因在宫颈癌组织内的转录表达分析应用RT-PCR检测30对宫颈癌组织标本中F10基因表达,以第4对标本的癌旁组织为参考值,2-△△Ct通过配对样本t检验分析,结果示宫颈癌组织中的F10的平均表达量为2.26±0.52,显著大于宫颈癌癌旁组织及正常组织中F10的平均表达量0.81±0.15,具有统计学意义(t=2.369,P=0.025,图 1)。前10组标本来自术前应用1~2次新辅助化疗病人,编号11至30组病人为术前未应用新辅助化疗并且按术后病理中分化鳞癌、中低分化鳞癌、低分化鳞癌、腺癌顺序排列。
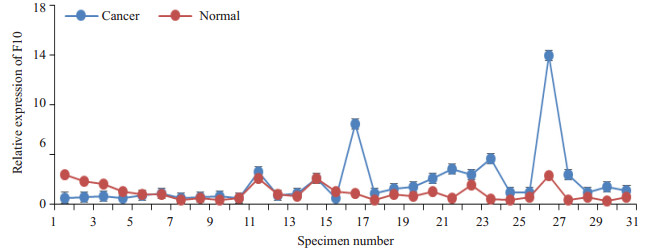
|
图 1 RT-PCR检测配对宫颈癌组织中F10的相对表达量 Figure 1 Relative expression of F10 mRNA in paired cervical cancer tissues detected by RT-PCR. Relative expression of F10 in paired cervical cancer tissues. |
肿瘤组织中F10基因表达蛋白免疫组织化学阳性染色主要位于肿瘤细胞的细胞质内[4],阳性染色为细胞质有棕黄色颗粒沉着。免疫组化检测结果显示:癌组织中F10蛋白的表达为0.123±0.010,癌旁组织中F10蛋白的表达0.040±0.005,整体数值及趋势如图 2所示。与癌旁组相比,F10基因在癌组织中的表达明显增高(P < 0.000)。30对标本免疫组化图片如图 3所示(图片内数字为标本编号,C为癌组织,N为配对癌旁组织或正常组织),前10组标本来自术前应用1~2次新辅助化疗病人,编号11~30组病人为术前未应用新辅助化疗并且按术后病理中分化鳞癌、中低分化鳞癌、低分化鳞癌、腺癌顺序排列。图示F10蛋白的强度癌组织明显高于癌旁组织。
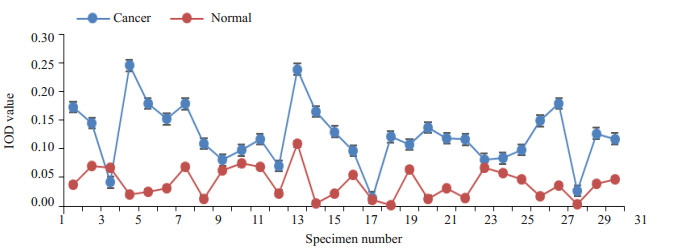
|
图 2 免疫组化法检测配对癌组织中F10蛋白的半定量表达量 Figure 2 Expression of F10 protein in paired tumor tissues detected by immunohistochemistry. The expression of F10 protein detected by immunohistochemistry in paired cervical cancer tissues. |
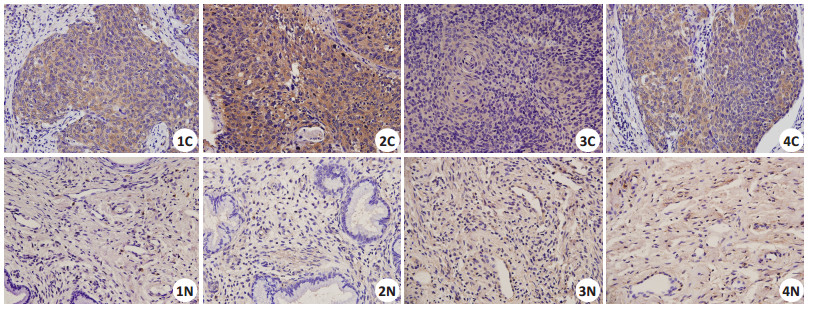
|
图 3 配对癌组织中F10蛋白的免疫组化检测 Figure 3 Expressions of paired tumor groups by immunohistochemistry(SP, original magnification: × 400). Number1-4: Specimen number; C: Cancer tissue; N: Ppaired adjacent tissue. |
在所有使用RT-PCR和免疫组化方法检测的癌组织F10mRNA相对表达水平结果中,我们比较了25份鳞癌标本中不同分化程度的癌组织内F10的表达强度,应用两独立样本t检验,两两组间相比较。其中RT-PCR方法检测结果示,中分化鳞癌1.85±0.50,中低分化鳞癌1.98±0.49,低分化鳞癌6.16±4.44。中分化鳞癌组与低分化鳞癌组相对比(P=0.00),中低分化鳞癌组和低分化鳞癌组相对比(P=0.00),结果均表示有统计学意义(P < 0.05)。中分化鳞癌组与中低分化鳞癌组相对比,组间比较无统计学意义(P>0.05)。免疫组织化学法检测F10蛋白表达水平结果示:中分化鳞癌0.13±0.02,中低分化鳞癌0.13±0.01,低分化鳞癌0.10±0.03。显示各组间比较均无统计学意义(P>0.05)。
2.4 化疗对宫颈癌组织中F10表达水平的影响所有配对组织样本中,有10组患者曾接受过术前新辅助化疗(TP方案,紫杉醇+顺铂),20组患者术前未接受过新辅助化疗。我们观察到RT-PCR结果中第1、2、3、4、5组中的癌组织F10表达值小于癌旁组织。按照术前是否接受过新辅助化疗将数据分为两组,使用两样本t检验比较10名术前应用新辅助化疗患者与20名术前未应用化疗治疗的患者癌组织中F10表达水平,RT-PCR结果显示:术前行新辅助化疗组F10mRNA表达量0.73±0.05,未行化疗组3.03±0.73,两组数据之间差异有统计学意义(P=0.040)。免疫组织化学结果显示:术前行新辅助化疗组F10蛋白表达量0.15±0.02,未行化疗组0.11±0.01,两组数据之间差异无统计学意义(P=0.99)。
3 讨论葡萄胎差异性表达新基因F10是一种功能未明的新基因。已证实F10基因在滋养细胞肿瘤中呈阳性表达,并在葡萄胎、侵蚀性葡萄胎到绒癌表达强度逐渐增强,并且初步研究表明F10不但参与葡萄胎发生,还可能与滋养细胞侵袭行为有关[6]。除了滋养细胞肿瘤,研究发现,使用原位杂交的方法检测,F10在正常组织、癌旁组织不表达,在卵巢腺癌、乳腺癌、肝癌、胃腺癌等腺癌中的表达情况均呈阳性,且在不同的腺癌之间的阳性表达无显著性差异(P>0.05)[7-8]。这些结果提示F10基因可能与上述肿瘤的发生有关。F10蛋白是在多种组织普遍表达的细胞内蛋白[9],并在肿瘤组织中有增强表达的趋势。其中在复层扁平上皮、神经节卫星细胞、胰腺以及消化道黏膜表达最为强烈,说明F10不仅是一种肿瘤特异性基因,更可能与细胞分泌、代谢相关。研究表明F10基因过表达建立的肺癌A549细胞株凋亡减少,并且其在裸鼠体内的致瘤性增强[10];F10基因沉默处理建立的子宫内膜癌KLE细胞株增殖性减弱,并通过下调细胞色素C促进细胞凋亡[11]。因此,我们初步推测F10基因不仅与滋养细胞肿瘤有关,还有可能作为一种癌基因参与某些肿瘤发展和转移[12]。
本研究通过RT-PCR及免疫组织化学的方法从基因转录和蛋白质表达两个层面定性和半定量地证明了在宫颈癌中F10基因的表达远高于癌旁组织及正常组织。肿瘤的发生发展以及转移,通常源于癌基因或抑癌基因的异常变化[13],越来越多的证据表明某些基因参与抑制或促进肿瘤转移。F10在滋养细胞肿瘤及某些腺癌中过表达现象提示我们F10可能作为一种癌基因参与细胞的增殖与凋亡。本研究中F10在宫颈癌中的过表达结果更证明了这一观点,其功能研究对于揭示宫颈癌的发病机制、指导临床治疗具有重要意义,关于F10在肿瘤细胞生长、浸润、转移中的作用机制还需要进一步的实验证明。
宫颈癌术前新辅助化疗主要应用于肿瘤直径大于4 cm的ⅠB~ⅡA及ⅡB期患者,因其直接手术或放疗或手术后放疗远期效果均不理想[14]。化疗药物可通过抑制细胞表达、分裂增殖及侵袭达到抗肿瘤效果[15-16]。接受化疗患者肿瘤组织细胞周期受到抑制,相关癌基因表达减弱。F10基因可能通过上调与细胞周期关键调控点的正相关调节因子cyclin-CDK复合物的表达水平[17],加快绒癌细胞的细胞周期进程,增强细胞分裂增殖活动能力[18]。F10基因还可通过上调MMP-2、8、11、16、19[19]的表达,下调PAI1[20]及TIMP-1[21]水平,加速绒癌组织中细胞基质的降解,从而起到促进绒癌侵袭性增强的作用[22]。这些都说明F10基因可能通过多种调节手段增强了绒癌的侵袭能力。F10基因在应用过术前新辅助化疗的患者癌组织中的检测值显著低于术前未应用化疗治疗的患者,可能与F10基因促癌细胞增殖、抑制细胞凋亡[23]功能受到抑制有关。癌组织分化程度越低,恶性程度相对增强。鳞癌组织中,中分化、中低分化、低分化癌组织侵袭性依次增强。既往研究提示,F10基因可促进绒癌细胞系JEG-3在裸鼠体内的成瘤性[24],并且,F10基因过表达可抑制肺癌细胞A549对紫杉醇化疗的敏感性[25]。中分化鳞癌、中低分化鳞癌组织中F10基因检测值分别显著低于低分化鳞癌组织中F10基因的表达,提示F10基因的表达强度与肿瘤的恶性程度呈正相关。我们还对比了相对应免疫组化的结果,术前化疗组与未化疗组,不同分化程度的癌组织中,F10蛋白表达量并未示统计学差异。关于RT-PCR和免疫组化半定量结果不一致的原因,考虑与影响F10基因表达水平的时空因素有关:一个原因可能是基因转录对化疗等外来因素的反应更为敏感,在观察期限内首先表现出差异来。另一个原因,推测可能与免疫组化半定量结果精确度稍差有关,不能完全反映出化疗对F10蛋白表达的影响。
| [1] | 李贵堂, 庞战军, 周瑾, 等. 葡萄胎发病相关新基因的克隆[J]. 广东医学, 2006, 27(1): 22-4. |
| [2] | 周瑾, 陈士岭, 邢福祺, 等. 葡萄胎发病新基因F10与滋养细胞肿瘤侵袭相关性研究[J]. 第一军医大学学报, 2005, 25(2): 171-3. |
| [3] | 庞战军, 周君桂. 葡萄胎病理相关基因F10编码蛋白单克隆抗体的制备与应用[J]. 免疫学杂志, 2015(2): 156-60. |
| [4] | 庞战军, 周君桂. 葡萄胎病理相关新基因F10重组蛋白的表达及鉴定[J]. 医学研究生学报, 2014(6): 577-81. |
| [5] | 付欣, 周问渠, 邢福祺, 等. F10基因与绿色荧光蛋白融合载体的构建及亚细胞定位[J]. 广州医学院学报, 2005, 33(5): 1-5. |
| [6] | 苏晓华, 庞战军, 苏桂栋. 葡萄胎病理相关新基因F10与绒癌细胞系JEG-3成瘤性的关系[J]. 南方医科大学学报, 2015(5): 707-11. |
| [7] | 周瑾, 梁卫华, 李冰, 等. 葡萄胎发病新基因F10在不同肿瘤组织的表达[J]. 广东医学, 2005, 26(5): 596-7. |
| [8] | 周瑾, 邢福祺, 余良宽, 等. 葡萄胎发病新基因F1O在原发性肝癌中的表达分析[J]. 解放军医学杂志, 2007, 32(6): 601-3. |
| [9] | 付欣, 李熹翀, 周问渠, 等. F10蛋白及mRNA在部分正常组织及癌组织中的表达[J]. 现代生物医学进展, 2014, 14(30): 5859-61,5854. |
| [10] | 宋亚丽, 张弓, 庞战军, 等. F10基因过表达对A549细胞致瘤性的影响[J]. 解放军医学杂志, 2012, 37(7): 676-80. |
| [11] | 崔艳国, 全松, 邢福祺. RNAi下调F10基因表达对KLE细胞凋亡的影响[J]. 南方医科大学学报, 2008, 28(3): 317-9. |
| [12] | 曹晓敏, 庞战军, 全松, 等. 葡萄胎发病相关新基因F10功能的初步研究[J]. 南方医科大学学报, 2008(5): 722-4,728. |
| [13] | 贺红娟, 陈尔飞, 雷蕾. 肿瘤发生与相关基因突变的关联[J]. 基因组学与应用生物学, 2015, 36(1): 208-14. |
| [14] | Lehman M, Thomas G. Is concurrent chemotherapy and radiotherapy the new standard of care for locally advanced cervical cancer[J]. Int J Gynecol Cancer, 2001, 11(2): 87-99. DOI: 10.1046/j.1525-1438.2001.011002087.x. |
| [15] | Kamoi S, Ohaki Y, Amano Y, et al. Pre-treatment mitotic index versus computer-quantitated Ki-67 nuclear antigen labeling index as predictors of response to neoadjuvant chemotherapy in uterine cervical carcinoma[J]. J Nippon Med Sch, 2003, 70(3): 219-26. DOI: 10.1272/jnms.70.219. |
| [16] | 曹晓敏, 庞战军, 全松, 等. F10基因对细胞中PCNA和Cyclin D1表达的影响[J]. 中山大学学报:医学科学版, 2009, 30(1): 6-9,14. |
| [17] | 周开梅, 郭瑞珍. 细胞周期蛋白在恶性肿瘤中的表达[J]. 医学综述, 2010, 16(4): 533-6. |
| [18] | 杨金娣, 庞战军. F10基因沉默及过表达对绒癌细胞系JAR细胞周期的影响[J]. 南方医科大学学报, 2016, 36(3): 351-5. |
| [19] | Gellersen B, Reimann K, Samalecos A, et al. Invasiveness of human endometrial stromal cells is promoted by decidualization and by trophoblast-derived signals[J]. Hum Reprod, 2010, 25(4): 862-73. DOI: 10.1093/humrep/dep468. |
| [20] | Yao H, He G, Chen C, et al. PAI1: a novel PP1-interacting protein that mediates human plasma's anti-apoptotic effect in endothelial cells[J]. J Cell Mol Med, 2017, doi: 10.1111/jcmm.13127.[Epubaheadofprint]. |
| [21] | Kotzsch M, Magdolen V, Greither T, et al. Combined mRNA expression levels of members of the urokinase plasminogen activator(uPA)system correlate with disease-associated survival of soft-tissue sarcoma patients[J]. BMC Cancer, 2011, 11: 273. DOI: 10.1186/1471-2407-11-273. |
| [22] | 苏晓华, 庞战军. F10基因过表达及沉默对绒癌细胞系JAR侵袭相关蛋白酶表达的影响[J]. 医学研究生学报, 2015(4): 350-4. |
| [23] | 曹晓敏, 庞战军, 全松, 等. F10基因对转录因子NF-κB、AP1活性的影响[J]. 中国病理生理杂志, 2008, 24(5): 901-4. |
| [24] | 苏晓华, 庞战军. 葡萄胎病理相关新基因F10与绒癌细胞系JAR成瘤性的关系研究[J]. 解放军医学杂志, 2016, 41(1): 17-21. DOI: 10.11855/j.issn.0577-7402.2016.01.04. |
| [25] | 宋亚丽. F10基因对A549细胞凋亡、化疗敏感性及致瘤性的影响[D]. 南方医科大学, 2010. |
 2017, Vol. 37
2017, Vol. 37

