2. 南方医科大学南方医院 血液科,广东 广州 510515;
3. 南方医科大学珠江医院神经外科,广东 广州 510282
2. Department of Hematology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
3. Department of Neurosurgery, Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China
异基因造血干细胞移植是治疗多种良恶性血液病的有效手段,目前在临床上已得到广泛应用[1],但移植后的并发症降低了患者的生存质量和生存率,其中移植物抗宿主病(GVHD)是移植后患者非复发死亡的主要原因[2],降低了异基因造血干细胞移植的疗效。因此预防和治疗GVHD是提高患者存活率的关键。
间充质干细胞(MSC)是中胚层来源的具有高度自我更新能力及多向分化潜能的成体干细胞,因其低免疫原性、独特的免疫调节作用等特点而被应用于GVHD的防治[1]。目前研究的最为广泛的MSC来源于骨髓,其优势是体外分离培养方法简单、增殖速度较快,但成人骨髓中可提取的MSC数量极少,其增殖分化潜能也随着年龄增大而下降,且hBMSC的采集必须行有创性操作,病毒感染率高,同时使其来源受到限制[3-4]。MSC几乎存在于所有的成人组织器官中,但是其细胞的获取需行侵袭性操作[5]。2004年研究者首次从羊膜中分离出间充质干细胞,人羊膜间充质干细胞(hAMSC)来源于产后废弃的胎盘组织,细胞来源丰富,避免了伦理学限制。胎盘来源的MSC还可表达某些胚胎干细胞表面标记,如ssEA-4、TRA-1-61、TRA-1-80[6],有研究者因此提出与其他成体干细胞相比,胎盘来源的间充质干细胞拥有更强的分化能力及干细胞特性可能[7-8]。本课题组前期研究结果[9]也证实hAMSC、hBMSC二者生物学特性相似,具有相似的免疫表型,但在增殖能力、干细胞特性及多向分化潜能方面,hAMSC似乎比hBMSC具有更大的优势。
现阶段关于hBMSC的研究报道较多也较成熟,临床试验中已经采用hBMSC治疗GVHD,Muroi和von Dalowski等[10-11]研究肯定了hBMSC联合传统免疫抑制剂治疗激素耐受的难治性aGVHD的疗效。随着对MSC研究的不断深入及应用的推广,hBMSC由于来源不足、获取途径有创、体外培养的增殖能力有限等原因的限制是很难满足临床需求的,势必需寻找新的MSC来源替代hBMSC在临床上的应用。
作为MSC家族中的一员hAMSC同样具有免疫调节功能,目前hAMSC已被应用于眼科疾病、烧伤性疾病、自身免疫性疾病、脊髓损伤等疾病领域中并取得了一定的疗效,研究中发现在即使没有应用免疫抑制治疗也没有观察到急性排斥反应[12]。
尽管目前有关于hAMSC、hBMSC的免疫调节作用的研究报道,但目前尚未有对二者的免疫调节作用进行比较的研究报道。本实验的前期研究[9]中免疫抑制方面的比较也只是对抑制淋巴细胞增殖及共培养体系上清中干扰素-γ(IFN-γ)水平方面进行了相对局限的比较研究。
本实验是在前期实验研究的基础上进一步比较hAMSC和hBMSC的免疫调节功能,根据T细胞亚群表面的特异性标志及其分泌细胞因子的特异性,选取CD4+ CD25+ Foxp3+、CD4+ IFN-γ+、CD4 + IL-4+、CD8+ IFN-γ+、CD8+IL-4+分别代表Treg、Th1、Th2、Tc1、Tc2细胞,通过建立两种MSC与PBMC的共培养体系,检测上述细胞亚群及共培养体系中IL-2、IL-10的水平,希望为未来临床应用hAMSC防治GVHD、寻找新的MSC来源、解决目前hBMSC来源不足的问题提供更加充分的实验依据。
1 材料和方法 1.1 标本来源经南方医科大学南方医院伦理委员会批准并知情同意后,获取健康剖宫产产妇志愿捐献的新鲜胎盘羊膜1份。健康成人骨髓标本1份(20 mL)和外周血标本1份(20 mL),均由本院血液科健康志愿者捐献。
1.2 主要试剂α-MEM培养基、RPMI 1640培养基及胎牛血清(FBS)、磷酸盐缓冲液(PBS)(美国Hyclone公司);L-谷氨酰胺、丙酮酸钠、青霉素-链霉素、非必需氨基酸(NEAA)、0.25%胰蛋白酶、Ⅱ型胶原酶、二甲基亚砜(DMSO)、植物血凝集素(PHA)(均是美国Sigma产品);丝裂霉素C(瑞士Roche);人外周血淋巴细胞分离液(天津灏洋生物公司);PerCP-Cy5标记的鼠抗人CD4单抗、APC标记的CD8单抗、FITC标记的鼠抗人IFN-γ单抗、PE标记的鼠抗人IL-4单抗、FITC及PE标记的同型对照Mouse IgG1,Human Regulatory T Cell Staining Kit试剂盒(均购自美国eBioscience);阻断剂Monensin/BFA(250×)、流式染色缓冲液、破膜固定剂FIX&PERM Kit(均购自杭州联科生物公司);IL-2、IL-10ELISA试剂盒(购自武汉Elabscience)。
1.3 方法 1.3.1 hAMSC和hBMSC的分离、体外传代培养无菌条件下从新鲜胎盘组织中分离出羊膜,生理盐水冲洗,剪成大小约1 mm×1 mm的组织块,胰蛋白酶消化30 min,200目细胞筛过滤细胞,重复3次去除羊膜上皮细胞,过滤后的羊膜组织中加入Ⅱ型胶原酶,37 ℃水浴消化30 min,200目细胞筛过滤并收集细胞,PBS洗2遍,加完全培养基培养48 h后换液去除未贴壁细胞,待贴壁细胞连生面积至80%~90%时按1:3比例传代记为P1代,以后每2~ 3 d全量换液1次,贴壁细胞90%左右融合时可传代记为P2代,以此类推。
无菌条件下用PBS稀释骨髓,再加入人淋巴细胞分离液,采用密度梯度离心法分离出单个核细胞,PBS洗2遍,加完全培养基培养48 h后全量换液去除未贴壁细胞,待贴壁细胞80%~90%融合时按1:2比例传代记为P1代,以后每2~3 d全量换液1次,贴壁细胞90%左右融合时可传代记为P2代,以此类推。
1.3.2 外周血淋巴细胞分离无菌条件下用PBS稀释外周血后用人淋巴细胞分离液分离出单个核细胞(PBMC),PBS洗2遍,培养24 h后收集上清的悬浮细胞计数备用。
1.3.3 共培养体系建立取两种来源的P4代MSC用含10%胎牛血清的α-MEM制成1×105/mL的单细胞悬液,分别接种1 mL于24孔板过夜培养,加入10 μg/mL丝裂霉素C去增殖处理3 h后,弃上清液,每孔接种上述PBMC悬液1 mL,加入终浓度为50 μg/mL的PHA,以PBMC+PHA组为阳性对照组,以PBMC组、hAMSC组、hBMSC组为阴性对照组,每组设3个复孔。共培养72 h后分离各培养组上清液并于-20 ℃冻存备用,收集各培养组的细胞采用流式细胞术检测Treg、Th1、Th2、Tc1、Tc2细胞亚群的变化。
1.3.4 流式细胞术检测Treg细胞亚群变化实验前参照Human Regulatory T Cell Staining Kit试剂盒说明书提前配制新鲜的Fixation/Permeabilization、1 × Permeabilization Buffer工作液、2%正常大鼠血清。各流式管底中先加入20 μL CD4/CD25预混抗体,各管分别加入hAMSC+PBMC+PHA组、hBMSC+PBMC+ PHA组及PBMC+PHA组细胞悬液100 μL,混匀,4 ℃避光孵育30 min,预冷的流式缓冲液洗1次。各管加入新鲜的Fixation/Permeabilization 1 mL,避光孵育60 min。各管加入2 mL 1×Permeabilization Buffer工作液,离心去上清后加入稀释好的2%正常大鼠血清100 μL封闭,室温避光孵育15 min。各管加入5 μL Foxp3,对照管加入同型对照小鼠IgG 5 μL,避光孵育30 min。各管加入2 mL 1×Permeabilization Buffer工作液,离心去上清后加入300 μL流式缓冲液立即上机检测。
1.3.5 流式细胞术检测Th1、Th2、Tc1、Tc2细胞亚群变化分别取hAMSC+PBMC+PHA组、hBMSC+PBMC+ PHA组及PBMC+PHA组的细胞悬液500 μL至24孔板中,加入250×Monensin/BFA 2 μL,混匀后置于37 ℃、5% CO2培养箱中培养4 h后收集细胞制成细胞悬液。各流式管底先加入CD4、CD8单抗各5 μL,然后每管分别加入上述细胞悬液,4 ℃避光孵育30 min。每管加入FIX&PERM MEDIUM A 100 μL固定,室温孵育15 min,流式缓冲液洗1次。每管加入FIX&PERM MEDIUM B 100 μL及IL-4、IFN-γ抗体各5 μL,对照管加入小鼠同型单抗IgG,室温孵育30 min。流式缓冲液洗1次,加入500 μL流式缓冲液后上机检测。
1.3.6 ELISA测定共培养上清中IL-2、IL-4、IL-10水平分别取hAMSC + PBMC + PHA及hBMSC + PBMC + PHA共培养组、阳性对照组及阴性对照组上清液,按ELISA试剂盒步骤处理,酶标仪测450 nm处A值。
1.4 统计学分析本实验数据采用SPSS 19.0软件进行分析,两独立样本比较采用独立样本t检验,不同组间采用单因素方差分析,计量资料均数±标准差表示,P < 0.05表示差异有统计学意义。
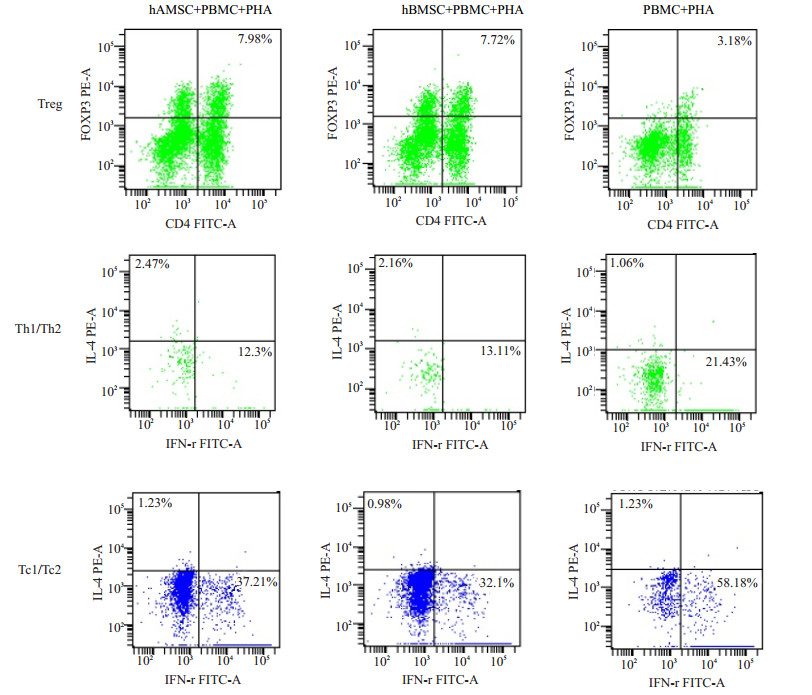
2 结果 2.1 流式细胞术检测T细胞亚群变化两种来源的MSC对外周血T淋巴细胞亚群影响的结果见表 1。与PBMC+PHA组相比,两共培养组均能促进PHA刺激的PBMC中Treg、Th2、Tc2细胞亚群比例上升(P < 0.05),减少Th1、Tc1细胞亚群比例,hAMSC与hBMSC对T淋巴细胞亚群影响的差异无统计学意义(P > 0.05,图 1)。
| 表 1 hAMSC与hBMSC对外周血T淋巴细胞亚群的影响 Table 1 Effects of hAMSCs and hBMSCs on peripheral blood T lymphocyte subsets in the co-culture systems (Mean±SD, %, n=6) |
|
图 1 hAMSC与hBMSC对外周血T淋巴细胞亚群影响的流式分析图 Figure 1 Phenotypic analysis of the effect of hAMSCs and hBMSCs on T lymphocyte subsets by flow cytometry. |
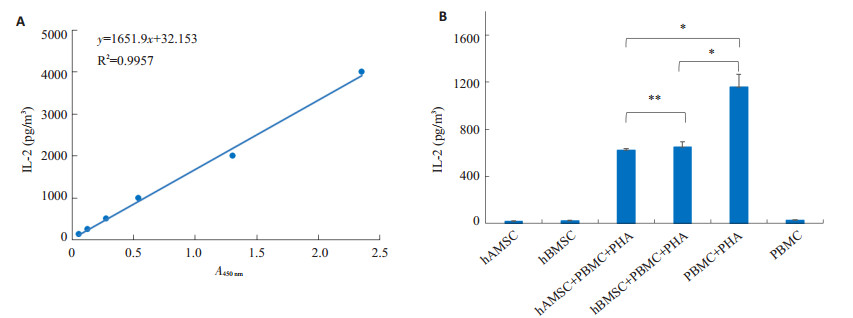
hAMSC + PBMC + PHA组上清中IL-2含量较hBMSC+PBMC+PHA组稍低(P=0.564),二者分别与PBMC+PHA组比较,IL-2含量明显降低(P < 0.05,图 2)。
|
图 2 ELISA法检测IL-2的标准曲线(A)和不同培养组上清液IL-2的水平(B) Figure 2 Standard curve (A) and supernatant level of IL-2 in each group (B) measured by ELISA. *P < 0.05, **P > 0.05. |
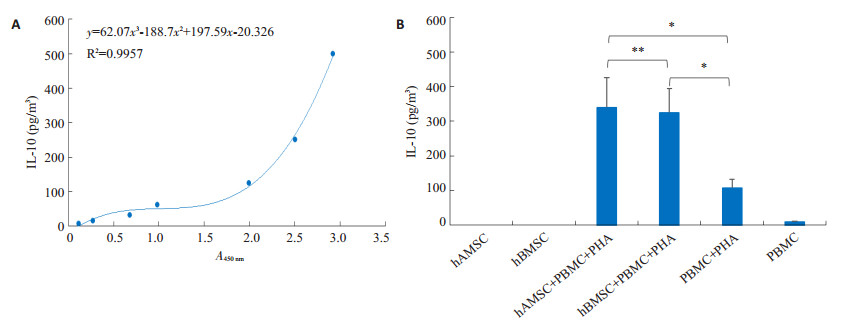
hAMSC + PBMC + PHA组上清中IL-10含量较hBMSC + PBMC + PHA组稍高(P=0.773),两者与PBMC+PHA组比较,IL-10含量明显升高(P < 0.05,图 3)。
|
图 3 ELISA法检测IL-10的标准曲线(A)和不同培养组上清液IL-10的水平(B) Figure 3 Standard curve (A) and supernatant level of IL-10 in each group (B) measured by ELISA. *P < 0.05, **P > 0.05. |
近年来,多项研究结果均表明MSC在体内外具有较强的免疫调节功能[13-14],尤其是作用于T淋巴细胞,MSC和HSCT共移植可减少急性移植物抗宿主病(aGVHD)的发生[15-16],但其具体机制和途径还不是很清楚,有研究认为MSC可通过与免疫细胞的直接接触或分泌多种可溶性细胞因子如吲哚胺-2,3-双加氧酶(IDO)等介导免疫调节效应[17-18]。
T细胞因微环境不同分化为功能不同的细胞亚群:CD4+CD25+Foxp3+(Treg)、CD4+IFN-γ+(Th1)、CD4+ IL-4+(Th2)、CD8+IFN-γ+(Tc1)、CD8+IL-4+(Tc2)。Tc1细胞分泌Th1类细胞因子,与Th1细胞协同诱导aGVHD的发生,Tc2细胞分泌Th2类细胞因子,协同Th2细胞抑制由Th1/Tc1介导的GHVD的发生或减轻其严重程度[19]。故在异基因造血干细胞移植后维持Th1/Th2、Tc1/Tc2细胞之间的平衡对防治GVHD至关重要。当然Treg细胞在GVHD防治方面的作用也不可忽视,其在免疫抑制过程中起着决定性作用,能抑制CD4+、CD8+T细胞的增殖活化,引起供者T淋巴细胞对受着自身抗原的耐受从而减弱aGVHD的发生风险[20]。
hAMSC和hBMSC均是间充质干细胞家族的成员,本实验的前期研究中[9]已经证实二者具有相似的生物学特性,均能抑制PHA刺激的淋巴细胞增殖,并能下调IFN-γ的水平。本实验是在前期研究的基础上进一步比较二者的免疫调节功能,通过建立MSC与PHA刺激的PBMC共培养的体系,采用流式免疫细胞术检测T细胞亚群的变化。结果显示加入MSC后的实验组中Treg、Th2、Tc2亚群的比例均不同程度的上升(P均 < 0.05),而Th1、Tc1细胞亚群比例则明显下降(P < 0.05)。研究报道MSC可促使共培养体系中Th1细胞比例下降,Th2、Treg细胞比例上升[13]。研究同样也证实了MSC通过HLA-G5和其他分子诱导Th2、Treg细胞生成[21]。已经证实hAMSC与T淋巴细胞共培养后能上调Treg、Th2、Tc2细胞比例,下调Th1、Th2细胞比例[22-23]。宣晏[24]的研究是针对hBMSC进行的,结果显示hBMSC对外周血T细胞亚群的影响同hAMSC对T细胞亚群的影响一致。但是关于hAMSC、hBMSC的免疫调节作用的强弱尚未有报道,Kia等[21]的研究也只是对骨髓、羊水、胎盘来源的MSC的免疫抑制作用进行比较,并不包括羊膜间充质干细胞。本实验采用相同的体外培养条件对二者的免疫调节作用进行比较研究,实验结果表明二者对T细胞亚群的影响同既往报道相似,表明MSC通过增加Treg、Th2、Tc2而减少Th1、Tc1细胞数量抑制或限制炎症反应并促进抗炎通路的的开发。但是本实验结果更重要的结果是两种来源的MSC对T淋巴细胞亚群变化影响的差异无统计学意义,由此我们可以推测二者对T淋巴细胞具有相似的免疫调节能力。
为进一步观察共培养体系中hAMSC、hBMSC对活化的T细胞功能的影响,本实验还采用ELISA法检测了在两组共培养组中T细胞对细胞因子IL-2、IL-10分泌情况。结果显示:PHA+PBMC组(即活化的T淋巴细胞组)的IL-2水平高于单独的PBMC组(即未活化的T淋巴细胞组)(P < 0.05),前者分别加入hAMSC、hAMSC后,IL-2的水平较加入MSC前明显下调(P均 < 0.05);PHA+PBMC组(即活化的T淋巴细胞组)的IL-10水平高于单独的PBMC组(即未活化的T淋巴细胞组)(P < 0.05),前者分别加入hAMSC、hAMSC后,IL-10的水平较加入MSC前明显上调(P均 < 0.05),说明异体T淋巴细胞经PHA刺激后活化,IL-2、IL-10细胞因子水平均可上调,但是在加入MSC后,抑制共培养体系中分泌IL-2细胞因子的细胞亚群导致IL-2的水平下降,而促进分泌IL-10细胞因子的细胞亚群导致IL-10的水平上升。已经有研究发现MSC具有抑制Th1细胞分泌IL-2细胞因子,增加Th2细胞分泌IL-10的能力[25],MSC与活化的T细胞接触后可促进IL-10的分泌[21]。该部分实验结果检测IL-2、IL-10水平得到与既往研究报道一致的结论。从此部分实验结果还可以得出一个重要结论:两种来源的MSC下调IL-2的水平及上调IL-10水平的差异无统计学意义,更进一步推测hAMSC和hBMSC的免疫调节能力相当。
综上所述,本研究结果为MSC联合异基因造血干细胞移植治疗血液病患者后预防和治疗GVHD提供了实验依据,同时本研究结果还表明了hAMSC和hBMSC具有相似的免疫调节功能,可能为GVHD的预防和治疗提供一种新的种子细胞,但其防治效果及具体免疫调节机制还需大量的体内外实验进一步证实。
| [1] | Kim N, Im KI, Jy L, et al. Mesenchymal stem cells for the treatment and preventionof graft-versus-host disease:experiments and practice[J]. Ann Hematol, 2013, 92(10): 1295-308. DOI: 10.1007/s00277-013-1796-z. |
| [2] | Sung AD, Chao NJ. Concise review: acute graft-versus-hostdisease: immunobiology, prevention, and treatment[J]. Stem Cells Transl Med, 2013, 2(1): 25-32. DOI: 10.5966/sctm.2012-0115. |
| [3] | Chou SH, Lin SZ, Day CH, et al. Mesenchymal stem cell insights: prospects in hematological transplantation[J]. Cell Transplant, 2013, 22(4, SI): 711-21. DOI: 10.3727/096368912X655172. |
| [4] | Choumerianou DM, Martimianaki G, Stiakaki E, et al. Comparative study of stemness characteristics of mesenchymal cells from bone marrow of children and adults[J]. Cytotherapy, 2010, 12(7): 881-7. DOI: 10.3109/14653249.2010.501790. |
| [5] | da Silva ML, Chagastelles PC, Nardi NB. Mesenchymal stem cells reside in virtually allpost-natal organs and tissue[J]. J Cell Sci, 2006, 119(Pt11): 2204-13. |
| [6] | 裴雪涛. 成体干细胞分化的可塑性及其在组织工程中的应用[J]. 中国修复重建外科杂志, 2004, 18(2): 81. |
| [7] | Sabapathy V, Ravi S, Srivastava V, et al. Long-Term cultured human term Placenta-Derived mesenchymal stem cells of maternal origin displays plasticity[J]. Stem Cells Int, 2012, 25(8): 174328. |
| [8] | Nazarov I, Lee JW, Soupene E, et al. Multipotent stromal stem cells from human placenta demonstrate high therapeutic potential[J]. Stem Cells Transl Med, 2012, 1(5): 359-72. DOI: 10.5966/sctm.2011-0021. |
| [9] | 洪佳琼, 高雅, 宋洁, 等. 人羊膜间充质干细胞与骨髓间充质干细胞的生物学特性及免疫抑制作用的比较[J]. 中国实验血液学杂志, 2016, 24(3): 858-64. |
| [10] | Muroi K, Miyamura K, Okada M, et al. Bone marrow-derived mesenchymal stem cells (JR-031) for steroid-refractory grade Ⅲ or Ⅳ acute graft-versus-host disease: a phase Ⅱ/Ⅲ study[J]. Int J Hematol, 2016, 103(2): 243-50. DOI: 10.1007/s12185-015-1915-9. |
| [11] | Dalowskif V, KramerM, WermkeM, et al. Mesenchymalstromal cells for treatment of acute steroid-refractory graft versus host disease:clinical responses and long-term outcome[J]. Stem Cells, 2016, 34(2): 357-66. DOI: 10.1002/stem.2224. |
| [12] | Insausti CL, Miguel B, Garcia-Hemandet AM, et al. Amniotic membrane-derived stem cells:immunomodulatory properties and potential clinical application[J]. Stem Cells Cloning, 2014, 7(6): 53-63. |
| [13] | Castro-Manrreza ME, Montesinos JJ. Immunoregulation by mesenchymal stem cells: biological aspects and clinical applications[J]. J Immun Res, 2015, 37(4): 394917. |
| [14] | Ma S, Xie N, Li W, et al. Immunobilogy of mesenchymal stemcells[J]. Cell Death Differ, 2014, 21(2): 215-6. |
| [15] | Fleitz J, Rumelhart S, Goldman F, et al. Successful allogeneic hematopoietic stem cell transplantion(HSCT)for shwachmandiamond syndrome[J]. Bone Marrow Transplant, 2002, 29(1): 75-9. DOI: 10.1038/sj.bmt.1703321. |
| [16] | Le Blanc K, Rasmusson I, Sundberg B, et al. Treatment of severe acute graft-versus-hostdiease with the third haploienntical mesenchymal stem cells[J]. Lanct, 2004, 363(9419): 1439-41. DOI: 10.1016/S0140-6736(04)16104-7. |
| [17] | Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses[J]. Blood, 2005, 105(4): 1815-22. DOI: 10.1182/blood-2004-04-1559. |
| [18] | 王佳萍. 欧阳桂芳HLA-G参与羊膜间充质干细胞抑制淋巴细胞增殖的机制研究[J]. 中国实验血液学杂志, 2014, 22(1): 187-91. |
| [19] | Flowler H. Share biology of GVHD and GVT effects:potential methods of separation[J]. Crit Rev Onclo Hematol, 2006, 57(3): 225-44. DOI: 10.1016/j.critrevonc.2005.07.001. |
| [20] | Safinia N, Scotta C, Vaikunthanathan TA, et al. Regulatory T cells: serious contenders in the promise for immunological tolerance in transplantation[J]. Front Immunol, 2015, 6(3): 438. |
| [21] | Marechi K, Castiglia S, FiorellaSanavio, et al. Immunoregulatory effects on T lymphocytes by human mesenchymal stromal cells isolated from bone marrow, amniotic fluid, and placenta[J]. Exp Hematol, 2016, 4(22): 138-50. |
| [22] | Pianta S, Magatti M, Vertua E, et al. Amniotic mesenchymal cells from pre-eclamptic placentae maintain immunomodulatory features as healthy controls[J]. J Cell Mol Med, 2016, 20(1): 157-69. DOI: 10.1111/jcmm.12715. |
| [23] | 刘圣. 人羊膜间充质干细胞对外周血T淋巴细胞的免疫调节作用及机制[D]. 贵州: 遵义医学院, 2013. |
| [24] | 宣晏, 谢小宝, 邱国强, 等. 骨髓间充质干细胞对外周血T淋巴细胞亚群影响的体外实验研究[J]. 临床血液学杂志, 2007, 20(2): 109-12. |
| [25] | Aggrewal S, Pittenger MF. Human mesenchymal stromal cells modulate allogeneic immune cell responses[J]. Blood, 2005, 105(4): 1815-22. DOI: 10.1182/blood-2004-04-1559. |
 2017, Vol. 37
2017, Vol. 37

