2. 南方医科大学,广东 广州 510515
2. Southern Medical University, Guangzhou 510515, China
胎儿生长受限(FGR)是产科常见并发症[1],致病因素包括母体因素、胎儿因素及胎儿附属物因素。胎盘作为母胎之间氧和营养物质交换的纽带,其正常结构和功能对胎儿发育至关重要[2-3]。但目前FGR的发病机制尚未完全阐明[4],孕期营养不良是FGR的确切诱因[5],营养不良时,胎儿接受的营养物质减少可能是FGR发生的一个原因,但营养不良是否影响胎盘功能,目前尚不清楚。我们的前期研究发现,孕期蛋白限制诱导的FGR大鼠模型中,胎盘部位滋养细胞IGF-1表达下降。IGF-1是调节机体生理活动的重要因子,可促进滋养细胞增殖、分化及迁移等[6]。由此推测,营养限制时IGF-1表达异常可能影响滋养细胞的正常增殖、侵袭进而影响胎盘发育。为验证这一推断,本研究利用不同浓度的胎牛血清(FBS)处理人滋养细胞株HTR-8/SVneo细胞,通过检测滋养细胞IGF-1、MMP-2表达变化以及该变化与滋养细胞增殖和侵袭能力变化的相关性,初步探讨蛋白限制对人滋养细胞侵袭和增殖能力的影响,为FGR发病机制研究提供参考。
1 材料和方法 1.1 实验材料 1.1.1 细胞株ATCC来源的人滋养细胞株HTR-8/ SVneo细胞(ATCC® CRL-3271TM)购于上海酶研生物科技有限公司。
1.1.2 主要试剂RNA分离试剂Trizol、逆转录及荧光定量PCR试剂盒(SYBR PrimeScriptTM RT-PCR Kit)购自TAKARA;1640培养基(Gibco);胎牛血清(全式金生物公司);重组人胰岛素样生长因子1(rhIGF-1)(PeproTech);IGF-1多克隆抗体及MMP-2单克隆抗体购自SantaCruz公司;山羊抗兔/小鼠荧光IgG、抗体稀释液及含DAPI抗淬灭封片剂购自北京中杉金桥生物公司;Transwell小室及Matrigel基质胶购自BD公司(美国)。
1.1.3 荧光定量PCR的引物通过PCR引物设计软件Primer Premier 5.0设计人IGF-1、MMP-2、GAPDH引物序列,由上海Invitrogen合成。
IGF-1:F:5'-GCTCTTCAGTTCGTGTGTGGA-3';R:5'-GCCTCCTTAGATCACAGCTCC-3';MMP-2:F:5'-TACAGGATCATTGGCTACACACC-3';R:5'-GGT CACATCGCTCCAGACT-3';GAPDH:F:5'-GGCTCA TGACCACAGTCCATG-3';R:5'-TCAGCTCTGGGA TGACCTTG-3'。
1.2 实验方法 1.2.1 细胞培养及实验分组人滋养细胞株HTR-8/ SVneo细胞培养于含5% FBS的1640培养基中,于37 ℃、5% CO2中培养,常规换液、传代,待细胞融合约70%~80%时用不添加FBS的1640培养基饥饿8 h进行同步化处理。实验分组:低浓度FBS组(1% FBS)、对照组(5% FBS)、高浓度FBS组(10% FBS),各组细胞处理48 h后比较各组HTR-8/SVneo细胞IGF-1、MMP-2表达水平及细胞侵袭力的差异;进一步给予rhIGF-1处理HTR-8/SVneo细胞后,比较细胞增殖及侵袭力的改变。
1.2.2 细胞IGF-1、MMP-2mRNA表达水平检测采用荧光定量PCR根据实验分组分别接种HTR-8/SVneo细胞于六孔板内并给予相应处理48 h后收集细胞,加入1 mL Trizol于冰上静置15 min充分裂解细胞,进一步通过氯仿、异丙醇及离心等分离纯化步骤,提取细胞总RNA,根据宝生物公司逆转录及荧光定量PCR试剂盒产品说明书的操作步骤,去除基因组DNA后逆转录形成cDNA,采用SYBR Green法进行荧光定量PCR,最后以人GAPDH基因作为内参,通过内参校准计算IGF-1、MMP-2 mRNA的2-△△Ct值来比较各组目的基因相对表达水平。
1.2.3 细胞IGF-1、MMP-2蛋白表达检测采用细胞免疫荧光HTR-8/SVneo细胞接种于6孔板内(底部放置爬片),待细胞贴壁后分别予1%、5%、10% FBS处理48 h后弃去培养基,PBS清洗2次,每次5 min,4%多聚甲醛固定15 min;PBS清洗2次,每次5 min;滴加100 μL山羊血清封闭15 min,0.1% Triton破膜5 min;加入60 μL IGF-1或MMP-2一抗工作液:(1:75稀释),4 ℃孵育过夜;滴加60 μL荧光二抗(1:100稀释),室温下闭光孵育30 min后;最后用含DAPI的抗荧光淬灭封片剂封片,正置荧光显微镜下(同一拍摄条件)拍照,比较各组细胞IGF-1、MMP-2蛋白荧光水平。
1.2.4 细胞增殖能力检测采用噻唑蓝比色法(MTT)HTR-8/SVneo细胞饥饿处理8 h后常规消化离心计数,根据实验目的加入分别加入不同浓度FBS或rhIGF-1,调整细胞密度至2×104/mL,取100 μL细胞悬液加入到96孔板内培养,分别在24、48 h及72 h后检测细胞增殖情况。检测前每孔加入5 mg/mL的MTT溶液20 μL,避光孵育4 h;弃上清,加入150 μL DMSO溶液,室温下轻摇10 min溶解结晶,最后在酶标仪上测定各孔在570 nm波长的吸光度,通过吸光度水平反应细胞增殖能力并绘制生长曲线。每组细胞设置5个复孔,去掉最大值和最小值后取平均值用于统计分析。
1.2.5 HTR-8/SVneo细胞侵袭能力检测采用Transwell小室侵袭实验取5 μL Matrigel基质胶溶于40 μL 1640培养基后加入到Transwell小室中,在37 ℃孵箱中静置4 h,待Matrigel基质胶凝结后吸除小室内的多余的液体用于实验。分别取1%、5%、10% FBS及rhIGF-1处理后的HTR-8/SVneo细胞,常规消化离心,用无血清培养基调整细胞浓度至2.5×105/mL,每个小室分别加入200 μL细胞悬液,下室加入500 μL含5% FBS的完全培养基,培养24 h后取出小室,用棉签拭去小室上层基质胶及细胞,PBS漂洗后用4%多聚甲醛固定30 min,0.1%结晶紫染色15 min。最后在正置显微镜下(200×)随机选择5个视野拍照并计数细胞数,通过计算各组侵袭细胞数目反映各组细胞侵袭能力。
1.2.6 统计学分析处理采用SPSS 20.0软件对数据进行统计学分析,实验数据以均数±标准差表示,以上细胞实验均为3次独立重复实验的结果。实验数据分析采用单因素方差分析。组间两两比较:方差齐者采用LSD分析,方差不齐者采用Dunnett's T3法。P < 0.05认为差异具有统计学意义。
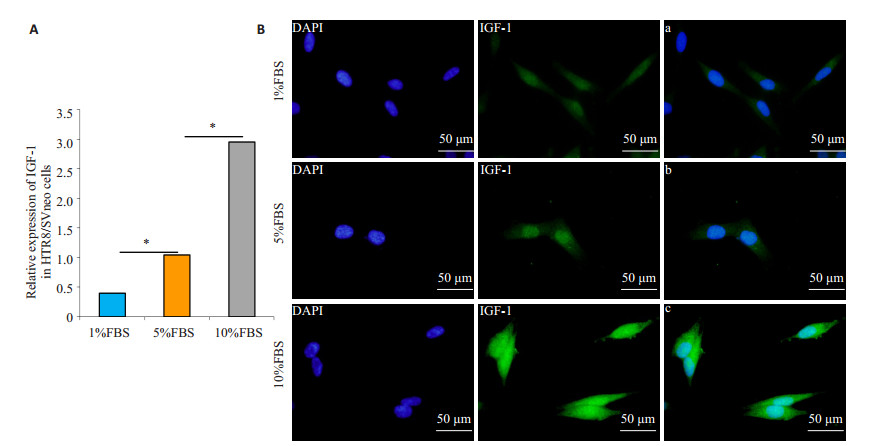
2 结果 2.1 FBS限制处理HTR-8/SVneo细胞后细胞IGF-1的表达下调荧光定量PCR结果显示,随着FBS浓度降低,HTR-8/SVneo细胞IGF-1 mRNA表达水平下降,且存在剂量效应,1% FBS组IGF-1mRNA表达显著低于5% FBS组和10% FBS组。和对照组(5% FBS)相比,高浓度FBS组(10% FBS)HTR-8/SVneo细胞IGF-1 mRNA水平上调(P < 0.05),而低浓度FBS组(1% FBS)HTR-8/ SVneo细胞IGF-1 mRNA水平下调(P < 0.05,图 1A);同时,细胞免疫荧光显示,低浓度FBS(1% FBS)处理48h后,HTR-8/SVneo细胞胞浆内IGF-1蛋白荧光较对照组(5% FBS)及高浓度FBS组(10% FBS)减弱(图 1B)。
|
图 1 FBS限制对人滋养细胞株HTR-8/SVneo细胞IGF-1的表达的影响 Figure 1 Effect of FBS restriction on IGF-1 expression in HTR-8/SVneo cells. A: IGF-1 mRNA expression in HTR-8/SVneo cell detected by fluorescent quantitative PCR; B: Immunofluorescence staining showing decreased cytoplasmic IGF-1 expression as FBS content in the culture medium decreased from 10% to 5% and 1%. *P < 0.05. |
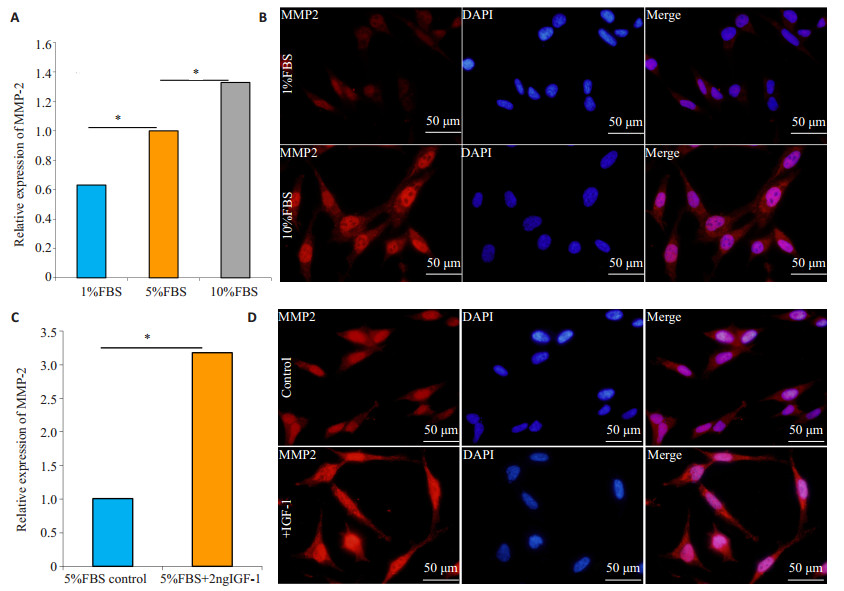
荧光定量PCR结果显示,随着FBS浓度下降,HTR-8/SVneo细胞MMP-2 mRNA水平下调,低浓度FBS组(1% FBS)MMP-2 mRNA表达水平显著低于5% FBS组和10% FBS组(P < 0.05,图 2A),细胞免疫荧光显示1% FBS组HTR-8/SVneo细胞MMP-2蛋白荧光减弱((图 2B))。进一步添加2 ng/mL的rhIGF-1处理HTR-8/SVneo细胞后进行荧光定量PCR及细胞免疫荧光染色发现,rhIGF-1处理HTR-8/SVneo细胞后其MMP-2表达水平较空白处理组显著升高(P < 0.05,图 2C~D)。
|
图 2 FBS限制及rhIGF-1对HTR-8/SVneo细胞MMP-2表达的影响 Figure 2 Effect of FBS restriction and rhIGF-1 on MMP-2 expression in HTR-8/SVneo cells. A: MMP2 mRNA expression in HTR-8/ SVneo cells cultured in the presence of 1%, 5% and 10% FBS detected by fluorescent quantitative PCR; B, D: Immunofluorescence staining of cytoplasm MMP-2 expression in HTR-8/SVneo cells with different treatments; C: mRNA expression of MMP-2 in HTR-8/ SVneo cells cultured in 5% FBS with or without 2 ng/mL rhIGF-1 detected by fluorescent quantitative PCR. *P < 0.05. |
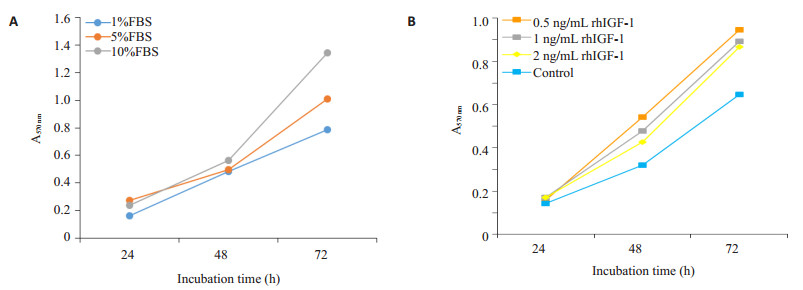
根据MTT比色实验结果描绘细胞增殖曲线,结果显示(图 3),相同时间内,随着FBS浓度下降,细胞增殖能力降低(P < 0.05)。进一步给予不同浓度rhIGF-1处理HTR-8/SVneo细胞后结果显示,和空白处理相比,0.5、1、2 ng/mL rhIGF-1,均能促进细胞增殖。
|
图 3 不同浓度FBS(A)及rhIGF-1(B)处理人滋养细胞株HTR-8/SVneo后的细胞生长曲线 Figure 3 Growth curves of HTR-8/SVneo cells cultured in the presence of different concentrations of FBS (A) and rhIGF-1 (B). |
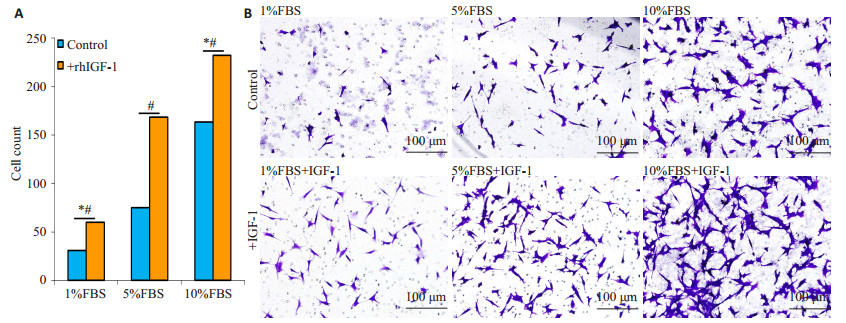
Transwell小室侵袭实验结果显示,随着FBS浓度下降,24 h侵袭细胞数目减少,各组间比较差异具有统计学意义(P < 0.05);补充2 ng/mL rhIGF-1能明显增加各组HTR-8/SVneo细胞24 h侵袭细胞数(P < 0.05),提示rhIGF-1促进HTR-8/SVneo细胞侵袭(图 4)。
|
图 4 Transwell小室侵袭实验检测细胞侵袭力 Figure 4 Cell invasion ability detected by Transwell invasion assay. A: Invasive cell numbers of HTR-8/SVneo cells treated with 1%, 5% or 10% FBS. *P < 0.05 vs the 5% FBS group; #P < 0.05 vs the control group without rhIGF-1 treatment; B: Invasive cells stained with crystal violet (Original magnification: ×200). |
FGR是多种不良因素所致胎儿宫内发育潜能不足、新生儿出生体质量低下的产科并发症,可致胎儿窘迫、新生儿窒息、围产儿死亡,也是围产儿死亡的主要因素之一[7],该类新生儿成年后罹患多种慢性代谢性疾病风险也增高,如高血压、心血管疾病、卒中等[8-9]。目前FGR全球发病率在5%~10%[2],其发病涉及母体、胎盘及胎儿等多种因素,其中胎盘因素是FGR发病的主要原因[10-11];母体因素如子痫前期、自身免疫性疾病、贫血、消化道疾病、营养不良等也可导致FGR发生[1],但具体发病机制未明,可能通过影响胎盘正常结构与功能介导胎儿生长受限。营养不良是导致胎儿发育受限的原因之一,一方面与胎儿生长所需营养物质缺乏直接相关;究对营养不良与胎盘发育、胎盘功能进行了相关探索。
本课题组前期通过孕期营养限制成功构建FGR大鼠模型,并证实FGR大鼠胎盘滋养细胞部位IGF-1表达下调。IGF-1是胰岛素样生长因子家族成员之一,通过自分泌和旁分泌广泛参与全身多个系统组织细胞增殖、分化、迁移及侵袭[13],同时IGF-1也是围孕期重要的生长发育调节激素,参与胎盘及胎儿生长发育的调节[14]。Akram等[15]在分析人类胎盘时候发现,FGR胎盘中IGF-1mRNA表达显著降低,并与新生儿体质量等参数呈正相关;Keswani等[16]在动物实验中证实过表达胎盘IGF-1可以增加胎盘交换区域面积,改善胎盘物质转运,纠正子宫动脉结扎诱导的FGR胎兔体重。因此,胎盘IGF-1可能直接或间接参与了胎儿生长发育调节,而胎盘部位IGF-1表达降低可能与FGR胎盘功能及子代出生体重下降有关。Jeong等[17]对孕早期猪的滋养外胚层细胞研究发现,IGF-1与其受体IGF-1R结合后通过活化MAPK、PI3K/Akt等信号通路参与调节滋养外胚层细胞增殖、分化、凋亡及代谢等,认为IGF-1可能通过影响胎盘滋养细胞功能干扰正常胎盘结构发育和功能形成。同时,Winder等[5]也证实了孕妇营养状况与胎盘大小、功能及胎儿出生体质量成正相关,母体低营养状态可能限制了正常的“母体-胎盘-胎儿”间营养物质转换,导致胎儿生长受限。由此我们推测,在营养限制所致FGR大鼠模型中其胎盘部位IGF-1表达下调,可能通过影响影响滋养细胞侵袭功能介导胎盘发育不足。
在早期胎盘形成过程中,滋养细胞侵入子宫蜕膜及肌层、破坏螺旋动脉血管壁并逐渐替代血管内皮细胞,完成子宫螺旋动脉重铸,保障母胎间血流灌注[18];各种致病因子干扰滋养细胞正常增殖及侵袭,介导孕早期滋养浅浸润及螺旋动脉重铸不足,导致子宫胎盘血管阻力增加,引起胎盘低灌注,可直接影响胎儿正常生长发育[6]。在早期胎盘形成滋养细胞侵袭过程中,涉及全身多因子参与调节,其中基质金属蛋白酶是滋养细胞侵袭子宫蜕膜及肌层的关键酶类之一,可以通过降解细胞外基质、破坏基底膜、促进血管表面生长因子生成等参与滋养细胞侵袭及血管重铸,对胎盘结构与功能形成具有重要影响[19-20]。其中MMP-2为基质金属蛋白酶家族重要成员之一,在早孕期胎盘滋养细胞中广泛表达,与滋养细胞侵袭密切相关[21]。异位妊娠中输卵管植入部位MMP2表达升高,活性增加[22],MMP2大量表达或激活导致滋养细胞侵袭过度可引起葡萄胎、绒毛膜癌、胎盘植入等病理妊娠事件[23-24];相反,MMP-2表达下调可导致滋养细胞侵袭障碍及胎盘“浅着床”,引起胎盘功能不足[21],如有学者在体外实验证实早孕滋养细胞侵袭力受MMP2调控,MMPs抑制剂和MMP2抗体可以通过阻断MMP2生物活性和功能抑制体外培养的滋养细胞侵袭力[25]。MMPs的表达与功能受体内多种因素调控,既往有研究证实,IGF-1可以通过调节侵袭相关酶类表达水平来调节细胞侵袭能力。Walsh等[26]证实IGF-1可以激活乳腺癌细胞株MMPs的活性,并促进乳腺癌的侵袭转移;也有学者在缺血性增生性视网膜病变的研究中发现,IGF-1可以上调视网膜Muller干细胞的MMPs表达水平,促进其侵袭力[27]。因此,在营养限制所致FGR中,胎盘部位IGF-1低表达可能影响了滋养细胞MMP-2表达水平、干扰滋养细胞正常侵袭功能。
为证实研究设想,我们首先通过给予低浓度FBS处理HTR-SVneo细胞模拟整体实验的营养限制条件,观察FBS限制对HTR-SVneo细胞的侵袭、增殖能力的另一方面,营养不良可能通过影响正常胎盘结构及功能,并最终导致母体间物质运障碍,引起FGR[11-12]。本研影响,并检测细胞IGF-1、MMP-2的变化。结果证实,FBS限制抑制HTR-SVneo细胞IGF-1表达,同时低浓度FBS组滋养细胞侵袭力明显下降,细胞MMP2表达水平下降。FBS限制下调滋养细胞IGF-1表达可能导致细胞侵袭力下降的原因之一。进一步,我们通过补充rhIGF-1进行反证。结果显示,rhIGF-1处理HTRSVneo细胞后,细胞MMP -2表达水平上调,并促进HTR-SVneo细胞增殖及侵袭能力。由此我们认为,FBS限制处理人滋养细胞后导致其IGF-1表达下调,可能抑制了HTR-SVneo细胞MMP-2表达,导致了细胞侵袭能力下降,胎盘发育不足。可能是孕期营养限制所致胎儿生长受限的原因之一。
FGR的致病因素多样,发病机制尚未阐明。本研究初步证实了IGF-1通过调节MMP-2表达水平影响滋养细胞正常增殖和侵袭功能,可能是营养限制所致FGR的发病机制之一,但IGF-1在滋养细胞侵袭过程中的相关信号通路调节机制等,有待进一步探索研究。
| [1] | American College of Obstetricians and Gynecologists. ACOG Practice bulletin no. 134: fetal growth restriction[J]. Obstet Gynecol, 2013, 121(5): 1122-33. DOI: 10.1097/01.AOG.0000429658.85846.f9. |
| [2] | Machado Nardozza LM, Rabachini Caetano AC, Perez Zamarian AC, et al. Fetal growth restriction: current knowledge[J]. Arch Gynecol Obstet, 2017, 295(5): 1061-77. DOI: 10.1007/s00404-017-4341-9. |
| [3] | Guttmacher AE, Spong CY. The human placenta project: it's time for real time[J]. Am J Obstet Gynecol, 2015, 213(4, S): S3-5. DOI: 10.1016/j.ajog.2015.08.037. |
| [4] | Devaskar SU, Chu A. Intrauterine growth restriction: hungry for an answer[J]. Physiology, 2016, 31(2): 131-46. DOI: 10.1152/physiol.00033.2015. |
| [5] | Winder NR, Krishnaveni GV, Veena SR, et al. Mother's lifetime nutrition and the size, shape and efficiency of the placenta[J]. J Dev Orig Health Dis, 2011, 2(1): S1-40. |
| [6] | Lyall F, Robson SC, Bulmer JN. Spiral artery remodeling and trophoblast invasion in preeclampsia and fetal growth restriction: relationship to clinical outcome[J]. Hypertension, 2013, 62(6): 1046-54. DOI: 10.1161/HYPERTENSIONAHA.113.01892. |
| [7] | 罗晓芳, 漆洪波. 胎儿生长受限的胎盘因素及其临床诊治[J]. 中国实用妇科与产科杂志, 2016, 32(4): 298-302. |
| [8] | Mierzynski R, Dluski D, Darmochwal-Kolarz D, et al. Intra-uterine Growth Retardation as a Risk Factor of Postnatal Metabolic Disorders[J]. Curr Pharm Biotechnol, 2016, 17(7): 587-96. DOI: 10.2174/1389201017666160301104323. |
| [9] | Rasyid H, Bakri S. Intra-uterine Growth Retardation and Development of Hypertension[J]. Acta Med Indones, 2016, 48(4): 320-4. |
| [10] | Andraweera PH, Bobek G, Bowen C, et al. IFPA meeting 2015 workshop report Ⅱ: mechanistic role of the placenta in fetal programming; biomarkers of placental function and complications of pregnancy[J]. Placenta, 2016, 48(1): S7-11. |
| [11] | Dimasuay KG, Boeuf P, Powell TL. Placental responses to changes in the maternal environment determine fetal growth[J]. Front Physiol, 2016, 7: 12. |
| [12] | Brett KE, Ferraro ZM, Gruslin A, et al. Maternal-Fetal nutrient transport in pregnancy pathologies: the role of the placenta[J]. Int J Mol Sci, 2014, 15(9): 16153-85. DOI: 10.3390/ijms150916153. |
| [13] | Forbes K, Westwood M. The IGF axis and placental function.a mini review[J]. Horm Res, 2008, 69(3): 129-37. |
| [14] | Randhawa R, Cohen P. The role of the insulin-like growth factor system in prenatal growth[J]. Mol Genet Metab, 2005, 86(1/2): 84-90. |
| [15] | Akram SK, Sahlin L, Ostlund E, et al. Placental IGF-I, estrogen receptor, and progesterone receptor expression, and maternal anthropometry in Growth-Restricted pregnancies in the Swedish population[J]. Horm Res Paediatr, 2011, 75(2): 131-7. DOI: 10.1159/000320466. |
| [16] | Keswani SG, Balaji S, Katz AB, et al. Intraplacental gene therapy with Ad-IGF-1 corrects naturally occurring rabbit model of intrauterine growth restriction[J]. Hum Gene Ther, 2015, 26(3): 172-82. DOI: 10.1089/hum.2014.065. |
| [17] | Jeong W, Song G, Bazer FW, et al. Insulin-like growth factor I induces proliferation and migration of porcine trophectoderm cells through multiple cell signaling pathways, including protooncogenic protein kinase 1 and mitogen-activated protein kinase[J]. Mol Cell Endocrinol, 2014, 384(1/2): 175-84. |
| [18] | Huppertz B. The anatomy of the normal placenta[J]. J Clin Pathol, 2008, 61(12): 1296-302. DOI: 10.1136/jcp.2008.055277. |
| [19] | Cohen M, Meisser A, Bischof P. Metalloproteinases and human placental invasiveness[J]. Placenta, 2006, 27(8): 783-93. DOI: 10.1016/j.placenta.2005.08.006. |
| [20] | Peng B, Zhu H, Klausen C, et al. GnRH regulates trophoblast invasion via RUNX2-mediated MMP2/9 expression[J]. Mol Hum Reprod, 2016, 22(2): 119-29. DOI: 10.1093/molehr/gav070. |
| [21] | Staun-Ram E, Goldman S, Gabarin D, et al. Expression and importance of matrix metalloproteinase 2 and 9 (MMP-2 and -9) in human trophoblast invasion[J]. Reprod Biol Endocrinol, 2004, 2: 59. DOI: 10.1186/1477-7827-2-59. |
| [22] | Bai SX, Wang YL, Qin L, et al. Dynamic expression of matrix metalloproteinases (MMP-2, -9 and-14) and the tissue inhibitors of MMPs (TIMP-1, -2 and-3) at the implantation site during tubal pregnancy[J]. Reproduction, 2005, 129(1): 103-13. DOI: 10.1530/rep.1.00283. |
| [23] | Singh M, Kindelberger D, Nagymanyoki Z, et al. Matrix metalloproteinases and their inhibitors and inducer in gestational trophoblastic diseases and normal placenta[J]. Gynecol Oncol, 2011, 122(1): 178-82. DOI: 10.1016/j.ygyno.2011.03.025. |
| [24] | Kocarslan S, Incebiyik A, Guldur ME, et al. What is the role of matrix metalloproteinase-2 in placenta percreta[J]. J Obstet Gynaecol Res, 2015, 41(7): 1018-22. DOI: 10.1111/jog.v41.7. |
| [25] | Isaka K, Usuda S, Ito H, et al. Expression and activity of matrix metalloproteinase 2 and 9 in human trophoblasts[J]. Placenta, 2003, 24(1): 53-64. DOI: 10.1053/plac.2002.0867. |
| [26] | Walsh LA, Damjanovski S. IGF-1 increases invasive potential of MCF 7 breast cancer cells and induces activation of latent TGF-beta 1 resulting in epithelial to mesenchymal transition[J]. Cell Commun Signal, 2011, 9(1): 10. DOI: 10.1186/1478-811X-9-10. |
| [27] | Lorenc VE, Jaldin-Fincati JR, Luna JD, et al. IGF-1 regulates the extracellular level of active MMP-2 and promotes muller glial cell motility[J]. Invest Ophthalmol Vis Sci, 2015, 56(11): 6948-60. DOI: 10.1167/iovs.15-17496. |
 2017, Vol. 37
2017, Vol. 37

