2. 南方医科大学 公共卫生学院心理学系,广东 广州 510515
2. Department of Psychology, School of Public Health2, Southern Medical University, Guangzhou 510515, China
认知灵活性是指人们在多项并发任务之间切换并产生适当行为反应的能力[1-2]。这种认知控制能力为人类快速适应环境的变化提供保障[3],它与工作记忆、注意和反应抑制等共同组成执行功能[4-5]。研究证明,自闭症[1]、轻度认知功能障碍、帕金森病[6]和额叶损伤[7]等疾病患者的多任务执行能力下降都与认知灵活性的损害有关,认知灵活性的机制研究有助于我们更好的理解相关疾病。
认知灵活性研究的常用实验范式为任务切换范式[2, 8],包括:交替切换范式、线索切换范式、指示切换范式和威斯康辛卡片分类任务等[9-10]。衡量认知灵活性的主要行为指标[11]为切换代价,即与重复条件比较,切换条件的反应时间延长和/或正确率下降[12]。
功能神经影像学研究报告,额顶网络和扣带-岛盖网络等多个脑网络参与任务切换的执行控制过程[1, 13]。然而,囿于fMRI时间分辨率不足的缺陷,不同脑网络在任务切换中的作用时机这一关键信息仍不清楚[14]。高时间分辨率的研究方法有助于进一步澄清上述脑区的作用时机[15]。事件相关电位(ERP)研究发现,一些ERP成分可能反映了任务切换过程中额顶网络的激活[16]:顶叶P3成分与准备过程中内部线索的加工有关;而前额P3成分可能反映切换加工过程中的行为抑制。但是,传统的ERP研究多局限于分析个别电极个别时间窗口的脑电成分振幅或潜伏期效应,无法从整体角度反映脑网络信息加工过程的动态演变[17]。此外,切换线索出现前的准备效应目前尚缺乏深入研究,其潜在神经心理机制仍不明确[18]。
本研究在经典的交替切换任务范式下,利用事件相关电位时空模式兼具高时间分辨率和一定空间分辨率的优势[19],考察认知灵活性相关的脑网络动态演化。
1 资料和方法 1.1 研究对象南方医科大学的29名在校大学生在2014年12月~ 2015年1月参加本实验。入组标准:(1)研究对象者合作,均为右利手;(2)视力或者矫正视力正常;(3)无神经及精神系统疾病;(4)焦虑自评量表(SAS)低于分界值50分,(5)抑郁自评量表(SDS)低于分界值53分。有6名研究对象因眼动伪差等原因被剔除,余23例(包括男12例,女11例),年龄23-35(25.6±2.4)岁;受教育年限18~21(17.9±0.9)年;SAS获25~43(33.7±6.6)分;SDS获25~47(36.8±6.7)分。本研究经南方医科大学南方医院医学伦理委员会批准,所有研究对象均知情同意后参加实验并领取一定报酬。
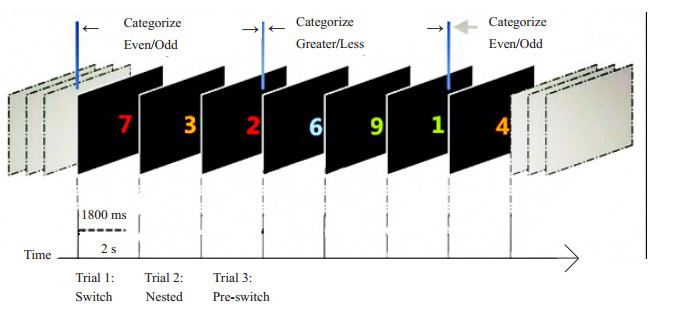
1.2 实验方法 1.2.1 刺激材料和实验任务刺激为除5以外的8个非零单一数字,各有红、橙、蓝、绿4种颜色,构成32个不同刺激。刺激位于屏幕中央,大小为4 cm×4 cm,呈现1800 ms,随后黑屏200 ms。交替切换任务范式如图 1所示。范式包含两个任务:数字奇偶判别和数字大小判别。其中,暖色调(红色或橙色)数字对应奇偶判别任务,奇数按游戏手柄左键,偶数则按游戏手柄右键;冷色调(蓝色或者绿色)数字对应大小判别任务,大于5数字按左键,小于5数字按右键。要求被试尽快、尽准按键反应。每3个试次规律变更一次任务规则(冷暖色交替),3个连续试次分别对应3种条件:试次1为切换(switch)、试次2为基线(nested)和试次3为准备(pre-switch)。两类任务试次比例为1:1,左右按键比例也为1:1。
|
图 1 交替切换任务范式图 Figure 1 Illustration of the alternating runs paradigm. |
在静音暗室内,研究对象取舒适坐位,双目距计算机1 m,双手持游戏手柄完成任务,同时记录其脑电。在完成2区组按键练习后,开始交替切换任务正式实验。共有10区组,各区组含90试次,不同任务试次以伪随机序列等概率呈现。区组之间安排30 s休息,实验持续大约45 min。
1.2.3 脑电记录和预处理采用本实验室开发的ERP系统和北京新拓公司的19通道脑电放大器[20]。记录电极按国际10~20标准导联系统安装,连接双侧耳垂为参考,接地电极置于前额正中。滤波通频带为[0.5, 100](Hz),头皮与电极间阻抗 < 10 kΩ。EEG片段时间窗为1100 ms,取刺激呈现前100 ms至刺激呈现后1000 ms,应用主成分分析法自动订正眼动等伪差,伪差检测阈值设为70 μV。伪差订正后的事件相关EEG片段参与叠加各类平均ERP。
1.3 统计分析行为绩效和ERP波幅等计量资料采用均值±标准差表示。应用SPSS19.0软件对行为绩效进行单因素三水平(切换、基线,准备)重复测量方差分析,并进一步行配对t检验。应用ERP系统的统计分析软件对19通道ERP波幅数据进行单因素三水平(切换、基线,准备)重复测量方差分析和配对t检验。对所获得的F和t统计量,经空间插值获得统计参数映像(SPM),分别缩写为SPM(F)或SPM(t),以P < 0.05为差异有统计学意义。
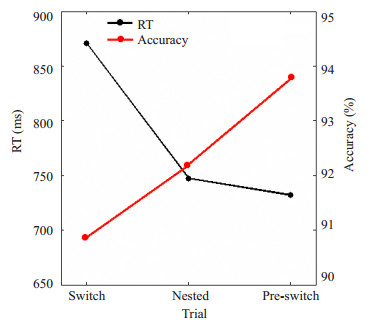
2 结果 2.1 行为绩效表 1示23名研究对象的行为绩效。3种试次条件的反应时存在显著差异:F(2, 44)=48.70,P=0.00。切换条件的反应时显著长于基线条件[t(22)=7.07,P=0.00]和准备条件[t(22)=8.09,P=0.00]。不同条件下的正确率差异显著:F(2.44)=12.95,P=0.00。其中,切换条件的正确率显著低于基线条件[t(22)=-4.01,P=0.01]和准备条件[t(22)=-4.73,P=0.00]。反应时的切换代价(切换-基线)为:(123.61±83.84)ms;正确率的切换代价(切换-基线)为(1.24±3.30)%。而准备条件与基线比较,反应时差异和正确率差异均不显著(图 2)。
| 表 1 行为绩效 Table 1 Behavioral performance of the volunteers (Mean±SD) |
|
图 2 23名被试行为绩效 Figure 2 Behavioral performance of the volunteers: reaction time (RT, ms) (black line) and accuracy (%) (red line). |
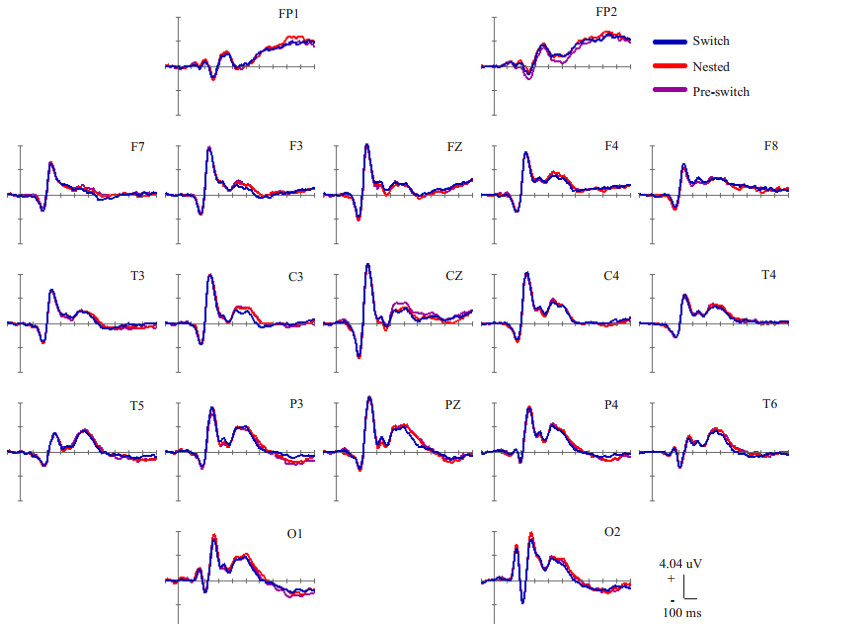
图 3示23位研究对象的19通道总平均ERP波形。
|
图 3 来自23名研究对象的总平均ERP波形 Figure 3 Grand average waveforms of the 19-channel ERP (blue line for switch trial, red line for nested trial, and purple line for pre-switch trial). |
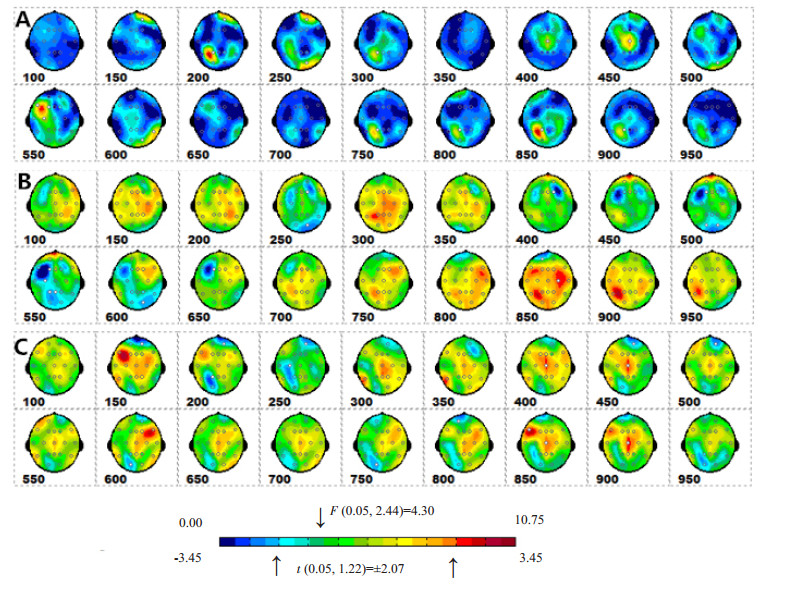
图 4示23名研究对象ERP的统计参数映像SPM(F)和SPM(t)(刺激出现后100~1000 ms),每个空间模式由各电极在50 ms时间窗口内的F值/t值平均值插值获得。其中,SPM(F)显示:有统计学意义的差异主要出现在前额(Fp2、F3、F7、C3)、顶中央(Cz)和后枕部(P3、O1、O2)等脑区。但SPM(F)不能区分差异反映切换效应还是准备效应。
|
图 4 ERP统计参数映像时空模式 Figure 4 Spatiotemporal patterns of ERP. A: SPM (F); B: Switch effects (the paired t-test of switch-nested trials); C: Preparation effects (paired t-test of prepared-nested trials). The white circle shows the significantly activated electrode. Except for the 8 colors to the left of the color scale, the rest colors represent the F-value beyond the significant thresholds. The 4 colors at each end of the color scale also represent the t-value beyond the significant thresholds. |
SPM(t)显示切换效应可分为3阶段:早期(250~ 450 ms)为右额区(F4)和右枕区(O2);中期(450~700 ms)为左额区(FP1、F3)、左顶(P3、Pz)和双侧枕区(O1、O2);晚期(700~1000 ms)为左额极(FP1)和右中央区(C4)。
SPM(t)显示准备效应可分为两阶段:早期(150~ 750 ms)右前额区(FP2)持续激活,分别伴随稍早(200~300 ms)的左额顶区(C3、P3)和稍迟(400~500 ms)的左额中央区(C3、Cz)激活;晚期(750~1000 ms)为左前额区(FP1、F7)、额中央区(Cz)和左枕区(O1)。
3 讨论本研究发现行为绩效方面的切换代价显著,反映了在切换任务中更高的认知控制需求[21]。但本研究并未发现交替任务切换范式在线索出现前阶段的显著准备效应,提示切换试次前的准备为次要过程[22],该过程在当前试次的行为反应结束后才展开。亦可能与交替切换范式的重复次数或时间不足有关。
3.1 准备效应的脑网络动态演化因错误线索可导致切换代价增加,研究者推测在类似交替切换任务这样的可预期范式中,准备效应包含兴奋预期任务定势和抑制无关任务定势两个方面[23]。本研究进一步澄清了准备效应相关脑网络的动态变化过程。本研究ERP结果显示双侧前额极参与准备过程:750 ms前后依次激活右额极和左额极,提示延迟意向可启动跨试次的准备过程;不同时段[200~300、400~ 500、850~950(ms)]的左额中央顶区(C3、Cz、P3)和左枕区(O1)ERP效应可能对应存储定势的激活,与下述切换效应中期的ERP模式类似。
前瞻记忆的“延迟意向注意”(AtoDI)模型认为背侧和腹侧FPN分别维护和检索延迟意向[24],而双侧前额参与调控认知资源(注意和工作记忆)在内部信息加工系统和外部信息加工系统之间的分配和转移[25]。由于交替切换任务范式的切换是可预期的,内部切换线索可视为延迟意向,因此本研究的范式负荷了前瞻记忆因素。
与重复试次的反应时小于750 ms相适应,SPM时空模式不仅支持AtoDI模型[18, 24],而且进一步提示750 ms前后顺序激活的右额极和左额极可能分别实现不同功能:早期(150~750 ms)的右额极(FP2)和晚期(750~ 950 ms)的左额极(FP1、F7)分别抑制和易化位于额顶网络和枕区的预激活定势,为即将到来的切换任务做准备。提示外部切换线索出现之后的可预期准备过程相关的脑网络与线索出现前的有所不同,而且上述脑网络的活动在反应时间窗口前后存在明显的动态变化。
3.2 切换效应的脑网络动态演化本研究中,切换过程激活的脑区主要包括:前额、中央及后顶叶等,对应于fMRI研究的额顶网络(FPN)[13]。且SPM结果进一步从更为精细的时间尺度上提示:FPN激活可区分为3个阶段。首先,切换早期(250~450 ms)激活的右额区(F4)和右枕区(O2)可能反映右腹侧FPN活动[26],也称为腹侧注意网络(VAN)。其中,后部VAN检测切换信息,前部VAN抑制旧定势[27]。其次,切换中期(450~700 ms)激活的左额极和背侧额区(FP1、F3)、左顶(P3、Pz)与背侧FPN高度重叠。其中,左额区可能参与激活和维持后部顶区的新任务定势,而双侧枕区(O1、O2)激活可能与视觉信息精细加工有关,如视空间信息集成[28]。第3,切换晚期(700~1000 ms)激活的左额极(FP1)和右额中央区(C4)可能涉及未来的情境更新和前瞻记忆[29]。
对比切换早期和中期可以发现,左右半球背侧额区分别参与任务切换的不同认知加工阶段,右额区在切换早期激活,可能与抑制旧定势有关,而左额区在切换中期激活,可能与激活和更新定势有关。上述结果表明,双侧额区尽管都参与任务切换,但作用性质并不相同。fMRI研究也曾报告,左侧额下联合区在多种任务范式(如:行为切换任务、规则切换任务等)条件下均激活;而右侧额下联合区激活则更多见于需要变更刺激-反应映射规则的概念切换任务范式中[14],可见左右额区在任务切换过程中功能的不对称性需要未来研究加以考虑。
此外,通过准备效应和切换效应相关脑网络活动的比较,我们推测准备过程的前额极与切换过程的背侧额区存在功能互补:前额极参与跨试次的前瞻记忆和计划,而切换加工依赖背侧额区对试次内目标刺激的即时处理,这可能也是剩余代价的产生机制[30]。
综上所述,任务切换所代表的认知灵活性这一执行功能主要依赖于额顶网络的动态激活,前额极和背侧额区可能构成分时工作的多层次调控系统介入任务切换,前者和后者分别参与准备过程和即时切换,而在即时切换过程中左额和右额功能不同,分别易化兴奋新定势和抑制不适宜的旧定势。
| [1] | Dajani DR, Uddin LQ. Demystifying cognitive flexibility: Implications for clinical and developmental neuroscience[J]. Trends Neurosci, 2015, 38(9): 571-8. DOI: 10.1016/j.tins.2015.07.003. |
| [2] | Monsell S. Task switching[J]. Trends Cogn Sci, 2003, 7(3): 134-40. DOI: 10.1016/S1364-6613(03)00028-7. |
| [3] | Kim C, Johnson NF, Cilles SE, et al. Common and distinct mechanisms of cognitive flexibility in prefrontal cortex[J]. J Neurosci, 2011, 31(13): 4771-9. DOI: 10.1523/JNEUROSCI.5923-10.2011. |
| [4] | Logue SF, Gould TJ. The neural and genetic basis of executive function: Attention, cognitive flexibility, and response inhibition[J]. Pharmacol Biochem Behav, 2014, 123(S1): 45-54. |
| [5] | Rubinstein JS, Meyer DE. Executive control of cognitive processer in task switching[J]. J Exp Psychol Hum Percept Perform, 2001, 27(4): 763-97. DOI: 10.1037/0096-1523.27.4.763. |
| [6] | Varalta V, Picelli A, Fonte CA, et al. Relationship between cognitive performance and motor dysfunction in patients with Parkinson's disease: A pilot cross-sectional study[J]. Biomed Res Int, 2015(2105): 365959. |
| [7] | Schmitter-Edgecombe M, Langill M. Costs of a predictable Switch between simple cognitive tasks following severe closed-head injury[J]. Neuropsychology, 2006, 6(20): 675-84. |
| [8] | Rogers R, Monsell S. The costs of a predictable switch between simple cognitive tasks[J]. J Exp Psychol Gen, 1995, 124(95): 207-31. |
| [9] | 史艺荃, 周晓林. 执行控制研究的重要范式--任务切换[J]. 心理学进展, 2004, 5(12): 627-79. |
| [10] | Koch I, Gade M, Schuch S, et al. The role of inhibition in task switching: A review[J]. Psychon Bull Rev, 2010, 17(1): 1-14. DOI: 10.3758/PBR.17.1.1. |
| [11] | Ravizza SM, Carter CS. Shifting set about task switching: Behavioral and neural evidence for distinct forms of cognitive flexibility[J]. Neuropsychologia, 2008, 46(12): 2924-35. DOI: 10.1016/j.neuropsychologia.2008.06.006. |
| [12] | Hsieh S, Liu L. The Nature of Switch cost: task set configuration or carry-over effect[J]. Cognitive Brain Res, 2005, 22(2): 165-75. DOI: 10.1016/j.cogbrainres.2004.08.006. |
| [13] | Brown JW, Reynolds JR, Braver TS. A computational model of fractionated conflict-control mechanisms in task-switching[J]. Cogn Psychol, 2007, 55(1): 37-85. DOI: 10.1016/j.cogpsych.2006.09.005. |
| [14] | Kim C, Cilles SE, Johnson NF, et al. Domain general and domain preferential brain regions associated with different types of task switching: a Meta-analysis[J]. Hum Brain Mapp, 2012, 33(1): 130-42. DOI: 10.1002/hbm.21199. |
| [15] | Wylie G. Task switching: a high-density electrical mapping study[J]. Neuroimage, 2003, 20(4): 2322-42. DOI: 10.1016/j.neuroimage.2003.08.010. |
| [16] | Gajewski PD, Falkenstein M. Diversity of the P3 in the task-switching paradigm[J]. Brain Res, 2011, 1411: 87-97. DOI: 10.1016/j.brainres.2011.07.010. |
| [17] | Salmela V, Salo E, Salmi J, et al. Spatiotemporal dynamics of attention networks revealed by representational similarity analysis of EEG and fMRI[J]. Cereb Cortex, 2016, 10(10): 93. |
| [18] | De BE, Wouter B, Marcel. Dissociating strategy-dependent and Independent components in task preparation[J]. Neuropsychologia, 2014, 62: 331-40. DOI: 10.1016/j.neuropsychologia.2014.04.015. |
| [19] | Karayanidis FH. Advance preparation in task-switching: converging evidence from behavioral, brain activation, and model-based approaches[J]. Front Psychoi, 2010, 1(15): 1-25. |
| [20] | Zhou S, Zhou W, Chen X. Spatiotemporal analysis of ERP during Chinese idiom comprehension[J]. Brain Topogr, 2004, 17(1): 27-37. DOI: 10.1023/B:BRAT.0000047334.48256.9f. |
| [21] | Kiesel A, Steinhauser M, Wendt M, et al. Control and interference in task Switching-A review[J]. Psychol Bull, 2010, 136(5): 849-74. DOI: 10.1037/a0019842. |
| [22] | Schmidt JR, Liefooghe B. Feature integration and task switching: diminished Switch costs after controlling for stimulus, response, and cue repetitions[J]. PLoS One, 2016, 11(3): e151188. |
| [23] | Hübner M, Kluwe RH, Luna-Rodriguez A, et al. Task preparation and stimulus-evoked competition[J]. Acta Psychol (Amst), 2004, 115(2/3): 211-34. |
| [24] | Cona G, Scarpazza C, Sartori GA, et al. Neural bases of prospective memory: A meta-analysis and the "Attention to Delayed Intention" (AtoDI) model[J]. Neurosci Biobehav Rev, 2015, 52: 21-37. DOI: 10.1016/j.neubiorev.2015.02.007. |
| [25] | Braver TS, Reynolds JR, Donaldson DI. Neural mechanisms of transient and sustained cognitive control during task switching[J]. Neuron, 2003, 39(4): 713-26. DOI: 10.1016/S0896-6273(03)00466-5. |
| [27] | Shi YQ, Meindl T, Szameitat AJ, et al. Task preparation and neural activation in stimulus-specific brain regions: an fMRI study with the cued task-switching paradigm[J]. Brain Cogn, 2014, 87: 39-51. DOI: 10.1016/j.bandc.2014.03.001. |
| [28] | Wu SS, Hitchman G, Tan JF, et al. The neural dynamic mechanisms of asymmetric switch costs in a combined stroop-task-switching paradigm[J]. Sci Rep, 2015, 5: 10240. DOI: 10.1038/srep10240. |
| [29] | Henson RN, Eckstein D, Waszak F, et al. Stimulus-response bindings in priming[J]. Trends Cogn Sci, 2014, 18(7): 376-84. DOI: 10.1016/j.tics.2014.03.004. |
| [30] | Schneider DW. Investigating a method for reducing residual Switch costs in cued task switching[J]. Mem Cognit, 2016: 1-16. |
 2017, Vol. 37
2017, Vol. 37

