蚊是一种重要的疾病传播媒介,能够传播疟疾、登革热、丝虫病、日本流行性乙型脑炎、圣路易脑炎、黄热病、寨卡病毒病和基孔肯雅热等疾病[1-5]。蚊媒疾病流行范围广,传播力强,发病率高,全球每年有上亿人感染疟疾、登革热等蚊媒疾病,死亡人数过百万[6-7]。据报到,2014年,登革热的发病率在过去的50年里上升了30倍,每年高达5000万~1亿的病例发生在全球一百多个国家和地区,几乎世界上一半的人口存在感染的风险[8]。其中,2014年广东省出现登革大爆发,感染病例多达4.5万余例[9]。另外,2015年全球感染疟疾人数高达2.14亿,其中近43.8万人死于疟疾[10]。
媒介化学防制由于其突出的效果在蚊媒防制中一度占有统治地位,但是随着传统上的化学防制所造成严重的环境污染,易引起蚊虫药物抗性产生等弊端的日益显现[11-14],蚊虫的生物防制愈来愈受到人们的青睐。生物防制主要应用蚊虫病原体、寄生物、捕食物来达到防制效果,对非目标生物和有益生物无害,不污染环境,蚊虫对其不易产生抗性[15-16]。
研究者们利用大肠埃希菌工程菌株的开发对于蚊虫的防控具有极大的价值[17-19],可应用于设置引诱蚊产卵的陷阱,或喷洒于蚊幼虫较多的水体,从而起到杀灭蚊幼虫的作用。
昆虫特异性神经毒素是一类作用于昆虫神经系统,有毒杀作用的蛋白类神经毒素,发现于由蝎子、蜘蛛、胡蜂、蚂蚁等捕食性动物的毒腺分泌的毒液中[20]。AaIT是来自于北非黄肥尾蝎(Androctonus australis)的昆虫特异性神经毒素,实验证实其对蚊幼虫有一定的杀灭作用,并对哺乳动物与甲壳动物均无毒害作用[21-22]。苏云金芽孢杆菌以色列亚种(Bacillus thuringiensis subsp israelensis, B.t.i)是第1种被发现的苏云金芽孢杆菌,被用作世界上许多蚊和蝇幼虫的有效生物防制剂[23]。由其产生的致病毒素属于两个结构不同的组,即晶体(Cry)δ-内毒素和溶细胞(Cyt)δ-内毒素[24]。其中B.t.i毒素Cyt2Ba被证实对蚊幼虫有显著杀灭作用[25-26]。
有研究曾构建过融合表达硫氧还蛋白(21 000)和AaIT(10 000)的大肠埃希菌,但未检测到其生物活性[27],怀疑是在融合表达过程中由于硫氧还蛋白比AaIT蛋白大两倍多,其折叠过程将AaIT蛋白包裹使其无法正常发挥生物活性。同时关于表达Cyt2Ba的大肠埃希菌的构建鲜有报道,目前没有将其重组大肠埃希菌应用于蚊媒防控的研究出现。为寻找一种制备简单、低成本的生物杀蚊剂,本研究成功构建了单独表达AaIT或Cyt2Ba毒素蛋白的大肠埃希菌,确保其生物活性不受其他融合蛋白的干扰,检测该工程菌的杀蚊毒效。另外配剂可以有效增强昆虫致病真菌在实验室及野外对蚊幼虫的杀灭效果,但是没有运用于大肠埃希菌上的报道。我们创新性地将杀蚊效果好的工程菌制成干粉剂,并与一些材料制成配剂使用,探索配剂是否可以增强工程菌对蚊幼虫的杀灭作用,使其更好的运用于蚊媒防制过程。
1 材料和方法 1.1 实验蚊虫致倦库蚊和白纹伊蚊为敏感品系,由南方医科大学病原生物学系培育,以Ⅱ龄健康幼虫为实验对象。
1.2 工程菌株的构建根据已报道的北非蝎的昆虫特异性神经毒素AaIT的蛋白序列(Swiss-Prot: P01497.2, 88aa)和苏芸金杆菌毒素Cyt2Ba基因(GenBank: GQ919041.1, 263aa)序列及大肠埃希菌的偏爱密码子分别合成它们的全长cDNA,并克隆至载体pET-28a(+)。将重组质粒pET-28a-Cyt2Ba和pET-28a-AaIT分别转化入大肠埃希菌BL21(DE3),标记为工程菌株Cyt2Ba-BL21和AaIT-BL21。
1.3 工程菌的诱导表达挑取工程菌单菌落,接种于含有卡那霉素(抗性为50 μg/mL)液体LB培养基中,置37 ℃摇床振荡过夜(250 r/min)。按1:100比例转入新鲜的含卡那霉素液体LB培养基中,继续振荡培养至对数生长期,加入无菌的IPTG溶液,使终浓度达到1 mmol/mL,诱导培育4 h。离心收集菌体。
1.4 SDS-PAGE电泳分析参照文献[28]进行SDS-PAGE电泳。分离胶浓度为15%,电压为120 V;浓缩胶为5%,电压为80 V。考马斯亮蓝R250染色。
1.5 Western blot分析菌体蛋白经SDS-PAGE电泳后,通过半干转印仪将蛋白转移到PVDF膜上进行Western blot分析。
1.6 工程菌菌液的毒效测定将工程菌梯度稀释后加入无菌水中,按常规方法[17]测试对致倦库蚊和白纹伊蚊幼虫的毒效。工程菌浓度设置为1×108、1×107、1×106、1×105和1×104 cells/mL等5个梯度(用分光光度计测量工程菌的浓度),每个浓度设置3个重复。阴性对照为正常大肠埃希菌BL21(DE3),空白对照为无菌水。计算24、48 h蚊幼虫死亡数量。
1.7 配剂的制作和毒效测定将工程菌经IPTG诱导表达24 h后,离心收集菌体,并置于37 ℃温箱烘干。选择干酵母粉、小麦粉和白胡椒粉为制作配剂的混合材料,将每种材料与细菌粉末分别按照质量比4:1、1:1和1:4的比例进行混合,制成配剂。然后选取10 mg的配剂,洒于30 mL饲养蚊幼虫的水体。取正常大肠埃希菌BL21(DE3)粉末、干酵母粉、小麦粉和白胡椒粉以及无菌水作为对照。计算24、48 h蚊幼虫的死亡数量。
1.8 统计分析根据蚊幼虫在毒效测定过程中的死亡数量计算其每天的死亡率,对死亡率进行反正弦变换,使其满足参数检验的条件,然后用方差分析和LSD检验比较组间差异,P < 0.05为差异有统计学意义。统计分析过程均采用SPSS 20.0软件完成。
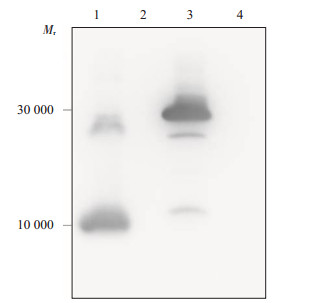
2 结果 2.1 重组质粒在大肠埃希菌中的表达鉴定挑取含有重组质粒pET-28a-AaIT和pET-28aCyt2Ba的工程菌单菌落分别进行扩增,在IPTG诱导下表达,经SDS-PAGE电泳后发现,在10 000和30 000处可观察到与预期大小相符的条带(图 1)。同样在工程菌株表达产物进行Western blot分析时,可看到相同位置的特异性条带(图 2)。可证明AaIT和Cyt2Ba在大肠埃希菌中成功表达。

|
图 1 SDS-PAGE分析工程菌株AaIT-BL21和Cyt2Ba-BL21的表达产物 Figure 1 SDS-PAGE analysis of the expression of AaIT-BL21 and Cyt2Ba-BL21. M: Protein maker; 1: AaIT-BL21 induced by IPTG for 4 h; 2: AaIT-BL21 without induction; 3: Cyt2Ba-BL21 induced by IPTG for 4 h; 4: Cyt2Ba-BL21 without induction. |
|
图 2 Western blot分析工程菌株AaIT-BL21和Cyt2Ba-BL21表达产物 Figure 2 Western blot analysis of the expression of AaIT-BL21and Cyt2Ba-BL21. 1: AaIT-BL21 induced by IPTG for 4 h; 2: AaIT-BL21 without induction; 3: Cyt2Ba-BL21 induced by IPTG for 4 h; 4: Cyt2Ba-BL21 without induction. |
工程菌AaIT-BL21对白纹伊蚊和致倦库蚊幼虫未观察到明显的杀灭作用。但工程菌Cyt2Ba-BL21对白纹伊蚊和致倦库蚊Ⅱ龄幼虫显示较好的杀灭效果。结果显示,工程菌Cyt2Ba-BL21加入48 h后对2种蚊幼虫均具有明显的杀灭作用,阴性及空白对照未见蚊幼虫死亡(表 1)。其中对白纹伊蚊的杀灭作用要好于对致倦库蚊幼虫的杀灭效果,差异有统计学意义(P < 0.001)。用软件SPSS计算LC50分别为3.00×106和1.25×107 cells/mL。
| 表 1 工程菌Cyt2Ba-BL21诱导后对白纹伊蚊和致倦库蚊Ⅱ龄幼虫的杀灭作用 Table 1 Larvicidal activity of engineered E. coli (Cyt2Ba-BL21) to the 2nd instar larvae of Aedes albopictus and Culex pipiens quinquefasciatus after induction by IPTG* |
由于工程菌Cyt2Ba-BL21菌液对白纹伊蚊幼虫有较好的杀灭作用,于是选取该工程菌制作成干粉,并选择合适的材料制成配剂,测试其对白纹伊蚊Ⅱ龄幼虫的毒力。结果显示,工程菌粉末对白纹伊蚊也有一定的杀灭作用,在处理白纹伊蚊幼虫24 h和48 h后死亡率分别为40%和80%(表 2)。当工程菌粉末与适配材料按不同比例制成配剂处理白纹伊蚊48 h后,不同质量比和不同适配材料之间对于蚊幼虫杀灭效果均存在显著差异。质量比例为1:1时效果最好(P=0.044),选择干酵母粉、小麦粉和白胡椒粉作为配剂材料,在48 h的死亡率分别为90%、85%和100%(表 2)。另外白胡椒粉末配剂的作用效果要显著好于其他两种配剂(P=0.002),并且当工程菌干粉与白胡椒粉的质量比为1:1时,在所有剂型中对蚊幼虫的杀灭效果最好。
| 表 2 工程菌Cyt2Ba-BL21干粉配剂对白纹伊蚊II龄幼虫的杀灭作用 Table 2 Larvicidal activity of formulations of Cyt2Ba-BL21 to the 2nd instar larvae of Aedes albopictus |
蝎神经毒素AaIT是1971年从北非黄尾蝎毒液中被分离出来的[27],AaIT作为一种昆虫特异性毒素,它通过影响昆虫的电压门控钠通道(VGSCs)使昆虫产生收缩麻痹而发挥其毒性作用[22, 29-30]。虽然不同类群中的VGSCs作用显示高度相似性,但是AaIT表现出对昆虫的高度特异性,并能区分昆虫和哺乳动物,对哺乳动物无害,这使得它特别适合用于开发安全的生物杀虫剂[22, 31]。本实验通过能使pET系列载体大量表达BL21(DE3)菌株和表达载体pET-28a(+)的组合,能最大限度的得到可溶有活性的目的产物。但是工程菌AaIT-BL21实验结果显示,AaIT虽然成功表达,未表现出对白纹伊蚊和致倦库蚊幼虫的杀灭作用。其原因可能是,蝎毒素含有4对二硫键,其正确形成对其功能极其重要,而大肠埃希菌表达很难形成多对二硫键,进而无法发挥其生物活性[27]。
Cyt蛋白毒素最早在对双翅目昆虫具有毒性的B.t.i中发现的[32],其中Cyt2Ba蛋白毒素已被报道具有杀蚊活性,当其进入昆虫消化道后,被消化道中的碱性肠液水解,释放出毒性肽核心片段。该片段与昆虫消化道刷状缘膜囊上的受体高亲性的结合,诱导细胞形成孔道,使细胞膜非极性化[23, 33]。因此,破坏了细胞的渗透平衡,从而致使中肠上皮细胞解离,中肠停止蠕动、瘫痪,昆虫停食[34]。本研究结果显示Cyt2Ba在大肠埃希菌中成功表达,并且工程菌Cyt2Ba-BL21菌液和干粉末都显示出对白纹伊蚊和致倦库蚊幼虫较好的杀灭效果。有研究显示蚊幼虫摄入食物颗粒的速度比惰性颗粒快6~9倍[35],于是我们选择了干酵母粉和小麦粉作为食物材料,与工程菌粉末制成配剂。蚊幼虫吞食食物颗粒的同时摄入了细菌粉末,提高了毒素摄入的效率,进而增强了对蚊幼虫的杀灭效果。另外有报道显示白胡椒粉末对蚊幼虫有一定毒性[36],于是同样选取其作为配剂材料,用来加强工程菌毒性作用。研究结果显示,当工程菌与其他材料的比例适当时,配剂可以有效提高工程菌对蚊幼虫的杀灭效果,其中当质量比为1:1时,效果最好。另外白胡椒粉末与工程菌的组合效果最好,由于两者均对蚊幼虫有一定毒性作用,配合使用可以产生增强作用或协同作用。
本研究发现表达Cyt2Ba蛋白的工程菌对白纹伊蚊和致倦库蚊等有良好的杀灭作用,并且其干粉配剂能有效提高其杀灭效果,在蚊虫生物防制方面做出了新的探索,对蚊虫生物防制有重要意义。
| [1] | Hochedez P, Jaureguiberry S, Debruyne M, et al. Chikungunya infection in travelers[J]. Emerg Infect Dis, 2006, 12(10): 1565-7. DOI: 10.3201/eid1210.060495. |
| [2] | Wong P, Li M, Chong CS, et al. Aedes (Stegomyia) albopictus (Skuse): a potential vector of Zika virus in Singapore[J]. PLoS Negl Trop Dis, 2013, 7(8): e2348. DOI: 10.1371/journal.pntd.0002348. |
| [3] | Benjelloun A, El Harrak M, Belkadi B. West nile disease epidemiology in north-west africa: bibliographical review[J]. Transbound Emerg Dis, 2016, 63(6): e153-9. DOI: 10.1111/tbed.12341. |
| [4] | Andersen LK, Davis MD. Climate change and the epidemiology of selected tick-borne and mosquito-borne diseases: update from the international society of dermatology climate change task force[J]. Int J Dermatol, 2017, 56(3): 252-9. DOI: 10.1111/ijd.2017.56.issue-3. |
| [5] | Dhawan R, Kumar M, Mohanty AK, et al. Mosquito-Borne diseases and omics: salivary gland proteome of the female Aedes aegypti mosquito[J]. OMICS, 2017, 21(1): 45-54. DOI: 10.1089/omi.2016.0160. |
| [6] | WHO. Dengue and severe dengue. http://www.who.int/mediacentre/factsheets/fs117/en/[R]. World Health Organization, 2017. |
| [7] | WHO. Diseases and topics. http://www.who.int/tdr/diseases-topics/en/[R]. World Health Organization, 2017. |
| [8] | WHO. Mosquitoes cause millions of deaths every year. World Health Organization. http://www.who.int/neglected_diseases/vector_ecology/mosquito-borne-diseases/en/[R]. World Health Organization, 2016. |
| [9] | Shen SQ, Wei HX, Fu YH, et al. Multiple sources of infection and potential endemic characteristics of the large outbreak of dengue in Guangdong in 2014[J]. Sci Rep, 2015, 5(4): 16913. |
| [10] | WHO. WHO/UNICEF report: Malaria MDG target achieved amid sharp drop in cases and mortality, but 3 billion People remain at risk. http://www.who.int/mediacentre/news/releases/2015/malariamdg-target/en/[R]. World Health Organization, 2017. |
| [11] | Al-Sarar A, S A. Insecticide resistance of Culex pipiens (L.) populations (diptera: culicidae) from riyadh city, saudi arabia: status and overcome[J]. Saudi J Biol Sci, 2010, 17(2): 95-100. DOI: 10.1016/j.sjbs.2010.02.001. |
| [12] | Lima EP, Santos Paiva MH, de Araujo AP, et al. Insecticide resistance in Aedes aegypti populations from Ceara, Brazil[J]. Parasit Vectors, 2011, 17(4): 5. |
| [13] | Stenhouse SA, Plernsub S, Yanola JA, et al. Detection of the V1016G mutation in the voltage-gated sodium channel gene of Aedes aegypti (Diptera: Culicidae) by allele-specific PCR assay, and its distribution and effect on deltamethrin resistance in Thailand[J]. Parasit Vectors, 2013, 6(1): 253. DOI: 10.1186/1756-3305-6-253. |
| [14] | Agra-Neto AC, Napoleao TH, Pontual EV, et al. Effect of moringa oleifera lectins on survival and enzyme activities of Aedes aegypti larvae susceptible and resistant to organophosphate[J]. Parasitol Res, 2014, 113(1): 175-84. DOI: 10.1007/s00436-013-3640-8. |
| [15] | Lacey LA, Frutos R, Kaya HK, et al. Insect pathogens as biological control agents: do they have a future[J]. Biological Control, 2001, 21(3): 230-48. DOI: 10.1006/bcon.2001.0938. |
| [16] | Lomer CJ, Bateman RP, Johnson DL, et al. Biological control of locusts and grasshoppers[J]. Annu Rev Entomol, 2001, 46(5): 667-702. |
| [17] | 刘相萍, 张昕, 阎歌, 等. 大肠埃希菌表达苏云金杆菌cryIVD基因杀蚊幼活性观察[J]. 中国媒介生物学及控制杂志, 2002, 13(5): 343-4. |
| [18] | Sazhenskiy V, Zaritsky A, Itsko M. Expression in Escherichia coli of the native cyt1Aa from Bacillus thuringiensis subsp israelensis[J]. Appl Environ Microbiol, 2010, 76(10): 3409-11. DOI: 10.1128/AEM.03068-09. |
| [19] | Pinto LD, Goncales RA, Conceicao FR, et al. Stability, oviposition attraction, and larvicidal activity of binary toxin from Bacillus sphaericus expressed in Escherichia coli[J]. Appl Microbiol Biotechnol, 2012, 95(5): 1235-41. DOI: 10.1007/s00253-011-3808-z. |
| [20] | 毛立群, 郭三堆. 昆虫神经毒素基因工程研究进展[J]. 生物技术通报, 1998(6): 1-6. |
| [21] | Sheng JJ, Feng L, Er Qiu LI, et al. Recombinant scorpion insectotoxin AaIT kills specifically insect cells but not human cells[J]. Cell Res, 2002, 12(2): 143-50. DOI: 10.1038/sj.cr.7290120. |
| [22] | Zlotkin E, Fishman Y, Elazar M. AaIT: from neurotoxin to insecticide[J]. Biochimie, 2000, 82(9/10): 869-81. |
| [23] | Ben-Dov B E. Bacillus thuringiensis subsp. israelensis and its dipteran-specific toxins[J]. Toxins (Basel), 2014, 6(4): 1222-43. DOI: 10.3390/toxins6041222. |
| [24] | Hofte H, Whiteley HR. Insecticidal crystal proteins of Bacillus thuringiensis[J]. Microbiol Rev, 1989, 53(2): 242-55. |
| [25] | Waalwijk C, Dullemans AM, van Workum ME, et al. Molecular cloning and the nucleotide sequence of the Mr 28 000 crystal protein gene of Bacillus thuringiensis subsp israelensis[J]. Nucleic Acids Res, 1985, 13(22): 8207-17. DOI: 10.1093/nar/13.22.8207. |
| [26] | Guerchicoff A, Ugalde RA, Rubinstein CP. Identification and characterization of a previously undescribed cyt gene in Bacillus thuringiensis subsp. israelensis[J]. Appl Environ Microbiol, 1997, 63(7): 2716-21. |
| [27] | 王二文, 徐进平, 鲁伟, 等. 蝎神经毒素AaIT的表达及功能分析[J]. 武汉大学学报:理学版, 2005, 51(6): 727-32. |
| [28] | 卢圣栋. 现代分子生物学实验技术[M]. 北京: 高等教育出版社, 1993: 101-13. |
| [29] | Gurevitz M, Karbat I, Cohen L, et al. The insecticidal potential of scorpion beta-toxins[J]. Toxicon, 2007, 49(4): 473-89. DOI: 10.1016/j.toxicon.2006.11.015. |
| [30] | Gilles N, Gurevitz M, Gordon D. Allosteric interactions among pyrethroid, brevetoxin, and scorpion toxin receptors on insect sodium channels raise an alternative approach for insect control[J]. FEBS Lett, 2003, 540(1/3): 81-5. |
| [31] | Dee A, Belagaje RM, Ward K, et al. Expression and secretion of a functional scorpion insecticidal toxin in cultured mouse cells[J]. Biotechnology (N Y), 1990, 8(4): 339-42. |
| [32] | Promdonkoy B, Rungrod A, Promdonkoy P, et al. Amino acid substitutions in alphaA and alphaC of Cyt2Aa2 alter hemolytic activity and mosquito-larvicidal specificity[J]. J Biotechnol, 2008, 133(3): 287-93. DOI: 10.1016/j.jbiotec.2007.10.007. |
| [33] | El-Kersh TA, Ahmed AM, Al-Sheikh YA, et al. Isolation and characterization of native Bacillus thuringiensis strains from Saudi Arabia with enhanced larvicidal toxicity against the mosquito vector Anopheles gambiae (s.l.)[J]. Parasit Vectors, 2016, 9(1): 647. DOI: 10.1186/s13071-016-1922-6. |
| [34] | Bravo A, Gill SS, Soberón M. Mode of action of Bacillus thuringiensis Cry and Cyt toxins and their potential for insect control[J]. Toxicon, 2007, 49(4): 423-35. DOI: 10.1016/j.toxicon.2006.11.022. |
| [35] | Aly C, Mulla MS. Orientation and ingestion rates of larval Anopheles albimanus in response to floating particles[J]. Entomol Exp Appl, 1986, 42(1): 83-90. DOI: 10.1111/eea.1986.42.issue-1. |
| [36] | Bukhari T, Takken W, Koenraadt CJ. Development of Metarhizium anisopliae and Beauveria bassiana formulations for control of malaria mosquito larvae[J]. Parasit Vectors, 2011, 4(5): 23. |
 2017, Vol. 37
2017, Vol. 37

