气道上皮作为抵御外部环境有害刺激的第一道防线,其不仅发挥着物理屏障功能,更重要的是,其释放多种细胞因子及炎症介质从而发挥免疫调节功能,是维持气道正常结构和功能的重要成分。当气道上皮结构或功能发生异常,一方面导致气道上皮对环境刺激的易感性增高,另一方面,上皮细胞受到刺激后分泌大量炎症介质,启动哮喘气道炎症,从而促进哮喘的发生发展[1-3]。哮喘患者气道上皮明显破坏,包括纤毛柱状上皮分离、对致敏原的高通透性以及上皮连接分子如E-cadherin蛋白的破坏[4]。屋尘螨(HDM)是哮喘主要的吸入性致敏原[5]。表皮生长因子受体(EGFR)是表皮生长因子受体家族成员之一。EGFR在细胞生理过程中发挥重要的调节作用。既往研究表明,通过全基因组关联研究和在哮喘患者中将EGFR与气道高反应性相关联的多态性连锁分析,证明EGFR参与哮喘的发病过程[6]。EGFR参与气道粘液高分泌、中性粒细胞聚集及气道上皮的修复等过程[7],而在HDM哮喘小鼠模型中敲除EGFR或应用EGFR抑制剂可明显改善气道高反应性及气道重塑[8]。同样,体外研究也进一步表明了抑制EGFR相关信号通路可明显改善HDM所导致的气道上皮高通透性[9],因此EGFR相关信号与哮喘的气道上皮屏障的破坏密切相关。然而,关于EGFR相关信号通路参与哮喘气道屏障破坏的研究甚少,其具体调控机制尚不明确。肌动蛋白应力纤维(F-actin)是表达于真核细胞中的细胞骨架的关键组分,细胞的各种生物活动及应对外界环境变化时的应答均依赖于肌动蛋白的聚合和快速解聚过程[10]。研究表明,F-actin参与调节多种细胞类型的高通透性,如F-actin的重新排布参与缓激肽、组胺及凝血酶所诱导的兔胸膜间皮细胞的高通透性[11]及凝血酶、内毒素和TGF-β诱导的血管内皮细胞的高通透性[12-14]。TNF-α通过激活NF-κB介导的MLC信号通路,从而介导了细胞骨架F-actin的重新排布,引起肠道上皮细胞高通透性[15]。同样有少量在气道上皮细胞的研究表明,假单胞菌的弹性蛋白酶通过调节细胞骨架蛋白F-actin的重新排布及连接蛋白的破坏,从而导致气道上皮细胞的高通透性[16]。也有研究证明EGFR相关信号通路可以通过调节F-actin重新排布从而参与病毒诱导的肠道上皮高通透性[17]。提示F-actin的重新排布在气道上皮屏障破坏中扮演十分重要的角色,亦是气道上皮屏障破坏的机制之一。
因此,本研究目的是探索EGFR相关信号通路在哮喘的发生发展中的具体调控机制,故而猜想EGFR相关信号通路通过调控F-actin重新排布参与HDM导致的气道上皮屏障破坏。我们以16HBE细胞为研究对象,拟为EGFR为靶点的哮喘患者的治疗提供新的依据。
1 材料和方法 1.1 材料与主要试剂人支气管上皮细胞系(16HBE,伯乐生命医学);HDM(安脱达);EGFR抑制剂AG-1478(Selleck);异硫氰酸萤光素-右旋糖酐(FITC-DX, Sigma);跨膜电阻测量仪Millicell-ERS(Millipore);RPMI 1640培养基、无酚红RPMI 1640培养基、胎牛血清(Gibco);Transwell板(#3460、#3470)、黑色96孔(#3601)板(Corning);兔抗E-cadherin和β-catenin多克隆抗体(Santa cruz);鼠抗F-actin和CytoPainter Phalloidin-iFlour 488 Reagent(Abcam);抗兔、鼠二抗(CST);化学发光显影液(Millipore);牛血清白蛋白组分Ⅴ(科昊生物);全蛋白提取试剂盒(凯基),Bradford法蛋白含量检测试剂盒(Thermo),Glass Bottom Cell Culture Dish(直径15 mm)及其他常用实验耗材(NEST)。
1.2 正常人支气管上皮细胞系16HBE的培养16HBE细胞用含10%胎牛血清的RPMI 1640培养基,37 ℃、5% CO2培养箱培养。当细胞90%融合后,按2.5 × 104/cm2的密度传至96孔板、Transwell 12或Transwell 24孔板及Glass Bottom Cell Culture Dish中继续培养。90%融合后换成无血清培养基同步化。
1.3 EGFR抑制剂AG-1478对16HBE细胞跨细胞膜电阻(TER)的影响16HBE细胞接种在12孔Transwell插入式培养皿的上层小室中,上层小室加入细胞悬液500 μL,下层加入1 mL含10%胎牛血清的RPMI 1640培养基。接种后隔天更换培养液,至细胞完全融合为单层,换成无血清培养基继续培养12 h。予EGFR抑制剂AG-1478(10 μmol/L)预处理1 h后,加入400 U/mL的HDM刺激细胞,同时以未加细胞悬液的小室作为空白组,每个组设3个复孔。37 ℃、5% CO2培养箱内孵育培养24 h后,Millicell-ERS跨细胞电阻仪的长短两片电极分别置于Transwell培养皿的的下层和上层小室并悬空浸没于培养液液面以下,待数据显示稳定后,测定各组的跨膜电阻值。TER(Ω×cm2)=(样本TER值-空白组TER值)× Transwell培养皿上层小室面积(cm2)
1.4 EGFR抑制剂AG-1478对16HBE细胞单层右旋糖酐(FITC-DX)透过率的影响16HBE细胞接种在24孔Transwell插入式培养皿的上层小室中,上层小室加入细胞悬液200 μL,下层加入600 μL含10%胎牛血清的RPMI 1640培养基。接种后隔天更换培养液,培养至细胞完全融合为单层后,将培养基换成无血清培养基继续培养12 h,予EGFR抑制剂AG-1478(10 μmol/L)预处理1 h后,加入400 U/mL的HDM刺激细胞,同时以未加细胞悬液的小室作为空白组,每个组设3个复孔,37 ℃、5% CO2培养箱内孵育培养24 h后,弃培养液,加200 μL无酚红的RPMI 1640培养基(内含0.5 mg/mL的FITC-DX)于上层小室,加600 μL无酚红的RPMI 1640培养基(不含FITC-DX)于下层小室,37 ℃、5% CO2培养箱内孵育90 min,再分别从每个上层和下层小室取100 μL液体,加入黑色避光96孔板中,用Infinite M200PRO-光栅型多功能酶标仪(TECAN公司,瑞士)测定嵌套小室上下双层的荧光值,激发光波长495 nm,发射光波长520 nm。支气管上皮细胞单层对FITC-DX通透性大小可用通透系数(apparent permeability coefficient, Pa)表示,按以下公式计算:Pa%=[A]/t×1/A×V/ [L]×100%。其中[A]为嵌套小室下层荧光值,t为FITC-DX孵育时间(以秒计算),A为嵌套小室滤膜面积,即FITC-DX滤过面积(以cm2计算),V为嵌套小室下层液体量,[L]为嵌套小室上层荧光值。
1.5 Western blotting方法检测HDM对16HBE细胞粘附连接蛋白E-cadherin、β-catenin和F-actin及磷酸化(p-)EGFR蛋白表达的影响将16HBE细胞接种到60 mm的细胞培养皿中,待细胞融合至90%时,将10%胎牛血清的RPMI 1640培养基换成不含血清RPMI 1640培养基继续培养12 h。加入EGFR抑制剂AG-1478预处理后,HDM刺激处理相应的时间后,弃培养液,预冷的PBS缓冲液清洗2次,再根据凯基全蛋白提取试剂盒操作说明提取全蛋白细胞裂解液,并按照Bradford法测定所提取蛋白浓度。灌制浓度为10% SDS-聚丙烯酰胺凝胶,按每孔40 μg蛋白上样,采用美国BIO-RAD电泳仪进行电泳、转膜,用5%脱脂奶粉液室温封闭2 h,使用E-cadherin抗体按1: 1000稀释、β-catenin抗体按1:1000稀释、F-actin抗体按1:1000稀释、EGFR抗体按1:1000稀释和p-EGFR抗体按1:1000稀释,并4 ℃摇床孵育过夜。第2天,TBST液体洗膜,室温孵育二抗1 h,兔、鼠二抗均按1:1000稀释,再用TBST液体洗膜,使用化学发光法显影。以β-actin为参照蛋白,使用Image J软件分析目的条带的灰度值。
1.6 免疫荧光检测16HBE细胞粘附连接蛋白E-cadherin、β-catenin及F-actin的分布情况将16HBE细胞接种在15 mm的Glass Bottom Cell Culture Dish中,待细胞融合至90%时,将10%胎牛血清的RPMI 1640培养基换成不含血清RPMI 1640培养基继续培养12 h。加入EGFR抑制剂AG-1478预处理后,HDM刺激处理相应的时间后,弃培养液,预冷的PBS缓冲液清洗2次,用预冷的4%多聚甲醛固定30 min,5%牛白蛋白组分V(PBS配置)室温封闭2 h,其间用预冷的PBS清洗。使用E-cadherin抗体按1:100稀释、β-catenin抗体按1:100稀释,荧光二抗1:1000稀释,37 ℃敷育40 min,而F-actin应用CytoPainter PhalloidiniFlour 488 Reagent 1:500稀释,37 ℃敷育90 min,DAPI染核10 min,使用激光共聚焦显微镜FV10-ASW 4.0 Viewer拍照并处理图像。
1.7 统计分析实验数据以均数±标准差表示,采用SPSS 20.0统计软件,比较采用单因素方差分析(one-way ANOVA),符合方差齐性检验者,使用Bonferonni方法分析,不符合方差齐性检验者,使用Dunnett's T3分析,以P < 0.05表示差异有统计学意义。
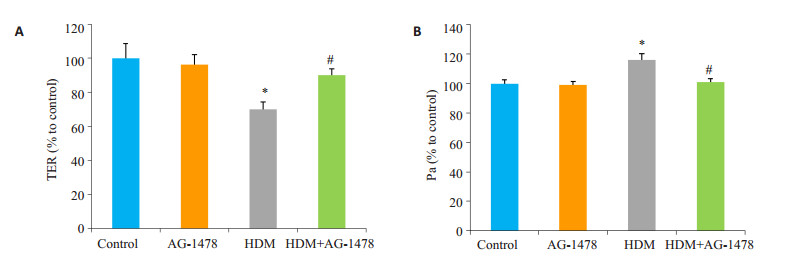
2 结果 2.1 EGFR相关信号通路参与HDM诱导的气道上皮高通透性与Control组相比较,HDM组TER值显著降低(P < 0.05,图 1),FITC-DX透过率显著增高(P < 0.05)。而与HDM组相比较,AG-1478+HDM组TER值(P < 0.05)和FITC-DX透过率(P < 0.05)均得到明显改善。
|
图 1 TER图及FITC-DX图检测气道上皮屏障的通透性 Figure 1 Assessment of the permeability of the bronchial epithelium based on TER (A) and FITC-DX (B). *P < 0.05 vs control group, #P < 0.05 vs HDM group. |
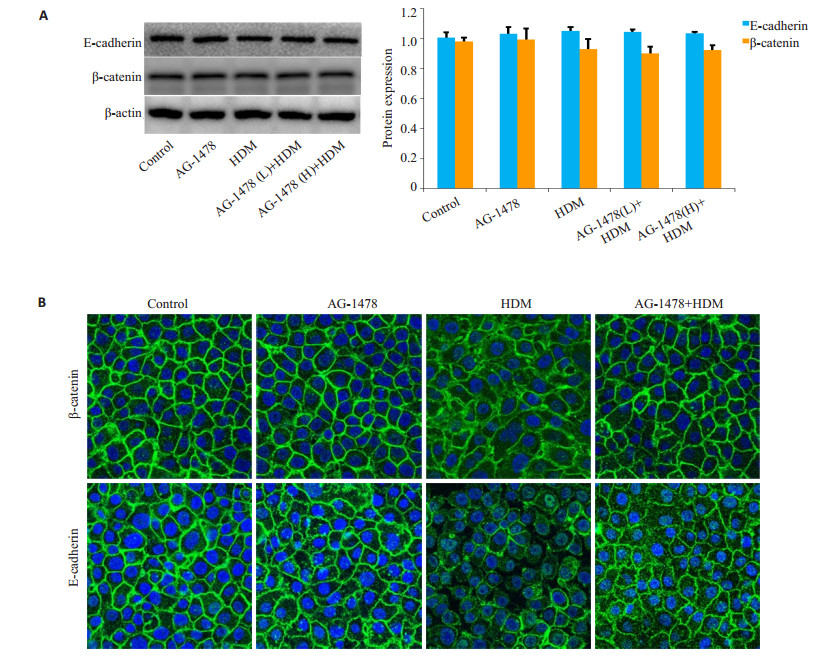
E-cadherin及β-catenin的蛋白表达水平在各组间无显著统计学差异(P>0.05,图 2A)。免疫荧光结果(图 2B)示,与Control组相比较,HDM组E-cadherin及β-catenin出现分布异常,细胞膜上蛋白分布呈不连续状态,并可见部分由胞膜向胞浆中弥散。予AG-1478预处理后可明显改善HDM诱导的E-cadherin及β-catenin的异常分布。
|
图 2 检测E-cadherin及β-catenin的表达和分布情况 Figure 2 E-cadherin or β-catenin expressions and localizations in different groups detected with Western blotting (A) and immunofluorescence staining (B, original magnification: ×60). L: 10 μmol/L; H: 100 μmol/L. |
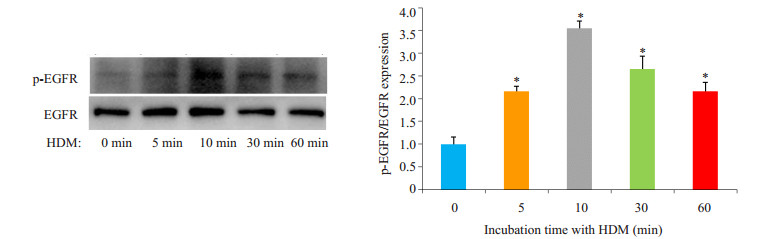
以浓度为400 U/mL的HDM刺激16HBE细胞,HDM刺激细胞后,p-EGFR的表达明显增多,并以10 min时最为明显(P < 0.05,图 3)。
|
图 3 Western blotting法检测EGFR磷酸化情况 Figure 3 Phosphorylation of EGFR assessed by Western blotting. *P < 0.05 vs HDM group at 0 min. |
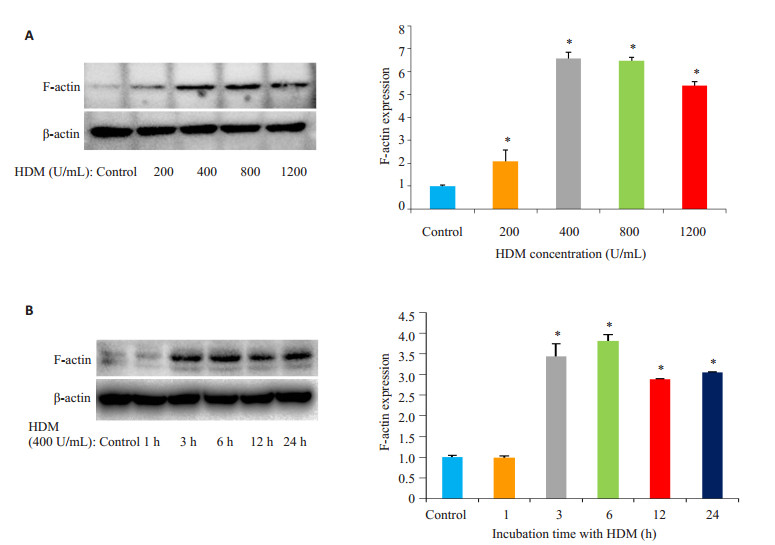
首先比较不同浓度的HDM刺激16HBE细胞,作用24 h,检测对F-actin的蛋白水平的影响,与正常Control组相相比,不同浓度HDM均可促进F-actin蛋白表达增加,且在HDM浓度为400 U/mL时F-actin的蛋白表达增加最明显(P < 0.05,图 4A)。予浓度为400 U/mL的HDM刺激16HBE细胞,和Control组相比较,HDM组在3 h开始可见明显的F-actin蛋白表达增加,并以刺激6 h时表达增加最明显(P < 0.05,图 4B)。因此HDM可促进F-actin蛋白表达增加。同样,予浓度为400 U/mL的HDM刺激细胞24 h后观察其对F-actin蛋白在细胞上分布位置的影响,与Control组相比较,HDM刺激后,F-actin表达增加,并发生重新排布,表现为F-actin分布更加集中、紧密,且更有方向性(图 5B)。
|
图 4 Western blotting法检测F-actin蛋白的表达情况 Figure 4 Western blotting for detecting F-actin expression in the cells treated with HDM at different concentrations (A) and with 400 U/mL HDM for different time (B). *P < 0.05 vs control group. |
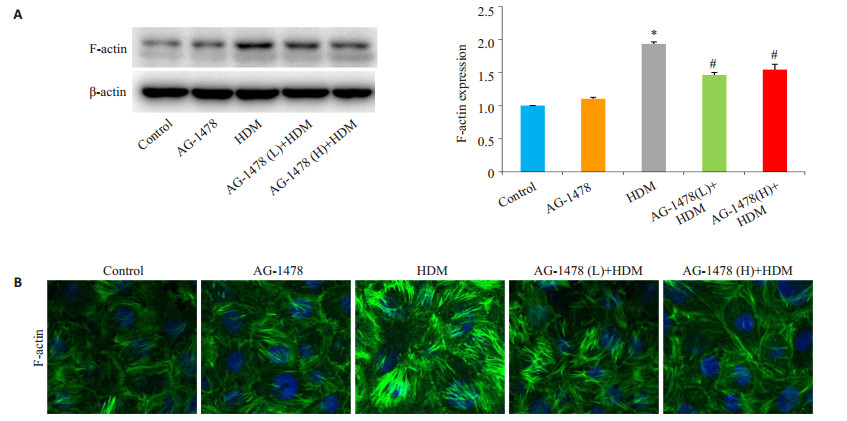
|
图 5 检测F-actin的表达及分布情况 Figure 5 Detection of F-actin expression with Western blotting (A) and F-actin rearrangement with immunofluorescence staining (B, ×60) in the cells. L: 10 μmol/L; H: 100 μmol/L. *P < 0.05 vs control group, #P < 0.05 vs HDM group. |
使用不同浓度EGFR抑制剂AG-1478(10,100 μmol/L)预处理细胞1 h后,予HDM(400 U/mL)刺激细胞24 h后检测F-actin的蛋白表达及其在细胞上的分布情况。与Control组相比较,HDM组F-actin蛋白表达明显增加(P < 0.05,图 5A),而不同浓度的AG-1478预处理后,F-actin蛋白表达均明显降低(P < 0.05),因此EGFR信号可介导HDM诱导的F-actin表达增多。与HDM组相比,不同浓度AG-1478(10,100 μmol/L)预处理1 h后,F-actin的表达均明显减少,其分布与Control组相似,明显改善了HDM所诱导的F-actin重新排布(图 5B)。
3 讨论本研究在体外证明了EGFR相关信号通路参与了HDM介导的F-actin重新排布,并导致气道上皮屏障破坏。
哮喘是一种异质性疾病,关于其发病机制尚有待进一步阐明,气道屏障破坏与哮喘发病关系密切,气道上皮屏障破坏主要表现为上皮细胞高通透性及上皮连接分子E-cadherin等蛋白分布异常。与前期研究[18]一致的是,本研究结果提示HDM可以导致气道上皮TER值下降、FITC-DX透过率的升高及上皮粘附连接蛋白E-cadherin及β-catenin分布明显异常,由胞膜向胞浆弥散。因此,表明HDM可导致气道上皮屏障的破坏。
在哮喘患者中EGFR表达增多,并与哮喘气道重塑及气道高反应性[8]均息息相关,哮喘相关的炎症介质如TNF-α可激活EGFR相关信号通路[7]。香烟提取物可调节EGFR调节气道上皮细胞的粘液蛋白MUC5AC的表达[19]。有研究表明,抑制EGFR后可明显改善HDM所导致的气道上皮高通透性和连接蛋白的分布异常[9],提示EGFR相关信号通路在哮喘气道屏障破坏中亦起了关键作用,我们加入EGFR的抑制剂AG-1478可明显改善HDM诱导的TER值的下降、FITC-DX透过率的升高及粘附连接蛋白E-cadherin及β-catenin分布异常。同样,HDM可引起p-EGFR的升高,表明EGFR相关信号通路介导了HDM诱导的气道上皮屏障的破坏。
然而,EGFR相关信号通路是如何参与HDM导致的气道上皮屏障的破坏呢?其机制尚不明确。F-actin是真核细胞中的细胞骨架的重要组分[20],气道上皮细胞的研究表明,假单胞菌的弹性蛋白酶通过调节连接蛋白破坏及细胞骨架F-actin的重新排布的机制参与气道上皮细胞的高通透性[16]。循环牵张通过F-actin的重新排布下调p-120介导肺泡上皮屏障的破坏[21]。脓毒症以F-actin依赖方式增加肺泡上皮的通透性[22]。同样,原肌球蛋白-1通过稳定F-actin从而保护烟草提取物破坏的肺泡上皮细胞间的连接[23]。提示F-actin在气道上皮屏障中的重要作用。本研究发现HDM刺激16HBE细胞可明显增加F-actin的蛋白表达,免疫荧光结果亦提示HDM可明显促使F-actin的重新排布,表现为F-actin分布更加集中、紧密,且更有方向性。因此,本研究假设F-actin的重新排布是EGFR相关信号通路参与HDM导致气道上皮屏障破坏的机制。为证实这一点,本研究发现加入不同浓度EGFR的抑制剂AG-1478预处理后,结果提示HDM所导致的F-actin表达增多及其重新排布得到明显的改善,且不同浓度抑制剂预处理组间无明显差异性,此结果与抑制EGFR可以改善HDM诱导的气道上皮屏障功能破坏相一致。提示我们EGFR相关信号通过调节的F-actin的重排参与HDM导致的气道上皮屏障的破坏过程。同时,这与Hu发现在肠道上皮中EGFR可以调节F-actin重新排布从而增加肠道上皮对病毒的通透性[17]的结果类似。
那么F-actin是如何调节屏障的破坏呢?大量的研究表明TNF-α通过调节F-actin的解聚及合成参与血管内皮屏障的破坏[24]。一方面,当细胞受到内毒素等有害物质刺激时,F-actin的蛋白水平表达增加并发生重新排布,重排后F-actin分布更集中且具有方向性,使得细胞的张力增加,从而引起屏障功能的破坏[13, 25]。另一方面,细胞骨架F-actin与E-cadherin及β-catenin复合物相结合,从而维持其稳定状态,形成完整的屏障结构,而F-actin的重新排布可导致E-cadherin及β-catenin复合物稳定性破坏,使其分布发生异常,细胞-细胞连接受损,从而导致屏障结构及功能异常[12-14, 25]。我们的研究也表明HDM组F-actin的表达更多,分布更加集中且具有方向性,同时EGFR信号的抑制剂保护HDM诱导的粘附连接蛋白E-cadherin及β-catenin分布异常和F-actin的重新分布。因此本研究阐明了EGFR相关信号通路在哮喘气道屏障中的作用机制,即EGFR相关信号通路可以通过调节F-actin的表达增多及其重新排布从而参与HDM所诱导的气道上皮屏障破坏。
本研究仍有一定的局限性,一方面,本研究仅局限于体外实验,我们仍需要在HDM诱导小鼠哮喘模型中进一步验证EGFR与F-actin的关系;另一方面,关于EGFR是如何介导HDM所导致的F-actin表达增多及重新排布还需进一步阐明,有研究表明EGFR可介导多种信号分子如p-FAK-Tyr(407)、cofilin、PI3K/Akt及Rho的活化[9, 17, 26],提示EGFR信号可能是通过激活这些下游的信号通路从而调节了F-actin的重新排布,介导气道上皮屏障的破坏。
总之,本研究证明了HDM通过EGFR相关信号通路促进F-actin表达增加并发生重新排布,从而引起支气管上皮高通透性及连接蛋白E-cadherin和β-catenin分布异常,为哮喘气道上皮屏障破坏提供了新的机制,从而为以EGFR为靶点的哮喘治疗方案提供了新的依据。
| [1] | Huang C, Dong H, Zou M, et al. Bevacizumab reduced auto-phosphorylation of VEGFR2 to protect HDM-induced asthma mice[J]. Biochem Biophys Res Commun, 2016, 478(1): 181-6. DOI: 10.1016/j.bbrc.2016.07.072. |
| [2] | Georas SN, Rezaee F. Epithelial barrier function: at the front line of asthma immunology and allergic airway inflammation[J]. J Allergy Clin Immunol, 2014, 134(3): 509-20. DOI: 10.1016/j.jaci.2014.05.049. |
| [3] | Hammad H, Lambrecht BN. Barrier epithelial cells and the control of type 2 immunity[J]. Immunity, 2015, 43(1): 29-40. DOI: 10.1016/j.immuni.2015.07.007. |
| [4] | Nawijn MC, Hackett TL, Postma DS, et al. E-cadherin: gatekeeper of airway mucosa and allergic sensitization[J]. Trends Immunol, 2011, 32(6): 248-55. DOI: 10.1016/j.it.2011.03.004. |
| [5] | Choi JP, Lee SM, Choi HI, et al. House dust Mite-Derived chitin enhances Th2 cell response to inhaled allergens, mainly via a TNF-alpha-Dependent pathway[J]. Allergy Asthma Immunol Res, 2016, 8(4): 362-74. DOI: 10.4168/aair.2016.8.4.362. |
| [6] | Wang X, Saito J, Ishida T, et al. Polymorphism of egfr intron1 is associated with susceptibility and severity of asthma[J]. J Asthma, 2006, 43(9): 711-5. DOI: 10.1080/02770900600925247. |
| [7] | Burgel PR, Nadel JA. Epidermal growth factor receptor-mediated innate immune responses and their roles in airway diseases[J]. Eur Respir J, 2008, 32(4): 1068-81. DOI: 10.1183/09031936.00172007. |
| [8] | Le Cras TD, Acciani TH, Mushaben EM, et al. Epithelial EGF receptor signaling mediates airway hyperreactivity and remodeling in a mouse model of chronic asthma[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 300(3): L414-21. DOI: 10.1152/ajplung.00346.2010. |
| [9] | Heijink IH, van Oosterhout A, Kapus A. Epidermal growth factor receptor signalling contributes to house dust mite-induced epithelial barrier dysfunction[J]. Eur Respir J, 2010, 36(5): 1016-26. DOI: 10.1183/09031936.00125809. |
| [10] | Normoyle KP, Brieher WM. Cyclase-associated protein (CAP) acts directly on F-actin to accelerate cofilin-mediated actin severing across the range of physiological pH[J]. J Biol Chem, 2012, 287(42): 35722-32. DOI: 10.1074/jbc.M112.396051. |
| [11] | Kuwahara M. Role of[Ca(2+)]i and F-actin on mesothelial barrier function[J]. Front Physiol, 2014, 5: 232. |
| [12] | Clements RT, Minnear FL, Singer HA, et al. RhoA and Rho-kinase dependent and Independent signals mediate TGF-beta-induced pulmonary endothelial cytoskeletal reorganization and permeability[J]. Am J Physiol Lung Cell Mol Physiol, 2005, 288(2): L294-306. |
| [13] | Joshi AD, Dimitropoulou C, Thangjam G, et al. Heat shock protein 90 inhibitors prevent LPS-induced endothelial barrier dysfunction by disrupting RhoA signaling[J]. Am J Respir Cell Mol Biol, 2014, 50(1): 170-9. |
| [14] | Vouret-Craviari V, Boquet P, Pouysségur J, et al. Regulation of the actin cytoskeleton by thrombin in human endothelial cells: role of Rho proteins in endothelial barrier function[J]. Mol Biol Cell, 1998, 9(9): 2639-53. DOI: 10.1091/mbc.9.9.2639. |
| [15] | Ye X, Sun M. AGR2 ameliorates tumor necrosis factor-alphainduced epithelial barrier dysfunction via suppression of NF-kappaB p65-mediated MLCK/p-MLC pathway activation[J]. Int J Mol Med, 2017, 39(5): 1206-14. |
| [16] | Clark CA, Thomas LK, Azghani AO. Inhibition of protein kinase C attenuates Pseudomonas aeruginosa elastase-induced epithelial barrier disruption[J]. Am J Respir Cell Mol Biol, 2011, 45(6): 1263-71. DOI: 10.1165/rcmb.2010-0459OC. |
| [17] | Hu W, Zhu L, Yang X, et al. The epidermal growth factor receptor regulates cofilin activity and promotes transmissible gastroenteritis virus entry into intestinal epithelial cells[J]. Oncotarget, 2016, 7(11): 12206-21. |
| [18] | 高元妹, 夏旸, 沈湘波, 等. 屋尘螨对支气管上皮细胞通透性的影响[J]. 中华哮喘杂志:电子版, 2011, 5(6): 394-7. |
| [19] | Kanai K, Koarai A, Shishikura Y, et al. Cigarette smoke augments MUC5AC production via the TLR3-EGFR pathway in airway epithelial cells[J]. Respir Investig, 2015, 53(4): 137-48. DOI: 10.1016/j.resinv.2015.01.007. |
| [20] | Von Der Ecken J, Mueller M, Lehman WA, et al. Structure of the F-actin-tropomyosin complex[J]. Nature, 2015, 519(7541): 114-7. |
| [21] | Wang YE, Minshall RD, Schwartz DE, et al. Cyclic stretch induces alveolar epithelial barrier dysfunction via calpain-mediated degradation of p120-catenin[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 301(2): L197-206. DOI: 10.1152/ajplung.00048.2011. |
| [22] | Cohen TS, Dipaolo BC, Lawrence GG. Sepsis enhances epithelial permeability with stretch in an actin dependent manner[J]. PLoS One, 2012, 7(6): e38748. DOI: 10.1371/journal.pone.0038748. |
| [23] | Gagat M, Grzanka D, Izdebska M, et al. Tropomyosin-1 protects transformed alveolar epithelial cells against cigaret smoke extract through the stabilization of F-actin-dependent cell-cell junctions[J]. Acta Histochem, 2016, 118(3): 225-35. DOI: 10.1016/j.acthis.2016.01.003. |
| [24] | Goldblum SE, Ding X, Campbell-Washington J. TNF-alpha induces endothelial cell F-actin depolymerization, new actin synthesis, and barrier dysfunction[J]. Am J Physiol, 1993, 264(4 Pt 1): C894-905. |
| [25] | Bogatcheva NV, Zemskova MA, Poirier C, et al. The suppression of myosin light chain (MLC) phosphorylation during the response to lipopolysaccharide (LPS): beneficial or detrimental to endothelial barrier[J]. J Cell Physiol, 2011, 226(12): 3132-46. DOI: 10.1002/jcp.22669. |
| [26] | Wan HT, Mruk DD, Wong CK, et al. Perfluorooctanesulfonate (PFOS) perturbs male rat sertoli cell Blood-Testis barrier function by affecting F-Actin organization via p-FAK-Tyr(407): an in vitro study[J]. Endocrinology, 2014, 155(1): 249-62. DOI: 10.1210/en.2013-1657. |
 2017, Vol. 37
2017, Vol. 37

