2. 湖北医药学院 生物医学工程学院,湖北 十堰 442000;
3. 湖北医药学院 胚胎干细胞湖北省重点实验室,湖北 十堰 442000
2. School of Biomedical Engineering, Hubei University of Medicine, Shiyan 442000, China;
3. Hubei Provincial Key Laboratory of Embryonic Stem Cell Research, Hubei University of Medicine, Shiyan 442000, China
胚胎植入是妊娠中至关重要的一步,在植入的过程中,胚胎需要被母体的子宫内膜识别、接受、最终完成植入[1]。母体子宫内膜只在一小段时间内可完成胚胎的植入,即“子宫接受态”或“种植窗”期[2]。胚胎的质量和接受态的子宫内膜对于胚胎的成功植入都是不可或缺的。研究表明约50%的体外受精胚胎移植失败都与子宫内膜接受态的异常有关[3]。子宫内膜蜕膜化,即子宫内膜基质细胞发生的蜕膜化。在人类,基质细胞蜕膜化的发生并不依赖于胚胎的植入[4],但在小鼠,蜕膜化开始于胚胎植入后[5],子宫内膜基质细胞的蜕膜化可保护、营养胚胎,参与妊娠的维持[6]。
组蛋白甲基化是表观遗传学重要的修饰之一,主要在异染色质形成、基因印记、X染色体失活和转录调控等方面发挥作用[7],而这些生物学进程与生殖密切相关。组蛋白甲基化修饰是由组蛋白甲基转移酶和去甲基转移酶共同作用,参与和维持组蛋白的甲基化状态,继而通过多种分子参与对甲基化的识别而作用于下游事件的发生。BIX01294(BIX)是一种小分子化合物,可特异性抑制EHMT2甲基转移酶的活性,抑制相关靶基因区组蛋白的甲基化,降低组蛋白H3的表达水平[8]。
目前关于子宫内膜和组蛋白甲基化的研究主要集中在DNA甲基化在人子宫内膜癌中的作用和分子机制的探讨[9],但有关组蛋白甲基化酶抑制剂BIX对子宫内膜基质细胞和蜕膜细胞中的作用研究尚未见报道。因此,本文对分离培养得到的小鼠子宫内膜基质细胞BIX处理,探讨BIX在小鼠内膜基质细胞和蜕膜化细胞中的适宜浓度和对细胞的作用,为BIX在实验动物研究,包括在小鼠子宫内膜基质细胞中的运用提供实验基础,为临床胚胎的植入提供更多的理论依据。
1 材料和方法 1.1 材料 1.1.1 实验动物SPF级CD1小鼠雄鼠5只,雌鼠50只,由北京维通利华实验动物技术有限公司提供[SCXK(京)2012-0001],本实验在湖北医药学院动物中心进行[SYXK(鄂)2011-0031],动物饲养管理严格按照中华人民共和国科技部实验动物管理规范,并按照3R原则给予人道关怀。
1.1.2 主要试剂DMEM/HIGH GLOUSE培养基(Hyclone),青链霉素(Thermo fisher),胎牛血清FBS、HBSS(1×)(Gibco),胰蛋白酶(Sigma),分散酶、Ⅰ型胶原酶(Roche),17β-雌二醇(Sigma),孕酮(Sigma),TRIzol(Invitrogen),异丙醇(东京化成工业,日本),鼠抗Vimentin抗体、鼠抗CK18抗体(Abcam抗体,上海),驴抗小鼠荧光二抗568(Abcam抗体,上海),无水乙醇,Triton-100(Sigma),BIX-01294(MCE,中国),反转录试剂盒Super Script III First-Strand(Invitrogen)Fast Sybgreen(Applied biosystems)。
1.2 方法 1.2.1 小鼠子宫内膜基质细胞原代培养选取性成熟的雌鼠和雄鼠4:1比例合笼,次日检查阴道栓,见栓当天记为妊娠第0.5天。第3.5天取小鼠子宫,纵向剖开,将组织剪成小块,含P/G HBSS清洗3次,125 mg/mL胰蛋白酶和60 mg/mL分散酶4 ℃消化1 h,室温消化1 h,37 ℃消化10 min,期间每20 min摇晃1次。10% FBS HBSS吹打终止,含P/G HBSS清洗置换出血清,5 mg/mL胶原酶Ⅰ 37 ℃消化30 min,每10 min摇晃1次。10% FBS/HBSS反复吹打终止,200目筛网过滤,取滤液10 μL细胞计数,余1500 r/min 10 min离心。弃上清,保留管底细胞沉淀,按所需的细胞密度重悬细胞,10% FBS DMEM P/G接种,37 ℃ 5% CO2培养箱培养,1 h后观察细胞贴壁情况,换液。
1.2.2 体外雌孕激素诱导基质细胞蜕膜化基质细胞生长至70% ~80%时,吸去原培养基,加入含2% FBS DMEM P/G,清洗细胞2次。配制含孕酮P4 1 μmol/L和雌二醇E2 10 nmol/L的2% FBS DMEM P/G,对照组加入含2% FBS DMEM P/G培养基,15 μmol/L BIX处理组加入含15 μmol/L BIX浓度的2% FBS DMEM P/ G培养基,激素处理组加入含P4 + E2的2% FBS DMEM P/G,激素加BIX处理组加入含15 μmol/L BIX浓度的P4+E2的2% FBS DMEM P/G培养基。记录入箱时间,分别在0、24、48、72、96 h拍照,收集细胞。
1.2.3 划痕法检测细胞迁移细胞生长至80%~90%时,DMEM P/G培养基清洗细胞3次。每孔加2 mL DMEM P/G培养过夜,12 h后用200 μL Tip头在6孔板中央处竖直画一直线,使划痕处细胞脱落,同时换用0、10、15、20 μmol/L BIX浓度梯度的10% FBS DMEM P/ G培养液继续培养,加BIX后分别在0、12、24 h同一位置拍照。
1.2.4 RNA提取TRIzol收细胞于1.5 mL EP管中,静置5 min后加氯仿200 μL,大力震荡混匀,室温孵育3 min,13 000 r/min 15 min 4 ℃离心,取上层水相转移至一新EP管中。再次加入氯仿200 μL,大力震荡混匀,室温孵育3 min,13 000 r/min 15 min 4 ℃离心。取上层水相转移至一新EP管中,加入等体积的异丙醇,涡旋5~10 s,室温孵育10 min,13 000 r/min 10 min 4 ℃离心,弃上清,加入DEPC水配制的75%乙醇,涡旋混匀,弃上清,冰上干燥5~10 min,加入适量DEPC水溶解RNA,Nanodrop测浓度,1.2%琼脂糖凝胶电泳评估RNA质量,-80 ℃冰箱保存。
1.2.5 免疫荧光鉴定小鼠子宫内膜基质细胞基质细胞接种培养48 h后去培养液,1× PBS清洗3次,4%多聚甲醛固定细胞20 min,1 × PBS清洗3次,0.2% Triton-100室温孵育30 min,1× PBS清洗3次,1% BSA 500 μL 37 ℃ 1 h孵育,加1% BSA配置的一抗Vimentine(1:150)、CK18(1:150),4 ℃过夜,1×PBS清洗3次,荧光二抗驴抗小鼠568(1:200)室温避光孵育1 h,1×PBS清洗3次,用具有DAPI的荧光介质封片载玻片,荧光显微镜观察拍照。
1.2.6 Real-time PCR检测mRNA的表达取500 ng RNA在10 μL混合体系中(Invitrogen)逆转录为cDNA,Real time PCR在5 μL反应体系包括2.5 μL Fast SYBR Green,0.1 μL cDNA,0.4 μL正反引物(引物设计名称及序列如下),及2 μL纯水,PCR反应条件为95 ℃预变性10 min,(95 ℃ 15 s,56 ℃ 1 min)重复40个循环。由于GAPDH属于管家基因,在组织中的表达恒定,故用来做内参。Abp1为蜕膜化标志分子,在蜕膜化组织中高表达,用来做阳性对照。
1.3 统计学处理所有数据以均数±标准差表示,每个样本设置重复3~5次,数据最后的统计学分析采用SPSS 18.0软件进行分析,两组间比较采用t检验,多组间的比较采用单因素方差分析,两两比较采用Dunnet t检验,P < 0.01表示差异具有统计学意义。
| 表 1 设计引物的名称及序列 Table 1 Sequence of the primers used for amplification of the target genes |
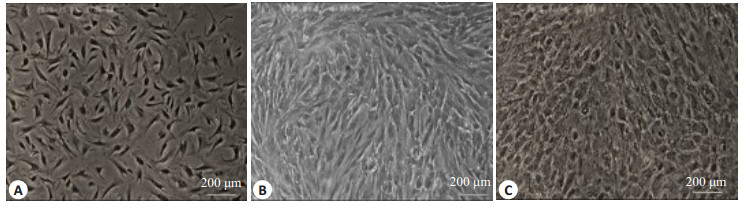
小鼠子宫内膜基质细胞培养24 h后,细胞生长至70%~80%,倒置显微镜下观察,小鼠子宫内膜基质细胞呈长梭形,类成纤维细胞形态,多平行排列,外形轮廓不太清晰(图 1A)。给予雌激素加孕激素诱导蜕膜化,72 h后可见未加激素处理的对照组细胞仍为长梭形,纤维细胞形态(图 1B),而激素处理组细胞变大变圆明显,即蜕膜化细胞(图 1C)。
|
图 1 不同时期小鼠子宫内膜基质细胞及蜕膜化细胞形态 Figure 1 Morphology of mouse endometrial stromal cells and decidualized cells at different time points. A: Adherent cells at 24 h; B: Adherent control cells at 72 h; C: Adherent cells with induced decidualization at 72 h. |
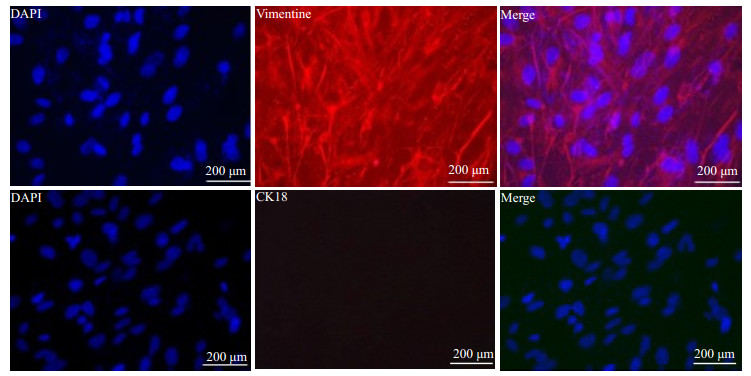
采用在基质细胞中特异性表达的Vimentin抗体和在上皮细胞中特异性表达的CK18抗体进行免疫荧光鉴定,Vimentin抗体和CK18抗体阳性染色均为红色荧光,主要表达在胞质,而DAPI染色为蓝色荧光,主要表达在细胞核。由图 2可知,分离培养得到的小鼠子宫内膜基质细胞Vimentin抗体染色为阳性,而CK18抗体染色为阴性。说明我们分离培养的小鼠子宫内膜基质细胞纯度较高,能够用于相关检测。
|
图 2 利用Vimentin和CK18抗体鉴定分离培养的小鼠子宫内膜基质细胞纯度 Figure 2 Identification of the purity of mouse endometrial stromal cells using vimentin and CK18 antibodies. |
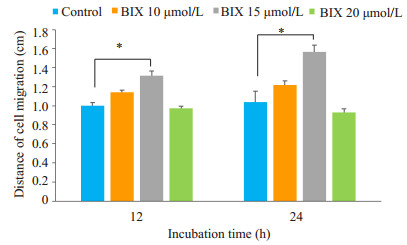
基质细胞生长至80%~90%后,给予饥饿后划痕处理,添加0、10、15、20 μmol/L的浓度梯度BIX处理细胞。BIX处理小鼠子宫内膜基质细胞24 h后,部分细胞已接近汇合(图 3,4)。以0 μmol/L为对照,当0 μmol/L < BIX≤15 μmol/L时,BIX对小鼠子宫内膜基质细胞的迁移有促进作用,单位时间内迁移距离0 μmol/L < 10 μmol/L < 15 μmol/L(P < 0.01)。与对照组相比,15 μmol/L BIX处理组的细胞在12 h(图 3B3)及24 h(图 3C3)划痕距离明显缩短,细胞迁移距离明显,差异具有统计学意义(图 4,P < 0.01)。BIX浓度提高到20 μmol/L时,细胞有迁移现象,迁移距离较对照组略有升高,但明显低于15 μmol/L处理组(P < 0.01);且此时细胞开始出现死亡,说明该浓度BIX对细胞有毒性作用。

|
图 3 细胞划痕法检测不同浓度药物处理下0,12,24 h小鼠子宫内膜基质细胞的迁移 Figure 3 Migration of mouse endometrial stromal cells treated with different concentrations of BIX at 0, 12, 24 h in cell scratching assay. |
|
图 4 不同浓度BIX对小鼠子宫内膜基质细胞迁移距离的影响 Figure 4 Effect of different concentrations of BIX on migration distance of mouse endometrial stromal cells. *P < 0.01. |
为研究BIX处理对小鼠子宫内膜基质细胞迁移过程中Ehmt2 mRNA表达的影响,收集对照组和BIX处理24 h组细胞做实时荧光定量PCR检测Ehmt2 mRNA的表达。结果显示,与对照组相比,BIX处理24 h后Ehmt2 mRNA表达显著下调,差异具有统计学意义(P < 0.01,图 4)。
2.5 BIX对体外诱导小鼠子宫内膜基质蜕膜化的作用小鼠子宫内膜基质细胞可经雌孕激素诱导发生蜕膜化为蜕膜化细胞,为研究BIX对小鼠子宫基质细胞蜕膜化的影响,在基质细胞生长至70%~80%时,将细胞分为4组,分别给予2% FBS(对照组)、2% FBS+15 μmol/L BIX、2%FBS+E+P、2% FBS+E+P+15 μmol/L BIX处理72 h,在0、24、48、72 h分别拍照,结果如下图(图 5):以2% FBS处理组为对照,细胞呈长梭状,轮廓较不清晰(图 5A1);2% FBS+15 μmol/L BIX处理后,细胞形态略变短,变圆(图 5B2、C2、D2);采用2% FBS+E+P诱导细胞蜕膜化,可见细胞较对照组明显变大、变圆(图 5B3、C3、D3);而经2% FBS+E+P+15 μmol/L BIX处理后,细胞形态和蜕膜化组细胞形态类似(图 5B4、C4),但蜕膜化处理72 h,可见雌激素加孕激素诱导蜕膜化组和雌激素加孕激素联合15 μmol/L BIX处理组细胞形态略不同:蜕膜化组细胞(图 5D3)均变大,变圆,形态变化明显;雌孕激素联合15 μmol/L BIX处理组细胞(图 5D4)部分细胞明显变大变圆,其他部分细胞仍维持基质细胞形态。

|
图 5 细胞分别给予2%FBS、2%FBS+BIX、2%FBS+E+P、2%FBS+E+P+BIX处理,0,24,48,72 h细胞拍照,观察细胞形态的变化 Figure 5 Morphology of the cells at 0, 24, 48 and 72 h after treatment with 2% FBS, 2% FBS+BIX, 2% FBS+E+P, and 2% FBS+E+ P+BIX. |
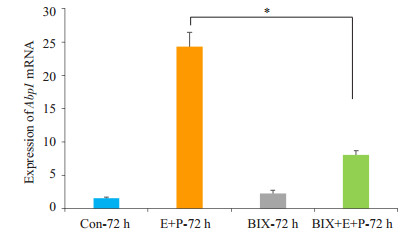
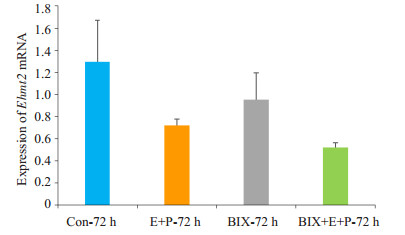
为验证雌孕激素诱导基质细胞发生蜕膜化模型是否制作成功,使用RT-PCR鉴定蜕膜化标记分子Abp1[10](图 6),雌孕激素联合处理72 h后Abp1 mRNA的表达较对照组显著升高(图 6),说明雌孕激素诱导小鼠子宫内膜基质细胞蜕膜化这个模型是成功的。同时,以雌孕激素处理72 h为对照,BIX加雌孕激素联合处理72 h后,Abp1 mRNA的表达显著降低,差异明显,P < 0.01,说明BIX对小鼠子宫内膜基质细胞蜕膜化过程有抑制作用。同时检测模型中Ehmt2 mRNA,以未做处理组为对照,BIX处理72 h后,Ehmt2 mRNA表达下调。但以雌孕激素处理72 h为对照,经15 μmol/L BIX加雌孕激素联合处理72 h后,Ehmt2 mRNA表达有下降的趋势(P > 0.05,图 7),差异无统计学意义。
|
图 6 Abp1 mRNA在小鼠子宫内膜基质细胞和蜕膜化细胞不同处理组的相对表达量 Figure 6 Relative expression of Abp1 mRNA in endometrial stroma cells and decidual cells with different treatments. *P < 0.01. |
|
图 7 Ehmt2 mRNA在小鼠子宫内膜基质细胞和蜕膜化细胞不同处理组的相对表达量 Figure 7 Relative expression of Ehmt2 mRNA in endometrial stroma cells and decidual cells with different treatments. |
辅助生殖技术在近二十年取得了巨大的进展,可研究表明胚胎种植失败仍是其主要的限制性因素[11]。现在越来越多的研究集中在植入前的胚胎基因诊断上[12-13],但研究子宫内膜接受态也不失为一种有效的研究方法。
Ehmt2主要参与了常染色质中单甲基和二甲基H3K9表达的水平调控[14],对于胚胎的早期发育和发育过程相关的基因表达调控至关重要[15]。BIX为Ehmt2的特异性抑制剂,可显著降低H3K9的二甲基化水平。在神经母细胞瘤细胞中BIX可抑制细胞的增殖,侵袭和迁移[16]。有研究表明BIX可抑制肿瘤细胞的生长,诱导细胞的凋亡,因此认为BIX有希望作为一种有效的抗肿瘤药物[17]。但同时BIX具有细胞毒性作用,高浓度剂量的BIX可影响细胞的生长,甚至使细胞死亡[18],因此本实验通过对小鼠子宫内膜基质细胞浓度梯度BIX处理,通过对细胞形态学的变化和细胞的迁移距离探讨出在小鼠子宫基质细胞中BIX的适宜浓度,并同时证明了适宜浓度BIX对小鼠子宫内膜基质细胞的迁移是有促进作用的。但这一结果与上述BIX在神经母细胞瘤细胞中的作用相反,推测BIX的作用是否具有种属特异性或者细胞特异性,相关研究还有待进一步阐明。收集BIX处理组细胞,采用Real-time PCR方法分析得,与未处理组基质细胞相比,细胞经BIX处理后Ehmt2 mRNA的表达显著下调,差异具有统计学意义。说明BIX可抑制基质细胞中Ehmt2的表达。
子宫内膜基质细胞是子宫内膜细胞重要成分之一,当胚胎植入后,基质细胞围绕胚胎建立广泛的交流[19],变为蜕膜细胞,这一变化过程对于胚胎的着床和妊娠的维持至关重要。这种改变需要雌孕激素的参与与调节,并开始于子宫内膜分泌中期[20]。为了研究BIX在子宫基质细胞蜕膜化的作用,本实验利用雌孕激素对小鼠子宫内膜基质细胞进行体外诱导蜕膜化得到蜕膜化细胞,通过对基质细胞和蜕膜化细胞分别给予BIX处理可得,BIX可使小鼠子宫内膜基质细胞发生类蜕膜化形态学改变,但使用雌孕激素蜕膜化处理后,BIX处理组蜕膜化细胞形态学变化没有对照组明显,因此我们推测BIX可能有抑制小鼠子宫内膜基质细胞蜕膜化的作用。
在人类,子宫基质细胞的蜕膜化并不依赖于胚胎的存在而存在,但在小鼠子宫中,胚胎种植后蜕膜化才发生[21]。从形态上来说,长梭形的基质细胞体积增大,形态变为多边形或圆形。此外,基因组学和蛋白组学也发生了很大的改变,包括蜕膜化标致性分子,Abp1[10]等分子mRNA的表达显著上调。在基质细胞处理组,通过检测蜕膜化标记性分子Abp1 mRNA的表达可得,对照组基质细胞和BIX处理组基质细胞的Abp1 mRNA的表达未见明显差异,说明BIX使小鼠子宫内膜基质细胞形态学发生的类蜕膜化改变并不是由基质细胞蜕膜化产生的。同时,在雌孕激素诱导基质细胞蜕膜化组,使用BIX处理蜕膜化细胞后,Abp1 mRNA的表达量明显下降,这证明了BIX能够抑制小鼠子宫内膜基质细胞蜕膜化。
当子宫内膜基质细胞发生蜕膜化时,可发生子宫内膜血管通透性的改变,血管生成和血管的重建[22]等生理变化过程,这些过程都有VEGF的参与。在人脐静脉内皮细胞中,BIX可通过抑制抑制VEGF/VEGFR-2信号通路,抑制HIF、VEGF等与血管生成相关分子的表达来抑制细胞迁移和血管管腔的形成[23]。因此我们初步推测BIX可能通过参与VEGF相关信号通路来抑制子宫基质细胞蜕膜化过程,这有可能可解释BIX处理蜕膜化细胞Ehmt2 mRNA表达略有降低这一现象。但VEGF及Ehmt2在蜕膜化中的作用及其相互关系有待进一步的研究和阐明。
因为子宫基质细胞蜕膜化是一个涉及到多因子,多信号通路的参与和调控的动态复杂过程[24],如C/EBPβ,BMP2和Wnt4,FoxO1,IL-11Rα信号通路等[11],目前很多机制尚未研究清楚,这可能是本实验中BIX处理蜕膜化细胞Ehmt2 mRNA的下调水平较BIX处理基质细胞Ehmt2 mRNA表达水平小的原因之一。但目前的研究还不能直接证明BIX在小鼠子宫内膜基质细胞和蜕膜化细胞中的作用与某一分子或明确的信号通路相关,有关BIX在小鼠子宫内膜基质细胞的作用机制还有待进一步的研究。
子宫基质细胞蜕膜化是胚胎着床中至关重要的一步,在雌孕激素的调解下基质细胞转化为蜕膜细胞有利于胚胎的着床[25],但本实验结果表明BIX可抑制基质细胞的蜕膜化过程,因此是不利于胚胎着床的。此外,胚胎种植失败[3],反复自然流产[26]和子宫内膜异位症[27]等都被证明与基质细胞的蜕膜化异常有关。因此,通过本实验可为临床不孕症的治疗提供新的理论基础及研究方向。
综上所述,本文首次提出在小鼠子宫内膜基质细胞实验中BIX的适宜浓度,且初步证明了BIX可促进小鼠子宫内膜基质细胞的迁移,抑制基质细胞的蜕膜化,为BIX在小鼠子宫基质细胞中的作用打下实验基础,为临床子宫接受态的研究提供更多的理论依据。
| [1] | Singh M, Chaudhry P, Asselin E. Bridging endometrial receptivity and implantation: network of hormones, cytokines, and growth factors[J]. J Endocrinol, 2011, 210(1): 5-14. DOI: 10.1530/JOE-10-0461. |
| [2] | Salker M, Teklenburg G, Molokhia M, et al. Natural selection of human embryos: impaired decidualization of endometrium disables embryo-maternal interactions and causes recurrent pregnancy loss[J]. PLoS One, 2010, 5(4): e10287. DOI: 10.1371/journal.pone.0010287. |
| [3] | Salamonsen LA, Nie G, Hannan NJ, et al. Society for reproductive biology founders' lecture 2009. preparing fertile soil: the importance of endometrial receptivity[J]. Reprod Fertil Dev, 2009, 21(7): 923-34. DOI: 10.1071/RD09145. |
| [4] | van Mourik MS, Macklon NS, Heijnen CJ. Embryonic implantation: cytokines, adhesion molecules, and immune cells in establishing an implantation environment[J]. J Leukoc Biol, 2009, 85(1): 4-19. |
| [5] | Quinn CE, Casper RF. Pinopodes: a questionable role in endometrial receptivity[J]. Hum Reprod Update, 2009, 15(2): 229-36. |
| [6] | Menkhorst EM, Lane N, Winship AL, et al. Decidual-secreted factors alter invasive trophoblast membrane and secreted proteins implying a role for decidual cell regulation of placentation[J]. PLoS One, 2012, 7(2): e31418. DOI: 10.1371/journal.pone.0031418. |
| [7] | Fischle W, Wang Y, Allis CD. Histone and chromatin cross-talk[J]. Curr Opin Cell Biol, 2003, 15(2): 172-83. DOI: 10.1016/S0955-0674(03)00013-9. |
| [8] | Schumacher A, Doerfler W. Influence of in vitro manipulation on the stability of methylation patterns in the Snurf/Snrpn-imprinting region in mouse embryonic stem cells[J]. Nucleic Acids Res, 2004, 32(4): 1566-76. DOI: 10.1093/nar/gkh322. |
| [9] | Stampoliou A, Arapantoni-Dadioti P, Pavlakis K. Epigenetic mechanisms in endometrial cancer[J]. J BUON, 2016, 21(2): 301-6. |
| [10] | Diao H, Xiao S, Li R, et al. Distinct spatiotemporal expression of serine proteases Prss23 and Prss35 in periimplantation mouse uterus and dispensable function of Prss35 in fertility[J]. PLoS One, 2013, 8(2): e56757. DOI: 10.1371/journal.pone.0056757. |
| [11] | Zhu H, Hou CC, Luo LF, et al. Endometrial stromal cells and decidualized stromal cells: origins, transformation and functions[J]. Gene, 2014, 551(1): 1-14. DOI: 10.1016/j.gene.2014.08.047. |
| [12] | Ercelen N, Turtar E, Gultomruk M, et al. Successful preimplantation genetic aneuploidy screening in Turkish patients[J]. Genet Mol Res, 2011, 10(4): 4093-103. DOI: 10.4238/2011.November.17.6. |
| [13] | Knez K, Zorn B, Tomazevic T, et al. The IMSI procedure improves poor embryo development in the same infertile couples with poor semen quality: a comparative prospective randomized study[J]. Reprod Biol Endocrinol, 2011, 9: 123. DOI: 10.1186/1477-7827-9-123. |
| [14] | Chen MW, Hua KT, Kao HJ, et al. H3K9 histone methyltransferase G9a promotes lung cancer invasion and metastasis by silencing the cell adhesion molecule Ep-CAM[J]. Cancer Res, 2010, 70(20): 7830-40. DOI: 10.1158/0008-5472.CAN-10-0833. |
| [15] | Benetatos L, Hatzimichael E, Dasoula A, et al. CpG methylation analysis of the MEG3 and SNRPN imprinted genes in acute myeloid leukemia and myelodysplastic syndromes[J]. Leuk Res, 2010, 34(2): 148-53. DOI: 10.1016/j.leukres.2009.06.019. |
| [16] | Lu Z, Tian Y, Salwen HR, et al. Histone-lysine methyltransferase EHMT2 is involved in proliferation, apoptosis, cell invasion, and DNA methylation of human neuroblastoma cells[J]. Anticancer Drugs, 2013, 24(5): 484-93. DOI: 10.1097/CAD.0b013e32835ffdbb. |
| [17] | Kim Y, Kim YS, Kim DE, et al. BIX-01294 induces autophagyassociated cell death via EHMT2/G9a dysfunction and intracellular reactive oxygen species production[J]. Autophagy, 2013, 9(12): 2126-39. DOI: 10.4161/auto.26308. |
| [18] | Chen P, Yao JF, Huang RF, et al. Effect of BIX-01294 on H3K9me2 levels and the imprinted gene Snrpn in mouse embryonic fibroblast cells[J]. Biosci Rep, 2015, 35(5): pii: e00257. |
| [19] | Castro-Rendón WA, Castro-Alvarez JF, Guzmán-Martinez C, et al. Blastocyst-endometrium interaction: intertwining a cytokine network[J]. Braz J Med Biol Res, 2006, 39(11): 1373-85. DOI: 10.1590/S0100-879X2006001100001. |
| [20] | Franco HL, Dai D, Lee KY, et al. WNT4 is a key regulator of normal postnatal uterine development and progesterone signaling during embryo implantation and decidualization in the mouse[J]. FASEB J, 2011, 25(4): 1176-87. DOI: 10.1096/fj.10-175349. |
| [21] | Ramathal CY, Bagchi IC, Taylor RN, et al. Endometrial decidualization: of mice and men[J]. Semin Reprod Med, 2010, 28(1): 17-26. DOI: 10.1055/s-0029-1242989. |
| [22] | Bany BM, Hamilton GS. Assessment of permeability barriers to macromolecules in the rodent endometrium at the onset of implantation[J]. Methods Mol Biol, 2011, 763: 83-94. DOI: 10.1007/978-1-61779-191-8. |
| [23] | Oh SY, Seok JY, Choi YS, et al. The histone methyltransferase inhibitor BIX01294 inhibits HIF-1α stability and angiogenesis[J]. Mol Cell, 2015, 38(6): 528-34. DOI: 10.14348/molcells.2015.0026. |
| [24] | Rosario GX, Stewart CL. The multifaceted actions of leukaemia inhibitory factor in mediating uterine receptivity and embryo implantation[J]. Am J Reprod Immunol, 2016, 75(3): 246-55. DOI: 10.1111/aji.2016.75.issue-3. |
| [25] | Wu D, Kimura F, Zheng L, et al. Chronic endometritis modifies decidualization in human endometrial stromal cells[J]. Reprod Biol Endocrinol, 2017, 15(1): 16. DOI: 10.1186/s12958-017-0233-x. |
| [26] | Teklenburg G, Salker M, Heijnen C, et al. The molecular basis of recurrent pregnancy loss: impaired natural embryo selection[J]. Mol Hum Reprod, 2010, 16(12): 886-95. DOI: 10.1093/molehr/gaq079. |
| [27] | Yotova IY, Quan P, Leditznig N, et al. Abnormal activation of Ras/ Raf/MAPK and RhoA/ROCKII signalling pathways in eutopic endometrial stromal cells of patients with endometriosis[J]. Hum Reprod, 2011, 26(4): 885-97. DOI: 10.1093/humrep/der010. |
 2017, Vol. 37
2017, Vol. 37

