2. 四川省妇幼保健院超声科,四川 成都 610031
2. 2Department of Ultrasonography, Sichuan Provincial Maternity and Child Healthcare Hospital, Chengdu 610031, China
法洛氏四联症(ToF)是活产严重先天性心脏病(CHD)中的一种常见疾病,约占CHD的12%~14%,占活产儿的0.3%,主要表现为室间隔缺损、主动脉增宽并骑跨、肺动脉狭窄或闭锁、右心室肥厚[1-2]。近年来,随着医疗诊治水平不断进步,ToF患儿的检出率及存活率都明显提高[3]。同时,人们越来越关注ToF患儿出生后的近远期并发症。据报道,25%的ToF胎儿可合并脑结构发育异常,主要包括脑积水、脑出血、胼胝体发育不良和小脑蚓部发育不良[4-5]。除了大脑皮质发育异常,以上颅脑结构异常在产前有明确超声特征。大脑皮质发育迟缓可影响胎儿多项生理功能,如智力障碍、精神分裂、协调能力差,这严重影响患儿日后的生长发育和生活质量[3, 6]。目前,影像学上对ToF胎儿脑皮质发育研究较少,主要应用核磁共振技术(MRI)对胎儿进行脑体积的测量[7],产前超声对ToF胎儿脑皮质发育的研究鲜见报道。然而,MRI技术受孕周、采集层厚、不能实时成像等影响,在产前观测胎儿颅脑结构发育的精细度欠佳,未纳入常规检查。超声检查具有无创、方便、可实时成像等优点,近20年来,产前超声在降低围产儿死亡率和出生缺陷率方面起到了举足轻重的作用。本文通过分析40例(52人次)不同孕周ToF胎儿的大脑沟回发育的超声特征,结合胎儿血流频谱,评价ToF胎儿大脑沟回发育情况,为宫内诊断和早期治疗提供依据。
1 对象和方法 1.1 研究对象2015年12月~2016年10月在南方医科大学附属深圳市妇幼保健院超声医学科进行产科超声检查的196例(208人次)单胎妊娠孕妇的胎儿[其中ToF病例40例(52人次),正常病例156例],40例ToF病例中10例隔3~5周进行了复查(2例进行了3次检查,8例进行了2次检查),共收集52次检查数据。根据纳入标准分为ToF组和对照组,ToF组纳入标准:根据美国超声心动图协会和国际妇产超声协会制定的《胎儿超声心动图指南》[8]进行胎儿超声心动图检查,由此诊断为ToF且不合并颅脑结构异常的单胎胎儿;对照组纳入标准:单胎胎儿,实验室及超声检查均提示胎儿无异常,超声及临床检查胎儿大小符合孕周,孕妇既往体健、月经规律,无妊娠期糖尿病、心脏病等,无异常家族史、妊娠史。病例数按ToF组:对照组=1:3进行匹配,并要求随机选取的对照组胎儿与ToF组胎儿孕周相匹配。
1.2 所用仪器仪器与方法:采用三星A80型多普勒超声扫描仪,配备1-8MHz单晶型容积探头,具有动态影像存储及回放功能,具备后处理二维及三维图像能力。
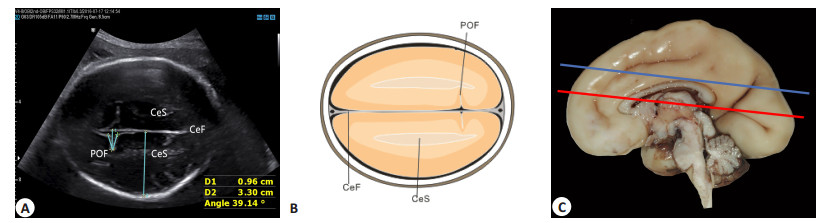
1.3 研究方法 1.3.1 顶枕沟切面及测量内容顶枕沟切面[9]:该切面可显示连续的大脑镰,两侧对称的连续的大脑白质(半卵圆中心),三者形成横向的“Ⅲ”线形(图 1)。
|
图 1 顶枕沟切面超声图及示意图 Figure 1 Ultrasound image and schematic diagram of the fetal parietal-occipital fissure. A: Ultrasound image of the fetal parietal-occipital fissure (POF); B: Schematic diagram of POF image; C: A photograph of the medial hemispheric surface of a fetal brain at 27 weeks of gestation. The red line represents the anatomic level at which the axial view of the biparietal diameter is taken. The blue line represents the anatomic level at which the axial view through the POF is taken. D1: POF depth; D2: Hemisphere depth on the view of POF; Angle: POF angle; POF: Parietal-occipital fissure; CeF: Cerebral falx; CeS: Centrum semiovale. |
顶枕沟切面测量内容:以顶枕沟顶点到大脑镰的垂直距离为顶枕沟深度;以顶枕沟顶点两侧大脑皮质最内缘为边测量顶枕沟角度;大脑镰所在直线的中点到颅骨内侧缘的距离顶为枕沟切面半球深度;各测值测量3次取平均值。
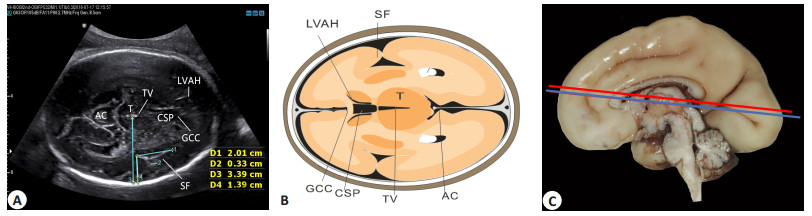
1.3.2 外侧裂切面及测量内容外侧裂切面[9]:该切面可显示侧脑室前角、透明隔腔、两侧丘脑及第三脑室、丘脑后方环池、胼胝体膝部(图 2)。
|
图 2 外侧裂切面超声图及示意图 Figure 2 Ultrasound image and schematic diagram of the fetal Sylvian fissure (SF). A: Ultrasound image of the fetal SF; B: Schematic diagram of the SF; C: A photograph of the medial hemispheric surface of a fetal brain at 27 weeks of gestation. The red line represents the anatomic level at which the axial view of the biparietal diameter is taken. The blue line represents the anatomical level at which the axial view through the SF is taken. D1: SF width; D2: Uncovered insular width; D4: SF depth; D3: Hemisphere depth on the view of SF. CSP: Cavum septum pellucidum; GCC: Genu of corpus callosum; LVAH: Left anterior horn of lateral ventricle; SF: Sylvian fissure; T: Thalamus; TV: Third ventricle. |
外侧裂切面测量内容:以外侧裂高回声线两端点直线距离为外侧裂宽度;平行于外侧裂宽度测量直线,取外侧裂内最小距离为脑岛未覆盖宽度;以外侧裂颞叶端点为顶点,做垂直于脑中线的垂线,在此垂线上外侧裂颞叶端点到颅骨内缘的距离为外侧裂深度;大脑镰所在直线的中点到颅骨内侧缘的距离为外侧裂切面半球深度;各测值测量3次取平均值。
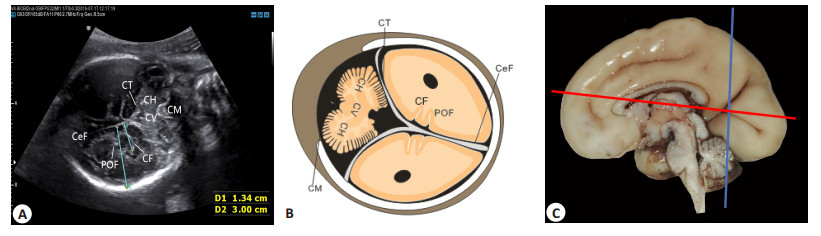
1.3.3 距状沟切面及测量内容距状沟切面[9]:该切面可显示“人”字样大脑镰及小脑幕,由上而下可见大脑镰与小脑幕交界处顶枕沟,两侧小脑半球及中间的小脑蚓部(图 3)。
|
图 3 距状沟切面超声图及示意图 Figure 3 Ultrasound image and schematic diagram of the fetal calcarine fissure (CF). A: Ultrasound image of the fetal CF; B: Schematic diagram of CF; C: A photograph of the medial hemispheric surface of a fetal brain at 27 weeks of gestation. The red line represents the anatomic level at which the axial view of the biparietal diameter is taken. The blue line represents the anatomic level at which the coronal view through the CF is taken. D1: CF depth; D2: Hemisphere depth on the view of CF. CF: Calcarine fissure; CeF: Cerebral falx; CH: Cerebellar hemisphere; CM: Cisterna magnum; CT: Cerebellar tentorium; CV: Cerebellar vermis; POF: Parieto-occipital fissure. |
距状沟切面测量内容:以距状沟顶点到大脑镰及小脑幕切线的垂直距离为距状沟深度;过距状沟与顶枕沟的交点作与一条与大脑镰垂直的直线,在该垂线上大脑镰与小脑幕的交点到颅骨内侧缘的距离为距状沟切面半球深度;各测值测量3次取平均值。
在丘脑水平横切面[10]上测量双顶径(BPD)和头围(HC)。
1.3.4 大脑中动脉血流频谱脑底部水平横切面上,清楚显示Willis环,脉冲多普勒取样线置于大脑中动脉起始部0.5~1 cm处,并将取样线与大脑中动脉方向的夹角小于30°,取样容积2~3 mm,测量3个连续均匀一致、边界清晰的多普勒频谱,记录大脑中动脉搏动指数(MCA-PI)、阻力指数(MCA-RI),重复测量3次取平均值。
1.3.5 脐动脉血流频谱在胎盘脐带插入口处,脉冲多普勒取样线置于脐带插入处1~2 cm的脐动脉上,并将取样线与脐动脉方向的夹角小于30°,取样容积2~3 mm,测量3个连续均匀一致、边界清晰的多普勒频谱,记录脐动脉搏动指数(UmA-PI)、阻力指数(UmA-RI),重复测量3次取平均值。
1.4 数据计算| $ {\text{脑岛未覆盖率}} = \frac{{{\text{脑岛未覆盖宽度}}}}{{{\text{外侧裂宽度}}}}\left[9 \right] $ |
| $ {\text{脑胎盘血流指数比}}\left( {{\text{CPR}}} \right) = \frac{{{\text{大脑中动脉博动指数}}}}{{{\text{脐动脉博动指数}}}}\left[{11} \right] $ |
| $ {\text{脑胎盘血流阻力指数比}}\left( {{\text{CPRR}}} \right) = \frac{{{\text{大脑中动脉阻力指数}}}}{{{\text{脐动脉阻力指数}}}}\left[{12} \right] $ |
随机选取60例行两观察者之间脑沟回测值的重复性检测。对两观察者测量的脑沟回数据行配对样本t检验或两相关样本的非参数检验(表 1),P>0.05,两观察者测值的差异无统计学意义。
| 表 1 两观察者脑沟回测值的重复性检验结果 Table 1 Repeatability test results of two observers' cerebral sulcus measurement |
假设ToF组胎儿的脑沟测值较对照组小、脑回闭合较对照组延迟,因此采用单侧检验。应用SPSS 20统计学软件,计量资料采用均数±标准差表示,对两组数据行两独立样本t检验或两独立样本非参数检验(Wilcoxon rank sum Test),P(单侧) < 0.05,差异有统计学意义。
2 结果 2.1 一般情况和随访本超声研究检查共包括196例单胎孕妇(其中男胎86例,女胎110例),孕妇平均年龄29.14±4.61岁(21~42岁),平均孕龄27.25±3.24周。
40例ToF胎儿中,6例合并心外结构异常(左侧唇腭裂、左侧桡骨缺如、钩状手、右侧拇指缺如、脐静脉肝内端增宽、右肾缺如、泄殖腔畸形),4例失访,22例选择性引产,14例选择继续妊娠的病例中有2例胎死宫内、1例出生后手术治疗后效果不佳而死亡。对ToF胎儿产后生长发育进行随访,如表 2所示,2例男性患儿均足月剖宫产出生,均为低体质量儿,产后超声诊断为ToF。患儿分别于2~3月时进行了生长发育评估,体质量、身长、头围低于同龄男性婴儿1~3个标准差,血细胞比容高于正常参考值上限,营养评价为中下或下下水平。
| 表 2 法络氏四联症胎儿产后生长发育随访 Table 2 Postnatal growth and development of two fetuses with Tetralogy of Fallot |
40例ToF病例中有18例进行了染色体数目和染色体微整列检查,结果均正常(包括6例合并心外结构异常的胎儿)。
2.2 两观察者间各脑沟回测值的重复性检测结果两观察者间各脑沟回测值比较均P>0.05,差异无统计学意义,说明两观察者间各脑沟回测量重复性好(表 1)。
2.3 不同孕周法络四联症组胎儿和对照组胎儿的各脑沟回测值的比较结果从表 3和表 4可见,除了胎儿顶枕沟角度、脑岛未覆盖宽度和脑岛未覆盖率随着孕周增长而减小,余测值均随着孕周增长而增加。ToF组BPD、HC、顶枕沟切面半球深度、外侧裂切面半球深度和距状沟切面半球深度测值均比对照组小,除了27~28周的外侧裂切面半球深度(P=0.054),余测值差异均有统计学意义(P < 0.05)。ToF胎儿顶枕沟深度、外侧裂深度和距状沟深度较对照组小,且测值差异均有统计学意义(P < 0.05)。ToF组胎儿外侧裂宽度测值比对照组小,除27~28周(P=0.091),余测值差异均有统计学意义(P < 0.05)。ToF胎儿顶枕沟角度和脑岛未覆盖率比对照组胎儿大,除了31~33周的顶枕沟角度(P=0.117)和27~28周的脑岛未覆盖率(P= 0.273),差异有统计学意义(P < 0.05)。
| 表 3 不同孕周法络氏四联症组胎儿和对照组胎儿的各脑沟回测值 Table 3 Cerebral sulcus measurement of Tetralogy of Fallot and normal fetuses at different gestational age (Mean±SD) |
| 表 4 不同孕周法络氏四联症组胎儿和正常组胎儿的各脑沟回测值的比较结果 Table 4 Comparison of cerebral sulcus measurement of Tetralogy of Fallot and normal fetuses at different gestational ages |
从表 5可见,两组孕周比较,差异无统计学意义(P> 0.05);两组胎儿的UmA-RI和UmA-PI差异无统计学意义(P>0.05);ToF组胎儿的MCA-PI、MCA-RI、CPR和CPRR均比对照组小,差异有统计学意义(P < 0.05)。
| 表 5 法络氏四联症组胎儿和对照组胎儿的脐动脉和大脑中动脉频谱测值的比较结果 Table 5 The comparison result of umbilical artery and middle cerebral artery's doppler spectrum of Tetralogy of Fallot and normal fetus |
大脑沟回是大脑皮质最直观的结构,神经学家认为大脑沟回对评价胎儿大脑发育情况具有重要意义,可作为胎儿大脑发育标志。多名学者应用超声技术对胎儿大脑沟回进行研究,并测量顶枕沟和距状沟深度及角度、外侧裂宽度及深度和计算脑岛未覆盖率,发现各大脑沟深度随孕周增加呈正相关,脑岛未覆盖率和顶枕沟角度随孕周增加呈负相关[9, 13-14]。如表 4所示,本研究的结果中各脑沟回测值与孕周的相关关系,与上述研究结果一致。超声技术对胎儿脑沟回发育的定量化研究可为产前评估胎儿大脑发育迟缓、脑皮质发育障碍提供依据。
目前,影像学上对CHD患儿大脑沟回发育的研究主要应用核磁共振成像技术,超声相关研究鲜见报道。CHD胎儿大脑皮质发育的产前研究和定量研究较少,主要集中在产后研究和定性研究,具体表现为脑沟出现延迟、皮质折叠程度下降、脑岛闭合不全和头围减小[15-18]。2015年,Schellen应用MRI技术对25名ToF胎儿进行脑体积测量,研究发现ToF胎儿的脑体积、灰质和大脑皮质体积均较正常儿小,ToF胎儿脑发育延迟[7]。2016年,李慕子应用三维超声技术发现晚孕期严重CHD胎儿的额叶和丘脑体积较正常儿小[19]。这些研究结果均提示CHD患儿在宫内时就出现大脑皮质发育异常。因此,本研究推测ToF胎儿大脑沟回发育迟缓。目前,产前超声对ToF胎儿大脑皮质发育研究尚处于研究空白,本研究应用陈曦[9]制定的脑沟回超声扫查标准切面对顶枕沟、外侧裂和距状沟进行了定量化测量以评估ToF胎儿大脑沟回发育情况。
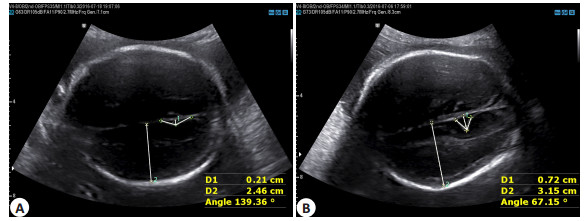
如表 3、4所示,ToF胎儿顶枕沟深度、外侧裂深度和距状沟深度较对照组小,且差异均有统计学意义(P < 0.05),说明ToF胎儿的顶枕沟、外侧裂和距状沟较正常胎儿浅。ToF胎儿的顶枕沟角度和脑岛未覆盖率比正常胎儿的大,除了31~33周的顶枕沟角度和27~28周的脑岛未覆盖率,差异均有统计学意义,说明ToF胎儿的顶枕沟和外侧裂闭合较正常胎儿延迟。而脑岛闭合延迟是脑发育不成熟的标志,可在86%的CHD患儿中发生[16],左心发育不良胎儿容易出现脑岛闭合不全[20]。ToF胎儿31~33周的顶枕沟角度与对照组相比无统计学差异,可能与31周以后97.31%的胎儿顶枕沟闭合、顶枕沟角度为0°[9],与该孕周段两组差异性逐渐减小有关。ToF胎儿27~28周的脑岛未覆盖率与对照组相比无统计学差异,可能为该孕周样本量较少而影响统计效能。胎儿大脑体积会随着孕周的增长而增大,超声上表现为BPD和HC的随孕周增长而增大。本研究用BPD、HC、顶枕沟切面半球深度、外侧裂切面半球深度和距状沟切面半球深度多个切面测量参数研究ToF胎儿大脑体积。不同孕周ToF组胎儿的以上测值均比正常胎儿小,除了27~28周外侧裂切面半球深度,均有统计学差异,这提示ToF胎儿的大脑皮质体积较正常胎儿小。这与多名学者[16]发现CHD胎儿头围低于正常值1个标准差、ToF胎儿大脑体积较正常儿小[7]的研究结果一致。如图 4~6所示,26周的ToF胎儿的顶枕沟和距状沟较正常26周胎儿的浅,顶枕沟开放程度更大;正常26周胎儿的额叶和颞叶开始聚拢,外侧裂呈“几”字形,脑岛开始闭合,而同孕龄的ToF胎儿的脑岛仍呈开放状态。本研究显示,ToF胎儿的大脑沟回发育迟缓、大脑体积减小。
|
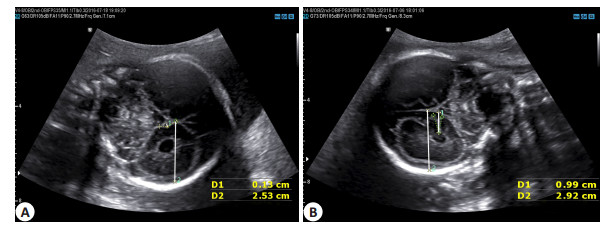
图 4 26周法络氏四联症胎儿和正常胎儿的顶枕沟 Figure 4 Parietal-occipital fissure of a tetralogy of Fallot fetus aged 26 weeks (A) compared with a normal fetus (B). D1: POF depth; D2: Hemisphere depth on the view of POF; Angle: POF angle. |
|
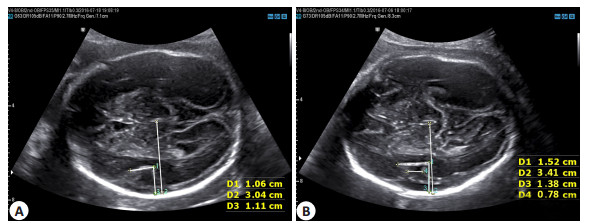
图 5 26周法络氏四联症胎儿和正常胎儿的外侧裂 Figure 5 Sylvian fissure of a tetralogy of Fallot fetus aged 26 weeks (A) compared with a normal fetus (B). D1: SF width; D2: Hemisphere depth on the view of SF; D3: SF depth; D4: Uncovered insular width. |
|
图 6 26周法络氏四联症胎儿和正常胎儿的距状沟 Figure 6 The calcarine fissure of a tetralogy of Fallot fetus aged 26 weeks (A) compared with a normal fetus (B). D1: CF depth; D2: Hemisphere depth on the view of CF. |
目前,许多学者研究认为CHD儿常合神经系统发育异常,主要与CHD胎儿异常的心脏结构改变胎儿脑血流动力学,导致胎脑灌注不足而引起脑皮质发育障碍有关[21-22];此外,还认为与染色体、基因异常有关[18, 23]。本研究应用超声多普勒技术观测胎儿大脑中动脉和脐动脉频谱以判断胎脑和机体血流灌注情况,发现ToF胎儿的血流频谱存在异常,表现为MCA-RI、MCA-PI、CPR和CPRR均较正常儿小(表 5)。胎儿缺氧早期,脑血流重新分布,MCA-PI会降低,机体启动脑保护效应使舒张期血流增加,MCA-RI降低,持续严重缺氧时,UmA-RI会升高[24-26]。多名学者提出了CPR(CPR= MCA-PI/UA-PI)来评价脑血流灌注情况[11, 24]。CHD胎儿的CPR较正常儿小,CPR < 1可出现在严重缺氧胎儿中,CPR是预测围产期不良预后的一项指标[27]。此外,Donofrio [12]研究指出,CHD胎儿CPRR(CPRR= MCA-RI/UA-RI)较正常儿小,当CPRR < 1时,说明机体处于严重低氧状态,并启动了自我调节功能,CPRR>1可出现在95%的正常胎儿和44%的CHD胎儿。此外,有研究学者应用MRI技术观察CHD患儿的脑血管灌注情况,发现CHD患儿不仅在产后新生儿期脑血管灌注显著降低,产前胎儿期既已出现脐静脉和升主动脉的氧饱和度低、大脑氧输出量减少15%的情况,而且不同类型的CHD表现不尽相同,其中紫绀型CHD患儿的丘脑、基底核核枕叶白质的血流量低于非紫绀型CHD患儿[22, 28]。因此,本研究认为ToF胎儿存在胎脑灌注障碍而呈现低氧状态,心脏结构异常导致机体脑血流灌注不足可能是ToF胎儿出现大脑沟回发育延迟的一个原因。本研究中,40例ToF胎儿18例行了染色体和染色体微整列分析,均未见异常。
本研究首次提出应用固定的大脑沟回标准切面定量化地观察ToF胎儿的大脑皮质发育,并结合胎儿血流动脉频谱和染色体情况探究ToF胎儿大脑沟回发育迟缓的原因。研究中发现,中晚孕期ToF胎儿的大脑沟回发育较正常儿迟缓,表现为顶枕沟、外侧裂和距状沟浅、顶枕沟和脑岛闭合延迟、大脑体积减小,具体表现为顶枕沟、外侧裂和距状沟深度、顶枕沟和距状沟切面半球深度、BPD和HC较正常儿小。ToF患儿产后生长发育评估可见,患儿头围、体质量、身长和营养水平较同龄正常儿低1~3个标准差,这提示ToF胎儿产后生产发育可能较正常儿差。此外,中晚孕期ToF胎儿存在胎脑灌注障碍,并影响患儿的产后生长发育,心脏结构异常导致胎脑灌注不足可能是ToF胎儿大脑沟回发育迟缓的一个原因。因此,产前可应用超声检查技术定量化追踪观察ToF胎儿宫内大脑沟回发育,为临床宫内ToF胎儿大脑发育情况的评估提供依据,这对宫内预防和产后治疗脑皮质发育迟缓具有重要意义。
本研究的不足之处在于,病例数相对较少,病例孕周分布不均匀,缺乏27周和29~30周病例,这可能会影响统计效能;随着孕周增长,胎儿颅骨骨化,影响颅内结构观察,因此未将34周后的胎儿列入本研究。此外,40例ToF胎儿仅12例活产,患儿产后随访依从性欠佳和本研究时间较短,因此,仅对2例ToF胎儿进行了产后生长发育的评估,缺乏对ToF胎儿产后远期生长发育的随访。ToF患儿日后生长发育和智力发育有待进一步的随访和研究。
| [1] | Starr JP. Tetralogy of fallot: yesterday and today[J]. World J Surg, 2010, 34(4): 658-68. DOI: 10.1007/s00268-009-0296-8. |
| [2] | 朱晓东. 心脏外科基础图解[M]. 第2版修订. 北京: 中国协和医科大学出版社, 2010. |
| [3] | Ozmen A, Terlemez S, Tunaoglu FS, et al. Evaluation of neurodevelopment and factors affecting it in children with acyanotic congenital cardiac disease[J]. Iran J Pediatr, 2016, 26(1): e3278. |
| [4] | Khalil A, Bennet S, Thilaganathan B, et al. Prevalence of prenatal brain abnormalities in fetuses with congenital heart disease: a systematic review[J]. Ultrasound Obstet Gynecol, 2016, 48(3): 296-307. DOI: 10.1002/uog.2016.48.issue-3. |
| [5] | Bertholdt S, Latal B, Liamlahi R, et al. Cerebral lesions on magnetic resonance imaging correlate with preoperative neurological status in neonates undergoing cardiopulmonary bypass surgery[J]. Eur J Cardiothorac Surg, 2014, 45(4): 625-32. DOI: 10.1093/ejcts/ezt422. |
| [6] | Zhang Y, Zhou Y, Yu C, et al. Reduced cortical folding in mental retardation[J]. AJNR Am J Neuroradiol, 2010, 31(6): 1063-7. DOI: 10.3174/ajnr.A1984. |
| [7] | Schellen C, Ernst S, Gruber GM, et al. Fetal MRI detects early alterations of brain development in Tetralogy of Fallot[J]. Am J Obstet Gynecol, 2015, 213(3): 392.e1-7. |
| [8] | Rychik J, Ayres N, Cuneo B, et al. American society of echocardiography guidelines and standards for performance of the fetal echocardiogram[J]. J Am Soc Echocardiogr, 2004, 17(7): 803-10. DOI: 10.1016/j.echo.2004.04.011. |
| [9] | 陈曦. 胎儿脑沟回生长发育规律的影像学研究[D]. 广州: 南方医科大学, 2014. |
| [10] | 李胜利, 文华轩. 中孕期胎儿系统超声检查切面及临床意义[J]. 中华医学超声杂志:电子版, 2010, 7(3): 366-81. |
| [11] | Yamamoto Y, Khoo NS, Brooks PA, et al. Severe left heart obstruction with retrograde arch flow influences fetal cerebral and placental blood flow[J]. Ultrasound Obstet Gynecol, 2013, 42(3): 294-9. DOI: 10.1002/uog.12448. |
| [12] | Donofrio MT, Bremer YA, Schieken RM, et al. Autoregulation of cerebral blood flow in fetuses with congenital heart disease: the brain sparing effect[J]. Pediatr Cardiol, 2003, 24(5): 436-43. DOI: 10.1007/s00246-002-0404-0. |
| [13] | Mittal P, Gonçalves LF, Kusanovic JP, et al. Objective evaluation of sylvian fissure development by multiplanar 3-dimensional ultrasonography[J]. J Ultrasound Med, 2007, 26(3): 347-53. DOI: 10.7863/jum.2007.26.3.347. |
| [14] | Quarello E, Stirnemann J, Ville Y, et al. Assessment of fetal Sylvian fissure operculization between 22 and 32 weeks: a subjective approach[J]. Ultrasound Obstet Gynecol, 2008, 32(1): 44-9. DOI: 10.1002/uog.v32:1. |
| [15] | Ortinau C, Alexopoulos D, Dierker D, et al. Cortical folding is altered before surgery in infants with congenital heart disease[J]. J Pediatr, 2013, 163(5): 1507-10. DOI: 10.1016/j.jpeds.2013.06.045. |
| [16] | Licht DJ, Shera DM, Clancy RR, et al. Brain maturation is delayed in infants with complex congenital heart defects[J]. J Thorac Cardiovasc Surg, 2009, 137(3): 529-36. DOI: 10.1016/j.jtcvs.2008.10.025. |
| [17] | Schaer M, Glaser B, Cuadra MB, et al. Congenital heart disease affects local gyrification in 22q11.2 deletion syndrome[J]. Dev Med Child Neurol, 2009, 51(9): 746-53. DOI: 10.1111/dmcn.2009.51.issue-9. |
| [18] | Fountain DM, Schaer M, Mutlu AK, et al. Congenital heart disease is associated with reduced cortical and hippocampal volume in patients with 22q11.2 deletion syndrome[J]. Cortex, 2014, 57(7): 128-42. |
| [19] | 李慕子, 周嘉炜, 徐赣琼, 等. 三维超声技术评价复杂先天性心脏病胎儿脑发育[J]. 中华医学超声杂志:电子版, 2016, 13(07): 519-27. |
| [20] | Clouchoux C, Du Plessis AJ, Bouyssi-Kobar M, et al. Delayed cortical development in fetuses with complex congenital heart disease[J]. Cereb Cortex, 2013, 23(12): 2932-43. DOI: 10.1093/cercor/bhs281. |
| [21] | Jain V, Buckley EM, Licht DJ, et al. Cerebral Oxygen metabolism in neonates with congenital heart disease quantified by MRI and optics[J]. J Cereb Blood Flow Metab, 2014, 34(3): 380-8. DOI: 10.1038/jcbfm.2013.214. |
| [22] | Sun L, Macgowan CK, Sled JG, et al. Reduced fetal cerebral Oxygen consumption is associated with smaller brain size in fetuses with congenital heart disease[J]. Circulation, 2015, 131(15): 1313-23. DOI: 10.1161/CIRCULATIONAHA.114.013051. |
| [23] | Mcquillen PS, Miller SP. Congenital heart disease and brain development[J]. Ann N Y Acad Sci, 2010, 1184(2): 68-86. |
| [24] | Masoller N, Martínez JM, Gómez O, et al. Evidence of secondtrimester changes in head biometry and brain perfusion in fetuses with congenital heart disease[J]. Ultrasound Obstet Gynecol, 2014, 44(2): 182-7. DOI: 10.1002/uog.2014.44.issue-2. |
| [25] | Sethi V, Tabbutt S, Dimitropoulos A, et al. Single-ventricle anatomy predicts delayed microstructural brain development[J]. Pediatr Res, 2013, 73(5): 661-7. DOI: 10.1038/pr.2013.29. |
| [26] | Stampalija T, Casati D, Monasta L, et al. Brain sparing effect in growth-restricted fetuses is associated with decreased cardiac acceleration and deceleration capacities: a case-control study[J]. BJOG, 2016, 123(12): 1947-54. DOI: 10.1111/1471-0528.13607. |
| [27] | Abuhamad A, Falkensammer P, Reichartseder F, et al. Automated retrieval of standard diagnostic fetal cardiac ultrasound planes in the second trimester of pregnancy: a prospective evaluation of software[J]. Ultrasound Obstet Gynecol, 2008, 31(1): 30-6. DOI: 10.1002/(ISSN)1469-0705. |
| [28] | Nagaraj UD, Evangelou IE, Donofrio MT, et al. Impaired global and regional cerebral perfusion in newborns with complex congenital heart disease[J]. J Pediatr, 2015, 167(5): 1018-24. DOI: 10.1016/j.jpeds.2015.08.004. |
 2017, Vol. 37
2017, Vol. 37

