2. 南方医科大学南方医院胸心外科,广东 广州 510515
2. Department of Cardiothoracic Surgery, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
小口径人工血管的动物实验模型是检验血管性能的关键因素之一。合适的实验模型[1]可以更好的模拟人类的疾病,即构建方便,又容易观察实验结果;不良的动物模型与人类的病情差别明显,获得的试验结果无法在人体中重复,会造成大量的资源浪费。目前国内外多应用猪[2-3]、狗[4]、羊[5-6]的颈动脉或者股动脉制作小口径血管置换的动物模型,这类动物体形较大,麻醉和监测不便;也有应用鼠[7-8]的腹主动脉制作血管置换模型,操作困难[9],术后监测难以实施。且上述动物模型的血流动力学与人类的冠心病搭桥术后“桥血管”的血流改变有明显的差别。
为了能更好的模拟冠心病搭桥手术后“桥血管”的血流情况,本研究利用兔的腹主动脉制作了新的小血管置换模型[10],我们首次构建该动物模型,并建立该动物模型中小口径血管通畅与否的观察办法,及动物模型术后处理的注意事项等。
1 材料和方法 1.1 动物模型的制作实验由南方医科大学实验动物伦理委员会批准。选用新西兰大白兔16只,随机分为2组。取一组实验用兔称质量,之后用1%戊巴比妥经兔耳缘静脉缓慢注入麻醉,剂量为30 mg/kg,麻醉至兔心率降至160~180次/min,呼吸频率40~60次/min,兔对疼痛刺激无明显反应。将兔固定于实验台上,腹部皮肤备皮,用碘酒、酒精消毒兔腹部皮肤,选择腹部正中切口,位置于腹部中下1/3处,加用1%盐酸利多卡因于拟切口处局部浸润麻醉,依次切开腹部皮肤及腹白线,长度约4 cm。用乳突撑开器撑开腹部切口,温盐水纱布将周围肠道推向上方及两侧,将膀胱推向下方,暴露腹主动脉,分离腹主动脉长度约4 cm,结扎腹主动脉分支,记录结扎的分支个数,小心将腹主动脉与腹主静脉分离开。用游标卡尺测量腹主动脉直径。然后经兔耳缘静脉注射肝素,剂量为3 mg/kg。完毕后阻断分离的腹主动脉近、远端,于中部横断腹主动脉,于腹主动脉前壁做一长3~4 mm纵行切口。将人工血管长度修建至3 cm的长度,采用连续缝合的方法,用6-0 Prolene线将小口径人工血管与腹主动脉近端行端端吻合。同法将人工血管与腹主动脉远心端行端端吻合。缝合远端最后一针时暂不打结,轻轻开放近心端血管阻断钳,排出人工血管内气体,然后夹闭近端阻断钳,开放远端阻断钳排除人工血管内气体。同时观察有无近端吻合口及远端吻合口出血。如无吻合口出血或出血量少,将远端吻合口处打结,然后开放远端血管阻断钳及近端血管阻断钳。如吻合口出血量大,用6-0 Prolene线加小块腹肌组织褥式缝合出血处,然后再次排气。伤口全面止血,观察近端吻合口与远端吻合口处自体血管的波动情况。满意后用4号丝线间断缝合关闭兔腹肌,用1号丝线间断缝合兔皮肤,伤口用酒精擦洗,无菌辅料覆盖,胶布固定。待兔清醒后送至单独兔笼内饲养。
取另一组实验用兔,切口位置选择在下腹部。麻醉和消毒方法同上组。消毒后于下腹部切开腹壁皮肤,局麻和切口长度同上组。用温盐水纱布将周围肠道推向上方,膀胱推向下方。暴露腹主动脉,分离腹主动脉与腹主静脉间粘连,分离的长度约4 cm。结扎分离过程中的腹主动脉分支,记录分支的数量。测量腹主动脉直径,肝素化同上组,小心将腹主动脉与腹主静脉分离开。满意后阻断分离的腹主动脉近远端,远端阻断于髂总动脉处。于中部横断腹主动脉,于腹主动脉前壁做一长3~4 mm切口,采用端端吻合的方法连续缝合,用6-0 Prolene线将小口径人工血管与腹主动脉近端吻合。同法将人工血管与腹主动脉远心端吻合。排气和止血方法同前。吻合后观察近、远端吻合口自体血管的波动情况。
术后48 h给予青霉素预防感染。术后6 h开始给予阿司匹林抗聚治疗,剂量为3 mg/kg。同时给予雷尼替丁抑制胃酸,防止胃溃疡。术后第1天给予常规兔粮饲养。
1.2 术后观察 1.2.1 观察腹部人工血管是否通畅利用动物体征观察:观察有无兔双下肢瘫痪,有无下肢肌力增高,下肢肢体强直,活动不能等;于兔大腿内侧触摸股动脉搏动,波动良好时可以判定腹主动脉是通畅的,波动差或无波动时需行腹主动脉B超[11]检查,了解有无人工血管堵塞或狭窄。
1.2.2 B超观察方法B超采用飞利浦iE33血管超声机器,于纵轴和横轴观察人工血管的通畅情况(图 1),血管的直径,血管内有无血流,测量血流的速度(图 2);其次观察伤口、腹部有无出血,伤口有无感染迹象。术后每3日行腹主动脉B超检查1次,了解有无腹主动脉闭塞或狭窄(图 3)。腹部伤口每2日换药1次,9 d后拆线。
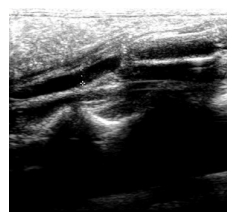
|
图 1 超声下通畅的人工血管 Figure 1 Ultrasound image showing patency of small diameter vascular graft. |
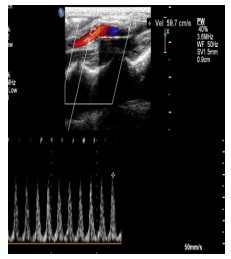
|
图 2 人工血管内的血流速度 Figure 2 Representative color Doppler for measureing the speed of blood flow of small diameter vascular graft. |
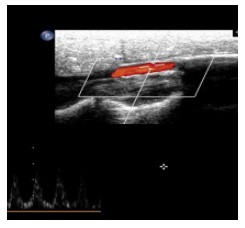
|
图 3 B超下通畅的人工血管 Figure 3 Representative ultrasound image showing patency of the small diameter vascular graft. |
根据兔活动能力来判定,兔腹主动脉栓塞后会很快出现双下肢瘫痪,下肢活动能力丧失,肌张力的增高,强直,大小便失禁等表现,该症状提示腹主动脉闭塞的可能性。出现该情况后立即行腹主动脉B超检查,明确有无腹主动脉栓塞,栓塞的位置等(图 4)。另外我们采用了定期超声检查的方法,腹部血管B超定期观察[12]:每3 d行腹主动脉B超检查1次,了解腹主动脉的通畅情况。
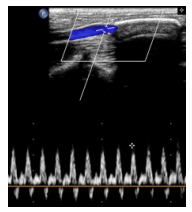
|
图 4 超声提示人工血管内堵塞。 Figure 4 Ultrasound image showing occluded small diameter vascular graft. Color Doppler flow image revealing the lack of blood flow through the graft. |
兔出现腹主动堵塞后用戊巴比妥实施安乐死,剂量为120 mg/kg。于小口径人工血管近端吻合口上5 mm处横断自体血管,于远端吻合口远测5 mm处横断自体血管,将取出的血管用生理盐水轻轻冲洗,观察血管内的栓塞情况。标本用10%福尔马林固定,送病理及扫描电镜检查。
未发生堵塞的试验用兔,3月后用同样的方法实施安乐死,使用的药物为戊巴比妥,剂量为120 mg/kg。于原手术伤口处切开腹部皮肤及肌肉,将肠道或其余腹腔脏器推开,暴露人工血管吻合处,仔细分离小口径人工血管与腹腔的粘连,满意后于近端吻合口上方5 mm处横断自体血管,远端的横断位置为远端吻合口远测5 mm。用生理盐水轻轻冲洗人工血管,然后用福尔马利固定。之后观察人工血管的通畅情况,人工血管内壁的增生情况,血管内膜生长的情况,人工血管的两端做纵行切开、中部横断做病理检查,了解其人工血管内壁的增生情况,内皮细胞的生长情况等。人工血管的表面做扫描电镜检查,了解人工血管的内膜形成情况。
选用SPSS13.0作为统计软件,实验中的计量资料用t检验,计数资料用χ2检验,P < 0.05认为差异有统计学意义。
2 结果本研究发现,切口选择在下腹部与中下1/3之处两组动物,其体重,手术时间,主动脉阻断时间和腹主动脉的直径之间无明显差别(P > 0.05,表 1)。手术切口选择在腹部中下1/3处组的手术时间和主动脉阻断时间较下腹部手术切口组有增长的趋势,但对比无明显统计学差异。在血管分支上,下腹部手术切口血管分支数超过中下1/3手术切口组(P=0.001)。
| 表 1 手术的基本情况 Table 1 Surgical data in the rabbits |
手术中在下腹部切口组有2例大出血的病例发生,而选择中下1/3切口组发生大出血1例,两组对比无明显差异。
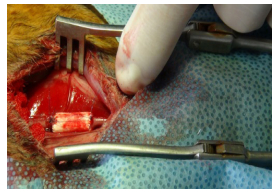
术中血管吻合后发现,下腹部切口组的吻合口远端血管的波动情况较差,5例波动不良,3例波动良好。而选择中下1/3切口组的试验兔中,所有的都波动良好(图 5),差异有统计学意义(P=0.026)。
|
图 5 腹部中下1/3切口吻合后远端血管搏动良好 Figure 5 The abdominal artery is patency after anastomosis in the 1/3 incision group. The abdominal artery is patency and with excellent pulse after the anastomosis in the 1/3 incision group. |
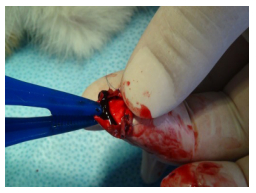
两组动物于术后3 d均有人工血管栓塞的情况出现,下腹部切口的兔中有7例出现栓塞。而中下1/3切口组的兔有3例出现栓塞(图 6)。两组对比差异无统计学意义,P值为0.119。手术中两组均有麻醉导致兔死亡,其中下腹部切口2例,中下腹部切口1例,经心肺复苏成功复苏1例,死亡的兔被剔除,再次使用其余兔补充。
|
图 6 人工血管内血栓栓塞 Figure 6 Embolism in artificial graft. The artificial graft was occluded by embolism. |
在本研究中,我们构建了全新的小血管置换动物模型,是文献报道的首次。本研究利用小口径人工血管置换兔的腹主动脉,因手术切口选择的位置不同,置换腹主动脉的位置会有相应的变化,实验需要的时间,需要结扎的分支血管数量也有不同。研究中发现:选择腹部中下1/3切口组的手术时间较下腹部切口组有增长的趋势,但在P值为0.05的条件下,两组无统计学差异;如果选择P值为0.1,那么这两组的手术时间就有统计学差异。可能的原因有以下几点:在实验中发现,切开腹白线后,中下1/3切口组更容易受到肠道组织的影响,肠道组织会随着动物的呼吸,再次涌向组织分离处。同时,腹主动脉在中下1/3腹部切口处位于腹主静脉后,位置较深,与腹主静脉粘连紧密,分离需要时间。而位于髂总动脉上方的腹主动脉,又再次移行于腹主静脉前方,容易分离和暴露。但是下腹部腹主动脉分支较多,结扎耗时较多。可能上述原因导致两类切口间的手术时间无明显差异。但中下1/3切口组有一增长的趋势。
在血管置换模型的制作过程中发现:小口径血管和兔腹主动脉吻合难度较大,是整个动物模型构建的关键点和难点。文献报道有兔腹主动脉内支架置入,行腹主动脉支架置入时使用纤维器械可提高成功率,手术的难度可见一斑。本实验中未使用显微器械,在实验中发现,兔腹主动脉菲薄,吻合血管时时耗时较多,吻合下腹部切口组的远端吻合口时,吻合口距离腹壁近,吻合操作相对迅速。但是下腹部手术吻合后的缺点也非常明显,因为人工血管的直径均大于自体血管,吻合后人工血管对自体血管有牵拉作用。尤其是远端吻合口,远端的髂动脉固定于盆腔,受牵扯后血管张力增加,常常导致远端血管的扭曲,血流通畅性差。而近端血管分离后活动性大,长度较长,对吻合口的牵扯较小,吻合口受影响相对较少,所以吻合后血管远端波动良好。手术切口选择在腹部中下1/3处时,术后远端吻合口的波动情况优于下腹部切口组,两组对比有明显的统计学差异。
两组动物模型中均有大出血的情况发生。发生的原因均是在实验中动物呛咳。导致动物呛咳的原因较多,如:麻醉后呼吸道分泌物增多,舌后坠,实验中手术动作粗暴,对动物的刺激过大等。所以实验需充分镇痛和镇静,本实验中除了应用戊巴比妥钠静脉麻醉外,还加用了利多卡因局部浸润麻醉,有效的较少了动物的疼痛刺激。还有可采用的预防办法有:将兔的舌头拉至口腔外,可以防止舌后坠导致兔呼吸道梗阻或分泌物梗阻导致呛咳;另外术中可给予少量的阿托品,防止气道分泌物的增多。如术中出现大出血,我们采用的方法是先用纱布压迫止血,然后利用6-0的Prolene线间断缝合止血,缝合时需加垫片。因为兔血管较薄,直接缝合会导致更大的撕裂口,只能使出血越来越大。而加用垫片后止血效果良好,选择的垫片为兔腹壁肌肉。
两组兔的人工血管均有较多的栓塞,这和使用的普通聚四氟乙烯血管的组织和血液相容性较差有关。目前普通的小口径聚四氟乙烯血管不能满足临床的需要,容易出现血栓栓塞。同时,兔的凝血明显强于人类,兔的血小板浓度为(200~1000)×109/L [13],而人类的为(100~ 300)×109/L,也就是兔的血小板浓度大约是人的2~3倍。同时,兔的腹主动脉血流量也较低,为35~52 mL/min,与人冠脉搭桥后的大隐静脉“桥血管”的血流量相当。使用普通的聚四氟乙烯血管吻合后很容易出现血管栓塞,尤其是下腹部切口的实验用兔。该组兔于吻合后就容易出现远端吻合口处血管波动不良,有时合并一侧髂动脉波动不良。
文献中有利用猪[14]、狗[15]、羊、鼠[16]作为实验动脉置换血管置换模型[17]的报道。一般行长期试验的研究,需要观察小口径血管的组织相容性和血液相容性,多利用大的动物作为置换模型[18]。而急性期的实验,多采用小动物作为制备的动物模型。其中猪[19-20]和羊一般利用颈动脉作为置换的血管,狗一般利用股动脉作为置换的血管,鼠一般利用腹主动脉作为支架植入的血管。但是,这些动物模型各有其明显的缺点。猪和羊的颈动脉做为实验的模型缺点有[21]:颈动脉可以经过大脑动脉环将血液循环至脑部,即使实验血管发生了栓塞,动物一般不会有明显的症状,所以就不能通过实验动物的症状进行观察,必须经过超声、CT [22]、DSA造影来明确是否有血管栓塞,但上述检查操作不便,有创伤性,无法经常随访检查,不可能做到24 h持续检查,常常导致不能及时地发现血管栓塞。另外,血管内的血栓是一个变化的过程,形成血栓后无症状,动物血管内的血栓可能进一步变化,如收缩,机化[23]等,有可能有的栓塞已经机化再通了,造影检查可能只是提示血管仍然是通畅的。这样验证的实验血管显然不能应用于临床,人造血管的栓塞,会导致冠脉搭桥患者的急性心肌梗塞,进而可能导致患者的死亡。而上述动物因其丰富的动脉网,即使动脉栓塞了,动物一样活动良好,如果造影检查无法及时进行的话,导致观察不及时,无法准确得到人工血管的栓塞几率。同时,上述大动物的血流量明显高于冠脉搭桥后桥血管的血流量,利用该动物模型验证的小口径血管,无法在人类冠脉搭桥中重复,甚至出现明显不同的试验结果。鼠类等小型啮齿类动物[24],血压与血流量与人类差别较大,对人类疾病的模型可信度有限,已有较多的文献报道显示:在鼠体内试验良好的组织工程血管,上升到人类的细胞水平时,出现了较大的差别,导致试验的结果无法对人类的情况进行预测。故我们希望构建出的小口径血管的动物实验模型,能更好的模仿人类的疾病病情。我们在文献中发现,兔的腹主动脉约2 mm,与人的冠脉相当,是模拟人类冠心病病情,行小血管置换的理想血管,同时,兔腹主动脉的血流量与人冠脉搭桥后大隐静脉桥血管的血流量相当[13]。并且腹主动脉是通向兔下肢和盆腔的唯一血管,栓塞后导致的症状明显。这与其余实验中应用的颈动脉、股动脉有明显区别,为利用症状来观察人工通畅与否打下了基础。
在本研究中,我们利用症状来观察人工血管是否栓塞[25]。因为置换的是兔的腹主动脉,侧支血管也被结扎,该人工血管栓塞后会立即导致兔的盆腔及下肢无血流灌注。于实验中我们发现,小口径人工血管栓塞后兔会立即表现出双下肢瘫痪,肌肉强直,肌张力增高,大小便失禁等,症状非常明显,但这些症状不会导致兔死亡。图 6中的图片可以看到,小口径血管内栓塞形成,动物可以较长时间的存活,为获取标本赢得了时间。在术后的观察随访方面,本研究发现,利用超声进行随访非常方便,重复性好,经济上更可行。利用血管超声探头可以清楚的进行近、远端吻合口血流速度的测量,自体血管和人工血管内直径测量,血管内血流速度测量,并能用超声观察人工血管内的情形。我们应用超声获得了良好的血管内血流速度图形和人工血管的测量图形,可以利用超声在纵轴和横轴上对小口径血管进行测量。这在其余的文献中未能查及。同时利用超声测量优于CTA检查或冠脉造影,它不需要将动物麻醉,不需要特殊的药物和设备,操作简单可行,结合3D超声可以得到血管的立体图像,值得在以后的动物实验中推广。但也有其缺点,该方法无法像造影检查那样得到良好的检查图像,不是血管检查公认的金标准。
在术后常规给予阿司匹林抗聚治疗,剂量为3 mg/kg,主要预防血小板的聚集引起白色血栓,进而进展为血栓栓塞。在兔的喂养过程本研究发现,给予阿司匹林抗聚治疗后,兔容易出现胃肠道出血导致死亡。考虑的原因为:兔粮为粗纤维草料,该类饲料对兔的胃肠道损伤明显,容易并发胃肠道出血或溃疡,特别是给予阿司匹林后。实验中发现,如给予制酸药物,可以有效防止消化道溃疡和消化道出血。我们在实验中发现,有些试验兔出现胃溃疡和消化道出血,并突发猝死的。在给予雷尼替丁后未再有上述现象出现。
在动物喂药方面,以往的文献显示是饲养员戴手套,将药物按在动物的咽后壁使动物吞服。该方法有较大的危险性,容易导致饲养员被动物咬伤,同时兔口腔较小,人手指相对其较大,强行喂药可以导致兔口腔的损伤。我们改进了给药的方法:我们利用1ml的注射器,将注射器前端剪掉,只留下注射器的针筒和推注器,将药物放于注射器内,然后把注射器放于兔的咽后壁,将药物推入。该方面可以避免被兔咬伤,同时可以避免兔口腔较小,人手指无法放入的难题,并且可以提高兔喂药的舒适性。该方法可以应用于其他动物的喂药。
本实验模型的制备尚有不足之处,没有行实验模型的毒理学实验,样本量也较小,观察时间短,需在以后的实验中改进。
本研究首次提出了利用兔来构建小口径人工血管的置换模型,利用动物表现和B超检查观察小口径人工血管的通畅情况,提出了动物饲养和喂药过程中的改进方法。该动物实验模型能更好的模仿人类冠脉搭桥后的血流动力学变化,值得推广。
| [1] | Swartz DD, Andreadis ST. Animal models for vascular tissueengineering[J]. Curr Opin Biotechnol, 2013, 24(5): 916-25. DOI: 10.1016/j.copbio.2013.05.005. |
| [2] | Bolli R, Tang XL, Sanganalmath SK, et al. Intracoronary delivery of autologous cardiac stem cells improves cardiac function in a porcine model of chronic ischemic cardiomyopathy[J]. Circulation, 2013, 128(2): 122-31. DOI: 10.1161/CIRCULATIONAHA.112.001075. |
| [3] | Johnson LL, Tekabe Y, Kollaros M, et al. Imaging RAGE expression in atherosclerotic plaques in hyperlipidemic pigs[J]. EJNMMI Res, 2014, 4: 26. DOI: 10.1186/s13550-014-0026-6. |
| [4] | Lu G, Cui SJ, Geng X, et al. Design and preparation of polyurethanecollagen/heparin-conjugated polycaprolactone double-layer bionic small-diameter vascular graft and its preliminary animal tests[J]. Chin Med J (Engl), 2013, 126(7): 1310-6. |
| [5] | Koobatian MT, Row S, Smith RJ, et al. Successful endothelialization and remodeling of a cell-free small-diameter arterial graft in a large animal model[J]. Biomaterials, 2016, 76: 344-58. DOI: 10.1016/j.biomaterials.2015.10.020. |
| [6] | Ahmed M, Hamilton G, Seifalian AM. The performance of a small-calibre graft for vascular reconstructions in a senescent sheep model[J]. Biomaterials, 2014, 35(33): 9033-40. DOI: 10.1016/j.biomaterials.2014.07.008. |
| [7] | Ghosh A, Lu G, Su G, et al. Phosphorylation of AKT and abdominal aortic aneurysm formation[J]. Am J Pathol, 2014, 184(1): 148-58. DOI: 10.1016/j.ajpath.2013.09.016. |
| [8] | Feng J, Fitz Y, Li Y, et al. Catheterization of the carotid artery and jugular vein to perform hemodynamic measures, infusions and blood sampling in a conscious rat model[J]. J Vis Exp, 2015, 95. DOI: 10.3791/51881. |
| [9] | Tara S, Kurobe H, Rocco KA, et al. Well-organized neointima of large-pore poly(L-lactic acid) vascular graft coated with poly (L-lactic-co-ε-caprolactone) prevents calcific deposition compared to small-pore electrospun poly (L-lactic acid) graft in a mouse aortic implantation model[J]. Atherosclerosis, 2014, 237(2): 684-91. DOI: 10.1016/j.atherosclerosis.2014.09.030. |
| [10] | Cona MM, Feng Y, Li Y, et al. Comparative study of iodine-123-labeled hypericin and (99m)Tc-labeled hexakis[2-methoxy isobutyl isonitrile] in a rabbit model of myocardial infarction[J]. J Cardiovasc Pharmacol, 2013, 62(3): 304-11. DOI: 10.1097/FJC.0b013e31829b2c6b. |
| [11] | Vlašín M, Lukáč R, Kauerová Z, et al. Specific contrast ultrasound using sterically stabilized microbubbles for early diagnosis of thromboembolic disease in a rabbit model[J]. Can J Vet Res, 2014, 78(2): 133-9. |
| [12] | Bonnard T, Hagemeyer CE. Ferric chloride-induced thrombosis mouse model on carotid artery and mesentery vessel[J]. J Vis Exp, 2015(10): e52838. |
| [13] | Byrom MJ, Bannon PG, White GH, et al. Animal models for the assessment of novel vascular conduits[J]. J Vasc Surg, 2010, 52(1): 176-95. DOI: 10.1016/j.jvs.2009.10.080. |
| [14] | Manno RA, Grassetti A, Oberto G, et al. The minipig as a new model for the evaluation of doxorubicin-induced chronic toxicity[J]. J Appl Toxicol, 2016, 36(8): 1060-72. DOI: 10.1002/jat.v36.8. |
| [15] | Kang MH, Park HM. Evaluation of autologous blood clot subsegmental pulmonary thromboembolism in minimally invasive experimental canine model[J]. Int J Exp Pathol, 2013, 94(5): 329-35. DOI: 10.1111/iep.2013.94.issue-5. |
| [16] | Cheng J, Koenig SN, Kuivaniemi HS, et al. Pharmacological inhibitor of notch signaling stabilizes the progression of small abdominal aortic aneurysm in a mouse model[J]. J Am Heart Assoc, 2014, 3(6): e001064. DOI: 10.1161/JAHA.114.001064. |
| [17] | Zhao H, Chen H, Li H, et al. Remodeling of small intramyocardial coronary arteries distal to total occlusions after myocardial infarction in pigs[J]. Coron Artery Dis, 2013, 24(6): 493-500. DOI: 10.1097/MCA.0b013e328363244b. |
| [18] | Meier LA, Syedain ZH, Lahti MT, et al. Blood outgrowth endothelial cells alter remodeling of completely biological engineered grafts implanted into the sheep femoral artery[J]. J Cardiovasc Transl Res, 2014, 7(2): 242-9. DOI: 10.1007/s12265-013-9539-z. |
| [19] | Houdek K, Moláček J, Třeška V, et al. Focal histopathological progression of porcine experimental abdominal aortic aneurysm is mitigated by atorvastatin[J]. Int Angiol, 2013, 32(3): 291-306. |
| [20] | Juntermanns B, Grabellus F, Zhang H, et al. Vascular and nerval damage after intraoperative radiation therapy of the liver hilum in a large animal model[J]. J Invest Surg, 2014, 27(3): 163-8. DOI: 10.3109/08941939.2013.868961. |
| [21] | Maslov MY, Edelman ER, Pezone MJ, et al. Myocardial drug distribution generated from local epicardial application: potential impact of cardiac capillary perfusion in a swine model using epinephrine[J]. J Control Release, 2014, 194: 257-65. DOI: 10.1016/j.jconrel.2014.09.012. |
| [22] | Ashton JR, Befera N, Clark D, et al. Anatomical and functional imaging of myocardial infarction in mice using micro-CT and eXIA 160 contrast agent[J]. Contrast Media Mol Imaging, 2014, 9(2): 161-8. DOI: 10.1002/cmmi.v9.2. |
| [23] | Fujii T, Fukuyama N, Tanaka C, et al. Visualization of microvessels by angiography using inverse-Compton scattering X-rays in animal models[J]. J Synchrotron Radiat, 2014, 21(Pt 6): 1327-32. |
| [24] | Torii S, Nakazawa G, Ijichi T, et al. Comparison of in vivo longitudinal strength and conformability following stent implantation in rabbit iliac artery[J]. J Invasive Cardiol, 2014, 26(2): 64-9. |
| [25] | Mrówczyński W, Mugnai D, de Valence S, et al. Porcine carotid artery replacement with biodegradable electrospun poly-ecaprolactone vascular prosthesis[J]. J Vasc Surg, 2014, 59(1): 210-9. DOI: 10.1016/j.jvs.2013.03.004. |
 2017, Vol. 37
2017, Vol. 37

