2. 南方医科大学口腔医学院,广东 广州 510515
2. College of Stomatology, Southern Medical University, Guangzhou 510515, China
支架材料作为组织工程学研究的四要素之一,深刻的影响着细胞的生物学行为与培养效率。材料学的应用从天然生物材料、合成有机高分子材料发展向生物陶瓷材料与复合材料。近年来随着组织工程学的进步,研究者们渴望利用组织工程学技术实现牙齿的再生修复[1-2]。国内外学者已对采用传统组织支架技术进行牙再生做出了大量研究,并取得了一定成绩[3-6],但由于牙齿形态结构的复杂与多样性,利用传统组织工程支架进行牙再生存在很多难以解决的问题,比如支架外形受到传统工艺的制约,可重复性较差,且传统组织工程支架中的细胞只能在构建好的材料表面黏附生长,黏附效率较低,难以实现细胞的空间合理分布。
目前,3D打印技术已在医疗领域中逐渐得到应用,属于全世界较为前沿的研究领域之一。本研究采用的3D打印明胶海藻酸钠凝胶支架,与一般组织工程支架相比,其突出优点在于通过3D打印技术,细胞不仅可黏附在支架表面,同时可以生长在支架内部,实现了细胞的立体培养[7-9]。将3D打印技术应用于牙再生,必将极力推进口腔组织工程领域的蓬勃发展。
本研究对3D打印明胶海藻酸钠凝胶支架对人牙髓细胞(HDPCs)黏附增殖的作用进行了初步探索,为后续牙再生领域选择合适的支架材料研究提供了理论基础与依据。
1 材料和方法 1.1 主要仪器与试剂Bioplotter三维生物打印机(Envision TEC,德国);扫描电子显微镜(ZEISS,德国);倒置显微镜、正置显微镜(Olmpus,日本);MD5多功能酶标仪(BD,美国);CO2培养箱(Thermo,美国)。DMEM培养基、胎牛血清、青霉素/链霉素、胰蛋白酶(Hyclone,美国);明胶、海藻酸钠、Ⅰ型胶原酶、台盼蓝(Sigma,美国);Cell Counting Kit CCK8(全式金,中国)。
1.2 HDPCs的体外分离培养与鉴定于南方医院口腔颌面外科门诊收集16~25岁志愿者(知情同意),因阻生或正畸需要而拔除的健康完整恒牙,利用组织块酶消化法[10]培养HDPCs,待细胞长满瓶底70%~80%时,用胰蛋白酶消化传代。取生长良好的第3代细胞经鉴定后用于后续实验。
1.3 3D打印明胶海藻酸钠凝胶支架将海藻酸钠与明胶粉末配成明胶海藻酸钠混合水凝胶。利用Magics X软件设计拟构建矩形模型,将该模型装载于Bioplotter预设软件中。将配置好的水凝胶放置于Bioplotter三维生物打印机的喷头中,设定温控温度37 ℃,可获得溶胶相的明胶海藻酸钠。设定打印速率2 mm/s,微丝中心间距400 μm,将材料逐层打印堆积。之后依次使用质量分数为5%的CaCl2溶液和1%的戊二醛进行交联,交联时间分别为10 min和30 min,交联后蒸馏水漂洗,谷氨酸溶液中除去多余戊二醛。最后将支架放入-20 ℃冻干,48 h后获得冻干支架[11]。
1.4 细胞毒性的测定P3代HDPCs生长至80%汇合后,以5000/孔细胞接种于96孔板中,每孔体积100 μL,放入37 ℃,5% CO2的恒温培养箱中培养24 h待细胞贴壁后,吸取培养液,于96孔中分别加入明胶海藻酸钠支架不同浓度浸提液及含10%胎牛血清的DMEM培养液,使材料浸提液的最终浓度分别为100%,75%,50%,25%。阴性对照为DMEM完全培养液。继续置于培养箱中培养。培养5 d后,于96孔中分别吸取10 μL培养液,加入10 μL CCK-8,继续培养2 h。选择450 nm波长,在多功能酶标仪上测定各孔A值,记录结果。计算出阴性对照及不同浸提液浓度的A均值。以阴性对照的A均值作为100%细胞增殖率,各浓度组的细胞增殖率依据下式求出:P%=各浓度组A均值/阴性对照A均值×100%。然后根据细胞增殖率评价细胞毒性,细胞毒性评级标准表见表 1。
| 表 1 细胞增殖率百分率与细胞毒性等级的对应关系 Table 1 Correlation between the cell proliferation rate and cytotoxicity grade |
将Co60辐照灭菌后的冻干支架置于24孔板中,每孔加入500 μL DMEM培养基,使支架达到溶胀平衡后吸取多余培养基,分别采用两种细胞接种方法接种HDPCs。方法1(低浓度细胞悬液法):将培养的P3代HDPCs稀释至密度为1×106/mL,用加样枪吸取1 mL细胞悬液后,直接滴加至支架中,置于37 ℃,5% CO2培养箱中培养,每2 d更换1次培养液。方法2(高浓度细胞浓缩液法):将培养的P3代HDPCs稀释至密度为1×106/mL,吸取1 mL细胞悬液后离心后弃上清,加入50 μL培养基,将50 μL高浓度细胞悬液滴加至支架中,于培养箱中培养4 h后,再向培养孔中加入1 mL培养液,每2 d更换1次培养液。
1.5.1 细胞经两种接种方法后在材料表面的生长情况两种不同接种细胞方法的材料,在相同条件下恒温孵箱中培养5 d后,分别吸去培养基,PBS漂洗3次,加入2.5%的戊二醛固定1 h后,PBS漂洗,梯度酒精脱水,风干后喷金,利用ZEISS扫面电镜观察不同接种方法的材料表面,细胞生长与黏附情况。
1.5.2 细胞经两种接种方法后在材料表面的存活率两种不同接种细胞方法的材料,在相同条件下恒温孵箱中培养5 d后,分别吸去培养基,将每孔中的材料用无菌镊转移至一空白新孔中,PBS漂洗3次,每块材料加入500 μL,0.25%的胰蛋白酶,用加样枪轻轻吹打,分别将每块材料中的细胞消化下来后用0.4%台盼蓝进行染色计数,死细胞被染成明显的蓝色,活细胞仍为无色透明状。分别计数高浓度与低浓度细胞接种法材料上的细胞总数与活细胞数,根据公式:活细胞率(%)=活细胞总数(/活细胞总数+死细胞总数)×100%计数两种接种方法培养后材料内细胞总数与活死率。实验重复3次后,将两组接种方法获得的细胞总数与计算出的活细胞率分别进行统计分析。
1.6 统计学分析采用SPSS19.0统计软件进行统计分析,不同浓度下的细胞增殖率比较采用单因素方差分析进行多组比较,在进行方差齐性检验证明方差齐后,用Bonferroni法进行不同浓度的材料浸提液组与阴性对照组的两两比较。台盼蓝计数低浓度与高浓度接种法接种后材料上的细胞数量与活细胞率,采用两独立样本t检验进行两组间比较。P<0.05表明差异有统计学意义。
2 结果 2.1 HDPCs的分离培养图 1为用于实验的第3代HDPCs,细胞为长梭形的成纤维样细胞,呈单层排列,生长状态良好,呈放射状或纤维状排列。

|
图 1 实验用第3代HDPCs Figure 1 Morphology of third-passage HDPCs (Original magnification: ×40). |
3D打印后micro-CT扫描完整支架后进行结构重建,电脑软件获得micro-CT扫描结果(图 2),可见支架呈7层堆积排列,为一10 mm×10 mm×2 mm矩形结构。扫描电镜观察3D打印的材料放入-20 ℃后获得的冻干支架,可见材料内部呈三维交错排列,为多孔结构,微丝中心间距400 μm,每层间沉积纤维取向为60°(图 3)。

|
图 2 3D打印后micro-CT重建材料结构图 Figure 2 Micro-CT reconstructed material structure after three dimensional printing. |

|
图 3 3D打印后获得冻干支架 Figure 3 Lyophilized scaffolds prepared by 3D printing (×80). |
CCK8法检测不同浓度的材料浸提液对HDPCs的细胞增殖影响,设置材料浸提液浓度分别为100%,75%,50%,25%和0,在孵箱中培养5 d后进行检测,结果发现不同浓度的材料浸提液A值与材料浸提液浓度为0的阴性对照组相比均明显增加,差异具有统计学意义(P<0.05,图 4)。利用不同浓度的材料浸提液组A值平均数,按照公式P%=各浓度组A均值/阴性对照A均值×100%计算不同浸提液浓度组细胞增殖率(P%)。浓度为100%的浸提液对细胞增殖率促进作用最大,计算得细胞增殖率为120%,其次依次为50%,25%,75%,细胞增殖率分别为109%,108%和104%。所有浓度下的材料浸提液分级均为0,不具有细胞毒性。
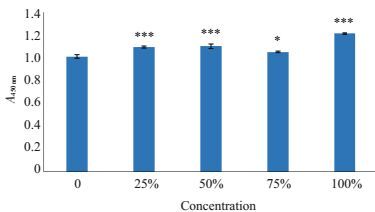
|
图 4 CCK-8法测定不同浓度浸提液的细胞增殖率 Figure 4 Proliferation rate of the cells treated with the aqueous extract of the scaffold material at different concentrations.*P < 0.05, ***P < 0.001 vs. concentration 0 Group. |
观察低浓度与高浓度细胞接种法,在材料表面与纤维中间均可见细胞黏附,如图 5中黄色箭头所示,细胞延展性较好,单位视野内,低浓度细胞悬液法细胞数量少于高浓度细胞浓缩液法。
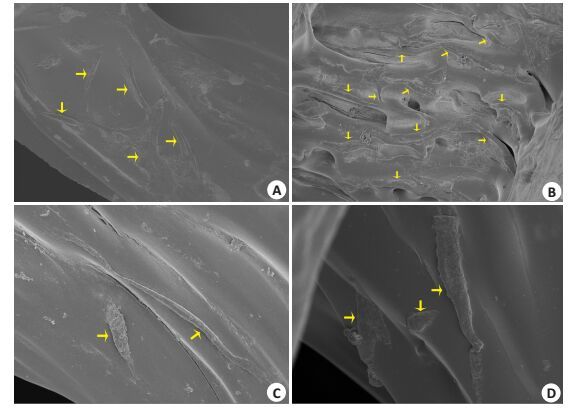
|
图 5 扫描电镜观察高、低浓度接种法细胞黏附情况 Figure 5 Scanning electron microscopy of adhesion of the cells seeded at different concentrations. A, C: Cells seeded at a low concentration(×500, ×1000); B, D: Cells seeded at a high concentration(×500, ×1000). Arrows indicate HDPCs. |
实验计数所得,低浓度接种法材料内消化脱落平均细胞数量为1.1×106个,高浓度接种法消化脱落平均细胞数量为1.6×106个,差异具有统计学意义(P<0.05)。低浓度接种法细胞存活率为91.14%±2%,高浓度接种法细胞存活率为91.28±2%,两种方法细胞存活率相似,差异无统计学意义。
3 讨论支架材料作为组织工程再生的必备条件之一,已成为学者们的研究热点。理想的支架材料必须具有良好的生物相容性、生物降解性、生物力学性能及材料-细胞界面关系等特点。
明胶与海藻酸钠[12-13]作为已知的天然生物聚合物材料,产生的水凝胶在组织工程与药物递送中的应用已得到认可[14-15]。本实验采用戊二醛化学交联后的明胶与海藻酸钠构成的复合水凝胶支架,其与细胞外基质具有化学相似性[16],且二者的结合也有效解决了传统水凝胶支架材料机械强度较弱的问题[17],相较单独使用两种水凝胶材料,明胶与海藻酸钠通过化学交联结合将有效提高二者的生物学稳定性与物理机械性能[18]。同时与传统的二维明胶海藻酸钠复合支架相比,本实验采用3D打印技术,利用Bioplotter软件精确计算,制备出的多孔支架具有100%的连通性,可精确控制支架内部连通孔隙率与孔直径,实现了细胞的空间合理分布,为细胞的营养物质、氧气和生物活性物质的输送提供合理的微环境,具有良好可重复性[19]。
牙髓牙本质复合体作为牙齿的主体,体外能否成功形成生理性的牙髓牙本质复合体样结构是构建组织工程牙齿的重要环节。在牙齿受到龋损、磨损、外伤等刺激时,牙髓内未分化的间充质细胞将被激活分化为成牙本质样细胞[20-21],因此牙髓细胞能否在支架材料上良好附着并增殖生长最终分化形成能分泌产生牙本质的成牙本质样终末细胞则十分关键[22-23]。适用于牙髓组织再生的支架材料必须能够最佳有效的模仿类似牙根的复杂立体环境,同时能够促进细胞的黏附与迁移[22, 24]。
本实验将HDPCs作为种子细胞研究3D打印的明胶海藻酸钠支架是否具有细胞毒性,材料浸提液的结果显示,25%、50%、75%、100%浓度的浸提液组相比阴性对照的普通培养基组,均未抑制细胞增殖,且整体随着材料浓度的增大,细胞增殖率也出现明显增加。因此我们认为,明胶海藻酸钠混合水凝胶细胞相容性好,无细胞毒性,并且材料浸提液可能能够促进牙髓细胞的增殖。大量对材料与生物体相互作用的机制的基础研究表明,组织与器官中细胞的行为除了受到基因序列与蛋白质的调控外,还明显受到外界环境因素的影响如细胞与细胞外基质的相互作用[25]。明胶作为一种动物胶原蛋白的水解产物,是皮肤、骨和其它结缔组织的主要成分,而胶原纤维则是一种主要的牙髓细胞外基质,因而我们推测材料浸提液中可能存在模拟HDPCs细胞外基质作用,促进细胞营养物质的交换与生长因子的聚集,从而一定程度上促进了HDPCs的生长与增殖。这一研究发现在国内外研究中仍鲜有涉及。当然,为了证明牙髓细胞在支架材料内模仿体内环境仍能促进增殖,开展体内实验也是本课题组正在进行研究的内容。
扫面电镜与台盼蓝结果显示,HDPCs在材料表面成功黏附且生长良好,低浓度细胞悬液与高浓度细胞浓缩液接种法细胞存活率均达到91%±2%,细胞存活率较高。两种方法接种细胞时细胞数量相同,5d后胰酶消化材料内细胞台盼蓝计数,由于两种方法在接种与消化后均会存在细胞损失,但消化后细胞计数均超过细胞原始量1×106个,证明HDPCs在支架内可增殖,且先滴加高浓度的细胞浓缩液更有利于细胞的黏附,材料内细胞数量与滴加低浓度细胞悬液相比明显增加。寻找方便快捷且高效的细胞接种方式是体外构建工程化组织的一个重要环节,静态接种则由于操作简单,是一种最常见的接种方式[26-28]。本实验结果发现先滴加高浓度的细胞浓缩液更有利于细胞的黏附,分析原因是由于直接滴加较大体积的细胞悬液于材料表面,只有部分细胞随液体向材料内部扩散,其余细胞则在重力作用下堆积在材料表面,导致材料表面有大量细胞黏附,内部细胞较少。而高浓度的细胞悬液则可避免此类问题,但细胞密度过大又易导致细胞结团,造成孔隙堵塞,这也是本研究的不足之处。因此,寻找更佳的细胞接种密度与接种方法也是本课题组下一步的研究方向。
综上所述,本实验证实3D打印的明胶海藻酸钠凝胶支架能够为HDPCs的生长提供适宜微环境,促进细胞的生长与增殖,可作为组织工程牙再生中的支架材料。将3D打印的明胶海藻酸钠凝胶支架与具备自我更新和多向分化潜能的人牙髓细胞[29-30]共培养应用于牙再生,预期将有良好的应用前景。
致谢: 感谢南方医院中心实验室、华南理工大学为本实验提供实验设备。| [1] | 张琳琳, 安莹, 陈发明, 等. 牙源性干细胞的研究进展[J]. 实用口腔医学杂志, 2015, 31(03): 425-31. |
| [2] | 薛世华, 吕培军, 王勇, 等. 人牙髓细胞共混物三维生物打印技术[J]. 北京大学学报:医学版, 2013, 45(01): 105-8. |
| [3] | Sonoyama W, Liu Y, Fang D, et al. Mesenchymal stem cellmediated functional tooth regeneration in swine[J]. PLoS One, 2006, 1: e79. DOI: 10.1371/journal.pone.0000079. |
| [4] | Huang GT, Yamaza T, Shea LD, et al. Stem/progenitor cellmediated de novo regeneration of dental pulp with newly deposited continuous layer of dentin in an in vivo model[J]. Tissue Eng Part A, 2010, 16(2): 605-15. DOI: 10.1089/ten.tea.2009.0518. |
| [5] | Kim K, Lee CH, Kim BK, et al. Anatomically shaped tooth and periodontal regeneration by cell homing[J]. J Dent Res, 2010, 89(8): 842-7. DOI: 10.1177/0022034510370803. |
| [6] | Wang Y, Preston B, Guan G. Tooth bioengineering leads the next generation of dentistry[J]. Int J Paediatri Dent, 2012, 22(6): 406-18. DOI: 10.1111/ipd.2012.22.issue-6. |
| [7] | 刘丰, 张人佶, 颜永年, 等. 明胶/海藻酸钠组织工程支架的快速成形[J]. 清华大学学报:自然科学版, 2006, 46(08): 1357-60. |
| [8] | Peltola SM, Melchels FP, Grijpma DW. A review of rapid prototyping techniques for tissue engineering purposes[J]. Ann Med, 2008, 40(4): 268-80. DOI: 10.1080/07853890701881788. |
| [9] | Wang X, Yan Y, Zhang R. Recent trends and challenges in complex organ manufacturing[J]. Tissue Eng Part B Rev, 2010, 16(2): 189-97. DOI: 10.1089/ten.teb.2009.0576. |
| [10] | 麻丹丹, 高杰, 吴补领. 改良组织块酶消化法培养人龋损牙髓干细胞的实验研究[J]. 牙体牙髓牙周病学杂志, 2011, 21(7): 371-4. |
| [11] | Pan T, Song WJ, Cao XD, et al. 3D bioplotting of gelatin/alginate scaffolds for tissue engineering: influence of crosslinking degree and pore architecture on physicochemical properties[J]. J Mater Sci Technol, 2016, 32(9): 889-900. DOI: 10.1016/j.jmst.2016.01.007. |
| [12] | Draget KI, Strand B, Hartmann M, et al. Ionic and acid gel formation of epimerised alginates; the effect of AlgE4[J]. Int J Biol Macromol, 2000, 27(2): 117-22. DOI: 10.1016/S0141-8130(00)00115-X. |
| [13] | 孙磊, 孟国林, 窦榆生, 等. 海藻酸盐与异种骨构建组织工程载体的适宜浓度(英文) J][J]. 中国组织工程研究与临床康复, 2007, 11(31): 6295-7. DOI: 10.3321/j.issn:1673-8225.2007.31.008. |
| [14] | Liao H, Zhang H, Physical CD, et al. And biological properties of rapid in situ gelable hydrogels composed of oxidized alginate and gelatin derived from Marine or porcine sources[J]. J Mater Sci Mater Med, 2009, 20(6): 1263-71. DOI: 10.1007/s10856-009-3694-4. |
| [15] | Nguyen TB, Min YK, Lee BT. Nanoparticle biphasic Calcium phosphate loading on gelatin-pectin scaffold for improved bone regeneration[J]. Tissue Eng Part A, 2015, 21(7/8): 1376-87. |
| [16] | Xu M, Wang X, Yan Y, et al. An cell-assembly derived physiological 3D model of the metabolic syndrome, based on adipose-derived stromal cells and a gelatin/alginate/fibrinogen matrix[J]. Biomaterials, 2010, 31(14): 3868-77. DOI: 10.1016/j.biomaterials.2010.01.111. |
| [17] | Billiet T, Vandenhaute M, Schelfhout J, et al. A review of trends and limitations in hydrogel-rapid prototyping for tissue engineering[J]. Biomaterials, 2012, 33(26): 6020-41. DOI: 10.1016/j.biomaterials.2012.04.050. |
| [18] | Hu X, Lu L, Xu C, et al. Mechanically tough biomacromolecular IPN hydrogel fibers by enzymatic and Ionic crosslinking[J]. Int J Biol Macromol, 2015, 72: 403-9. DOI: 10.1016/j.ijbiomac.2014.08.043. |
| [19] | 李客楼, 李宗安, 朱莉娅, 等. 3D打印技术在医疗领域的应用进展[J]. 机械设计与制造工程, 2016, 45(09): 11-6. DOI: 10.3969/j.issn.2095-509X.2016.09.002. |
| [20] | Kawashima N. Characterisation of dental pulp stem cells: a new horizon for tissue regeneration[J]. Arch Oral Biol, 2012, 57(11): 1439-58. DOI: 10.1016/j.archoralbio.2012.08.010. |
| [21] | Farges JC, Alliot-Licht B, Renard E, et al. Dental pulp defence and repair mechanisms in dental caries[J]. Mediators Inflamm, 2015, 2015: 230251. |
| [22] | Cavalcanti BN, Zeitlin BD, Nör JE. A hydrogel scaffold that maintains viability and supports differentiation of dental pulp stem cells[J]. Dent Mater, 2013, 29(1): 97-102. DOI: 10.1016/j.dental.2012.08.002. |
| [23] | Rosa V, Zhang Z, Grande RH, et al. Dental pulp tissue engineering in full-length human root canals[J]. J Dent Res, 2013, 92(11): 970-5. DOI: 10.1177/0022034513505772. |
| [24] | Jones TD, Kefi A, Sun S, et al. An optimized injectable hydrogel scaffold supports human dental pulp stem cell viability and spreading[J]. Advances in medicine, 2016, 2016: 7363579. |
| [25] | Wang K, Nune KC, Misra RD. The functional response of alginategelatin-nanocrystalline cellulose injectable hydrogels toward delivery of cells and bioactive molecules[J]. Acta Biomater, 2016, 36: 143-51. DOI: 10.1016/j.actbio.2016.03.016. |
| [26] | 刘延晓, 贝抗胜. 组织工程骨体外构建和培养的相关技术进展[J]. 中国组织工程研究, 2013, 17(46): 8090-5. DOI: 10.3969/j.issn.2095-4344.2013.46.018. |
| [27] | Karp JM, Sarraf F, Shoichet MS, et al. Fibrin-filled scaffolds for bone-tissue engineering: An in vivo study[J]. J Biomed Mater Res A, 2004, 71(1): 162-71. |
| [28] | Chim H, Schantz JT. Human circulating peripheral blood mononuclear cells for calvarial bone tissue engineering[J]. Plast Reconstr Surg, 2006, 117(2): 468-78. DOI: 10.1097/01.prs.0000201489.65811.e7. |
| [29] | Didilescu AC, Rusu MC, Nini G. Dental pulp as a stem cell reservoir[J]. Rom J Morphol Embryol, 2013, 54(3): 473-8. |
| [30] | Sloan AJ, Waddington RJ. Dental pulp stem cells: what, where, how[J]. Int J Paediatr Dent, 2009, 19(1): 61-70. DOI: 10.1111/ipd.2009.19.issue-1. |
 2017, Vol. 37
2017, Vol. 37

