2. 中国科学院大学存济医学院,北京 100049
2. Savaid Medical School, University of Chinese Academy of Sciences, Beijing 100049, China
肥胖是糖尿病、心血管疾病和牙周疾病的重要危险因素[1],被认为是一种轻度的全身炎症状态[2-3]。肥胖的状态可以激发脂肪组织中的巨噬细胞聚集,并发生表型转换,从而释放炎性细胞因子。也可以通过激活肝脏中的枯否式细胞,引起细胞因子的释放,引起系统性的胰岛素抵抗和炎症[4-5]。牙周炎是侵犯牙周支持组织的慢性炎症性破坏性疾病。有报道称,体重指数,腰围(腹型肥胖),血脂水平和皮下体脂肪的百分比,与牙周炎的感染程度呈正相关[6-7]。但肥胖如何影响牙周炎症的发生发展,和牙周炎的感染程度、牙周治疗是否能对肥胖引起的代谢紊乱情况产生不同的影响及影响机制等等方面的问题,目前尚未明确[8]。近年来,有关胰岛素信号通路的研究发现,剔除了胰岛素受体底物IRS-1,IRS-2基因的纯合子大鼠的体内发生了严重的胰岛素抵抗和血糖升高,向我们提示了IRS-1,IRS-2在胰岛素抵抗机制中的重要作用[9]。本研究通过建立牙周炎和肥胖大鼠模型,检测实验大鼠各项血液指标及病理切片,探讨牙周炎和牙周干预治疗对肥胖大鼠牙周炎的控制、胰岛素抵抗及脂代谢水平的影响。
1 材料和方法 1.1 实验动物分组及饲养选择检疫合格的4周龄SPF级雄性SD大鼠45只,随机挑选10只以普食喂养作为空白对照组(C组),其余35只饲喂高脂食物[10]。成功建立肥胖模型后(肥胖组大鼠体质量为750.80±77.06 g,对照组大鼠体质量为651.08±49.36 g;肥胖组体质量大于对照组15%),筛出肥胖不合格的5只后,随机挑选10只肥胖大鼠作为肥胖组(简称O组),挑选其余的20只肥胖大鼠在20周龄时,进行牙周结扎,诱导实验性牙周炎。4周后,剔除死亡的4只大鼠死亡,将剩余的16只大鼠中随机挑选8只拆除结扎线并进行牙周基础治疗(包括龈上洁治,龈下刮治,1%过氧化氢液+生理盐水冲洗,上碘甘油)作为牙周治疗组(简称T组)和其余8只未做牙周治疗为牙周炎复合肥胖组(简称P组,即未治疗组)。2周后,过量麻醉处死大鼠。
1.2 采血时间及检测指标 1.2.1 采血时间所有实验组大鼠在处死前,禁食12 h,从眼底静脉丛采血2 mL。
1.2.2 检测指标血脂4项:血清甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC),采用比色法测定,试剂盒由北京中生生物工程高技术公司生产。
空腹血糖:用氧化酶法测定4组大鼠空腹血糖浓度。葡萄糖检测试剂盒(南京建成生物工程研究所)。
胰岛素:取离心后的血清,采用ELISA方法检测。
胰岛素抵抗指数HOMA-IR:HOMA-IR= In空腹血糖(mmol/L)×空腹胰岛素(mIU)/22.5。
1.3 实时定量PCR检测肝脏中IRS-1,IRS-2的表达根据试剂盒操作说明用实时定量PCR检测IRS-1,IRS-2在胰腺组织中的表达。实验步骤包括:总RNA抽提→反转录→定量PCR→PCR扩增。引物序列大小见表 1。每个样品均设定3个平行复孔,取平均值。用ΔΔCT法计算。
| 表 1 基因引物序列及扩增产物大小 Table 1 Primer sequence for q RT-PCR |
在牙周治疗后2周,腹腔注射10%水合氯醛1 mL/100 g致死4组大鼠。取上颌第1、2恒磨牙的颌骨组织块,生理盐水清洗,4%多聚甲醛溶液固定48 h,滴水条件下行组织修正,放入EDTA脱钙液(pH=7)4 ℃脱钙8周,包埋,切片,HE染色,显微镜下观察组织结构。
1.5 肝脏标本的制作处死大鼠后,解剖。分离肝脏,称质量,生理盐水冲洗。用锐利的刀片将肝脏分为2 cm×2 cm大小组织块数块。取部分肝脏组织块置入液氮,用于液氮冷冻研磨,裂解,提取总RNA。部分组织块用4%多聚甲醛固定24 h后对样本进行脱水,包埋,切片HE染色,显微镜下观察组织结构。
1.6 统计分析采用SPSS18.0统计软件处理数据,计量资料以均数±标准差来表示,多组之间的比较采用单因素方差分析,两组计量资料的比较采用独立样本t检验,检验水准设为α=0.05(双侧)。
2 结果 2.1 4组大鼠的胰岛素抵抗HOMA-IR值与血脂变化情况如表 2,胰岛素抵抗HOMA-IR值:4组比较均有差异(P<0.05)。高脂饮食诱导的肥胖大鼠较正常组大鼠HOMA-IR值升高。其中牙周炎的肥胖大鼠(P组)HOMA-IR值最高,经牙周治疗后,HOMA-IR值出现降低。血脂变化:四组大鼠的TC,LDL-C值比较:P组最高、C组最低(P<0.05),其余两组之间比较差异无统计学意义(P>0.05)。HDL-C值比较:P组最低、C组最高(P<0.05),其余两组之间比较差异无统计学意义(P<0.05)。TG值比较:C组最低(P<0.05),其余三组之间两两比较差异无统计学意义(P>0.05)。
| 表 2 各组HOMA-IR与血脂的变化 Table 2 HOMA-IR and serum lipid levels in each group |
IRS-1,IRS-2的溶解曲线和扩增曲线分析:未见杂峰,单一峰,无非特异荧光,定量准确。4组大鼠肝脏湿重比较:相比正常组(C group)大鼠,其余3组肥胖大鼠肝湿重增加明显。IRS-1,IRS-2实时定量PCR结果显示:与正常对照组相比,其余3组胰岛素底物的表达量出现了不同程度的降低,肥胖合并牙周炎组(P group)肥胖大鼠的底物表达量最低(P<0.05),牙周治疗组(T group)与肥胖组(O group)表达量相近,两组之间比较无统计学差异(P>0.05,表 3)。
| 表 3 各组肝重量及IRS-1,IRS-2的QPCR结果 Table 3 Liver weight and QPCR results of IRS-1 and IRS-2 in each group |
肉眼观:正常对照组大鼠(图 1A)肝色鲜红,边缘锐利,质韧;肥胖组大鼠(图 1B~D)肝脏外观颜色暗红淤血,体积明显增大,肝小叶融合不清,边缘变钝,质硬,切面油腻,组织变松脆。牙周炎合并肥胖组大鼠出现了更明显的肝小叶融合,肝门变大,体积增大,脂肪增多。
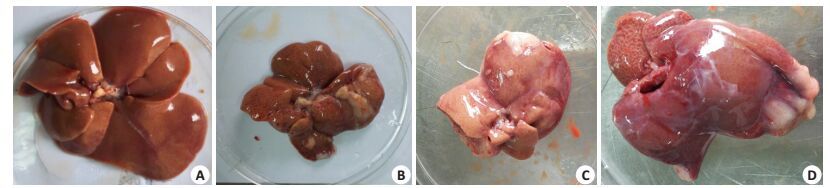
|
图 1 肝脏肉眼观 Figure 1 Gross observation of the liver in each group. A: Control group; B: Obese group; C: Obesity with periodontitis group; D:Periodontal treatment group. |
镜下观:正常组(图 2A)肝细胞体积大,胞质丰富,嗜酸性。高脂饮食诱导的大鼠(图 2B~D)均出现了弥漫性肝细胞脂肪变性,且有小叶内炎症、汇管区炎症,炎症细胞浸润以单核细胞、淋巴细胞为主,有少量中性粒细胞浸润,未见明显纤维化。而牙周炎合并肥胖组出现了更为明显的脂肪变性,脂变肝细胞以中央静脉周围最多,细胞体积明显增加,胞浆内充满大量脂肪空泡,界限不清,肝窦狭窄。部分肝细胞溶解坏死。血管内出现了大量的炎细胞浸润。
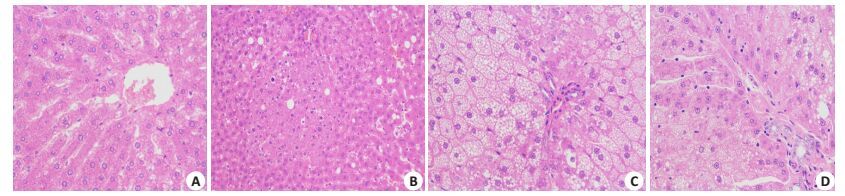
|
图 2 4组大鼠肝脏HE染色切片镜下观 Figure 2 Pathological examination of liver sections in each group (HE staining, original magnification: × 400). A: Control group; B: Obese group; C: Obesity with periodontitis group; D: Periodontal treatment group. |
大鼠第二磨牙的牙周附着水平(clinical attachment level, CAL)的比较:经牙周结扎后的P组大鼠的CAL(12.47 mm±0.43)和T组大鼠的CAL(12.23 mm±0.38)较未行牙周结扎的C组的CAL(1.84 mm±0.09)和O组的CAL(2.06 mm±0.11)出现了明显的升高(P,T组与C,O组之间比较,差异有统计学意义,P<0.05),提示出现了严重的牙周附着丧失。
镜下观察,HE染色:P组(图 3C)和T组(图 3D)可见牙龈复层鳞状上皮破坏明显,沟内上皮出现糜烂,有炎细胞浸润,结合上皮向根方增殖,形成牙周袋。有附着丧失(结合上皮位于牙釉质骨质界的根方)。牙槽骨部分吸收至根中部,提示牙周炎建模成功。牙周治疗组大鼠的牙龈上皮无明显糜烂和溃疡,牙周治疗组大鼠的牙龈上皮无明显糜烂和溃疡好转,见新生纤维组织,炎细胞浸润情况有改善。
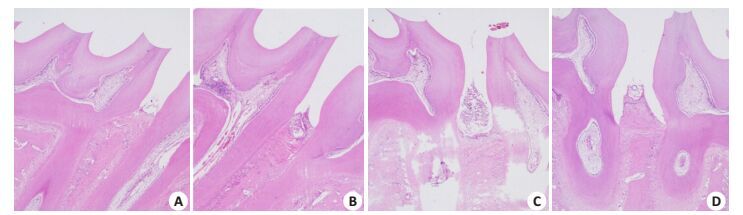
|
图 3 4组大鼠上颌骨切片的病理学比较 Figure 3 Pathological examination of the upper jaw in each group (HE staining, ×400). A: Control group; B: Obese group; C: Obesity with periodontitis group; D: Periodontal treatment group. |
肥胖已经日益成为一个全球性的健康隐患,肥胖的人群通常伴随有免疫性的或者炎症性的问题。它与许多全身性的疾病(如:高血压、Ⅱ型糖尿病、脑卒中、冠心病等)密切相关,是诱发疾病的重要危险因素。肥胖的特点是增加脂肪的储存,在外周组织,如骨骼肌和肝脏中扩大的脂肪组织的质量,促进胰岛素抵抗的发展[11]。脂肪组织的扩张可导致巨噬细胞浸润增加和引起促炎性细胞因子如TNF-α和IL-6等的分泌,促进胰岛素抵抗的发展。从而导致系统性的炎症[12-14]。目前,已经有大量的研究证明了,肥胖状态下的人群罹患牙周炎的风险较正常人群高[15-16]。牙周炎是发生在牙周组织的慢性感染性疾病。当代研究认为,它不仅仅是发生在口腔内的慢性疾病,它与许多系统性疾病有着密切的联系。发生于牙周组织的长期轻度炎症,也会加重其他器官的感染。牙周治疗可能通过控制牙周致病菌感染及内毒素释放,下调炎性细胞因子(TNF-α,IL-6等)的产生,减轻胰岛素抵抗而改善代谢紊乱的情况[17-18]。本实验研究中也发现,进行基础牙周治疗的T组与未行治疗的P组大鼠比较,HOMA-IR值出现下降,说明胰岛素抵抗的情况开始好转,两者比较,差异有统计学意义(P<0.05)。颌骨切片提示,治疗组的炎细胞浸润减少,出现了新生纤维组织,说明牙周治疗对于控制肥胖大鼠炎症及胰岛素抵抗方面起到了一定的作用。
本研究发现,高脂喂养的实验组大鼠肝脏切片均出现了肝细胞弥漫性的脂肪变性,镜下观察经牙周结扎的肥胖大鼠肝脂变情况更为严重。通过对比四组大鼠的脂代谢水平发现,P组大鼠血脂水平:与高血脂正相关的指数LDL-C,TC值最高,而与高血脂负相关的HDL-C值最低,组间比较差异有统计学意义(P<0.05)。上述情况进一步证实了,关于牙周炎加重肥胖大鼠全身炎症水平,影响代谢紊乱情况的推测,也说明了胰岛素抵抗与血脂代谢紊乱有一定的关联。这可能是因为肥胖引起的胰岛素抵抗使周围组织对胰岛素不敏感使胰岛素效应减弱,并抑制脂肪组织的脂解作用。从而引起血游离脂肪酸和甘油三酯浓度增高[19]。而牙周炎可能通过牙周致病菌及其毒性产物刺激IL-6、TNF-α、PEG2等促炎细胞因子上调,从而引起胰岛素抵抗的方式影响代谢[18-19]。
胰岛素受体底物IRS属于细胞质中的接头蛋白,主要连接胰岛素受体和多种效应分子,IRS主要通过PI3K激活途径发挥作用,是β细胞胰岛素分泌的重要信号,也是胰岛素多种生物调节作用的中间体。其中IRS-1和IRS-2在胰岛素信号传导通路中起主要作用,且广泛地表达于外周靶组织中[3, 22]。研究发现,剔除IRS-1基因的纯合子大鼠只发生胰岛素抵抗,可导致β细胞代偿性分泌增强;而剔除IRS -2基因的纯合子大鼠不仅胰岛素抵抗严重,血糖也显著升高。在肥胖的情况下,脂肪组织贮存过多导致炎性细胞因子释放。当靶细胞受到刺激后,靶细胞内IR酪氨酸磷酸化水平降低,IRS磷酸化水平升高,使胰岛素信号向下游PI3K的传递受阻,从而削弱胰岛素刺激的骨骼肌葡萄糖摄取,最终引起胰岛素抵抗[23]。相比大量关于糖尿病大鼠牙周炎情况下胰岛素抵抗的研究,国内外目前鲜少有关于肥胖状态下合并牙周炎时是否有IRS表达受抑制从而引起PI3K通路受阻的报道。本研究比较四种状态下的大鼠肝细胞中IRS-1及IRS-2的表达情况,在国内外尚属首次。通过对四组大鼠在同一时间点肝细胞中IRS-1,IRS-2的QPCR分析,我们发现,肥胖大鼠的IRS表达量较正常组出现了明显的下降,而罹患牙周炎后,这种受抑制的情况更加严重,这与胰岛素抵抗的情况和肝脏内的炎症状况基本一致。本实验进一步说明,IRS表达水平影响了肥胖大鼠的胰岛素抵抗的情况,在牙周炎的状态下肥胖大鼠胰岛素抵抗的程度更趋严重。
本实验表明,牙周基础治疗对肥胖大鼠合并的实验性牙周炎的控制及脂代谢水平可能有一定的影响。肥胖人群是牙周炎的易感人群,胰岛素抵抗引起的全身性的炎症加重也可以增加牙周的炎性感染,加重牙周局部组织的破坏。肥胖人群中,由于多余的脂肪沉积,释放炎性的细胞因子,可造成多种系统炎症。因此,我们倡导健康的生活方式和均衡的营养搭配,避免肥胖。对于肥胖及肥胖引起的一系列代谢综合症的患者,应加强口腔卫生宣教、口腔疾病的预防与定期牙周治疗以维护牙周健康。
| [1] | Quispe R, Martin SS, Jones SR. Triglycerides to high-density lipoprotein-cholesterol ratio, glycemic control and cardiovascular risk in obese patients with type 2 diabetes[J]. Curr Opin Endocrinol Diabetes Obes, 2016, 23(2): 150-6. DOI: 10.1097/MED.0000000000000241. |
| [2] | Emanuela F, Grazia M. Inflammation as a Link between obesity and metabolic syndrome[J]. J Nutr Metab, 2012, 2012: 476380. |
| [3] | Choi AJ, Ryter SW. Inflammasomes: molecular regulation and implications for metabolic and cognitive diseases[J]. Mol Cells, 2014, 37(6): 441-8. DOI: 10.14348/molcells.2014.0104. |
| [4] | Cavalcante-Silva LA, Galvão JM, Sales-Neto JD, et al. ObesityDriven gut microbiota inflammatory pathways to metabolic syndrome[J]. Front Physiol, 2015, 6(461): 341. |
| [5] | Cho Y, Lee Y, Kim J. Association between oral health status and body mass index in older adults[J]. JKSDH, 2016, 16(1): 129-36. |
| [6] | Akram Z, Safii SH, Vaithilingam RD, et al. Efficacy of non-surgical periodontal therapy in the management of chronic periodontitis among obese and non-obese patients: a systematic review and meta-analysis[J]. Clin Oral Investig, 2016, 20(5): 903-14. DOI: 10.1007/s00784-016-1793-4. |
| [7] | Song IS, Han K, Park YM, et al. Severe periodontitis is associated with insulin resistance in non-abdominal obese adults[J]. J Clin Endocrinol Metab, 2016, 101(11): 4251-9. DOI: 10.1210/jc.2016-2061. |
| [8] | Zhu M, Nikolajczyk B S. Immune cells link obesity-associated type 2 diabetes and periodontitis[J]. J Dent Res, 2014, 93(4): 346-52. DOI: 10.1177/0022034513518943. |
| [9] | Ekuni D, Tomofuji T, Irie K, et al. Effects of periodontitis on aortic insulin resistance in an obese rat model[J]. Laboratory Investigation, 2010, 90(3): 348-359. DOI: 10.1038/labinvest.2009.141. |
| [10] | Mansor F, Gu HF, Ostenson CG, et al. Labisia pumila upregulates peroxisome proliferator-activated receptor gamma expression in rat adipose tissues and 3T3-L1 adipocytes[J]. Adv Pharmacol Sci, 2013(3): 808914. |
| [11] | Masoodi M, Kuda O, Rossmeisl M, et al. Lipid signaling in adipose tissue: Connecting inflammation & metabolism[J]. Biochim Biophys Acta, 2015, 1851(4): 503-18. DOI: 10.1016/j.bbalip.2014.09.023. |
| [12] | Mcmorrow AM, Connaughton RM, Lithander FE, et al. Adipose tissue dysregulation and metabolic consequences in childhood and adolescent obesity: potential impact of dietary fat quality[J]. Proc Nutr Soc, 2015, 74(1): 67-82. DOI: 10.1017/S002966511400158X. |
| [13] | Gregor MF, Hotamisligil GS. Inflammatory mechanisms in obesity[J]. Immunology, 2011, 29(29): 415-45. |
| [14] | Zimmermann GS, Bastos MF, Dias Gonçalves TE, et al. Local and circulating levels of adipocytokines in obese and normal weight individuals with chronic periodontitis[J]. J Periodontol, 2013, 84(5): 624-33. DOI: 10.1902/jop.2012.120254. |
| [15] | Akram Z, Abduljabbar T, Abu Hassan MI, et al. Cytokine profile in chronic periodontitis patients with and without obesity: a systematic review and Meta-Analysis[J]. Dis Markers, 2016(2016): 4801418. |
| [16] | Gorman A, Kaye EK, Apovian C, et al. Overweight and obesity predict time to periodontal disease progression in men[J]. J Clin Periodontol, 2012, 39(2): 107-14. DOI: 10.1111/jcpe.2012.39.issue-2. |
| [17] | Akram Z, Al-Shareef SA, Daood U, et al. Bactericidal efficacy of photodynamic therapy against periodontal pathogens in periodontal disease: a systematic review[J]. Photomed Laser Surg, 2016, 34(4): 137-49. DOI: 10.1089/pho.2015.4076. |
| [18] | ÖngözDede F, BozkurtDoğan Ş, BallıU, 等. The effect of initial periodontal treatment on plasma, gingival crevicular fluid and salivary levels of 8-hydroxy-deoxyguanosine in obesity[J]. Arch Oral Biol, 2016, 62: 80-5. |
| [19] | 吴南楠, 李强. 代谢综合征的发病机制研究进展[J]. 哈尔滨医科大学学报, 2010, 44(1): 95-8. |
| [20] | 苏媛, 轩东英, 倪佳, 等. 牙周炎对大鼠血清瘦素水平及胰岛素抵抗的影响[J]. 口腔疾病防治, 2014, 22(8): 397-9. |
| [21] | Benguigui C, Bongard V, Ruidavets JB, et al. Metabolic syndrome, insulin resistance, and periodontitis: a cross-sectional study in a middle-aged French population[J]. J Clin Periodontol, 2010, 37(7): 601-8. DOI: 10.1111/cpe.2010.37.issue-7. |
| [22] | Jellusova J, Rickert R. The PI3K pathway in B cell metabolism[J]. Crit Rev Biochem Mol Biol, 2016, 51(1): 95-8. |
| [23] | Becattini B, Marone R, Zani F, et al. PI3Kγ within a nonhematopoietic cell type negatively regulates diet-induced thermogenesis and promotes obesity and insulin resistance[J]. Proc Natl Acad Sci USA, 2011, 108(42): E854-63. DOI: 10.1073/pnas.1106698108. |
 2017, Vol. 37
2017, Vol. 37

