2. 中山大学第五附属医院放射科,广东 珠海 519000;
3. 中国科学院深圳先进技术研究院,广东 深圳 518055
2. Department of Radiology, Fifth Affiliated Hospital of Sun Yat-Sen University, Zhuhai 519000, China;
3. Shenzhen Institute of Advanced Technology of Chinese Academy of Sciences, Shenzhen 518055, China
退变性关节疾病是临床上常见的关节疾患,主要是由于关节长期磨损导致的结果,该疾患主要发生在负重关节[1]。随着我国进入老龄化社会,患病人群逐年增加,该病主要以关节部位慢性疼痛为主,临床上的治疗方法有限,该病治疗周期长,费用昂贵,为社会和家庭带来沉重负担[2-4]。软骨细胞是关节中非常重要的结构组分,损伤后很难修复,而干细胞移植有望作为替代方案修复软骨组织,避免疾病进一步进展[5]。骨髓间充质干细胞是目前研究较为广泛的细胞,取材广泛,价格低廉,研究发现该细胞具有多向分化能力,能体外诱导成软骨细胞,但目前在关节内直接植入干细胞由于关节微环境的问题,分化成软骨细胞结果不理想,而体外培养成软骨细胞或软骨组织再植入损伤部位可能是另一种较为合理的方案,因此寻找一种能明显促进骨髓间充质干细胞成软骨分化的成分对退变性关节病的干细胞治疗有积极意义[6-8]。由于超顺磁氧化铁纳米微粒对骨间充质干细胞向软骨细胞分化过程中的影响目前仍不得而知,严重阻碍超顺磁氧化铁纳米微粒在骨与软骨代谢中的进一步应用,因此本研究旨在通过体外实验探究超顺磁氧化铁纳米微粒对骨髓间充质干细胞向成软骨细胞分化的影响,并探究背后机制,为以后退变性关节疾病的干细胞治疗提供借鉴作用。
1 材料和方法 1.1 材料取原代BMSCs所用的雌性4周大SD大鼠,体质量180~230 g,购至南方医科大学实验动物中心;主要实验仪器与试剂:(1)主要仪器:倒置光学显微镜(型号:TE2000-U,Nikon),荧光定量聚合酶链反应仪(型号:CFX96,Bio-Rad);(2)主要试剂:一抗Col2 α2(CST),一抗aggrecan(CST),一抗MMP13(CST),一抗Ihh(CST),二抗鼠抗(CST),二抗兔抗(CST),一抗PTHrP(CST),一抗β-actin(CST),反转录反应试剂盒(Takara),SYBR® Green I qPCR(Takara),Caspase-8比色测定工具包(凯基生物公司,江苏南京),SPIO(Sigma),α-MEM(Hyclone),胎牛血清(Gibco),阿利新蓝(Sigma),普鲁士蓝(Sigma),余试剂均购置Sigma。
1.2 方法 1.2.1 SD大鼠BMSCs的提取与培养SD大鼠寰枢椎脱臼处死后75%酒精浸泡消毒5 min,在超净台中用眼科剪和眼科镊剥开大鼠腹股沟处皮肤,从髋臼关节处取下小鼠双下肢,PBS清洗粘连毛发,剥离附属肌肉等软组织整理出股骨,浸泡于α-MEM基础培养基中,用一套新的灭菌眼科剪和眼科镊剪开股骨双侧骨端暴露骨髓腔,用1 mL注射器吸取10% FBS的完全培养基冲出骨髓,反复两端交换冲洗,肉眼视骨髓腔中内容物完全冲洗出来后将含有骨髓的完全培养基转移至干净的15 mL离心管,800 r/min低速离心5 min,骨髓重悬后转移至10 cm培养皿中5%的CO2下37 ℃培养,培养基3 d更换1次[9]。
1.2.2 细胞实验的分组与处理取第3代生长良好的大鼠BMSCs按1×105/孔密度接种于6孔板,待细胞融合率达到90%以上时,将细胞分为2组,对照组:成软骨诱导培养基培养;SPIO处理组:成软骨诱导培养基条件下分别以1和5 μg/mL的SPIO培养。成软骨诱导培养基各成分比例为:抗坏血酸50 μg/mL、100 nmol/L地塞米松、100 μg/mL丙酮酸盐、40 μg/mL脯氨酸、50 mg/mL ITS +Premix和TGF-β1 10 ng/mL。药物连续处理9 d,3 d更换1次培养基,37 ℃,5% CO2条件下培养[10]。
1.2.3 Caspase-8比色测定工具包(CCK8法)检测SPIO对BMSCs的细胞毒性第3代BMSCs种于96孔板中,细胞的种植密度为1×105/孔,培养2 d后对细胞进行加药处理,加入SPIO浓度分别为1和5 μg/mL,加药处理3 d,使用CCK8法进行药物细胞毒性检测。每孔加入10 μL的CCK8溶液和90 μL的α-MEM基础培养基,使用酶标仪测量各孔吸光度,CCK8溶液吸收波长为450 nm[11]。
1.2.4 Western blotting检测二型胶原α2,聚集蛋白聚糖,基质金属蛋白酶13对细胞成软骨诱导并加入SPIO(1和5 μg/mL)处理9 d后,在冰上用蛋白裂解缓冲液(每孔100 μL)裂解细胞,收集蛋白,样品金属浴96 ℃处理10 min,10 000 r/min高速离心1 min,取上清,-20 ℃长期储存备用。每条泳道上样20 μg蛋白,用体积分数(V/V)为10%的聚丙烯酰胺凝胶电泳60 min,将凝胶中蛋白电泳转移至硝酸纤维素膜上,脱脂奶粉常温封闭1 h后分别加入一抗(1:2000)冰箱4 ℃过夜孵育,室温TBST溶液清洗3遍,每遍5 min,二抗(1:3000)常温孵育1 h,增强化学发光试剂显色摄像。条带用Image J软件分析,测定灰度值。目的条带与对应的β-actin条带灰度比值为统计结果[12]。
1.2.5 阿利新蓝染色和普鲁士蓝染色第3代BMSCs种于6孔板中,细胞成软骨诱导并加入SPIO(1和5 μg/mL)处理9 d后,对细胞行阿利新蓝染色。具体步骤为:吸去细胞培养基,使用无菌PBS轻柔冲洗2次,每孔加入2 mL的4%多聚甲醛室温固定20 min;PBS冲洗3次,每次3 min,洗掉多余多聚甲醛;按照使用说明书配制阿利新蓝染色和普鲁士蓝染液,现配现用;每孔细胞加入染液1 mL常温孵育20 min;PBS冲洗3遍,每遍3 min,终止染色,苏木素复染。光镜下拍照,Image-Pro Plus software(IPP,美国)软件计数阳性细胞数[13]。
1.2.6 荧光定量聚合酶链反应检测二型胶原α2,聚集蛋白聚糖,基质金属蛋白酶13的mRNA水平对细胞成软骨诱导并加入SPIO(1和5 μg/mL)处理9 d后每孔加入TRIZOL试剂2 mL提取mRNA,获得cDNA程序:预变性Cycle:1,95 ℃ 30 s,Cycle:40,95 ℃ 5 s,60 ℃ 30 s,反应体系:SYBR® Premix Ex TaqTM Ⅱ(2×):12.5 μL,PCR Forward Primer(10 μmol/L):1 μL,PCR Reverse Primer(10 μmol/L):1 μL,DNA模板:2 μL,dH2O(灭菌蒸馏水):8.5 μL。实时定量聚合酶链反应程序文献[14]。
1.3 统计学方法实验数据在SPSS 20.0统计软件中运用单因素方差分析。首先行方差齐性检验,若结果方差齐,则组间多重比较采用LSD法;若结果方差不齐组间多重比较采用Dunnett's T3法。P<0.05为差异具有统计学意义,定量数据均采用均数±标准差表示。
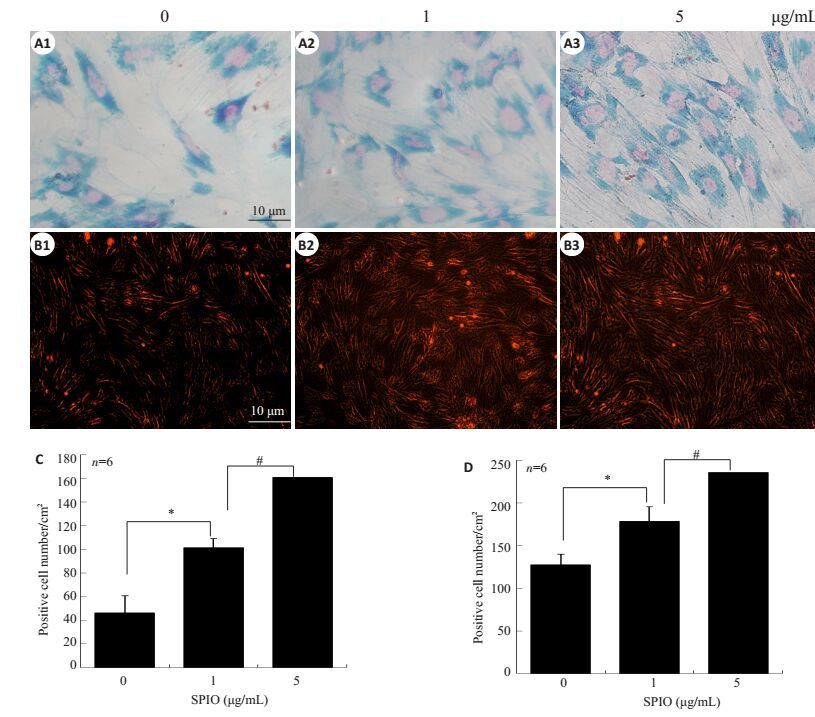
2 结果 2.1 SPIO体外与大鼠骨髓间充质干细胞亲和力检测大鼠原代BMSCs常规培养并加药SPIO(1 μg/mL和5 μg/mL)2 d,行普鲁士蓝染色(图 1A1~A3和C)提示随着SPIO(1 μg/mL和5 μg/mL)浓度增大,阳性细胞数明显增加,差异具有统计学意义(图 1A1~A3和C);行红光激发实验提示随着SPIO(1 μg/mL和5 μg/mL)浓度增大,阳性细胞数明显增加,差异具有统计学意义(图 1B1~B3和D)以上结果提示SPIO与大鼠BMSCs具有生物相容性,且随着SPIO浓度增加,细胞亲和的SPIO量也相应增加。
|
图 1 BMSCs摄取SPIO实验 Figure 1 SPIO absorption test of the BMSCs. A1-A3: Prussian blue staining of BMSCs cultured with SPIO (1 and 5 μg/mL)for 2 days; B1-B3: Fluorescence excitation assay of BMSCs cultured with SPIO (1 and 5 μg/mL) for 2 days; C:Quantitative analysis of positively stained cells by Prussian blue; D: Quantitative analysis of the positively stained cells (red) in fluorescence excitation assay. Data are shown as Mean±SD. *P < 0.05, #P < 0.05. |
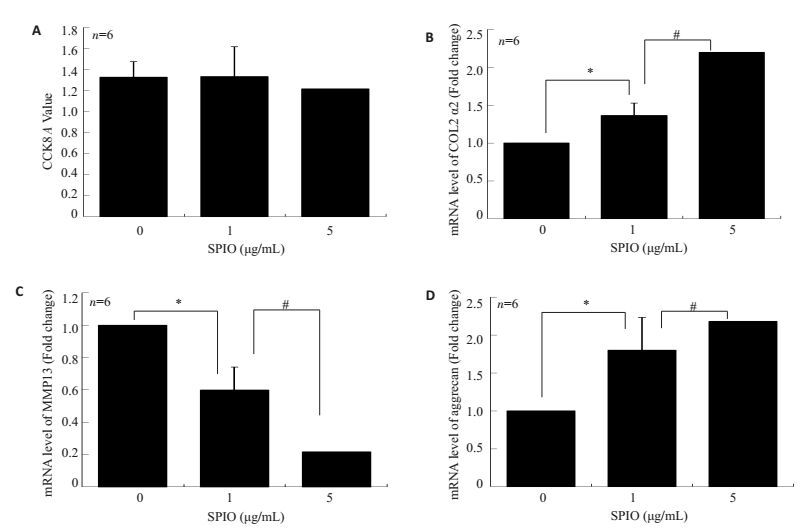
SPIO处理2 d后对大鼠BMSCs行CCK8细胞毒性实验发现,在实验所涉及SPIO浓度(1 μg/mL和5 μg/mL)下SPIO对大鼠BMSCs未见明显毒性作用,差异无统计学意义(P>0.05,图 2A)。
|
图 2 SPIO对软骨相关基因表达的影响 Figure 2 Effect of SPIO on mRNA expressions of chondrocyte marker genes. A: CCK8 assay of BMSCs cultured with SPIO (1and 5 μg/mL) for 2 days; B, C, D: Q-PCR for detecting COL2 α2, MMP13 and aggrecan mRNAs, respectively, in BMSCs cultured with SPIO (1 and 5 μg/mL) for 2 days. Data are shown as Mean±SD. *P < 0.05, #P < 0.05. |
成软骨诱导条件下BMSCs常规培养并加药SPIO(1和5 μg/mL)9 d,行荧光定量PCR,结果提示和对照组相比,SPIO 1 μg/mL组COL2 α2(图 2B)和aggrecan(图 2D)的mRNA表达量明显升高,差异具有统计学意义(P>0.05,图 2B和C),而SPIO 5 μg/mL组COL2 α2(图 2B)和aggrecan(图 2D)的mRNA表达量,差异具有统计学意义(P<0.05,图 2B、D);和对照组相比,SPIO 1 μg/mL组和5 μg/mL组MMP13(图 2C)的mRNA明显降低,差异具有统计学意义(P<0.05,图 2C),以上结果均出现浓度依赖性。
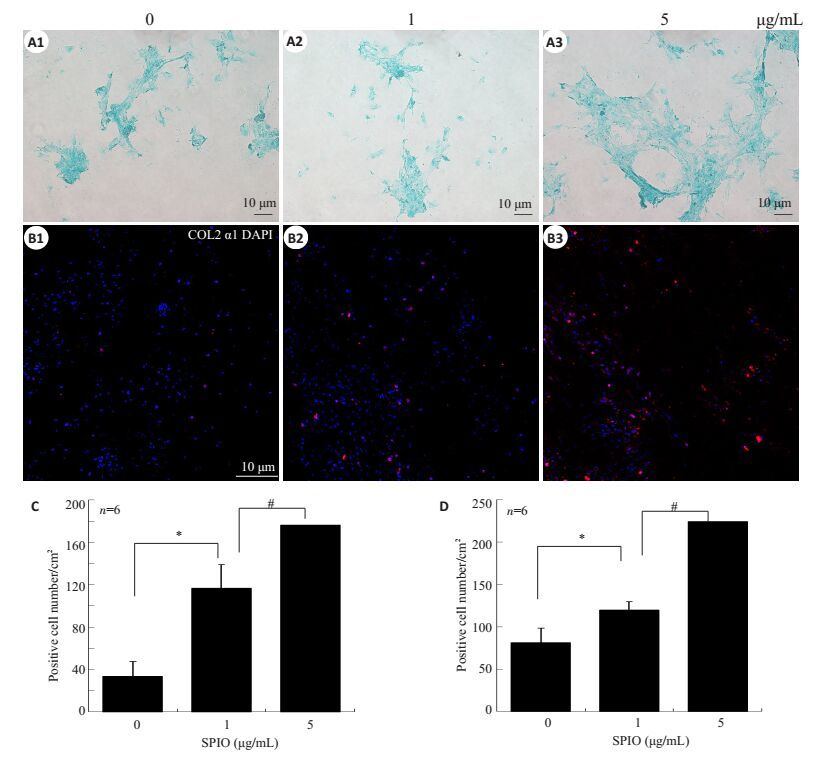
2.4 SPIO体外对软骨细胞内酸性粘多糖表达影响及COL2 α2蛋白含量影响成软骨诱导条件下BMSCs常规培养并加药SPIO(1和5 μg/mL)9 d,行阿利新蓝染色(图 3A1~A3)观察软骨细胞内酸性粘多糖表达,结果提示,阳性细胞数随着SPIO浓度增加出现促进作用,和对照组相比,SPIO 1 μg/mL组和5 μg/mL组(图 3A1~A3和C)的阳性细胞数明显增加,差异具有统计学意义(P<0.05,图 3A1~A3和C);行COL2 α2免疫荧光染色(图 3B1~B3)发现,和对照组相比,SPIO1 μg/mL组和5 μg/mL组(图 3B1~B3和D)的阳性细胞数明显增加,差异具有统计学意义(P<0.05,图 3B1~B3和D)。
|
图 3 SPIO对成软骨相关蛋白表达的影响 Figure 3 Effect of SPIO on protein expressions of chondrocyte markers. A1-A3: Alcian blue staining of BMSCs cultured with SPIO (1 and 5 μg/mL) for 9 days in chondroblast induction medium; B1-B3: Immunofluorescent staining of COL2 α2; C:Quantitative analysis of results of Alcian blue staining; D: Quantitative analysis of immunofluorescent staining results for COL2 α2. Data are shown as Mean±SD. *P < 0.05, #P < 0.05. |
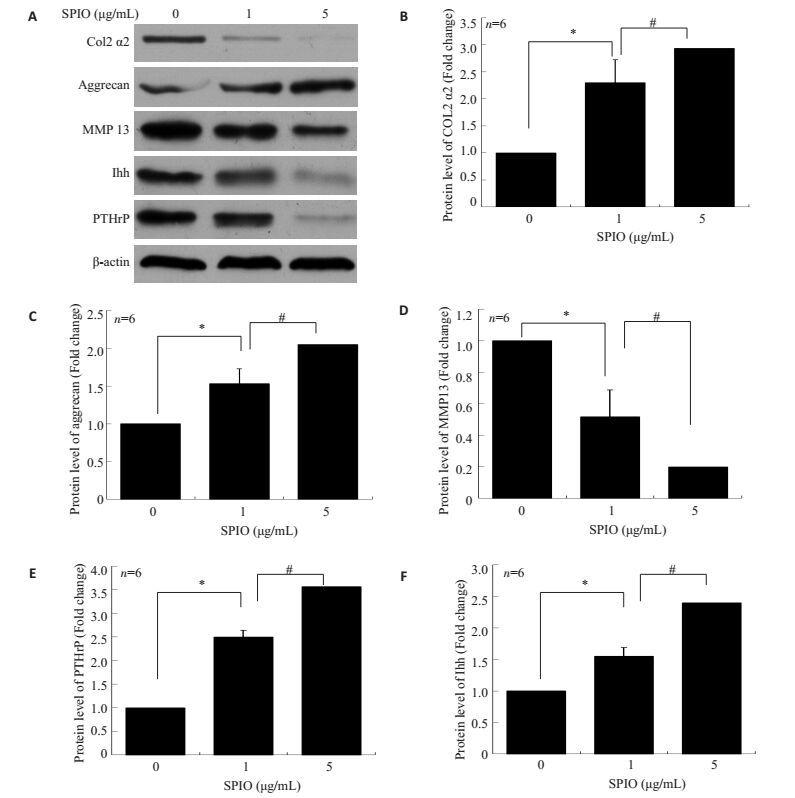
大鼠BMSCs成软骨分化过程中在SPIO(1 μg/mL和5 μg/mL)处理9 d情况下,对细胞行蛋白免疫印迹(图 4)检测发现:SPIO促进aggrecan蛋白的表达,和对照组相比,SPIO 1 μg/mL组和5 μg/mL组(图 4A)的aggrecan蛋白条带灰度值明显增加,差异具有统计学意义(P<0.05,图 4C);而SPIO抑制MMP13蛋白的表达,和对照组相比,SPIO 1 μg/mL组和5 μg/mL组(图 4A)的MMP13蛋白条带灰度值逐渐递减,差异具有统计学意义(P<0.05,图 4D),提示SPIO促进aggrecan的表达,抑制MMP13的表达。
|
图 4 SPIO对Ihh/PTHrP信号通路的影响 Figure 4 Effect of SPIO on Ihh/PTHrP signal pathway. A: Western blot assay of BMSCs cultured with SPIO (1and 5 μg/mL) for 9 days in chondroblast induction medium; B-F: Protein levels of COL2 ls (B), aggrecan (C), MMP13 (D), PTHrP (E) and Ihh (F). Data are shown as Mean±SD *P < 0.05, #P < 0.05. |
大鼠BMSCs成软骨分化过程中在SPIO(1 μg/mL和5 μg/mL)处理9 d情况下,对细胞行蛋白免疫印迹(图 4A)检测发现:SPIO促进Ihh/PTHrP信号通路中Ihh和PTHrP蛋白的表达,和对照组相比,SPIO 1 μg/mL组和5 μg/mL组(图 4A)的Ihh(图 4A和F)和PTHrP(图 4A和E)条带灰度值明显增加,差异具有统计学意义(P<0.05,图 4E和F),提示SPIO促进Ihh/PTHrP信号通路活性。
3 讨论退行性骨关节疾病主要以软骨凋亡,成骨异常为主。软骨细胞无法增殖,自我损伤修复能力非常有限,随着疾病的进展,关节置换往往是最终选择[15]。随着干细胞研究深入进展,自身软骨修复被认为是一种潜在的治疗方案,前景广阔。骨髓间充质干细胞作为体内来源非常广泛的细胞,提取及纯化方便,而对骨髓间充质干细胞的研究也非常全面,其成软骨分化能力已经得到证实[3]。
SPIO是临床上较为常用的一种造影剂,生物亲和性好[16]。SPIO具有促进大鼠骨髓间充质干细胞向成骨细胞分化的能力[3, 17],但SPIO在骨髓间充质干细胞向软骨细胞分化过程中所起的生物学作用目前仍不十分清楚。普鲁士蓝染色和荧光激发实验结果显示骨髓间充质干细胞在体外能摄取SPIO,随着浓度的增加,摄取的SPIO的量也随之增加,这为细胞内SPIO促进成软骨分化提供物质基础[18]。二型胶原α2是软骨细胞的主要结构成分,维持细胞的基本骨架,也是软骨细胞的标志性蛋白,临床研究中多用于衡量软骨细胞的数量和成熟状态,二型胶原α2的表达量和软骨细胞的数量及成熟状态正相关[19];而聚集蛋白聚糖是透明软骨组织中的一种主要蛋白多糖,其主要功能是参与软骨细胞中胶原蛋白合成,研究表明随着软骨细胞的分化成熟,聚集蛋白聚糖的含量也随之升高[20];本研究通过体外诱导BMSCs向成软骨分化的同时加入SPIO行荧光定量PCR,结果提示二型胶原α2和聚集蛋白聚糖的mRNA量明显增加,以上结果提示SPIO在BMSCs向成软骨分化过程中发挥促进作用。MMP13又被称作胶原酶-3,其主要作用是消化软骨细胞主要成分的胶原蛋白,研究表明软骨细胞的数量和状态受MMP13调控,而MMP13的表达升高会抑制软骨细胞的数量和健康状态[21],本研究结果提示在BMSCs向软骨细胞分化的过程中,细胞内MMP13的mRNA表达被SPIO抑制,表明SPIO抑制分解软骨细胞基质相关基因的表达;另外通过阿利新蓝染色提示SPIO促进软骨细胞内酸性粘多糖表达,体外实验的蛋白免疫印迹检测提示SPIO促进二型胶原α2和聚集蛋白聚糖的蛋白表达,抑制MMP13蛋白的表达,以上结果提示不管是从蛋白水平还是基因水平,SPIO在BMSCs向软骨细胞分化过程中抑制软骨细胞骨架的分解,促进其向软骨细胞的分化和细胞骨架蛋白的表达,对软骨细胞提供保护作用。
研究发现Ihh/PTHrP信号通路是调控软骨细胞成熟分化的重要通路之一[22],Cai等[23]在研究中也阐述了Ihh和PTHrP的含量变化是决定软骨细胞由静止期转为增殖期,最后向肥大期转变的关键。Ihh和PTHrP相互调节,共同控制着人体内软骨细胞的分化和增殖,而Ihh在生物学效应主要体现为促进软骨细胞分化,而PTHrP主要表现为促进软骨细胞增殖,在体内处于肥大期的表现为成熟的软骨细胞中Ihh的浓度比较高,而在处于增殖期的幼稚软骨细胞中,PTHrP的浓度相较于其他各期的软骨细胞要高。本研究通过检测BMSCs向软骨细胞分化过程中Ihh/PTHrP信号通路的关键蛋白Ihh和PTHrP的表达水平,了解到SPIO促进Ihh和PTHrP蛋白合成,并上调Ihh/PTHrP信号通路的活性,因此不难看出SPIO通过促进分化过程中的关键信号通路Ihh/PTHrP的表达从而促进BMSCs向软骨细胞分化,并抑制软骨细胞自身骨架分解,对软骨细胞提供保护作用。
综上所述,SPIO是一种安全的造影剂,体外还能促进骨髓间充质干细胞向软骨细胞分化,并上调成软骨细胞分化关键通路Ihh/PTHrP的活性,以上研究为临床上干细胞治疗退行性骨关节病提供了基础实验依据。
| [1] | Tomaszewski W. Chondroitin-application in the treatment of degenerative joint disease[J]. Ortop Traumatol Rehabil, 2016, 18(6): 621-8. DOI: 10.5604/15093492.1230504. |
| [2] | Monfort J, Pujol J, Contreras-Rodríguez O, et al. Effects of chondroitin sulfate on brain response to painful stimulation in knee osteoarthritis patients. A randomized, double-blind, placebocontrolled functional magnetic resonance imaging study[J]. Med Clin (Barc), 2017, 22: S0025-7753(17): 30042-8. |
| [3] | Cantero-Téllez R, Villafañe JH, Valdes K, et al. Effect of immobilization of metacarpophalangeal joint in thumb carpometacarpal osteoarthritis on pain and function. A quasiexperimental trial[J]. J Hand Ther, 2017, 22: S0894-1130(16): 30201-0. |
| [4] | Spahn G, Lipfert JU, Maurer C, et al. Risk factors for cartilage damage and osteoarthritis of the elbow joint: case-control study and systematic literature review[J]. Arch Orthop Trauma Surg, 2017, 137(4): 557-66. DOI: 10.1007/s00402-017-2654-6. |
| [5] | Wang SX, Qiao YJ. PDK2 promotes chondrogenic differentiation of mesenchymal stem cells by upregulation of Sox6 and activation of JNK/MAPK/ERK pathway[J]. Braz J Med Biol Res, 2017, 50(2): e5988. |
| [6] | Kraeutler MJ, Mitchell JJ, Chahla J, et al. Intra-articular implantation of mesenchymal stem cells, Part 1: A review of the literature for prevention of postmeniscectomy osteoarthritis[J]. Orthop J Sports Med, 2017, 19(1): 2325967116680815. |
| [7] | Kriston-Pál É, Czibula Á, Gyuris Z, et al. Characterization and therapeutic application of canine adipose mesenchymal stem cells to treat elbow osteoarthritis[J]. Can J Vet Res, 2017, 81(1): 73-8. |
| [8] | Akpancar S, Tatar O, Turgut H, et al. The current perspectives of stem cell therapy in orthopedic surgery[J]. Arch Trauma Res, 2016, 5(4): e37976. |
| [9] | Wu J, Liu S, Meng H, et al. Neuropeptide Y enhances proliferation and prevents apoptosis in rat bone marrow stromal cells in association with activation of the Wnt/β-catenin pathway in vitro[J]. Stem Cell Res, 2017, 21(5): 74-84. |
| [10] | Zhang L, Zheng L, Fan HS, et al. A scaffold-filter model for studying the chondrogenic differentiation of stem cells in vitro[J]. Mater Sci Eng C Mater Biol Appl, 2017, 70(Pt 2): 962-8. |
| [11] | Ying X, Cheng S, Wang W, et al. Effect of Boron on osteogenic differentiation of human bone marrow stromal cells[J]. Biol Trace Elem Res, 2011, 144(1/3): 306-15. |
| [12] | Nakao N, Nakayama T, Yahata T, et al. Adipose tissue-derived mesenchymal stem cells facilitate hematopoiesis in vitro and in vivo: advantages over bone marrow-derived mesenchymal stem cells[J]. Am J Pathol, 2010, 177(2): 547-54. DOI: 10.2353/ajpath.2010.091042. |
| [13] | Dhakshinamoorthy V, Manickam V, Perumal E. Neurobehavioural toxicity of iron oxide nanoparticles in mice[J]. Neurotox Res, 2017. DOI: 10.1007/s12640-017-9721-1. |
| [14] | Bateman ME, Strong AL, Hunter RS, et al. Osteoinductive effects of glyceollins on adult mesenchymal stromal/stem cells from adipose tissue and bone marrow[J]. Phytomedicine, 2017, 27(5): 39-51. |
| [15] | Gates LS, Leyland KM, Sheard S, et al. Physical activity and osteoarthritis: a consensus study to harmonise self-reporting methods of physical activity across international cohorts[J]. Rheumatol Int, 2017, 37(4): 469-78. DOI: 10.1007/s00296-017-3672-y. |
| [16] | Yang CY, Hsiao JK, Tai MF, et al. Direct labeling of hMSC with SPIO: the long-term influence on toxicity, chondrogenic differentiation capacity, and intracellular distribution[J]. Mol Imaging Biol, 2011, 13(3): 443-51. DOI: 10.1007/s11307-010-0360-7. |
| [17] | Roeder E, Henrionnet C, Goebel JC, et al. Dose-response of superparamagnetic Iron oxide labeling on mesenchymal stem cells chondrogenic differentiation: a multi-scale in vitro study[J]. PLoS One, 2014, 9(5): e98451. DOI: 10.1371/journal.pone.0098451. |
| [18] | Saha S, Yang XB, Tanner S, et al. The effects of Iron oxide incorporation on the chondrogenic potential of three human cell types[J]. J Tissue Eng Regen Med, 2013, 7(6): 461-9. DOI: 10.1002/term.v7.6. |
| [19] | Whitaker AT, Whitaker, Berthet E, et al. Smad4 regulates growth plate matrix production and chondrocyte polarity[J]. Biol Open, 2017, 6(3): 358-364. DOI: 10.1242/bio.021436. |
| [20] | Zhu Y, Gu J, Zhu T, et al. Crosstalk between Smad2/3 and specific isoforms of ERK in TGF-β1-induced TIMP-3 expression in rat chondrocytes[J]. J Cell Mol Med, 2017, 23. DOI: 10.1111/jcmm.13099. |
| [21] | Moussa M, Lajeunesse D, Hilal G, et al. Platelet rich plasma (PRP) induces chondroprotection via increasing autophagy, antiinflammatory markers, and decreasing apoptosis in human osteoarthritic cartilage[J]. Exp Cell Res, 2017, 352(1): 146-56. DOI: 10.1016/j.yexcr.2017.02.012. |
| [22] | Kamper M, Paulsson M, Zaucke F. Absence of collagen Ⅸ accelerates hypertrophic differentiation in the embryonic mouse spine through a disturbance of the Ihh-PTHrP feedback loop[J]. Cell Tissue Res, 2017, 367(2): 359-67. DOI: 10.1007/s00441-016-2501-z. |
| [23] | Cai H, Liu A. Spop promotes skeletal development and homeostasis by positively regulating Ihh signaling[J]. Proc Natl Acad Sci USA, 2016, 113(51): 14751-6. DOI: 10.1073/pnas.1612520114. |
 2017, Vol. 37
2017, Vol. 37

