脓毒症是目前ICU重症患者死亡的主要原因之一,28 d死亡率高达32%,居世界前十[1]。脓毒症可由多种致病原引起,严重者可发生多器官功能障碍综合征(MODS)和多器官功能衰竭(MOF)。国外有研究显示,本病的高病死率不但与病情的严重程度相关,而且与是否能早期诊断及判断预后密切相关[2]。寻找早期诊断及判断预后的指标,将能有效控制脓毒症的发展,阻止MODS或者MOF的发生,从而降低脓毒症患者的死亡率。现今,国内仍用胱抑素C(Cys-c)与血清肌酐(Scr)评价早期肾损伤,但其并敏感性不佳[3],寻找更为灵敏的血清指标仍是亟待解决的问题。
近年来发现微小RNA(miR)与各种疾病包括肾脏疾病的发生、发展及预后有紧密联系,一些miR的表达水平改变具有帮助诊断急性肾损伤(AKI)和指导临床治疗的意义[4],国外有报道称[5-6],miR-29a、miR-10a-5p在AKI患者外周血表达升高,但并未做深入研究。本研究通过检测脓毒症所致AKI患者外周血中miR-29a、miR-10a-5p的表达水平,发现miR-29a、miR-10a-5p与AKI患者外周血肾损伤指标Cys-C、Scr、KIM-1呈正相关,但是这些miRNA在脓毒症所致AKI患者预后判断中的价值尚不完全明确,有深入研究价值。本研究拟通过前瞻性临床分析,探讨血清miR-29a、miR-10a-5p对脓毒症所致AKI患者血清中的达标及预后评估的价值。
1 资料和方法 1.1 病例选择与收集2015年1月~2016年12月在本院确诊为脓毒症所致AKI患者共74例(男39例,女35例);选取同期在我院确诊为脓毒症但无AKI患者45例为对照组,45例对照组中有4例患者治疗过程出现AKI,予以排除,实际入组41例(男22例,女19例)。病史采集患者年龄、性别、身高、体质量、血压、手术史记录都由ICU专科医师完成。终点事件为任何原发疾病或原发疾病并发症所引起的死亡。两组患者基本情况无统计学意义(P>0.05),其中对照组死亡6例,观察组死亡21例,有统计学意义(P<0.05)。本研究中患者均签署知情同意书,并由重庆中医院伦理委员会审核通过。临床研究样本量参考两样本均数比较的样本含量估算法:n1=n2=2[(tα+tβ)s/δ]。
诊断标准由ICU两名专科副主任医师医师进行评估,脓毒症诊断ACCP/SCCM诊断标准[7],AKI符合阿姆斯特丹AKI合作研究会诊断标准评估[8]。
纳入标准:(1)年龄大于14周岁;(2)符合重症医学会ACCP/SCCM提出脓毒症诊断标准;(3)阿姆斯特丹AKI合作研究会诊断标准评估。
排除标准:(1)单纯脓毒症患者;(2)合并病毒性心肌炎的患者;(3)合并重症肝炎及肝硬化的患者。
1.2 血清采集和化验所有患者入院后第1天即抽取静脉血5 mL置于促凝管中,低温离心10 min(3000 r/min),取上清液,冻存于-80 ℃冰箱。血清Cys-C、Scr浓度在检验科用微粒子酶免疫分析法检测。
1.3 荧光定量RT-PCR检测miR-30a、miR-10a-5p表达提取血清中的总RNA,将提取的总RNA逆转录成cDNA,反应体系为20 μL,反应条件为:1 6 ℃(30 min),45 ℃(30min),85 ℃(5min)。运用SYBR Green法检测miR-29a、miR-10a-5p的表达情况,运用的反应条件为:94 ℃(15 min),94 ℃(30 s),60 ℃(30 s),72 ℃(30 s),共循环40次;最后72 ℃延伸8 min。每组样品重复3次,试验重复6次,统计分析各标本中miR-29a、miR-10a-5p的相对表达,miR-29a、miR-10a-5p序列参照Biocarta(http://www.biocarta.corn)数据库和miRBase(www.mirbase.prg)数据库[9]。
1.4 统计学方法采用SPSS、MedCalc和GraphPad Prism软件进行统计学分析计量数据。中位数比较用median检验。两组均数间比较用t检验。miR-29a与miR-10a-5p进行Spearman相关分析。多因素logistic回归预测脓毒血症所致AKI患者28 d死亡的危险因素。ROC曲线分析比较miR-29a及miR-10a-5p在AKI患者预后评估中的价值。P<0.05为差异有统计学意义。
2 结果 2.1 miR-29a与miR-10a-5p在各组患者血清中的表达与对照组相比,观察组患者血清中miR-29a及miR-10a-5p表达升高,具有统计学意义(P<0.05,图 1)。
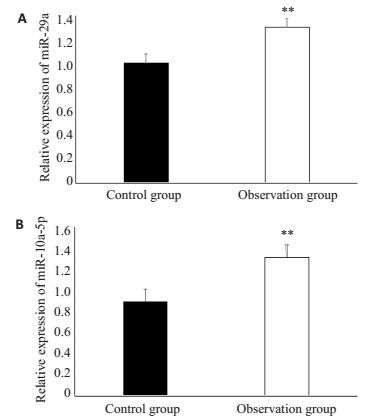
|
图 1 各组患者血清miR-29a与miR-10a-5p的表达 Figure 1 Serum levels of miR-29a (A) and miR-10a-5p (B)in septic patients with (observation group) and without (control) acute kidney injury (AKI). **P < 0.05 vs control group. |
观察组随访28 d后,21例患者死亡,占全体人数的35.53%。各组患者一般情况见表 1。
| 表 1 各组患者一般情况 Table 1 General data of patients with (observation group) and without (control) acute kidney injury (AKI) (Mean±SD) |
miR-29a与Scr呈正相关,r=0.73,P<0.01;miR-29a与Cys-C呈正相关,r=0.69,P<0.01;miR-29a与KIM-1呈正相关,r=0.647,P<0.01;miR-10a-5p与Scr呈正相关,r=0.67,P<0.01;miR-10a-5p与Cys-C呈正相关,r=0.67,P<0.01;miR-10a-5p与KIM-1呈正相关,r=0.74,P<0.01(图 2)。
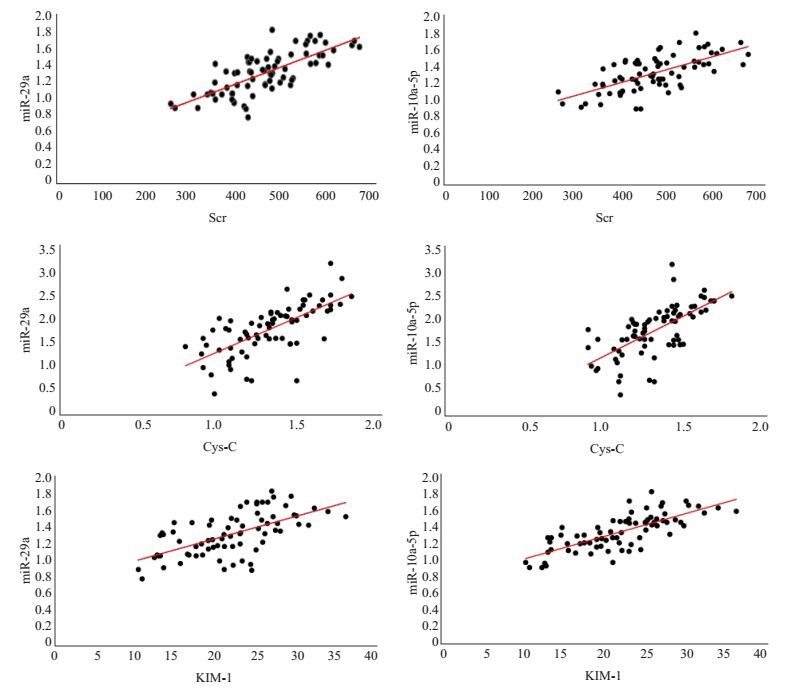
|
图 2 观察组患者血清中miR-29a、miR10a-5p和Scr、Cys-C、KIM-1的相关性分析 Figure 2 Correlation analysis of miR-29a and miR10a-5p with Scr, Cys-C and KIM-1 in septic patients with AKI. |
多因素logistic回归结果显示(表 2),miR-29a、miR-10a-5p、Scr及Cys-C是AKI患者28 d死亡率的危险因素;其中,miR-29a(OR=2.18,95% CI=1.23~2.94),miR-10a-5p(OR=1.32,95% CI=1.06~2.75),Scr(OR=1.18,95% CI=1.002~1.02),Cys-C(OR=1.24,95% CI=0.94~1.39),KIM-1(OR=1.33,95% CI=0.97~1.98)。
| 表 2 多因素logistic回归分析观察组患者28 d死亡率的危险因素 Table 2 Multivariable Logistic regression analysis in septic patients with AKI |
死亡组患者血清中miR-29a及miR-10a-5p水平高于生存组,P<0.01(图 3)。
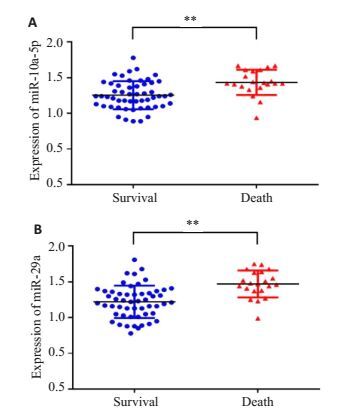
|
图 3 miR-29a和miR-10a-5p在观察组生存与死亡患者血清中的表达 Figure 3 Serum levels of miR-10a-5p (A) and miR-29a (B) in septic patients with AKI who survived or died within 28 days. **P < 0.01. |
miR-29a及miR-10a-5p曲线下面积(AUC)分别为0.82(95% CI,0.71-0.89)及0.75(95% CI,0.64-0.85);Cys-C、Scr及KIM-1 AUC分别为0.72(95% CI,0.66-0.86)、0.71(95% CI,0.63-0.84)及0.81(95% CI,0.72-0.81)。根据ROC曲线分析进一步计算得出miR-29a及miR-10a-5p和Cys-C、Scr及KIM-1用于预测观察组患者28 d死亡率的cut-off值,以及其敏感性和特异性,并对miR-29a及miR-10a-5p做了ROC曲线对比,结果显示miR-10a-5p在预测观察组患者28 d死亡率时敏感性优于miR-29a、Cys-C、Scr、KIM-1(均P<0.05),特异性miR-29a优于miR-10a-5p、Cys-C、Scr、KIM-1(均P<0.05,表 3)。用多元逻辑回归算得在联合检测miR-29a及miR-10a-5p和Cys-C、Scr、KIM-1预测观察组患者28 d死亡率时各因子前的系数(miR-29a & miR-10a-5p)=5.569 × miR-29a + 5.383 ×miR-10a-5p-15.756。miR-29a及miR-10a-5p联合检测优于单一检测miR-29a、miR-10a-5p、Cys-C、Scr和KIM-1检测(均P<0.05,图 4、表 3)。
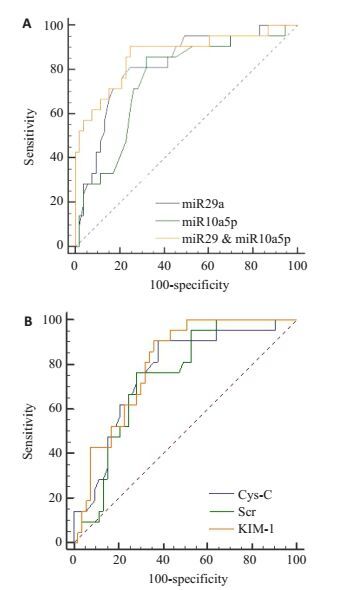
|
图 4 miR-29a及miR-10a-5p和Cys-C、Scr、KIM-1检测在预测观察组患者28 d死亡率中的ROC曲线分析 Figure 4 ROC curve analysis of miR-29a, miR-10a-5p (A) and Cys-C, Scr, KIM-1(B) in predicting the 28-day mortality in septic patients with AKI. |
| 表 3 miR-29a、miR-10a-5p和Cys-C、Scr预测观察组患者28 d死亡率中ROC曲线分析 Table 3 ROC curve analysis of miR-29a, miR-10a-5p, Cys-C, and Scr in predicting 28-day mortality in septic patients with AKI |
脓毒症是ICU常见的重症,不及时治疗可使病情迅速恶化,可导致MODs或者MOF等并发症的发生,甚至威胁生命[10-11]。近年来研究发现脓毒症所引发的脏器损害的原因并不是由细菌或者其他感染性微生物直接引起,主要是由于体内的非特异性炎症反应系统紊乱,炎症因子表达失常,进而损伤全身各脏器所造成[12]。有学者研究显示[13],脓毒症所致的AKI临床中病死率高达70%,死亡率明显高于其他原因所致的AKI。本研究显示,脓毒症所致AKI患者临床死亡率为35.53%,与文献报道有一定差距,这可能由于本研究样本量较小。脓毒症一方面可使血液中内毒素和炎症介质的增多直接造成肾脏受损,并且触发凝血和纤溶系统反应,使肾小球内形成血栓,阻塞肾脏微血管[14-15];另一方面肾脏血管其本身血管床与其他部分血管不同,脓毒症刺激时,增强对收缩物质的反应,加剧肾脏血流和肾小球滤过率的下降[16]。由于脓毒症患者的个体差异以及感染程度的不同,临床上尚未发现一种理想的检测标志物可以用来准确评估脓毒症患者的死亡风险[17-18]。目前学界主流观点都认为通过检测多个指标,再用统计学方法整合其评估效应,可以有效的提高对脓毒症患者死亡风险评估的敏感性和特异性[19]。
miRNA是一种可调控基因表达的内源性非编码单链小分子RNA,最早在线虫中发现,其与靶mRNA产生特异碱基配对,使靶mRNA的基因信使功能在转录后发生沉默,可调控诸多生命活动的过程,包括细胞的发育、分化、增殖和凋亡[20-22],虽然至今仍无确定证据说明血清miRNAs的来源,但是miRNAs在不同疾病的不同病理进程中往往呈现不同的表达谱,在人类许多肿瘤、炎症甚至自身免疫性疾病的诊断和预后中显示出特有的价值[23-25]。本研究选取在AKI领域研究热门的2种miRNAs,即miR-29a和miR-10a-5p[5-6]。首先发现上述两种miRNA在脓毒症所致AKI患者血清中的表达明显高于脓毒症非AKI人群,说明miR-29a和miR-10a-5p确与肾损伤有关。而在进行miR-29a和miR-10a-5p与肾损伤标志物Scr、Cys-C及KIM-1的相关性能分析中,不仅再次证实了miR-29a和miR-10a-5p与肾损伤程度相关,而且证实上述两种miRNAs与早期肾损伤标志物KIM-1呈正相关,为miR-29a和miR-10a-5p可早期反应AKI发生提供证据。为了进一步分析miR-29a和miR-10a-5p在脓毒症所致AKI中的临床意义,本研究对这2种miRNAs和Scr、Cys-C、KIM-1行ROC曲线分析,结果发现血清中miR-29a和miR-10a-5p的表达情况在脓毒症所致AKI患者血清中具有较高的AUC值,分别0.82(95% CI,0.71-0.89)及0.75(95% CI,0.64-0.85),而Scr、Cys-C AUC值分别0.72(95% CI,0.66-0.86)及0.71(95%CI,0.63-0.84)。在评价脓毒症所致AKI患者28 d死亡率特异性方面,miR-29a明显优于其他指标,而miR-10a-5p敏感性则最优。说明这两种miRNAs对脓毒症所致AKI的28 d生存率临床参考价值较高,具有良好的应用潜力。
在本研究中,采用多元逻辑回归算得在用miR-29a & miR-10a-5p在脓毒症患者28 d死亡率评估时其前系数(miR-29a & miR-10a-5p)=5.569 × miR-29a +5.383×miR-10a-5p-15.756,对(miR-29a & miR-10a-5p)行ROC曲线分析发现其AUC值高达0.87,优于单一miR-29a、miR-10a-5p、Scr、Cys-C及KIM-1。随着现在检测技术和设备的提升,在少量的血清样本中快速、灵敏的对多种炎症因子同时进行检测已成为可能。miR-29a和miR-10a-5p联合检测可以大大提高对脓毒症患者预后评估的敏感性和特异性,有希望成为脓毒症所致AKI早期诊断及预后预测的一种理想血清标志物。
| [1] | Liu H, Liu Y, Sun JK, et al. Extravascular lung water monitoring of renal replacement therapy in lung water scavenging for septic acute kidney injury[J]. Int J Clin Exp Med, 2015, 8(10): 18907-16. |
| [2] | RENAL Replacement Therapy Study Investigators, Bellomo R, Cass A, et al. Intensity of continuous renal-replacement therapy in critically ill patients[J]. N Engl J Med, 2009, 316(17): 1627-38. |
| [3] | 陆任华, 严玉澄, 车妙琳, 等. 生物学标志物在急性肾损伤病因鉴别诊断中的作用[J]. 上海医学, 2015, 38(5): 360-5. |
| [4] | Fan PC, Chen CC, Chen YC, et al. MicroRNAs in acute kidney injury[J]. Hum Genomics, 2016, 10(1): 29. DOI: 10.1186/s40246-016-0085-z. |
| [5] | Sun SQ, Zhang T, Ding D, et al. Circulating MicroRNA-188, -30a, and -30e as early biomarkers for Contrast-Induced acute kidney injury[J]. J Am Heart Assoc, 2016, 5(8): 116. |
| [6] | Aguado-Fraile E, Ramos E, Conde E, et al. A pilot study identifying a set of microRNAs as precise diagnostic biomarkers of acute kidney injury[J]. PLoS One, 2015, 10(6): 0127175. |
| [7] | 唐昊, 刘冬, 张画羽, 等. 三版国际脓毒症诊断标准诊断效能分析[J]. 解放军医学杂志, 2016, 41(4): 295-300. |
| [8] | Mehta RL, Kellum JA, Shah SV, et al. Acute kidney injury network: report of an initiative to improve outcomes in acute kidney injury[J]. Crit Care, 2007, 11(2): R31. DOI: 10.1186/cc5713. |
| [9] | 张莹, 高春林, 夏正坤, 等. MiR-106b在2型糖尿病db/db小鼠骨骼肌中的表达及生物信息学分析[J]. 医学研究生学报, 2013, 26(3): 232-8. |
| [10] | Buendgens L, Yagmur E, Bruensing J, et al. C-terminal proendothelin-1 (CT-proET-1) is associated with organ failure and predicts mortality in critically ill patients[J]. J Intensive Care, 2017, 5(5): 25. |
| [11] | Hattori M, Yamazaki M, Ohashi W, et al. Critical role of endogenous histamine in promoting end-organ tissue injury in sepsis[J]. Intensive Care Med Exp, 2016, 4(1): 36. DOI: 10.1186/s40635-016-0109-y. |
| [12] | Xu XJ, Tang YM, Song H, et al. A multiplex cytokine score for the prediction of disease severity in pediatric hematology/oncology patients with septic shock[J]. Cytokine, 2013, 64(2): 590-6. DOI: 10.1016/j.cyto.2013.08.012. |
| [13] | Lamelre N, Van Biesen W, Vanholder R. Acute renal failure[J]. Lancet, 2005, 365(9457): 417-430. DOI: 10.1016/S0140-6736(05)70238-5. |
| [14] | 周健淞. 清瘟败毒散联合高容量血液滤过对脓毒症患者炎症介质及血流动力学的影响[J]. 中药药理与临床, 2014, 30(6): 166-7. |
| [15] | 陈裕洁, 龚楚链, 谭芳, 等. 右美托咪啶预处理对脓毒症肾损伤大鼠炎性因子和氧化应激的影响[J]. 南方医科大学学报, 2015, 35(10): 1472-5. |
| [16] | 陈铭铭, 刘一娜, 曹勇, 等. 脓毒症急性肾损伤危险因素及对预后影响318例分析[J]. 中国实用内科杂志, 2012, 32(7): 537-9. |
| [17] | Kyr M, Fedora M, Elbl L, et al. Modeling effect of the septic condition and trauma on C-reactive protein levels in children with sepsis: a retrospective study[J]. Crit Care, 2007, 11(3): R70. DOI: 10.1186/cc5955. |
| [18] | Wong HR, Weiss SL, Giuliano JS, et al. Testing the prognostic accuracy of the updated pediatric sepsis biomarker risk model[J]. PLoS One, 2014, 9(1): e86242. DOI: 10.1371/journal.pone.0086242. |
| [19] | Briassoulis G, Galani A. Prognostic markers of pediatric meningococcal sepsis[J]. Expert Rev Anti Infect Ther, 2014, 12(9): 1017-20. DOI: 10.1586/14787210.2014.945431. |
| [20] | Xiong XP, Vogler G, Kurthkoti K, et al. SmD1 modulates the miRNA pathway independently of its Pre-mRNA splicing function[J]. PLoS Genet, 2015, 11(8): e1005475. DOI: 10.1371/journal.pgen.1005475. |
| [21] | Lu YC, Chen YJ, Wang HM, et al. Oncogenic function and early detection potential of miRNA-10b in oral cancer as identified by microRNA profiling[J]. Cancer Prev Res (Phila), 2012, 5(4): 665-74. DOI: 10.1158/1940-6207.CAPR-11-0358. |
| [22] | 丁桃, 李阳, 唐睿珠, 等. 内毒素血症大鼠心肌组织miRNA差异表达[J]. 南方医科大学学报, 2015, 35(2): 213-7. |
| [23] | Chen J, Liu X, Chen X, et al. Real-time monitoring of miRNA function in pancreatic cell lines using recombinant AAV-based miRNAAsensors[J]. PLoS One, 2013, 8(6): e66315. DOI: 10.1371/journal.pone.0066315. |
| [24] | Tay FC, Lim JK, Zhu H, et al. Using artificial microRNA sponges to achieve microRNA loss-of-function in cancer cells[J]. Adv Drug Deliv Rev, 2015, 81(1): 117-27. |
| [25] | Kim SW. The role of MicroRNAs in colorectal cancer[J]. Korean J Gastroenterol, 2017, 69(4): 206-11. DOI: 10.4166/kjg.2017.69.4.206. |
 2017, Vol. 37
2017, Vol. 37

