2. 暨南大学再生医学教育部重点实验室,广东 广州 510632;
3. 暨南大学生命科学技术学院发育与再生生物学系,广东 广州 510632
2. Key Laboratory for Regenerative Medicine (JNU-CUHK), Ministry of Education, Jinan University, Guangzhou 510632, China;
3. Department of Developmental and Regenerative Biology, College of Life Science and Technologies3, Jinan University, Guangzhou 510632, China
球状脂联素为全长脂联素蛋白水解裂解的产物,具有比全长脂联素更为广泛的生物学活性[1-3]。多年来一直有研究称脂联素与卵泡发育相关[4-7],近期通过基因敲除小鼠发现脂联素缺失突变的雌性小鼠生育能力受损,卵母数量减少,动情周期紊乱,闭锁卵泡数量增加以及晚期卵泡发育阻滞[8]。
卵泡的发育与血管密切相关,卵泡周围血管网络能够为卵泡发育提供更多的氧气、激素和营养物质保证卵泡的正常发育。血管内皮细胞的减少能够导致卵泡颗粒细胞的凋亡,进而引起卵泡闭锁[9-10]。已有大量的研究表明脂联素能够促进血管内皮细胞增殖及管状形成过程,参与血管新生调控,且球状脂联素较全长脂联素的效果更为明显[11-13]。脂联素是否通过调控卵巢内的微血管网络调控卵泡发育目前尚未见报道。
为了研究脂联素在卵泡发育过程中对卵巢血管网络调控的影响,本研究采用分离大鼠卵巢黄体微血管内皮细胞[14]类似的Percoll密度梯度离心法从小鼠卵巢中分离出卵泡发育过程中的卵巢微血管内皮细胞(OMECs),并检测了球状脂联素对卵巢微血管内皮细胞血管新生的影响。
1 材料和方法 1.1 主要试剂兔抗卵泡刺激素受体(FSHR)、兔抗黄体生成素(LHR)、兔抗血管性血友病因子(vWF)多克隆抗体、4', 6-二脒基-2-苯基吲哚(DAPI)染色液、鼠抗IgM及抗荧光淬灭封片剂购自武汉博士德生物工程有限公司,过氧化物酶(HRP)标记的羊抗小鼠IgM、Cy3标记的羊抗兔IgG(H+L)、Percoll、胶原酶Ⅰ购自Sigma公司;磷酸化的腺苷酸活化蛋白激酶(pAMPK)和AMPK抗体购自美国CST公司;ECM培养基及内皮细胞生长因子购自美国Sciencell公司,血管内皮生长因子A(VEGFA)购自北京义翘神州生物科技有限公司;重组的球状脂联素蛋白购自美国ProSpec公司;MTS试剂盒购自美国Promega公司;低生长因子Matrigel基质胶购自美国BD Bioscience公司;ECL化学发光试剂盒和磷酸酶蛋白酶抑制剂cocktail购自美国Thermo Fisher Scientific公司;孕马血清促性腺激素购自宁波第二激素厂;胎牛血清(FBS)、DMEM及青霉素-链霉素购自美国Gibco公司。
1.2 实验动物SPF级别的3周龄的昆明雌性小鼠购于广东省实验动物中心,许可证号:SCXK(粤)2013-0034。
1.3 小鼠卵巢微血管内皮细胞分离及培养取3周龄昆明雌鼠10只,腹腔注射孕马血清促性腺激素5 IU/只,44 h后颈椎脱臼法处死,无菌下迅速取出卵巢放入预冷的PBS中,去除脂肪和结缔组织后将卵巢置于DMEM培养基中,用BD 32号注射器针头刺破卵巢表面卵泡,使颗粒细胞释放到培养基中,用200目网筛过滤2遍后,残余组织用1 mg/mL胶原酶Ⅰ37 ℃处理40 min,期间每20 min吹打50次。然后加入含10% FBS的DMEM培养基终止反应,用200目、400目网筛过滤后将细胞悬液收集到15 mL离心管250 g离心10 min。细胞沉淀用1 mL 40% Percoll悬浮,然后垂直滴加1 mL20% Percoll,再滴加2 mL PBS,避免振荡。垂直离心机400 g离心5 min,溶液分3层,小心的吸取中检测的细胞悬液于15 mL离心管中,加入DMEM培养基,250 g离心5 min;然后用ECM培养基(ECM基础培养基+ 10% FBS+50 μg/mL内皮生长因子+青霉素-链霉素双抗)重悬细胞并铺板,37 ℃、5% CO2培养4 h后换新鲜ECM培养基至融合度达80%~90%,细胞贴壁呈现铺路石状,传代培养。仅3~8代的细胞用于后续实验。
1.4 免疫荧光鉴定分离的卵巢微血管内皮细胞(OMECs)表面标记取生长状态良好的3~5代分离的细胞爬片生长融合到80%~90%后从培养箱中取出,用预温的PBS洗3次,每次10 min,4%多聚甲醛4 ℃固定2 h,TBS洗3次,每次10 min,然后用0.2% TritonX-100透化2~5 min,TBS洗3次,每次10 min;5%牛血清蛋白(BSA)室温封闭30 min后加入兔抗FSHR抗体、兔抗LHR抗体及兔抗vWF抗体(用1%BSA 1: 100稀释),湿盒4 ℃过夜孵育(对照不加抗体孵育),TBS洗3次,每次10 min后Cy3标记的羊抗驴IgG(H+L)(1: 32)室温闭光孵育1 h,然后TBS洗3次,每次10 min;DAPI染核5 min,PBS洗涤3次,抗荧光淬灭封片剂封片,在Nikon荧光显微镜下观察拍照。
1.5 Matrigel基质胶上血管形成低生长因子Matrigel基质胶4 ℃静置过夜,次日取100 μL铺板4 ℃预冷的48孔板然后置于37 ℃,5% CO2无菌培养箱中1 h,使液态胶凝固成固态胶。选择第3~5代生长状态良好的OMECs,用ECM基础培养基、ECM基础培养基+ 20 ng/mL VEGFA、ECM基础培养基+ 0.1 μg/mL、1 μg/mL或3 μg/mL的球状脂联素蛋白重悬细胞,然后以2×104/孔铺板,每组6孔。37 ℃,5% CO2培养箱中培养12 h,在相差显微镜下观察小管形成并拍照。
Compound C是AMPK选择性的抑制剂,为了研究AMPK对球状脂联素诱导的血管形成的影响,细胞先用含有20 μmol/L Compound C的ECM基础培养基重悬,铺板预处理1 h抑制AMPK活性后,然后换成ECM基础培养基+3 μg/mL的球状脂联素蛋白培养12 h后检测小管形成情况。
每个独立的实验孔都会采集4个随机视野拍照并通过Image J测定视野内可见的小管的周长,然后与未加入蛋白的对照组的小管长度进行标准化处理以评估各处理对小管形成的影响。
1.6 MTS检测细胞增殖将卵巢微血管内皮细胞按1×104个/mL接种于96孔板内,待细胞长到80%融合率无血清的ECM基础培养基饥饿处理12 h然后加入不同浓度的球状脂联素蛋白(0、0.1、1、3 μg/mL),每个浓度6个复孔,共培养48 h后,每孔加入20 μL CellTiter 96® AQueous One Solution Reagent,培养箱中孵育2 h,酶联免疫检测各孔吸光值,评价细胞生长情况。
1.7 细胞划痕愈合实验检测细胞迁移将卵巢微血管内皮细胞5×105/mL细胞接种于6孔板至融合率为90%后划痕,用PBS洗涤去除脱落的细胞,并在无血清培养基中饥饿处理12 h。然后加入不同浓度的球状脂联素蛋白(0、0.1、1、3 μg/mL),每个浓度6个复孔,培养24 h观察划痕愈合并拍照。采用Image J测定划痕面积,划痕愈合率为(0 h的划痕面积~24 h的划痕面积)/0 h的划痕面积×100%。
1.8 Western blot检测AMPK磷酸化激活将卵巢微血管内皮细胞5×105个/mL细胞接种于6孔板至融合率为90%后无血清培养基中饥饿处理12 h。然后加入3 μg/mL的球状脂联素蛋白处理细胞15 min及30 min后收集细胞,加入含有磷酸酶蛋白酶抑制剂cocktail的裂解液抽提总蛋白,12 000 r/min,4 ℃离心10 min;吸取上清,BCA法测定蛋白浓度。每泳道上样50 μg总蛋白,12% SDS-PAGE电泳,并蛋白转印。将膜用2%牛血清蛋白封闭2 h后,加兔抗pAMPK和AMPK的抗体(1: 1000)4 ℃孵育过夜,次日用HRP标记的羊抗兔IgG(1: 1000)孵育1 h。TBST洗膜后,ECL显色。以GAPDH为内参,一抗为鼠源IgM(1: 1000),二抗是羊抗小鼠IgM(1: 300)。用Quantity one对pAMPK及AMPK的灰度值进行定量分析。
1.9 统计学分析所有实验都重复3次或3次以上。采用Graphpad Prism 6.0进行统计分析,数据均采用均数±标准差表示,组间两两比较采用最小显著性差异法(LSD法)。P < 0.05为差异有统计学意义。
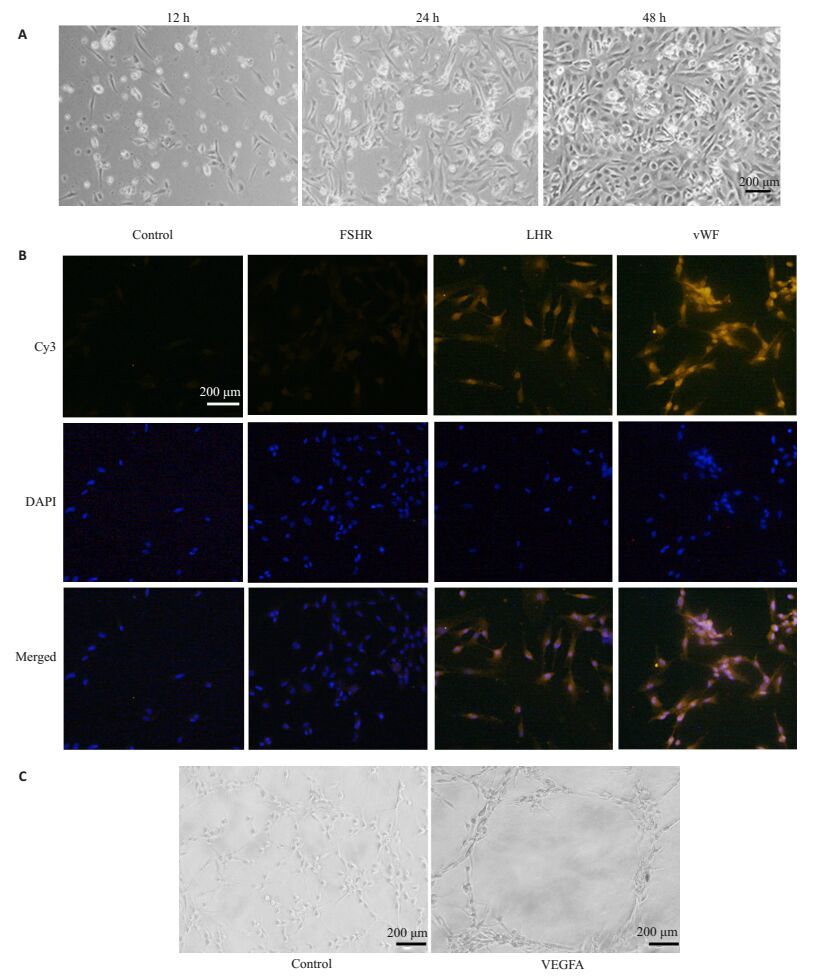
2 结果 2.1 卵巢微血管内皮细胞的分离培养及鉴定采用不连续Percoll密度梯度离心分离的卵巢微血管内皮细胞铺板4 h后大部分贴壁生长,12 h后细胞逐渐变为多呈角形或梭形,24 h后细胞完全贴壁,融合成单层,48 h后融合度可达90%,呈内皮细胞特有的铺路石状结构(图 1A)。免疫荧光检测分离得到的细胞表达LHR及vWF,不表达FSHR(图 1B)。绝大部分细胞都呈vWF染色阳性,表明所分离的细胞纯度较高。分离得到的细胞饥饿处理后进行成管形成实验,发现VEGFA能够诱导分离得到的细胞形成管状结构形成(图 1C)。以上的结果表明从小鼠卵巢组织中分离得到的细胞具有血管内皮特性。
|
图 1 卵巢血管内皮细胞的分离及鉴定 Figure 1 Isolation and identification of OMECs. A: Representative bright field photomicrograph of OMECs; B: Immunofluorescence staining of FSHR, LHR and vWF in OMECs. FSHR, LHR and vVW were detected with Cy3-labeled anti-rabbit IgG (orange), and the cell nuclei were stained with DAPI (blue).C: Capillary-like tube formation of OMECs induced by VEGFA. |
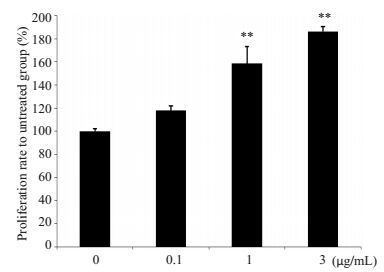
与未处理对照相比,不同剂量浓度的重组的球状脂联素蛋白都能促进卵巢微血管内皮细胞的增殖,且呈剂量依赖性效应(图 2)。但0.1 μg/mL的球状脂联素对卵巢微血管内皮细胞增殖的影响效果并不显著,而高剂量浓度(1 μg/mL和3 μg/mL)的脂联素处理后细胞数量分别增加(158.72±14.50)%和(186.50±4.20)%,显著的促进细胞增殖(P < 0.01)。
|
图 2 球状脂联素对卵巢血管内皮细胞增殖的影响 Figure 2 Effect of globular adiponectin on OMECs proliferation. OMECs were treated with or without globular (0-3 μg/mL) for 48 h and assessed by MTS proliferation assay. Results are expressed as percentage of cells relative to untreated cells and represent the averages from triplicate experiments. **P < 0.01 vs compared to untreated group; n=6/group. |
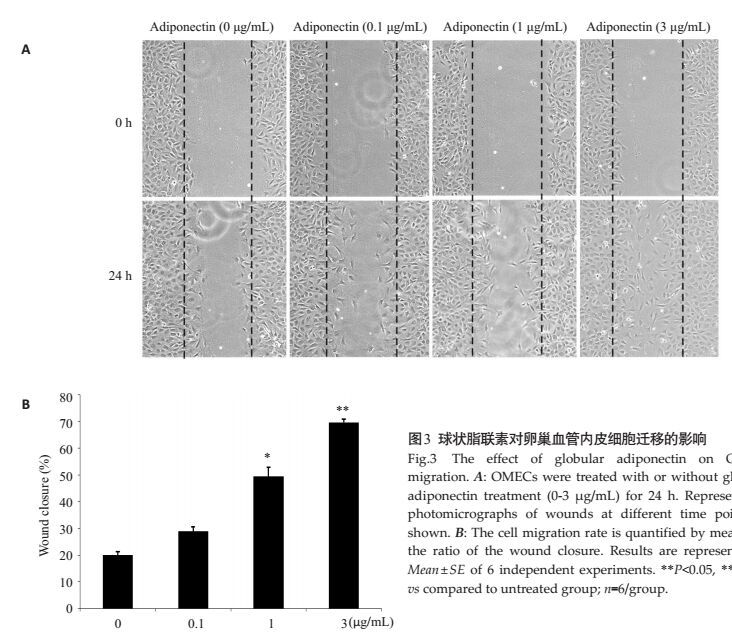
对照组的细胞的划痕愈合率为(19.94±1.35)%,0.1 μg/mL的球状脂联素蛋白处理的划痕愈合率为(28.90±1.74)%,与对照组相比没有明显的变化。与对照组相比1 μg/mL的脂联素处理显著的促进了划痕愈合(49.43±3.43)%(P < 0.05),3 μg/mL的脂联素处理24 h后划痕的愈合率达到(69.67±1.2)%,与对照组相比达到极显著水平(P < 0.01,图 3)。
|
图 3 球状脂联素对卵巢血管内皮细胞迁移的影响 Figure 3 The effect of globular adiponectin on OMECs migration. A: OMECs were treated with or without globular adiponectin treatment (0-3 μg/mL) for 24 h. Representative photomicrographs of wounds at different time point are shown. B: The cell migration rate is quantified by measuring the ratio of the wound closure. Results are represented as Mean ± SE of 6 independent experiments. **P < 0.05, **P < 0.01 vs compared to untreated group; n=6/group. |
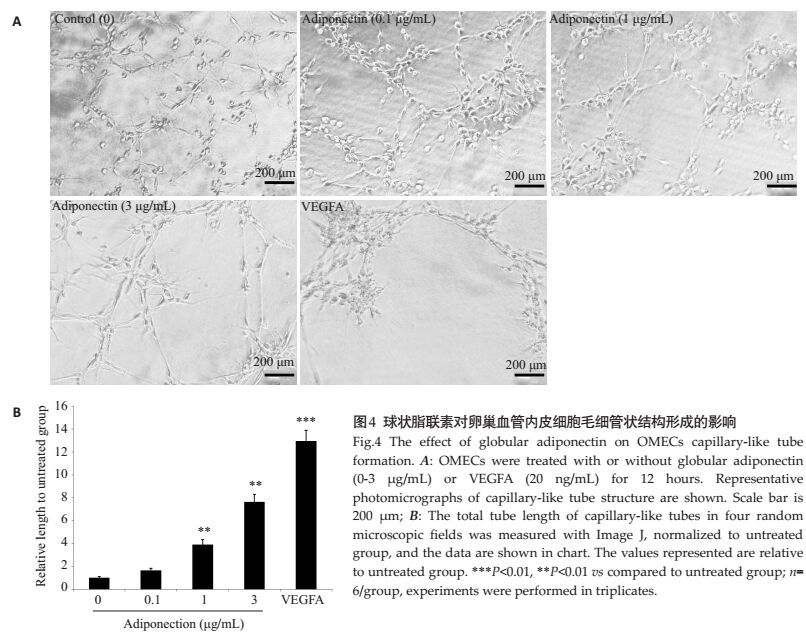
不同剂量浓度的球状脂联素蛋白能够诱导卵巢微血管内皮细胞在Matrigel基质胶上形成毛细管状结构,与VEGFA类似,且管状结构的长度与脂联素蛋白浓度呈现出剂量依赖效应。1 μg/mL和3 μg/mL的脂联素都能够诱导出明显的管状结构,但形成的管状结构的周长明显低于20 ng/mL的VEGFA处理。在无血清无其他外源生长因子的情况下VEGFA处理12 h后形成的管状结构长度为对照组的12.96±0.93倍(P < 0.001),而3 μg/mL的脂联素处理形成的毛细管状长度为对照组的7.63±0.66倍(P < 0.01,图 4)。
|
图 4 球状脂联素对卵巢血管内皮细胞毛细管状结构形成的影响 Figure 4 The effect of globular adiponectin on OMECs capillary-like tube formation. A: OMECs were treated with or without globular adiponectin (0-3 μg/mL) or VEGFA (20 ng/mL) for 12 hours. Representative photomicrographs of capillary-like tube structure are shown. Scale bar is 200 μm; B: The total tube length of capillary-like tubes in four random microscopic fields was measured with Image J, normalized to untreated group, and the data are shown in chart. The values represented are relative to untreated group. ***P < 0.01, **P < 0.01 vs compared to untreated group; n= 6/group, experiments were performed in triplicates. |
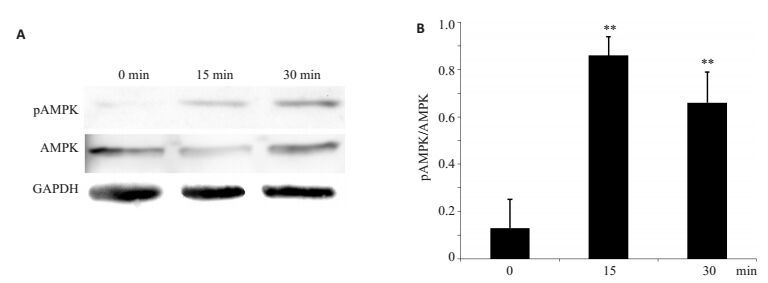
3 μg/mL的球状脂联素蛋白处理饥饿处理后的卵巢微血管内皮细胞培养15 min后,磷酸化的AMPK表达明显增加,一直持续至脂联素处理细胞30 min(图 5A)。灰度值定量分析显示脂联素处理卵巢微血管内皮细胞15 min后pAMPK/AMPK为0.86±0.08,30 min后pAMPK/AMPK为0.66±0.13,显著高于未加入蛋白处理的对照(0.13±0.12)(图 5B)。
|
图 5 球状脂联素对卵巢内皮细胞AMPK磷酸化的影响 Figure 5 The effect of globular adiponectin on OMECs AMPK phosphorylation. A: OMECs were treated with globular adiponectin (3 μg/mL) for 0, 15, and 30 minutes, then phosphorylated AMPK (pAMPK) and total AMPK are analyzed by Western blot. GAPDH served as an internal control; B: The fold change of phosphorylation are analyzed as the ratio of band density of pAMPK to that of total AMPK, which is used as quantitative analyses and shown in statistical chart. Results are represented as Mean±SD of three independent experiments. **P < 0.01 vs compared to untreated group (0 min). |
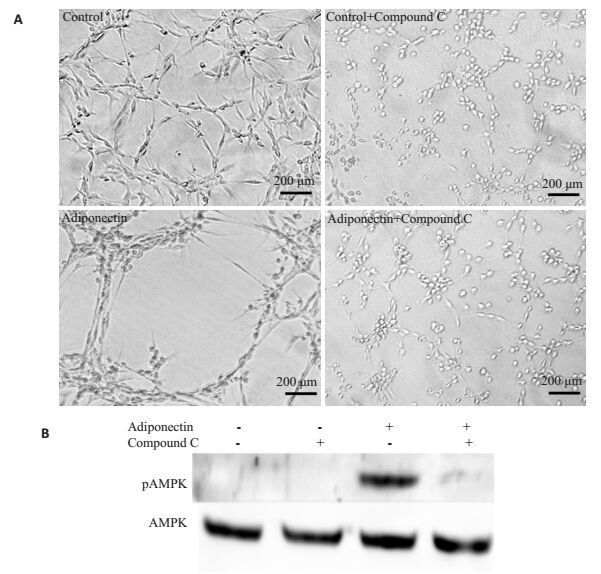
20 μmol/L的AMPK抑制剂Compound C与卵巢微血管内皮细胞预培养1 h后,Martrigel上的血管生长没有明显影响,而球状脂联素诱导的毛细管状结构形成明显被抑制(图 6A)。Compound C同样也抑制了球状脂联素诱导的pAMPK的表达(图 6B)。
|
图 6 AMPK抑制剂Compound C对球状脂联素诱导的卵巢血管内皮管状结构形成及AMPK磷酸化的影响 Figure 6 Effect of AMPK inhibitor, Compound C, on tube formation of OMECs tube formation and AMPK phosphorylation induced by globular adiponectin. A: OMECs were treated with Compound C (20 μmol/L) for 1 h, then 3 μg/mL globular adiponectin was added into the media for 12 h to analyze tube formation. Representative photomicrographs of capillary-like tube structure are shown; B: OMECs were treated with Compound C (20 μmol/L) for 1 h, then 3 μg/mL globular adiponectin was added into the media for 30 min to analyze AMPK phosphorylation by Western blot. |
卵泡在发育早期如始基卵泡及初级卵泡周围是没有血管的,主要依赖间质血管供应能量及养分。随着卵泡直径的增长,卵泡周围的毛细管在卵泡膜逐渐密集[10]。为了尽量富集卵巢血管内细胞,本研究我们采用3周龄的小鼠腹腔注射PMSG 44 h,此时大量卵泡处于大的窦状卵泡发育时期,卵巢内存在密集的毛细管网络且无黄体血管内皮细胞污染。针刺法将颗粒细胞及卵母细胞释放,并用细胞筛过滤方法将颗粒细胞、卵母细胞与卵泡膜细胞及基质细胞细胞团分离,然后将卵泡膜细胞及基质细胞细胞团用胶原酶Ⅰ消化,采用类似分离卵泡黄体微血管内皮细胞的方法[14]用不连续Percoll密度梯度离心法对微血管内皮细胞进一步纯化。不连续Percoll密度梯度离心法已经被广泛的应用到各种组织器官的微血管内皮细胞的纯化,如心脏微血管内皮细胞[15]、肺微血管内皮细胞[16]以及卵巢黄体微血管内皮细胞[14]。经Percoll纯化的卵巢微血管内皮细胞铺板4 h后经过差速贴壁法与不贴壁的血细胞等分离。通过这种方法分离出来的细胞不表达FSHR,但表达LHR。在卵巢内,FSHR主要在颗粒细胞表达[17],而LHR主要表达在生长卵泡的卵泡膜细胞及颗粒细胞中[18]。Yung等[18]发现在血管也有LHR的表达。本研究从小鼠卵巢组织分离出的细胞表现为LHR+FSHR-(图 1B),表明所分离的细胞不存在颗粒细胞污染,且来源于卵泡膜或者血管。我们采用血管内皮细胞表面标记物vWF进行免疫荧光分析发现分离的细胞为vWF阳性,表明分离的细胞为卵巢特异的内皮细胞(vWF+LHR+ FSHR-)。VEGFA是对血管形成具有特异性的重要作用因子,能够通过促进内皮细胞的迁移及增殖促进血管新生[19]。Matrigel是一种重组的基底膜,能够模拟体内基底膜的结构、组成、物理特性和功能,在血管生成过程中。种植在Matrigel基质上的内皮细胞能够响应血管生长因子,并促使微血管内皮细胞形成毛细管状的分支结构[20]。为了进一步验证所分离细胞的血管生成特性,我们采用VEGFA诱导所分离的vWF + LHR + FSHR-细胞在低生长因子的Matrigel上的血管生成活性,结果显示所vWF+ LHR+ FSHR-细胞在VEGFA的刺激下能够形成毛细管状结构。以上结果说明我们成功的分离出了卵巢微血管内皮细胞,细胞表面标记为vWF+LHR+FSHR-。本研究所分离出来的OMECs与Trau等[21]分离的hOMECs以及Sakurai等[14]卵巢黄体细胞分别来源于小鼠、人及大鼠的卵巢组织,都表达血管内皮特异标记,且我们分离得到的OMECs与Trau等[21]分离的hOMECs在VEGF的作用下都可以诱导毛细管状结构形成,然而Trau等[21]分离的hOMECs并没有对其细胞表面标记进行鉴定。且分离的hOMECs主要来源于排卵后的卵泡,而本研究所分离的小鼠OMECs从卵泡发育阶段的卵巢分离得到,更适合于研究卵泡发育过程中的血管新生调控。
近期Cheng等[18]发现脂联素基因敲除的雌性小鼠生育能力受损,卵母数量减少,动情周期紊乱,闭锁卵泡数量增加以及晚期卵泡发育阻滞。这些结果表明脂联素可能参与调控卵泡发育过程及卵泡闭锁。卵泡的发育过程与血管新生密切相关,卵泡周围血管网络的发育障碍将导致卵泡颗粒细胞的凋亡,进而能够导致卵泡的闭锁[22-23]。血管新生过程首先是基底膜及基质的降解,接着是内皮细胞的增殖、迁移,然后小管生成,然后管腔逐渐融合成管状结构。在本研究中发现重组的球状脂联素蛋白能够以剂量依赖的方式促进卵巢微血管内皮细胞的增殖(图 2)、迁移(图 3)以及毛细管状结构(图 4)的形成,表明球状脂联素参与卵泡发育过程中的血管新生调控。PCOS患者[4]及脂联素基因敲除小鼠[5]卵泡闭锁及晚期卵泡发育阻滞可能与卵巢内的脂联素水平低,血管新生过程受到抑制,从而造成卵泡发育过程中养分、能力及细胞因子供应不足相关。血管新生受到多种血管新生因子的调控,通过与内皮细胞膜上的特异性受体结合,启动下游信号分子的级联激活后促进细胞增殖、迁移及管状结构形成效应分子表达[15]。AMPK是一个调控能量稳态的重要激酶,参与许多细胞信号传导通路调控[24]。AMPK信号通路在也参与血管新生调控,其磷酸化水平被抑制后减少内皮细胞的迁移和增殖,血管新生过程受到影响[25]。本研究发现在球状脂联素促进卵巢微血管内皮增殖及细胞迁移过程中,AMPK的磷酸化被激活(图 5)。采用AMPK抑制剂Compound C能够特异的抑制有脂联素诱导的卵巢微血管内皮细胞的AMPK磷酸化及管状结构形成(图 6)。表明AMPK信号通路参与到了球状脂联素诱导的卵巢微血管血管新生过程。该研究结果与球状脂联素对人脐带静脉血管内皮细胞[11]及人微血管内皮细胞[13]血管新生中的结果一致。脂联素对卵巢微血管内皮血管新生的促进作用将有助于卵泡发育过程中卵巢微血管网络的形成。卵巢微血管网络在始基卵泡发育阶段主要存在于间质血管中,而随着卵泡的发育,卵巢微血管在卵泡膜细胞形成,且在卵泡的发育过程中,卵泡周围的微血管网络密度同步增加。脂联素对卵巢微血管内皮细胞血管新生的促进作用将更有利于卵泡发育过程中营养物质的获得,促进优势卵泡的选择发育。
本研究从小鼠卵巢中分离出vWF+ LHR+ FSHR-的卵巢微血管内皮细胞,并从卵泡血管新生调控的角度进一步探索脂联素在卵泡发育过程中的作用,有助于对卵泡发育不良性疾病如多囊卵巢综合征、卵巢早衰等病因进行解析。通过对卵巢血管新生调控及信号调控通路进行深入以期能够对卵泡发育调控及优势卵泡选择机理进行阐释,为临床上进一步提高卵子质量提供参考。
| [1] | Karnati HK, Panigrahi MK, Li Y, et al. Adiponectin as a potential therapeutic target for prostate cancer[J]. Curr Pharm Des, 2017. DOI: 10.2174/1381612823666170208123553. |
| [2] | 严婷, 李玲玲, 王怀明, 等. 2型糖尿病中患者脂肪细胞因子与代谢综合征的关系[J]. 南方医科大学学报, 2014(02): 275-8. |
| [3] | 张凌娟, 苏青. 脂联素血管保护机制研究进展[J]. 上海交通大学学报医学版, 2010, 30(9): 1164-74. |
| [4] | Tao T, Xu B, Liu W. Ovarian HMW adiponectin is associated with folliculogenesis in women with polycystic ovary syndrome[J]. Reprod Biol Endocrinol, 2013, 11: 99. DOI: 10.1186/1477-7827-11-99. |
| [5] | Palin MF, Bordignon VV, Murphy BD. Adiponectin and the control of female reproductive functions[J]. Vitam Horm, 2012, 90: 239-87. DOI: 10.1016/B978-0-12-398313-8.00010-5. |
| [6] | Tabandeh MR, Hosseini A, Saeb M, et al. Changes in the gene expression of adiponectin and adiponectin receptors(AdipoR1 and AdipoR2) in ovarian follicular cells of dairy cow at different stages of development[J]. Theriogenology, 2010, 73(5): 659-69. DOI: 10.1016/j.theriogenology.2009.11.006. |
| [7] | Tabandeh MR, Golestani N, Kafi M, et al. Gene expression pattern of adiponectin and adiponectin receptors in dominant and atretic follicles and oocytes screened based on brilliant cresyl blue staining[J]. Anim Reprod Sci, 2012, 131(1/2): 30-40. |
| [8] | Cheng L, Shi H, Jin Y, et al. Adiponectin deficiency leads to female subfertility and ovarian dysfunctions in mice[J]. Endocrinology, 2016, 157(12): 4875-87. DOI: 10.1210/en.2015-2080. |
| [9] | Robinson RS. The critical importance of ovarian angiogenesis[J]. Reprod Fertil Dev, 2013, 25(2): iii-v. DOI: 10.1071/RDv25n2_ED. |
| [10] | Robinson RS, Woad KJ, Hammond AJ, et al. Angiogenesis and vascular function in the ovary[J]. Reproduction, 2009, 138(6): 869-81. DOI: 10.1530/REP-09-0283. |
| [11] | Ouchi N, Kobayashi H, Kihara S, et al. Adiponectin stimulates angiogenesis by promoting cross-talk between AMP-activated protein kinase and Akt signaling in endothelial cells[J]. J Biol Chem, 2004, 279(2): 1304-9. DOI: 10.1074/jbc.M310389200. |
| [12] | Zhu W, Cheng KK, Vanhoutte PM, et al. Vascular effects of adiponectin:molecular mechanisms and potential therapeutic intervention[J]. Clin Sci, 2008, 114(5): 361-74. DOI: 10.1042/CS20070347. |
| [13] | Adya R, Tan BK, Chen J, et al. Protective actions of globular and full-length adiponectin on human endothelial cells:novel insights into adiponectin-induced angiogenesis[J]. J Vasc Res, 2012, 49(6): 534-43. DOI: 10.1159/000338279. |
| [14] | Sakurai T, Suzuki K, Yoshie M, et al. Stimulation of tube formation mediated through the prostaglandin EP2 receptor in rat luteal endothelial cells[J]. J Endocrinol, 2011, 209(1): 33-43. DOI: 10.1530/JOE-10-0357. |
| [15] | Xia JB, Mao CZ, Chen ZY, et al. The CXCL10/CXCR3 axis promotes cardiac microvascular endothelial cell migration via the p38/FAK pathway in a proliferation-independent manner[J]. Exp Mol Pathol, 2016, 100(2): 257-65. DOI: 10.1016/j.yexmp.2016.01.010. |
| [16] | Lou JN, Mili N, Decrind C, et al. An improved method for isolation of microvascular endothelial cells from normal and inflamed human lung[J]. In Vitro Cell Dev Biol Anim, 1998, 34(7): 529-36. DOI: 10.1007/s11626-998-0112-z. |
| [17] | Griswold MD, Heckert L, Linder C. The molecular biology of the FSH receptor[J]. J Steroid Biochem Mol Biol, 1995, 53(1/6): 215-8. |
| [18] | Yung Y, Aviel-Ronen S, Maman E, et al. Localization of luteinizing hormone receptor protein in the human ovary[J]. Mol Hum Reprod, 2014, 20(9): 844-9. DOI: 10.1093/molehr/gau041. |
| [19] | Matsumoto K, Ema M. Roles of VEGF-A signalling in develo-pment, regeneration, and tumours[J]. J Biochem, 2014, 156(1): 1-10. DOI: 10.1093/jb/mvu031. |
| [20] | Benelli R, Albini A. In vitro models of angiogenesis:the use of Matrigel[J]. Int J biol Markers, 1999, 14(4): 243-6. |
| [21] | Trau HA, Brannstrom M, Curry TE, et al. Prostaglandin E2 and vascular endothelial growth factor A mediate angiogenesis of human ovarian follicular endothelial cells[J]. Hum Reprod, 2016, 31(2): 436-44. |
| [22] | Suzuki T, Sasano H, Takaya R, et al. Cyclic changes of vasculature and vascular phenotypes in normal human ovaries[J]. Hum Reprod, 1998, 13(4): 953-9. DOI: 10.1093/humrep/13.4.953. |
| [23] | 王志强, 倪亚莉, 柴三明. 卵泡液促血管生成因子在卵泡发育过程中的作用及研究进展[J]. 现代妇产科进展, 2014, 23(10): 834-6. |
| [24] | 杨子初, 廖焌伶. AMPK在转化医学中的意义与展望[J]. 中国细胞生物学学报2013, 2335(3): 1-10. |
| [25] | Nagata D, Mogi M, Walsh K. AMP-activated protein kinase(AMPK)signaling in endothelial cells is essential for angiogenesis in response to hypoxic stress[J]. J Biol Chem, 2003, 278(33): 31000-6. DOI: 10.1074/jbc.M300643200. |
 2017, Vol. 37
2017, Vol. 37

