关节软骨缺损是临床常见疾病,由于软骨组织内没有血管供应、神经支配和淋巴回流,加之细胞成分单一,其自身修复能力非常有限[1]。近年来,软骨组织工程得到飞速发展,为关节软骨缺损的治疗提供了新思路[2]。以往认为“支架材料”“、种子细胞”、生物活性因子“是软骨组织工程修复不可或缺的三部分。随着研究不断深入,体外构建活性因子-生物材料复合材料,利用生物活性因子激活内源性细胞,从而促进软骨缺损修复的研究技术为组织工程提供了新的思路,并取得了良好的效果[3]。本实验研究采用的PCL支架材料,是一种有机高分子材料,具有良好的吸引细胞附着、增殖和良好的生物相容性、机械特性等优点,被广泛应用与软骨缺损修复[4-6]。生物活性因子在软骨组织工程中具有重要地位[7]。目前公认的能促成软骨的主要有转移生长因子(TGF-β)[8],骨形态发生蛋白(BMP)[9],成纤维样生长因子(FGF)[10],胰岛素样生长因子(IGF-1)等[11]。既往研究发现,作为生物体内的还原剂,AA在促进软骨胶原合成的过程中发挥重要作用。缺少AA的生物活性因子的信号传导,会抑制软骨胶原合成并最终导致骨关节炎。此外有研究指出,AA通过改变胶原合成进程中的基因表达,从而影响软骨细胞分化和软骨再生[12-13]。但是,既往研究多局限在研究AA与体外培养软骨细胞的相互作用或者PCL生物材料在动物体内的成软骨作用。关于PCL+ AA复合生物功能化材料的体内成软骨效果如何以及AA促进内源性修复机制方面未见报道。此外,与既往研究骨软骨缺损模型不同,本研究采用单纯软骨缺损模型,着重研究在无骨髓源性干细胞参与自发性修复条件下,复合材料在体内的软骨修复作用。因此,本实验采用抗坏血酸活性因子,创新性运用体外预加载因子技术,体外构建PCL+AA生物功能化复合材料,观察材料修复新西兰白兔膝关节单纯软骨缺损的作用,为软骨组织再生修复提供实验数据,为临床关节软骨缺损治疗提供新思路。
1 材料和方法 1.1 实验动物选用健康的6月龄雄性新西兰白兔,共8只,体质量3.0~3.5 kg,实验动物由广东省实验动物中心提供(合格证号:44052110000025)。
1.2 实验分组植入有机生物材料为聚已内酯颗粒,在体外利用材料合成技术预加载抗坏血酸,制备成PCL-AA复合生物材料。共分为3组,A组:PCL+AA实验材料组(n=8);B组:PCL单纯材料组(n=5)C组:空白组(n=3),其中材料组A组与B组在植入材料后,加入纤维蛋白胶—凝血酶原复合物起到固定作用,保证材料有效在动物体内发挥其生物效应。
1.3 动物造模兔子以3%戊巴比妥钠(1 mL/kg)和速眠新注射液(0.1 mL/kg)分别于双侧肌肉麻醉,双侧膝关节常规备皮、消毒、铺巾。取膝关节内侧小切口,向上向下少许锐性分离,屈曲膝关节将髌骨脱位于外侧,暴露股骨滑车关节面,利用磨钻造成直径3.5 mm、深3 mm的圆形单纯软骨缺损,各组缺损均未见出血,不钻通骨髓腔。以生理盐水充分冲洗缺损部位,两侧膝关节随机植入两组不同生物材料,填满缺损,加入纤维蛋白胶—凝血酶原复合物,静置1 min待材料固定后,逐层缝合。空白组制造缺损后不予处理,冲洗后直接缝合。术后置于标准动物实验笼单笼关养,所有术肢不予固定,任其自由活动。常规皮肤涂红霉素软膏预防感染。术后第6、12周空气栓塞法处死白兔,取膝关节作大体、光镜观察,进行组织形态学分析(图 1)。
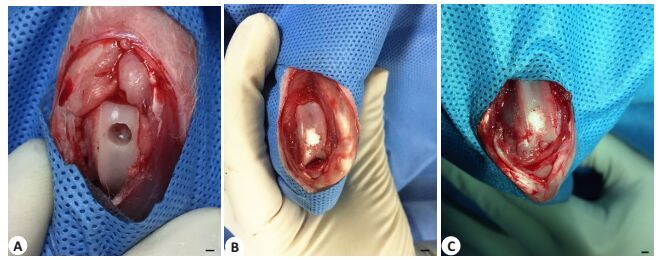
|
图 1 单纯软骨缺损和生物材料植入情况 Figure 1 Cartilage defects created in the trochlear groove of male New Zealand white rabbits and implantation of the biomaterials. A: No treatment (with no bleeding); B: PCL implantation; C: Injection of the mixture of fibrin gel (10 μg) and thrombinogen (10 μg) into the defects. Scale bar=2 mm. |
术后白兔行走步态,膝关节活动度,动物活动、饮食、精神状态以及切口情况。
1.3.2 关节软骨修复的大体观察关节缺损面平整与否,修复软骨的色泽,质地,与邻近软骨的结合情况;边缘软骨是否有退行性的变化;材料有无脱落以及有无骨赘形成等。
1.3.3 组织形态学的光镜观察所有标本在取材后用10%中性缓冲福尔马林溶液固定72 h,0.1 mol/L EDTA脱钙,期间用大头针轻戳标本,至针头可轻松刺入标本中提示脱钙完成,脱钙时间约6~8周,脱钙完成后60%乙醇4 h→70%乙醇4 h→80%乙醇4 h→正丁醇8 h脱水,脱水完成后常规石蜡包埋,包埋完成后以5 μm厚度连续切片,所得切片行苏木素-伊红染色(HE染色)和番红-固绿染色(Safranin O-Fast Green),观察各组材料与组织相容性、组织形态以及蛋白多糖沉积情况,评估成软骨情况。,利用Image-Pro Plus 6.0软件计算各组代表性切片组织新生软骨面积百分数(NCA%)、新生软骨细胞密度(NCD),分析各组生物材料软骨缺损修复效果。
新生软骨面积百分数=新生软骨面积/缺损总面积× 100%
新生软骨细胞密度=新生软骨细胞数/缺损面积
1.3.4 根据Wakitani等制定的软骨组织修复评分标准,采用双盲法,对各个标准进行组织学评价 1.4 统计学分析应用SPSS 20.0统计软件分析,数据用均数±标准差表示,各组资料采用One-way ANOVA方差分析进行检验,如果差异有统计学意义,若方差齐用LSD检验、方差不齐用Dunnett T3检验作两两比较。P < 0.05为差异有统计学意义。
2 结果 2.1 术后一般情况观察术后实验动物全部存活,膝关节无感染和积液现象发生,膝关节活动度较术前无明显改变,表现活跃,食欲佳。术后10 d伤口即完全愈合。所有动物按期分批取材。
2.2 大体观察术后所有标本未见关节腔粘连,周围软骨无磨损,无骨赘生成。A组:术后6周取材的5个标本中可见缺损处基本由再生组织完全填充,表面光滑透明而富有光泽,质地坚硬,与周围软骨组织结合紧密,无间隙,但可清楚的显示界面,术后12周取材3个标本,缺损处填充物为白色半透明软骨样组织,颜色基本与正常软骨较为一致,边界也趋于模糊,缺损基本与正常软骨组织高度持平。B组:术后6周取材5个标本,缺损处由再生组织覆盖,色泽尚可,但较A组光泽度略差,缺损处可见材料颗粒样物质,质可,与周围软骨平齐,与周围软骨有一定界限。C组:术后6周所有标本均未见完整的软骨修复,凹陷明显,仅边界可见少许白色纤维样组织出现,色泽红白相间,周围软骨可见有少许磨损(图 2A1,B1,C1)。
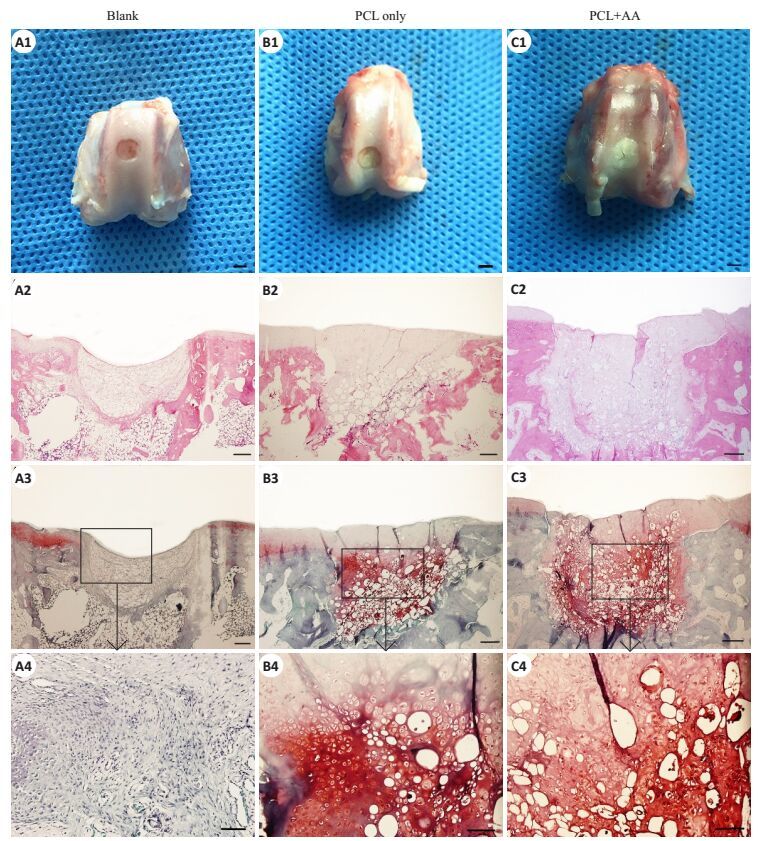
|
图 2 6周标本宏观图和镜下所见HE、Safranin O染色切片图像 Figure 2 Results of cartilage defects repair using PCL + AA scaffold.A1-C1: Macroscopic appearance of the specimens harvested at 6 weeks after operation; A2-C2: HE staining of the sections in each group at 6 weeks; A3-C3: Safranin O staining of the sections in each group. A4-C4: Magnification of the boxed areas in A3-C3, respectively. Scale bar=1.0 mm (A1-A3, B1-B3, C1-C3); Scale bar=100 μm (A4-C4). |
6周各组取材后所有标本进行HE染色(图 2A2,B2,C2)和Safranin O染色(图 2A3,B3,C3),进行组织形态学分析。12周A组标本进行相同染色分析(图 4 A~D)。
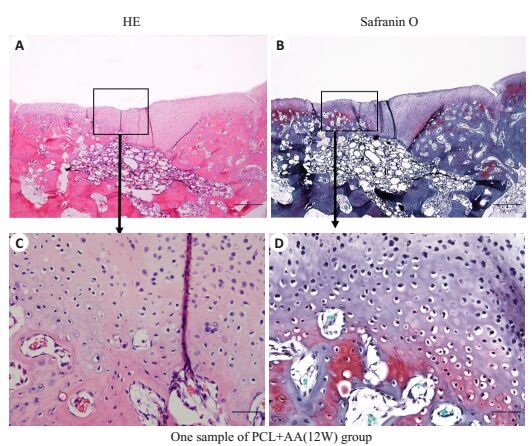
|
图 4 12周A组标本所见HE(A, C)和Safranin O(B, D)染色图像 Figure 4 HE Staining and Safranin O Staining of the tissue from the defects harvested at 12 weeks. Scale bar=1.0 mm (A, B), Scale bar=100 μm (C, D). |
A组:术后6周,HE染色显示缺损处已被修复,修复组织与边缘软骨紧密结合,由缺损边缘呈内生性生长,出现大量清晰蓝染的细胞核(图 3A,C),未见明显的炎性细胞和淋巴细胞浸润。Safranin O染色见缺损部位明显红染,糖胺多糖类物质大量沉积,大量软骨细胞围绕PCL支架材料生长,出现软骨陷窝,新生软骨基质明显红染,细胞呈现分层分布的特点。表明修复组织由透明软骨样组织构成(图 3B,D)。术后12周,缺损处出现平整的软骨界面,新生的软骨与周围软骨结合更为紧密,缺损边界趋于模糊,大量软骨细胞增殖,呈蜂巢样不规则排列的软骨细胞清晰可见,Safranin O染色可见更多的红染的软骨基质,PCL材料在12周时已明显降解吸收,缺损底部见少量材料残余(图 4B,D)。
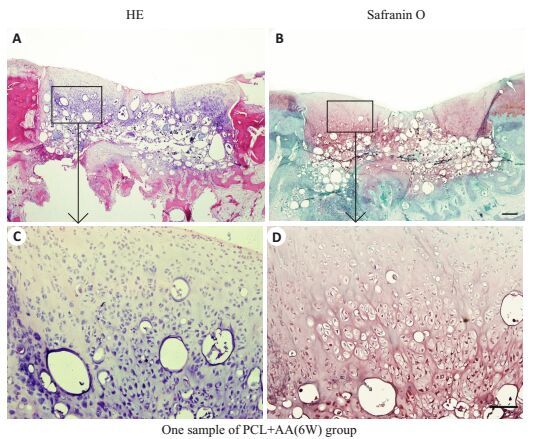
|
图 3 6周A组标本所见HE(A, C)和Safranin O(B, D)染色图像 Figure 3 HE Staining and Safranin O Staining of the tissue from the defects harvested at 6 weeks. Scale bar=1.0 mm (A, B); Scale bar=100 μm (C, D). |
B组:术后6周,HE染色显示缺损区已基本修复,但表面欠平整,仍少许凹陷,Safranin O染色可见有红染,软骨细胞聚集,可见少量长梭行的成纤维样细胞,材料周围可见明显的软骨细胞再生,核清晰,材料与周围软骨边界清楚,交界处细胞增生较多,材料底部与软骨下骨有明显间隙(图 2B3,B4)。
C组:术后6周,缺损凹陷明显,缺损内部可见大量长梭型成纤维样细胞,内部被肉芽组织和纤维组织填充,Safranin O染色阴性,未见明显红染基质和软骨细胞,仅缺损交界处可见少数红染基质(图 2A3,A4)。
2.4 组织学评分根据改良Wakitani评分标准对各个标本进行软骨缺损修复进行评分,统计各组修复例数,SPSS 20.0统计软件分析结果,组间对比采用完全随机方差分析。
结果显示:术后6周,PCL材料复合AA组(4.05± 1.11)修复关节软骨缺损结果明显优于单纯PCL材料组(7.05±0.98)和空白对照组(11.25±1.25)。A、B、C各组之间评分结果具有显著统计学学差异(P < 0.05)。12周A组标本评分结果与6周无统计学差异(图 5)。
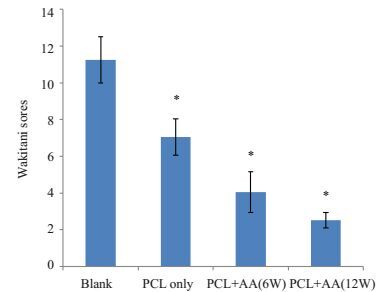
|
图 5 软骨缺损修复的评分结果(改良的Wakitani法) Figure 5 Statistical analysis of Wakitani sores in different groups. Wakitani scores were assessed in experiment group compared with the control group. *P < 0.05 vs blank group. |
术后取材切片进行组织学分析,IPP6.0软件定量新生软骨组织面积百分数(图 6)以及新生软骨细胞密度(图 7),相对于空白组,单纯PCL材料组,PCL+AA实验组新生软骨组织百分数明显增加,具有统计学差异(P < 0.05);添加AA组修复软骨面积百分数优于单纯材料组,实验组12周的新生软骨面积百分数优于6周。6周时,实验组新生软骨细胞密度(230±20/mm2)优于单纯材料组(192±10/mm2)和空白组(35±5/mm2),差异具有统计学意义。实验组中12周和6周新生软骨细胞密度无统计学意义。
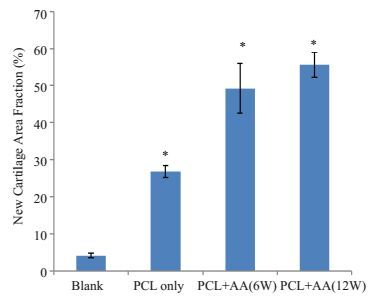
|
图 6 Safrinin O染色切片新生软骨面积百分数定量结果分析 Figure 6 Quantitative assessment of New cartilage area fraction. *P < 0.05 vs blank group. |
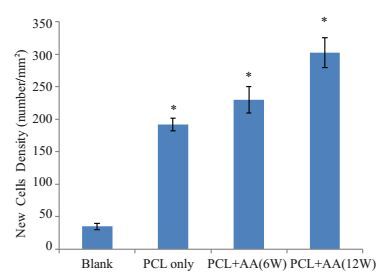
|
图 7 Safrinin O染色切片新生软骨细胞密度定量结果分析 Figure 7 Quantitative assessment of New cells density, *P < 0.05 vs blank group. |
本实验使用PCL+AA生物功能化复合材料用于修复新西兰白兔单纯软骨缺损,根据本实验的研究结果提示缺损有不同程度的新生软骨长入,其中加入AA组修复最为显著。说明活性因子AA起到了加快软骨缺损修复的作用。Sharma等[14]在山羊实验也发现,添加AA进行体外培养的软骨细胞展现了更好的机械特性,并可以延缓关节软骨细胞形态学和生物化学层面上的凋亡进程,在维持细胞健康和关节软骨的功能稳定起到重要作用。另一方面,Esteban等[15]在小鼠和人的体细胞研究中发现,AA能通过多种机制加速诱导多能干细胞(IPSCs)的分化过程,同时可通过设置“路障”的改编程序,延缓细胞衰老进程,从而达到组织修复的目的。因此我们推测,缺损的修复,可能是AA促进了软骨细胞向PCL材料黏附和增殖,并促进软骨形成所必须的胶原合成,具体机制仍需进行下一步的探索。
“stem cell homing”理论的发展[16-17],为组织工程提供了新思路。研究者利用复合TGF-β但无外源性细胞的生物支架材料成功修复白兔膝关节软骨缺损,证明细胞因子可激活内源性干细胞与支架材料生物性的结合,控释生物分子,完成修复过程。另一反面,在Schagemann等[17]对绵羊大型动物实验中单纯应用PCL材料修复骨软骨缺损,发现缺损修复并不完整,多数为纤维修复,仅有少量新生细胞和再生软骨。因此细胞因子在再生修复中的重要性以及不同骨缺损模型中生物材料的功能差异,也是值得探索的课题。本实验研究的复合材料可克服单纯材料植入所带来的不足。并且以白兔自体软骨干细胞为种子细胞,以AA为细胞活性因子,构建新型生物材料,探究其修复软骨缺损的效果。
既往研究指出,骨髓腔中存在的骨髓间充质干细胞(BMSCs),具有多分化潜能,在骨与软骨工程中应用广泛,并取得了良好的效果[8]。在Xu等[18]的研究中发现,加载了BMSCs的PCL-AA生物支架材料展现了良好的软骨修复能力,骨软骨缺损也得到了良好的修复。但是软骨表层的透明软骨修复效果并不理想。临床上常用增强软骨或者软骨下骨自身愈合能力的方法,如钻孔、微骨折技术,通过穿透软骨下骨从骨髓补充多向潜能细胞,修复的组织多为纤维软骨,存在远期退变可能。另外,针对软骨缺损的细胞疗法如自体细胞移植,携带干细胞的生物支架等方法也存在细胞浓度有限等不足缺陷[19-20]。此研究在充分的预实验准备下,得出3.0~3.5 kg新西兰白兔软骨厚度大概为2.5~3.5 mm之间,因此本实验研究的是单纯软骨缺损,在动物手术过程严格控制在以不出血为前提,避免骨髓腔干细胞进入缺损进行自发性内源性修复[21]。所以此实验目的完全基于软骨层面探讨PCL-AA生物材料的软骨修复能力。在无血液中BMSCs和外源性细胞的参与下,通过AA激活内源性软骨来源干细胞与PCL生物材料相互作用,并得到了良好的修复效果。
本实验:术后6周取材标本,以复合PCL+AA的生物支架组修复效果最佳,软骨缺损有不同程度的新生软骨长入,较单纯材料组有更显著的修复效果,表明AA因子在一定程度上促进了软骨缺损的修复。Mauricio等[22]在实验中也发现,在小鼠关节炎模型添加AA后,小鼠关节炎得到了缓解,并展现了更好的软骨细胞活性和延缓透明软骨的变形降解。表明AA能促进软骨基质的再生和胶原的合成,从而修复软骨缺损。6周在单纯PCL材料组后在HE染色切片组织形态学分析中未观察到明显炎症细胞浸润,PCL材料周围长入大量软骨细胞,safranin O染色明显红染,表明再生软骨细胞分泌细胞外基质GAG。缺损周围界面愈合良好。支架本身及降解产物无明显毒副作用,并与软骨细胞结合良好,具有良好的生物相容性,为软骨细胞的黏附、增殖、和生物合成提供了生长的空间。另一方面,6周取材空白组基本无软骨修复,HE切片提示多为长梭形纤维样细胞,safranin O染色阴性。这与我们上述应用模型是密切相关的。空白组在6周时出现阴性结果,证明关节软骨在多种原因所致损伤后,在无外源性干预情况下,修复是相当困难的。
关节软骨内蛋白多糖占基质干重的40%,软骨基质内含有大量蛋白多糖,是透明软骨区别于其他软骨的特征之一[23]。本研究中,对组织切片进行新生软骨面积百分数定量提示PCL-AA复合生物材料可促进新生软骨的长入,切片提示是内生性修复,这可能是边界软骨细胞分泌因子,在趋化因子的作用下不断向缺损中间和材料表面迁移,由此完成全部修复。新生软骨细胞密度是评价再生软骨的质量的关键因素。新生软骨细胞密度定量提示实验组明显优于单纯材料组,AA因子可通过多种调节机制促进软骨细胞的增值,维持良好的细胞稳定性。6周和12周实验组都观察到了典型的软骨细胞陷窝,细胞外基质明显红染,说明再生软骨细胞分泌软骨基质。统计学Wakitani评分评估软骨修复程度实验组明显优于单纯材料组。Clark[24]的研究中也发现AA能通过调控mRNA的转录过程来促进软骨细胞的增值和二型胶原的表达,本研究结果与既往研究一致,也提示AA能促进软骨细胞的增殖和细胞外基质的合成。
综上所述,本研究所构建的PCL-AA生物复合材料在新西兰白兔单纯软骨缺损修复的实验中表现出了良好的生物相容性、成软骨能力,修复效果优于单纯应用材料组,有望成为生物学修复关节软骨缺损的良好方法。与此同时,本研究也存在不足,样本量较少、修复周期较短等。在切片分析中,除了进行HE和safranin O染色,未进行二型胶原等软骨特异性和基因层面上的相关检测。这也是下一步实验需要解决的问题和所需要改进的。目前关节软骨缺损的修复仍缺乏系统、安全、高效的修复方法,对软骨修复机制的认识仍存在争议[25-26]。软骨组织工程方法仍是未来最有发展希望的修复方法。而对于种子细胞、支架材料、生物活性因子的研究和各种配对组合的软骨缺损修复模型都表现出了不同的促进软骨修复的作用。修复方法也更多从外源性修复转到内源性修复迁移。正在蓬勃发展的间接3D打印技术[27]、纳米材料与基因技术的结合应用[28-30]、生物反应器[31]等研究,为软骨修复提供了新的思路。随着材料科学、细胞生物学、生物力学的进步,针对软骨缺损的组织工程正蓬勃发展,结果也令人振奋。未来研究将以软骨组织的彻底修复为目标,在支架材料的相容性,生物因子修复,细胞信号传递的基因调控机制[32]等方面做更加深入的研究,最终为软骨损伤提供成熟的治疗方法。
| [1] | Huey DJ, Hu JC, Athanasiou KA. Unlike bone, cartilage regeneration remains elusive[J]. Science, 2012, 338(619): 917-21. |
| [2] | Makris EA, Gomoll AH, Malizos KN, et al. Repair and tissue engineering techniques for articular cartilage[J]. Nat Rev Rheumatol, 2015, 11(1): 21-34. |
| [3] | Lee CH, Cook JL, Mendelson A, et al. Regeneration of the articular surface of the rabbit synovial joint by cell homing:a proof of concept study[J]. The Lancet, 2010, 376(9739): 440-8. DOI: 10.1016/S0140-6736(10)60668-X. |
| [4] | Labet M, Thielemans W. Synthesis of polycaprolactone:a review[J]. Chem Soc Rev, 2009, 38(12): 3484-504. DOI: 10.1039/b820162p. |
| [5] | Wei B, Yao Q, Guo Y, et al. Three-dimensional polycaprolactone-hydroxyapatite scaffolds combined with bone marrow cells for cartilage tissue engineering[J]. J Biomater Appl, 2015, 30(2): 160-70. DOI: 10.1177/0885328215575762. |
| [6] | Vikingsson L, Gómez-Tejedor JA, Gallego Ferrer G, et al. An experimental fatigue study of a porous scaffold for the regeneration of articular cartilage[J]. J Biomech, 2015, 48(7): 1310-7. DOI: 10.1016/j.jbiomech.2015.02.013. |
| [7] | Fortier LA, Barker JU, Strauss EJ, et al. The role of growth factors in cartilage repair[J]. Clin Orthop Relat Res, 2011, 469(10): 2706-15. DOI: 10.1007/s11999-011-1857-3. |
| [8] | Luo Z, Jiang L, Xu Y, et al. Mechano growth factor(MGF)and transforming growth factor(TGF)-β3 functionalized silk scaffolds enhance articular hyaline cartilage regeneration in rabbit model[J]. Biomaterials, 2015, 52: 463-75. DOI: 10.1016/j.biomaterials.2015.01.001. |
| [9] | Zhou N, Li Q, Lin X, et al. BMP2 induces chondrogenic differentiation, osteogenic differentiation and endochondral ossification in stem cells[J]. Cell Tissue Res, 2016, 366(1): 101-11. DOI: 10.1007/s00441-016-2403-0. |
| [10] | Guan PP, Guo JW, Yu X, et al. The role of cyclooxygenase-2, interleukin-1β and fibroblast growth factor-2 in the activation of matrix metalloproteinase-1 in sheared-chondrocytes and articular cartilage[J]. Sci Rep, 2015, 5: 10412. DOI: 10.1038/srep10412. |
| [11] | Man Z, Hu X, Liu Z, et al. Transplantation of allogenic chondrocytes with chitosan hydrogel-demineralized bone matrix hybrid scaffold to repair rabbit cartilage injury[J]. Biomaterials, 2016, 108: 157-67. DOI: 10.1016/j.biomaterials.2016.09.002. |
| [12] | Sato Y, Mera H, Takahashi D, et al.Synergistic effect of ascorbic acid and collagen addition on the increase in type 2 collagen accumulation in cartilage-like MSC sheet[J].Cytotechnology, 2015:Nov 16.[Epub ahead of print] |
| [13] | Sharma G, Saxena RK, Mishra P. Regeneration of static-load-degenerated articular cartilage extracellular matrix by vitamin C supplementation[J]. Cell Tissue Res, 2008, 334(1): 111-20. DOI: 10.1007/s00441-008-0666-9. |
| [14] | Vinatier C, Mrugala D, Jorgensen C, et al. Cartilage engineering:a crucial combination of cells, biomaterials and biofactors[J]. Trends Biotechnol, 2009, 27(5): 307-14. DOI: 10.1016/j.tibtech.2009.02.005. |
| [15] | Esteban MA, Wang T, Qin B, et al. Vitamin C enhances the Generation of mouse and human induced pluripotent stem cells[J]. Cell Stem Cell, 2010, 6(1): 71-9. DOI: 10.1016/j.stem.2009.12.001. |
| [16] | Mendelson A, Frank E, Allred C, et al. Chondrogenesis by chemotactic homing of synovium, bone marrow, and adipose stem cells in vitro[J]. FASEB J, 2011, 25(10): 3496-504. DOI: 10.1096/fj.10-176305. |
| [17] | Schagemann JC, Rudert N, Taylor ME, et al. Bilayer implants:electromechanical assessment of regenerated articular cartilage in a sheep model[J]. Cartilage, 2016, 7(4): 346-60. DOI: 10.1177/1947603515623992. |
| [18] | Xu L, Wu Y, Xiong Z, et al. Mesenchymal stem cells reshape and provoke proliferation of articular chondrocytes by paracrine secretion[J]. Sci Rep, 2016, 6: 32705. DOI: 10.1038/srep32705. |
| [19] | Madeira C, Santhagunam A, Salgueiro JB, et al. Advanced cell therapies for articular cartilage regeneration[J]. Trends Biotechnol, 2015, 33(1): 35-42. DOI: 10.1016/j.tibtech.2014.11.003. |
| [20] | Mardones R, Jofré CM, Minguell JJ. Cell therapy and tissue engineering approaches for cartilage repair and/or regeneration[J]. Int J Stem Cells, 2015, 8(1): 48-53. DOI: 10.15283/ijsc.2015.8.1.48. |
| [21] | Li WJ, Tuli R, Okafor C, et al. A three-dimensional nanofibrous scaffold for cartilage tissue engineering using human mesenchymal stem cells[J]. Biomaterials, 2005, 26(6): 599-609. DOI: 10.1016/j.biomaterials.2004.03.005. |
| [22] | de Arruda MF, Cassettari LL, Neves LM, et al. Ascorbic acid iontophoresis for chondral gain in rats with arthritis[J]. Acta Ortop Bras, 2014, 22(4): 202-5. DOI: 10.1590/1413-78522014220400769. |
| [23] | Shi D, Xu X, Ye Y, et al. Photo-Cross-Linked scaffold with Kartogenin-Encapsulated nanoparticles for cartilage regeneration[J]. ACS Nano, 2016, 10(1): 1292-9. DOI: 10.1021/acsnano.5b06663. |
| [24] | Clark AG, Rohrbaugh AL, Otterness I, et al. The effects of ascorbic acid on cartilage metabolism in Guinea pig articular cartilage explants[J]. Matrix Biol, 2002, 21(2): 175-84. DOI: 10.1016/S0945-053X(01)00193-7. |
| [25] | Zhen G, Cao X. Targeting TGFβ signaling in subchondral bone and articular cartilage homeostasis[J]. Trends Pharmacol Sci, 2014, 35(5): 227-36. DOI: 10.1016/j.tips.2014.03.005. |
| [26] | Lee CH, Rodeo SA, Fortier LA, et al. Protein-releasing polymeric scaffolds induce fibrochondrocytic differentiation of endogenous cells for knee meniscus regeneration in sheep[J]. Sci Transl Med, 2014, 6(266): 266r. |
| [27] | Moutos FT, Freed LE, Guilak F. A biomimetic three-dimensional woven composite scaffold for functional tissue engineering of cartilage[J]. Nat Mater, 2007, 6(2): 162-7. DOI: 10.1038/nmat1822. |
| [28] | Liu X, Jin X, Ma PX. Nanofibrous hollow microspheres self-assembled from star-shaped polymers as injectable cell carriers for knee repair[J]. Nat Mater, 2011, 10(5): 398-406. DOI: 10.1038/nmat2999. |
| [29] | Saraf A, Mikos A. Gene delivery strategies for cartilage tissue engineering☆[J]. Adv Drug Deliv Rev, 2006, 58(4): 592-603. DOI: 10.1016/j.addr.2006.03.005. |
| [30] | Monteiro N, Ribeiro D, Martins A, et al. Instructive nanofibrous scaffold comprising runt-related transcription factor 2 gene delivery for bone tissue engineering[J]. ACS Nano, 2014, 8(8): 8082-94. DOI: 10.1021/nn5021049. |
| [31] | Luciani N, Du V, Gazeau F, et al. Successful chondrogenesis within scaffolds, using magnetic stem cell confinement and bioreactor maturation[J]. Acta Biomater, 2016, 37: 101-10. DOI: 10.1016/j.actbio.2016.04.009. |
| [32] | Bernhard JC, Vunjak-Novakovic G. Should we use cells, biomaterials, or tissue engineering for cartilage regeneration[J]. ? Stem Cell Res Ther, 2016, 7(1): 56. DOI: 10.1186/s13287-016-0314-3. |
 2017, Vol. 37
2017, Vol. 37

