2. 湖北医药学院生物工程学院,湖北 十堰 442000;
3. 湖北医药学院胚胎干细胞湖北省重点实验室,湖北 十堰 442000
2. College of Bioengineering, Shiyan 442000, China;
3. Hubei Key Laboratory of Embryonic Stem Cell Research, Shiyan 442000, China
母体、胎儿和胎盘的脂质代谢对于正常妊娠、胚胎发育有重要作用。胎儿的生长与胎盘转运营养的能力有关,而这依赖于滋养层细胞中特异转运蛋白的表达和激活[1-2]。异常的胚胎或胎儿营养供给失衡与成年后各种代谢疾病如出生后胎儿低体质量、Ⅱ型糖尿病及心血管疾病的风险有直接联系[3-4]。所有的营养物质中,促进子宫内胚胎的生长发育作用与脂肪酸的关系密切,特别是在中孕期,胎儿对多不饱和脂肪酸PUFAs的需求增加[5-6],这将会增加脂肪酸经胎盘从母体血循环的摄取,然而其经过胎盘转运的机制还不清楚。
FABP7是脑型脂肪酸结合蛋白,属于细胞内脂肪酸结合蛋白家族成员之一,能结合及溶解长链多不饱和脂肪酸,调控细胞内的脂质平衡[7],是神经元干细胞的一种标志性分子。研究表明FABP7在胚胎形成早期阶段的脑组织内含量丰富,与DHA有高度亲合力[8],而DHA能促进FABP7在星形胶质细胞内的表达[9],说明FABP7与早期胚胎的脑部发育及神经细胞有关。目前的研究主要体现在FABP7与脑组织内各种神经细胞间的关系,而在生殖方面,虽有研究指出FABP3、FABP1、FABP4、FABP5在主要的滋养层细胞及胎盘组织中有表达[10],但FABP7在胎盘发育过程中的表达、调节及它在胎盘中的精确定位目前还未见报道。本文旨在研究FABP7在小鼠正常妊娠7.5~10.5 d和14.5 d、18.5 d子宫及胎盘组织,体外滋养层HTR-8/Svneo细胞中的表达,并给予类固醇激素处理HTR-8/Svneo细胞,初步探讨FABP7与胎盘发育的关系。
1 材料和方法 1.1 材料 1.1.1 实验动物由湖北医药学院实验动物中心提供的健康CD1小鼠,鼠龄6~8周。饲料为湖北医药学院实验动物中心提供的标准饲料,饮用自来水,室温下(接近22 ℃)饲养。光周期调控:12 h光照,12 h黑暗。为保证结果的可重复性,研究中各模型条件下及各处理组的每组小鼠至少5只。
1.1.2 主要试剂TRIzol Reagent(ambion life technologies)、反转录试剂盒(Invitrogen),POWER SYBR @ Green PCR Master Mix(applied biosysterms),FABP7、GAPDH引物(上海生物工程股份有限公司合成)芝麻油,17β-雌二醇、孕酮(Sigma),山羊抗兔荧光二抗(Thermo fisher),TritonX-100,PBS(10 ×),SSC(20 ×),DSS,L-咪唑,Tris-HCl(PH=7.5和PH=9.5),tRNA(瑞士Roche公司),Albumin Bovine V,甲基绿,胰蛋白酶(美国Hyclone公司),青链霉素(100 ×)(Thermo fisher),胎牛血清(Gibco),RPMI 1640培养基,DMEM培养基(Hyclone),HBSS(1×)缓冲液(Gibco)等。
1.2 方法 1.2.1 实验动物取材妊娠小鼠模型:性成熟小鼠按雌:雄比例4: 1合笼交配,次日晨检查阴道栓,见有白色或淡黄色阴栓者记为妊娠第0.5天。不同时期的妊娠小鼠至少取材5只。在小鼠妊娠第7.5、8.5、9.5和10.5天,颈椎脱臼法处死小鼠,打开腹腔后无菌分离小鼠子宫组织,剔除子宫系膜及周边脂肪组织,妊娠后小鼠子宫呈串珠样,此时按胚胎数(正常小鼠1次妊娠可孕育十余只胚胎)切分子宫组织,随机分为两组:一组直接迅速置于干冰上,另一组须将胚胎分离后只保留子宫组织再置于干冰上冷冻,再转移至-80 ℃冰箱保存。在妊娠第14.5、18.5天,颈椎脱臼法处死小鼠后按同样的方法分离及切分子宫组织,再将每个胚胎的胎盘及去除胎儿和胎盘的子宫组织分别置于干冰上最后保存于-80 ℃冰箱。
卵巢切除小鼠模型:选择出生后42 d(6周龄)的小鼠进行双侧卵巢切除术,手术后2周随机将卵巢切除的小鼠分为4组,每组10只小鼠。在9:00~10:00间分别皮下注射:芝麻油oil(0.1 mL/只)、17β-雌二醇E2(100 ng/只)、孕酮P4(2 mg/只)、17β-雌二醇(100 ng/只)+孕酮(2 mg/只)E2+P4。在类固醇激素处理后6 h随机取5只小鼠,无菌分离小鼠子宫,剔除子宫周围的系膜及脂肪组织,将两侧子宫切成3 mm的小段,置于干冰上冷冻后转移至-80 ℃冰箱保存。各组剩余的5只小鼠用于类固醇激素处理24 h的组织取材,取材方法同6 h的处理。
1.2.2 Realtime-PCR检测TRIzol法提取组织和细胞RNA并检测,RNA浓度A260/A280在1.8~2.0之间纯度较高,利用琼脂糖凝胶电泳确定提取RNA的完整性和DNA污染情况。提取的RNA按反转录试剂盒说明书进行小鼠子宫组织或HTR-8/Svneo细胞cDNA的合成。以GAPDH为内参,Realtime-PCR检测表达,反应条件为95 ℃变性10 min,95 ℃退火15 s,56 ℃延伸1 min,进行40个循环,每个样品设置至少3个复孔,在Life Technologies公司Applied Biosystems ViiATM 7实时定量PCR仪上进行。mFabp7引物:上游引物5'-AACCT GGAAGCTGACAGAC-3',下游引物5'-AACGATATCCCCAAAGGTAA-3';mGAPDH(内参)引物:上游引物5'-GCCGAGAATGGGAAGCTTGTCAT-3',下游引物5'-GTGGTTCACACCCATCACAAACAT-3'。hFABP7引物:上游引物5'-ATGGTGGAGGCTTTCTGT-3',下游引物5'-GCCATCCCATTTCTGTATG-3';hGAPDH(内参)引物:上游引物5'-GAGATCCCTCCAAAATCA AG-3',下游引物5'-CTGATGATCTTGAGGCTGTT-3'。
1.2.3 原位杂交冰冻切片热固定30 min后用4%多聚甲醛固定1 h。1×PBS洗5 min×2,1% TritonX-100室温20 min,1×PBS洗5 min×3次,预杂交液(DEPC水,20× SSC,50%甲酰胺)200 μL室温孵育15 min,用DIG-标记的cRNA探针先85 ℃变性3 min后迅速置于冰上2 min,杂交液(DEPC水,20×SSC,50%甲酰胺,tRNA,1% BSA):探针比例15:1混合后55 ℃孵育15 h;5 × SSC,50%甲酰胺55 ℃洗15 min,2×SSC,50%甲酰胺55 ℃洗30 min、0.2×SSC,50%甲酰胺55 ℃洗30 min× 2,0.2×SSC室温洗5 min,Buffer(l 1 mol Tris-HCl pH=7.5,2.5 mol NaCl,ddH2O)室温洗5 min,1% Blocking Reagent室温孵育1 h,地高辛抗体(1: 2000)4 ℃孵育过夜;Bufferl室温洗5 min × 3,Buffer3(1 mol Tris-HCl pH=9.5,0.5 mol MgCl2,2.5 mol NaCl,ddH2O)室温洗5 min,NBT/BCIP于37 ℃显色直至出现信号为止,1%甲基绿染色5 min后置于显微镜下观察、拍照。
1.2.4 组织切片免疫荧光冰冻切片热固定30 min后用4% PFA固定1 h。1 × PBS洗5 min,ddH2O洗5 min,0.01 mol/L柠檬酸三钠溶液行微波抗原修复20 min,自然冷却至室温,ddH2O洗5 min,1×PBS洗5 min,10%封闭用马血清37 ℃孵育1 h,一抗(兔抗FABP7,Abcam)按1: 100稀释后4 ℃孵育过夜;1×PBS洗5 min×3次,二抗(山羊抗兔488,Invitrogen)按1: 400稀释后室温孵育1 h,1×PBS洗5 min×2次,DAPI染色37 ℃计15 min,1×PBS洗5 min,ddH2O洗5 min,H-1200荧光介质封片剂处理,置于倒置荧光显微镜下观察,拍照。
1.2.5 细胞爬片免疫荧光HTR-8/Svneo细胞按2×106/mL密度接种至含爬片的24孔皿中,5% FBS/RPMI 1640培养基,37 ℃、5% CO2培养24 h后细胞长满。1×PBS洗5 min×2次,4% PFA固定20 min,1×PBS洗5 min×3次,0.2% TritonX-100室温20 min,1 × PBS洗5 min × 3次,1%BSA 37 ℃孵育40 min,一抗(FABP7,Abcam)按1: 100稀释后4 ℃孵育过夜;次日1×PBS洗5 min×3次,二抗(山羊抗兔488,Abcam)按1: 400稀释后室温孵育1 h,1×PBS洗5 min×3次,H-1200荧光介质封片剂处理,置于倒置荧光显微镜下观察,拍照。
1.3 统计方法数据以均数±标准差表示,用SPSS20.0统计软件对实验结果进行分析,两组间均数比较采用t检验,P < 0.05表示差异具有统计学意义。
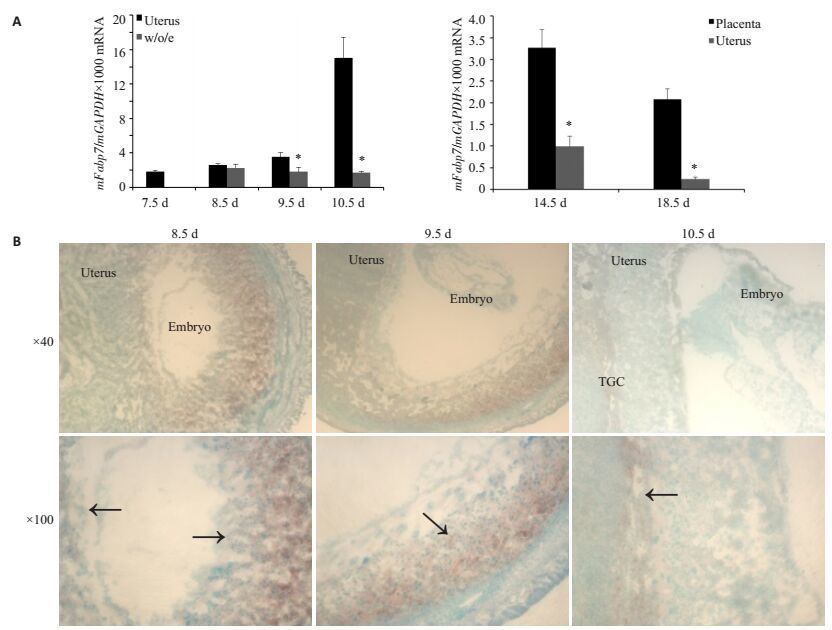
2 结果 2.1 Fabp7 mRNA在妊娠小鼠7.5~18.5 d子宫和胎盘组织中的表达通过Realtime-PCR的方法检测Fabp7 mRNA在妊娠小鼠7.5~18.5 d子宫组织中的表达,8.5~10.5 d分别取小鼠含胎儿的子宫组织及去除胚胎以后的子宫组织,以排除胚胎对其表达量的影响,14.5、18.5 d取成熟的胎盘组织及去除胎儿和胎盘的了宫组织。结果显示在9.5 d和10.5 d去除胚胎以后的子宫组织中Fabp7 mRNA的相对表达量较含胚胎的子宫组织中的低(P < 0.05,图 1A),说明Fabp7在小鼠的胚胎组织中也有一定的表达;而在胎盘形成以后胎盘组织中的相对表达量较高于去除胎儿和胎盘的了宫组织中的表达量,尤其在18.5 d的子宫组织中差异具有统计学意义(P < 0.05,图 1A)。
|
图 1 Fabp7 mRNA在妊娠小鼠8.5~10.5 d子宫及胎盘组织中的表达 Figure 1 Differential expression of Fabp7 mRNA in the uterine and placental tissue of pregnant mice at 8.5-10.5 days of gestation. A: Results of real-time PCR (*P < 0.05 vs 9.5, 10.5, 14.5 d or 18.5 days in the same group); B: Results of in situ hybridization. Arrow indicates the signal sites. w/o/e: Uterus without embryo; TGC: Trophoblast giant cells. |
采用组织原位杂交的方法对妊娠小鼠8.5~10.5 d子宫组织中的Fabp7 mRNA进行检测,发现在8.5~ 10.5 d小鼠子宫蜕膜化区有明显的棕色杂交信号,在10.5 d的胚胎组织中也有较强的杂交信号。同样在小鼠胚胎外的滋养层巨细胞尤其是10.5 d的组织中也可看到明显的杂交信号(图 1B)。
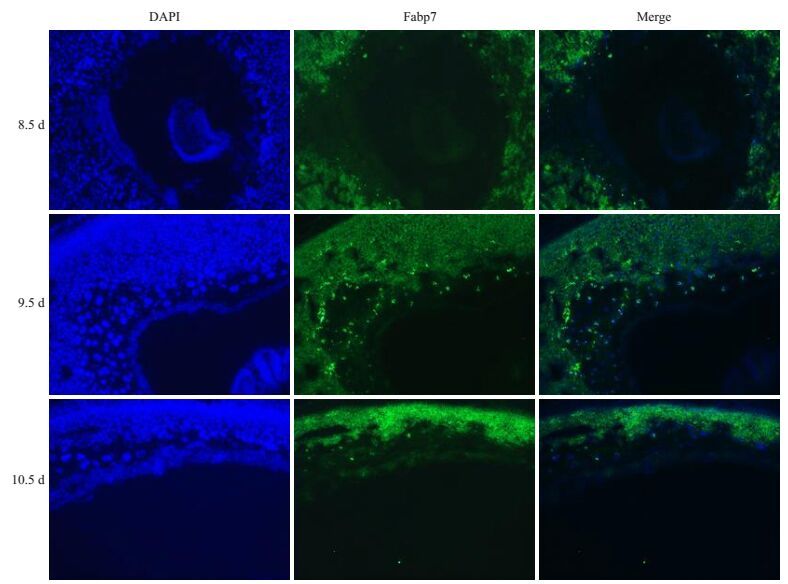
2.2 Fabp7蛋白在妊娠小鼠8.5~10.5 d子宫组织中的表达组织切片免疫荧光的结果显示,从8.5 d开始Fabp7蛋白表达于滋养层巨细胞的细胞核中,且随着妊娠天数的增加有信号表达的细胞数增多,而在小鼠子宫蜕膜化区也见绿色荧光信号(图 2),这与原位杂交的信号部位一致。这说明Fabp7蛋白在小鼠胎盘发育8.5~10.5 d过程中的滋养层巨细胞核内和子宫蜕膜化区有表达。
|
图 2 免疫荧光检测Fabp7在妊娠小鼠8.5~10.5 d子宫组织中的表达 Figure 2 Immunofluorescence assay for Fabp7 expression in uterine tissue of mice at 8.5-10.5 days of gestation (Original magnification: ×40). DAPI: Nuclear Staining; Merge: Single superposition. |
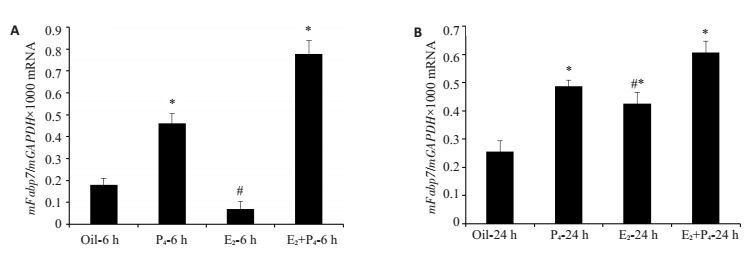
为了探究Fabp7的表达是否受激素调节的影响,我们建立卵巢切除小鼠模型,排除内源性性激素的作用,在此基础上分别用芝麻油(对照组)、E2、P4及E2+P4联合处理,行皮下注射,并于处理后6 h和24 h收集小鼠子宫组织。利用Realtime-PCR检测Fabp7 mRNA的相对表达量,结果(图 3)单独P4和E2+P4联合处理6 h后较对照组比其表达上调(P < 0.05),而E2单独处理6 h后较对照组比其相对表达量变化不明显,差异不具有统计学意义;E2+P4联合处理6 h后较E2单独处理组比其表达上调(P < 0.05)。激素处理24 h后小鼠子宫组织中Fabp7 mRNA的相对表达量,E2、P4及E2+P4较对照组比其表达均上调(P < 0.05),E2+P4联合处理24 h后较E2单独处理组比其表达上调(P < 0.05)。
|
图 3 激素处理后小鼠子宫组织中Fabp7 mRNA的表达 Figure 3 Expression of Fabp7 mRNA in the uterine tissue of mice with hormone treatments. A: Results of real-time PCR after hormone treatment for 6 h (*P < 0.05 vs oil-6 h, #P < 0.05 vs E2 + P4-6 h); B: Results of real-time PCR after hormone treatment for 24 h (*P < 0.05 vs oil-6 h, #P < 0.05 vs E2+P4-24 h); oil: control group; E2: 17β-estradiol; P4: progesterone; E2+P4: 17β-estradiol+progesterone. |
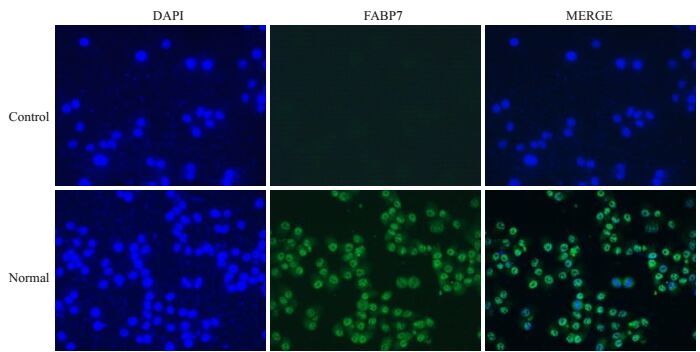
为了研究FABP7在体外滋养层细胞中的表达情况,我们选择了HTR-8/Svneo人绒毛滋养层细胞株作为研究对象,通过细胞免疫荧光结果看出FABP7蛋白在HTR-8/Svneo细胞的核内与阴性对照相比有很强的荧光信号,而这种变化与小鼠的实验结果一致(图 4)。这表明FABP7蛋白在HTR-8/Svneo细胞的细胞核中表达较强。
3 讨论胚胎的生长依赖于其对营养物质的吸收和利用,这在很大程度上取决于胎盘转运的营养物质的多少。而胎盘中脂肪酸的转运是一个非常重要和复杂的过程,需要脂肪酸转运蛋白、脂肪酸转位酶及脂肪酸结合蛋白等促进滋养层摄取和细胞内脂质的转运,但它们发挥作用的具体生物学机制尚不清楚。胎盘中乳糜微粒是脂肪酸的主要来源,需要甘油三酯水解酶的活性促使胎盘摄取脂肪酸[11-12]。此外,一些膜蛋白也被认为对胎盘中脂肪酸的摄取很重要,例如胎盘特异的质膜相关的脂肪酸结合蛋白和脂肪酸转移酶。胎盘组织的异常会导致多种疾病的发生如子痫前期、胎儿宫内生长受限等。流行病学的研究表明胎儿生长受限会增加一些疾病的发生率,例如心血管疾病、肥胖和代谢综合症等,而这可能是子宫胎盘血流灌注的不足造成的[13-14]。
研究表明,通过限制妊娠期饮食建立小鼠胎儿生长受限模型,随机分成2组发现,在饮食限制组小鼠的神经元干细胞中FABP7阳性的细胞较对照组减少,在饮食限制的前提下再加用牛磺酸,FABP7的表达又升高[15]。在胚胎形成的早期,FABP7表达较高且与DHA有很强的亲和力,研究表明高浓度的DHA与FABP7的表达呈正相关并能促进胚胎的发育。这些都说明FABP7与摄入脂肪酸、氨基酸等的营养物质有关,以此来调节胚胎的发育[16]。FABP7是细胞中脂肪酸结合蛋白的一员,也是神经元细胞的标志分子[17],而本文主要检测妊娠期小鼠发育中的胎盘和子宫组织中FABP7的差异性表达和调节。
为了探究FABP7与胎盘发育的关系,本研究中检测了FABP7在妊娠小鼠7.5~10.5 d子宫和14.5 d、18.5 d胎盘组织,及人早孕期滋养层细胞HTR-8/Svneo中的表达,结果显示在妊娠小鼠滋养层巨细胞、HTR-8/Svneo细胞均有表达。研究表明在缺氧的滋养层中FABP1、FABP3、FABP4的蛋白水平是增加的[18],因HIF是细胞对低氧环境下作出应答的核转录调控因子,故可以推测脂肪酸结合蛋白是它的下游信号分子,应在本研究的基础上需要进一步探究FABP7存在及发挥作用的分子机制。
为了进一步研究FABP7在滋养层细胞中的表达情况,我们选择HTR-8/Svneo人滋养层细胞作为研究对象,通过免疫荧光方法检测到在HTR-8/Svneo细胞的细胞核中较阴性对照组有FABP7蛋白的荧光信号(图 3)。FABP7蛋白在核内的表达说明其发挥作用的部位可能在细胞核内,通过与核内的转录调控因子的相互作用从而引起信号转导的变化,但其具体的机制还需要更深入的研究。
脂肪酸结合蛋白与类固醇激素之间的关系如何?FABP1即肝脏型脂肪酸结合蛋白,在妊娠妇女的肝脏组织的细胞之中浓度高于同年龄的未孕女性,相反地,在孕晚期FABP1 mRNA的水平下降。以往的研究证明在男女性FABP1的表达差异依赖于性激素的不同且与mRNA的表达水平一致[19]。这说明FABP1的表达与激素水平有关。FABP7与激素之间又有什么联系?研究表明FABP7参与肿瘤细胞的增殖、迁移,并与不良的预后有关。FABP7在乳腺癌中的表达水平明显升高,而这与雌孕激素受体缺乏及细胞增殖能力增强有关[20]。所以我们检测FABP7的表达调节与体内的激素水平是否有一定的关系。子宫是受激素控制的周期性变化的器官,雌、孕激素的协同作用能够使子宫内膜细胞发生增殖和分化。本研究在卵巢切除小鼠模型的基础上,分别用E2、P4及E2+P4联合处理并于激素处理后6 h和24 h检测Fabp7 mRNA表达,单独P4和E2+P4联合处理6、24 h后较对照组比其表达均上调(P < 0.05),说明E2+P4、P4对其表达有促进作用;而E2单独处理6 h后较对照组比其相对表达量变化不明显,差异不具有统计学意义,E2处理24 h后又促进它的表达(P < 0.05),说明雌激素发挥作用的时间更晚;E2+P4联合处理6、24 h后较E2单独处理组比其表达上调(P < 0.05),说明E2或者P4能够协同作用上调子宫内FABP7的表达。
在胚胎植入后,子宫内膜基质细胞就会发生蜕膜化,这一过程包括子宫内腺体的分泌、自然杀伤细胞的汇聚、血管的重建及内膜基质细胞转化成高度特异的蜕膜细胞。于此同时,胚泡的滋养外胚层向子宫内膜侵袭,开始血管的重建与母体发生联系。而滋养层细胞的分化和侵袭活性受到时间和空间的调控确保形成合适的胎盘,滋养层细胞的过度侵入会导致胎盘的附着增大和穿透性增加,而这也是导致母体产后出血和死亡的主要原因[21]。有研究表明绒毛膜外滋养层细胞获得侵袭能力主要通过产生大量的金属蛋白酶减少细胞外基质,而蜕膜化细胞则会产生金属蛋白酶的抑制剂来抗衡这种作用,因此蜕膜化能产生一种物理和生化屏障限制其侵袭[22]。由此可以看出,蜕膜化与滋养层细胞的侵袭及胎盘的形成关系密切。本研究中也发现FABP7在小鼠妊娠8.5~10.5 d的蜕膜组织中有较强的表达(图 1B,图 2),而蜕膜对于妊娠的建立和维持是至关重要的,所以FABP7与小鼠蜕膜化有一定的关系。
胎盘是母体与胎儿之间互相联系的纽带,胎盘的正常发育关系母体及胎儿的健康,本文探究了FABP7在妊娠小鼠子宫及HTR-8/Svneo细胞中的表达情况及类固醇激素对其表达的影响,但妊娠过程涉及胎盘和胎儿的各个方面,本研究只是它的表达情况及激素的调控作用的初步结果,其具体作用机制还需更深入的探索。
|
图 4 FABP7在HTR-8/Svneo细胞中的表达 Figure 4 Expression of FABP7 in HTR-8/Svneo cells (× 400). Control: Negative control group; Normal: Experiment group. DAPI: Nuclear Staining; MEerge: Single superposition. |
| [1] | Sibley CP. Understanding placental nutrient transfer-why bother? New biomarkers of fetal growth[J]. J Physiol, 2009, 587(14): 3431-40. DOI: 10.1113/jphysiol.2009.172403. |
| [2] | Jansson T, Myatt L, Powell TL. The role of trophoblast nutrient and ion transporters in the development of pregnancy complications and adult disease[J]. Curr Vasc Pharmacol, 2009, 7(4): 521-33. DOI: 10.2174/157016109789043982. |
| [3] | Barker DJ. Adult Consequences of fetal growth restriction[J]. Clin Obstet Gynecol, 2006, 49(2): 270-83. DOI: 10.1097/00003081-200606000-00009. |
| [4] | Barker DJ, Bagby SP, Hanson MA. Mechanisms of disease:in utero programming in the pathogenesis of hypertension[J]. Nat Clin Pract Nephrol, 2006, 2(12): 700-7. DOI: 10.1038/ncpneph0344. |
| [5] | Islam A, Kagawa Y, Sharifi K, et al. Fatty acid binding protein 3 is involved in n-3 and n-6 PUFA transport in mouse trophoblasts[J]. J Nutr, 2014, 144(10): 1509-16. DOI: 10.3945/jn.114.197202. |
| [6] | Haggarty P. Meeting the fetal requirement for polyunsaturated fatty acids in pregnancy[J]. Curr Opin Clin Nutr Metab Care, 2014, 17(2): 151-5. DOI: 10.1097/MCO.0000000000000036. |
| [7] | Morihiro Y, Yasumoto Y, Vaidyan LK, et al. Fatty acid binding protein 7 as a marker of glioma stem cells[J]. Pathol Int, 2013, 63(11): 546-53. DOI: 10.1111/pin.2013.63.issue-11. |
| [8] | Elsherbiny ME, Goruk S, Monckton EA, et al. Long-Term effect of docosahexaenoic acid feeding on lipid composition and brain fatty Acid-Binding protein expression in rats[J]. Nutrients, 2015, 7(10): 8802-17. DOI: 10.3390/nu7105433. |
| [9] | Tripathi S, Kushwaha R, Mishra J, et al. Docosahexaenoic acid up-regulates both PI3K/AKT-dependent FABP7-PPARγ interaction and MKP3 that enhance GFAP in developing rat brain astrocytes[J]. J Neurochem, 2017, 140(1): 96-113. DOI: 10.1111/jnc.2017.140.issue-1. |
| [10] | Campbell FM, Bush PG, Veerkamp JH, et al. Detection and cellular localization of plasma membrane-associated and cytoplasmic fatty acid-binding proteins in human placenta[J]. Placenta, 1998, 19(5/ 6): 409-15. |
| [11] | Larqué E, Ruiz-Palacios M, Koletzko B. Placental regulation of fetal nutrient supply[J]. Curr Opin Clin Nutr Metab Care, 2013, 16(3): 292-7. DOI: 10.1097/MCO.0b013e32835e3674. |
| [12] | Gauster M, Hiden U, Blaschitz A, et al. Dysregulation of placental endothelial lipase and lipoprotein lipase in intrauterine growth-restricted pregnancies[J]. J Clin Endocrinol Metab, 2007, 92(6): 2256-63. DOI: 10.1210/jc.2006-2403. |
| [13] | Varvarigou AA. Intrauterine growth restriction as a potential risk factor for disease onset in adulthood[J]. J Pediatr Endocrinol Metab, 2010, 23(3): 215-24. |
| [14] | Baschat AA, Hecher K. Fetal growth restriction due to placental disease[J]. Semin Perinatol, 2004, 28(1): 67-80. DOI: 10.1053/j.semperi.2003.10.014. |
| [15] | Wang Y, Li XW, Liu J, et al. Antenatal taurine supplementation in fetal rats with growth restriction improves neural stem cell proliferation by inhibiting the activities of Rho family factors[J]. J Matern Fetal Neonatal Med, 2017, 4(16): 1-15. |
| [16] | Maximin E, Langelier B, A oun J, et al. Fatty acid binding protein 7 and n-3 poly unsaturated fatty acid supply in early rat brain development[J]. Dev Neurobiol, 2016, 76(3): 287-97. DOI: 10.1002/dneu.v76.3. |
| [17] | Li XW, Li F, Liu J, et al. Effect of antepartum taurine supplementation in regulating the activity of Rho family factors and promoting the proliferation of neural stem cells in neonatal rats with fetal growth restriction[J]. Zhongguo Dang Dai Er Ke Za Zhi, 2016, 18(11): 1158-65. |
| [18] | Mishima T, Miner JH, Morizane M, et al. The expression and function of fatty acid transport protein-2 and -4 in the murine placenta[J]. PLoS One, 2011, 6(10): e25865. DOI: 10.1371/journal.pone.0025865. |
| [19] | Besnard P, Foucaud L, Mallordy A, et al. Expression of fatty acid binding protein in the liver during pregnancy and lactation in the rat[J]. Biochim Biophys Acta, 1995, 1258(2): 153-8. DOI: 10.1016/0005-2760(95)00114-R. |
| [20] | Liu RZ, Graham K, Glubrecht DD, et al. A fatty acid-binding protein 7/RXRβ pathway enhances survival and proliferation in triple-negative breast cancer[J]. J Pathol, 2012, 228(3): 310-21. DOI: 10.1002/path.2012.228.issue-3. |
| [21] | Tantbirojn P, Crum CP, Parast MM. Pathophysiology of placenta creta:the role of decidua and extravillous trophoblast[J]. Placenta, 2008, 29(7): 639-45. DOI: 10.1016/j.placenta.2008.04.008. |
| [22] | Burrows TD, King A, Loke YW. Trophoblast migration during human placental implantation[J]. Hum Reprod Update, 1997, 2(4): 307-21. |
 2017, Vol. 37
2017, Vol. 37

