2. 蚌埠医学院第一附属医院消化科,安徽 蚌埠 233030
2. Department of Gastroenterology, First Affiliated Hospital, Bengbu Medical College, Bengbu 233030, China
近年来,随着人们生活环境的改变,癌症的发生率也逐年增加。2015年国际癌症研究机构发布的数据显示,2012年全世界癌症新增人数为1410万,死亡人数达到了820万。其中,乳腺癌的发病率逐年提升,已成为威胁女性健康的首要问题[1]。目前,对于乳腺癌的治疗仍以手术和放化疗为主,但是继发性耐药的出现导致了整体治疗效果的不理想。因此,克服肿瘤耐药,增加肿瘤对化疗药物的敏感性已成为研究热点。通过靶向糖酵解达到“饿死”肿瘤的治疗策略在肿瘤领域受到广泛研究,并取得了一系列有力的证据[2-5]。3-溴丙酮酸(3-BrPA)是一种糖酵解抑制剂,能通过抑制肿瘤细胞糖酵解来减少三磷酸腺苷(ATP)的产生,导致细胞死亡[6]。虽然研究证实3-BrPA具有不错的抗肿瘤效果[7-8],但仍有部分癌细胞对其敏感性较差。
单羧酸转运蛋白是广泛分布在哺乳动物细胞膜上的一类跨膜转运蛋白,在肿瘤的发生发展过程中具有重要的意义[9-10]。单羧酸转运蛋白1(MCT1)作为单羧酸转运蛋白家族中的一员,负责调控乳酸、丙酮酸、脂肪酸等一元羧酸的转运,并受到了大量关注,但目前MCT1在调控3-BrPA敏感性方面的研究尚浅。本课题检测不同乳腺癌细胞对3-BrPA的敏感性,选择低敏感性的乳腺癌细胞,通过上调MCT1表达进一步探究其在增强3-BrPA敏感性中的作用,以期为乳腺癌的临床治疗提供新的方法和思路。
1 材料和方法 1.1 细胞株人乳腺癌细胞株MDA-MB-231和MCF-7购于中科院上海细胞库,冻存培养于蚌埠医学院生化药理实验室。培养于含10%新生胎牛血清的DMEM高糖培养基中(青霉素1×105 U/L、链霉素100 mg/L),置于37 ℃、5%CO2培养箱中。
1.2 主要试剂DMEM高糖培养基、Opti-MEM培养基、胰蛋白酶、胎牛血清购于Gibco,3-BrPA、MTT、溴化丙啶购于Sigma,兔抗人MCT1抗体、兔抗人β-actin抗体购于Abcam,MCT1过表达质粒购于上海吉玛基因有限公司,Lipo2000购于Invitrogen,ATP检测试剂盒购自碧云天生物技术研究所。
1.3 MTT法检测细胞增殖抑制取对数生长期细胞种于96孔板中,每孔分别加入100 μL含有MDA-MB-231(1×104/孔)和MCF-7(5×103/孔)细胞的培养液,在培养箱中培养24 h后,弃去孔中培养液,加入含有不同浓度(0、25、50、100、200 μmol/L)3-BrPA的新鲜培养液,并设置调零孔,每组5个复孔。培养24 h后,在显微镜下观察细胞形态学变化,每孔加入15 μL MTT,避光操作。培养箱中培养4 h后,弃去孔中培养液,每孔加入150 μL二甲基亚砜溶解,37 ℃温箱孵育30 min后,酶标仪检测波长在490 nm处各孔吸光度。
1.4 溴化丙啶法检测细胞凋亡取对数生长期细胞种于12孔板中,每孔加入1 mL新鲜DMEM培养液,调整细胞悬液浓度,使MDA-MB-231和MCF-7浓度分别为2×105/孔和1.5×105/孔,培养24h后,更换含有不同浓度(0、25、50、100、200 μmol/L)3-BrPA的培养液,继续培养24 h,收集细胞,加入1 mL 75%冰乙醇固定,4 ℃过夜。用溴化丙啶染液染色2 h后,用流式细胞仪检测细胞凋亡率。
1.5 己糖激酶Ⅱ和乳酸脱氢酶活性的测定取对数生长期细胞种于6孔板中,每孔加入2 mL培养液,调整MDA-MB-231和MCF-7细胞悬液浓度分别为3.5×105/孔和2.5×105/孔,培养24 h后,更换含有不同浓度(0、25、50、100、200 μmol/L)3-BrPA的培养液,继续培养24 h后收集细胞,4 ℃ 12 000 r/min离心30 min取上清用于后续分析。分别使用己糖激酶Ⅱ检测试剂盒(Cloud-Clone Crop.)和乳酸脱氢酶测定试剂盒(南京建成)并按其说明书操作,检测酶活性。实验重复3次。
1.6 细胞内乳酸、ATP水平的测定取生长状态良好的细胞种于6孔板中,调整MDA-MB-231和MCF-7细胞悬液浓度分别为3.5×105/孔和2.5×105/孔,培养箱中培养24 h后,加入含有不同浓度(0、25、50、100、200 μmol/L)3-BrPA的培养液处理24 h或6 h(检测乳酸和ATP分别处理24 h和6 h)后收集细胞加入适量磷酸盐缓冲液重悬并转移至1.5 mL EP管中,-20 ℃反复冻融3次,使细胞膜充分裂解,4 ℃ 12 000 r/min离心30 min取上清用于后续分析。分别使用乳酸测定试剂盒(BioVision)和ATP测定试剂盒(碧云天)进行检测。实验重复3次。
1.7 Western blot检测蛋白表达将细胞接种于60 mm平皿24 h后,收集细胞,加入适量的蛋白裂解液,冰上裂解30 min。4 ℃低温离心机12 000 r/mim离心30 min,提取蛋白上清,使用BCA法进行蛋白定量,使各组蛋白至等浓度。每组取40 μg蛋白进行SDS-PAGE电泳;转至聚偏氟乙烯膜;用5%脱脂牛奶封闭4 h;四聚丙烯(烷基)苯磺酸盐溶液洗膜3次,5 min/次;4 ℃一抗过夜,四聚丙烯(烷基)苯磺酸盐溶液洗膜3次;二抗室温下孵育2 h;四聚丙烯(烷基)苯磺酸盐溶液洗膜3次;ECL试剂盒暗室发光显影,Bio-Rad凝胶成像系统获取图像。
1.8 过表达质粒转染取生长状态良好的细胞种于6孔板中,调整MDA-MB-231细胞悬液浓度分别为3.5×105/孔,培养箱中培养24 h后,使用lipo2000和Opti-MEM培养基与质粒(对照组为空载体质粒)形成的复合物加入不含抗生素和血清的Opti-MEM培养基中,6 h后换用新鲜的DMEM培养基,继续培养48 h后用于后续分析。
1.9 统计分析方法采用SPSS13.0软件对实验结果进行分析,实验数据均以均数±标准差表示,各组间差异采用单因素方差分析和LSD检验比较组间差异,P < 0.05为差异有统计学意义。
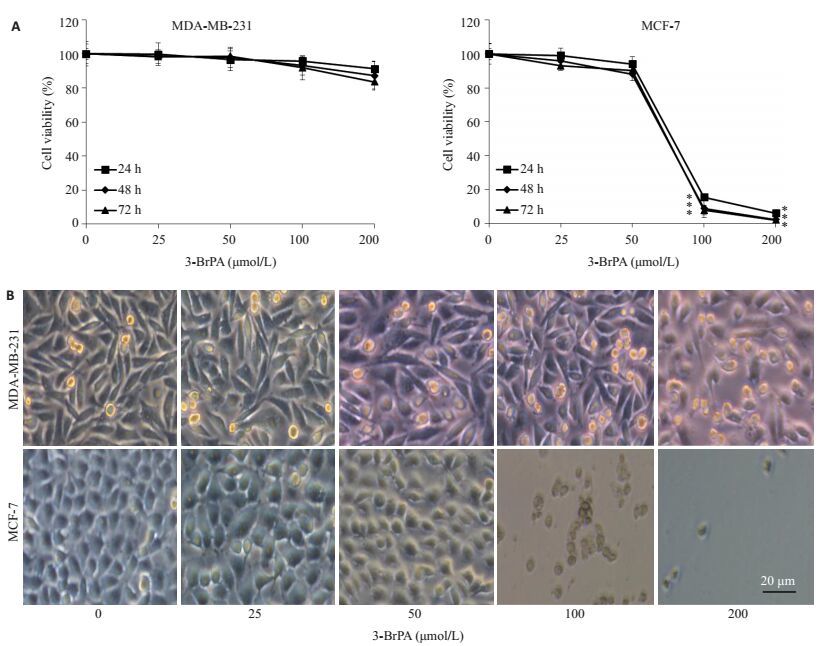
2 结果 2.1 3-BrPA对人乳腺癌细胞MDA-MB-231和MCF-7的增殖抑制作用MTT结果表明:随着药物浓度增加和作用时间延长,3-BrPA对人乳腺癌细胞MDA-MB-231和MCF-7的增殖抑制作用也相应增加(图 1)。MDA-MB-231细胞相对不敏感,200 μmol/L 3-BrPA作用MDA-MB-231细胞72 h后抑制率仅为16.64%,而100 μmol/L药物作用MCF-7细胞24 h后抑制率达到84.64%,与对照组比较具有统计学差异(P < 0.05,图 1A)。在倒置显微镜同一视野下观察不同浓度3-BrPA处理后的细胞形态,结果显示:随着药物浓度的增加,MDA-MB-231细胞的形态和密度未见明显改变;而MCF-7细胞的形态和密度有明显改变(图 1B)。
|
图 1 3-BrPA对MDA-MB-231和MCF-7细胞的增殖抑制作用 Figure 1 Inhibitory effect of 3-BrPA on MDA-MB-231 and MCF-7 cells. A: Cell viability; B: Morphological changes of the cells (*P < 0.05 vs control). |
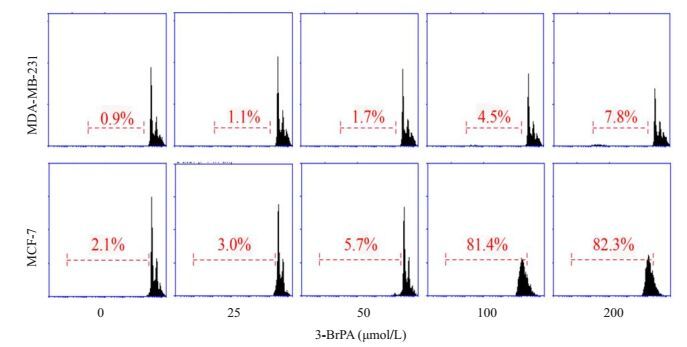
流式细胞术检测结果显示,3-BrPA对MDA-MB-231细胞的凋亡未有明显影响,200 μmol/L的3-BrPA作用于细胞后,凋亡率仅为7.8%,3-BrPA能显著诱导MCF-7细胞的凋亡,200 μmol/L的3-BrPA作用于细胞后,其凋亡率为82.3%(图 2)。
|
图 2 3-BrPA对MDA-MB-231和MCF-7细胞凋亡的影响 Figure 2 Effect of 3-BrPA on apoptosis of MDA-MB-231 and MCF-7 cells. |
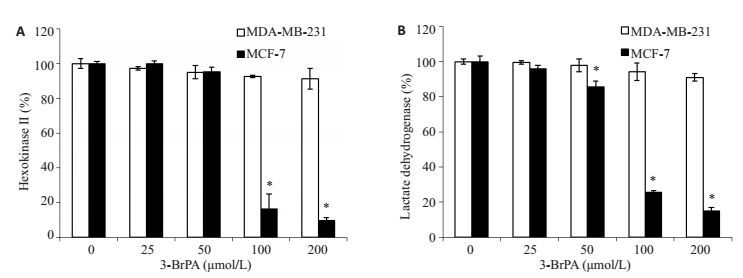
ELISA结果显示,与对照组比,随着药物浓度的增加,MDA-MB-231细胞内己糖激酶Ⅱ和乳酸脱氢酶的活性未出现显著下降,差异不具有统计学意义(P > 0.05);而MCF-7细胞内的己糖激酶Ⅱ和乳酸脱氢酶活性在100、200 μmol/L时均有明显下降,差异具有统计学意义(P < 0.05,图 3)。
|
图 3 3-BrPA对MDA-MB-231和MCF-7细胞的糖酵解酶活性的影响 Figure 3 Effect of 3-BrPA on glycolysis enzyme activity in MDA-MB-231 and MCF-7 cells. A: Hexokinase Ⅱ activity; B: Lactate dehydrogenase activity (*P < 0.05 vs control group). |
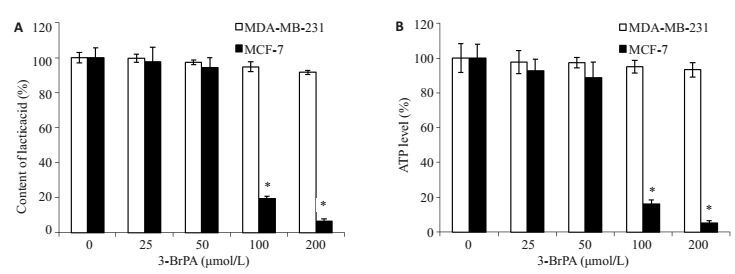
ELISA试剂盒检测表明,MDA-MB-231细胞内乳酸和ATP水平随着3-BrPA浓度的增加并未出现明显降低,与对照组比较差异均无统计学意义(P > 0.05);而MCF-7细胞内的乳酸和ATP水平随着3-BrPA浓度的增加出现明显下降,在3-BrPA浓度为100、200 μmol/L时与对照组比较差异有统计学意义(P < 0.05,图 4)。
|
图 4 3-BrPA影响MDA-MB-231和MCF-7细胞的乳酸和ATP含量 Figure 4 3-BrPA affects the level of lactic acid (A) and ATP (B) in MDA-MB-231 and MCF-7 cells.*P < 0.05 vs control. |
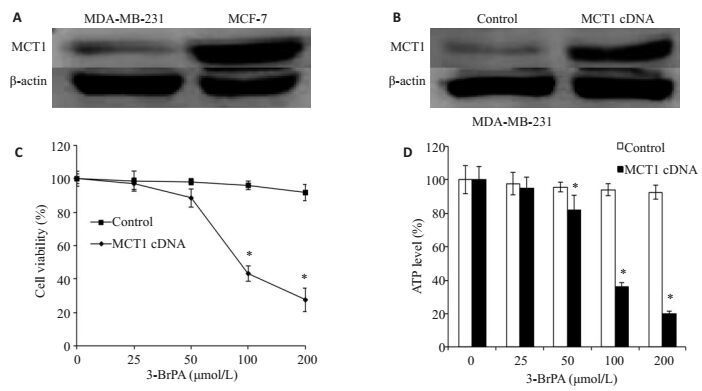
通过Western blot法检测发现,MCT1在MDA-MB-231细胞中几乎不表达,而在MCF-7细胞中表达较高(图 5A)。为了证实MCT1对3-BrPA敏感性的影响,将MCT1 cDNA转染到MDA-MB-231细胞中(图 5B),并检测3-BrPA对过表达MCT1的MDA-MB-231细胞的增殖抑制作用和ATP水平的影响。结果表明(图 5C、D),3-BrPA对于过表达MCT1的MDA-MB-231细胞有明显的增殖抑制作用,同时也能显著降低细胞内的ATP水平。
|
图 5 过表达MCT1增强MDA-MB-231细胞对3-BrPA的敏感性 Figure 5 Overexpression of MCT1 enhances the sensitivity of MDA-MB-231 cells to 3-BrPA. A: Expression of MCT1 in MDA-MB-231 and MCF-7 cells; B: MDA-MB-231 cells transfected with control or MCT1 cDNA; C, D: MDA-MB-231 cells transfected with control or MCT1 cDNA for 48 h and cultured with 3-BrPA (0, 25, 50, 100, and 200 μmol/L). (*P < 0.05 vs control). |
肿瘤细胞即使在氧气含量充足的情况,仍然以糖酵解作为主要的产能方式,这种现象被称为“瓦博格效应”[11]。相比于有氧氧化而言,糖酵解是一种低效率、不经济的产能方式。但是由于肿瘤细胞快速增殖的特点,便注定着其需要以糖酵解这种快速供能的产能方式来维持存活[12]。
3-BrPA是一种靶向糖酵解抑制剂,能够抑制糖酵解,减少ATP的产生、切断肿瘤的能量供应,从而导致细胞大量死亡[13]。因此,3-BrPA受到了广泛的关注,并有望成为一种新型的抗肿瘤药物。已有大量研究证明3-BrPA对于多种肿瘤细胞具有增殖抑制和诱导凋亡的作用,如胃癌细胞SGC-7901[14]、淋巴癌[15-16]、间皮细胞瘤[17]、人肝癌细胞HepG2[18-19]。同时,也有研究证实[20],3-BrPA对于肝、肾、心肌细胞和骨骼肌细胞均无明显毒副作用。虽然很多肿瘤细胞对3-BrPA具有不错的敏感性, 但仍有癌细胞对其敏感性较差。因此,克服肿瘤耐药、增加肿瘤细胞对3-BrPA的敏感性,将为其成为新型的抗肿瘤药物打下坚实的基础。本研究发现,3-BrPA对MCF-7细胞具有明显的增殖抑制和诱导凋亡作用,也能显著降低细胞内ATP产生,但对MDA-MB-231细胞几乎无影响,证明MDA-MB-231细胞对3-BrPA的敏感性差。
单羧酸转运蛋白家族共有14位成员,均由SLC16A基因编码,主要通过参与调控肿瘤细胞能量代谢和肿瘤微环境酸碱度两方面来影响肿瘤细胞的生物学行为。MCT1作为单羧酸转运蛋白家族的一员,主要调控乳酸、丙酮酸,脂肪酸等一元羧酸的转运,并通过1: 1方式共转运H+和单羧酸阴离子,这对于肿瘤细胞的糖酵解代谢尤为重要[21]。肿瘤细胞上某些特定蛋白的异常表达使得其可将小分子物质转运到细胞内,所以肿瘤细胞能将一些毒性物质吸收进入细胞内而正常细胞不能[22]。因此,可以利用这种特点来选择性杀死肿瘤细胞。已有研究证实3-BrPA可通过MCT1蛋白转运进入细胞,抑制己糖激酶Ⅱ的活性,减少细胞内ATP的产生,促使细胞能量供应不足而死亡[23]。正因为MCT1在肿瘤细胞膜表面呈现高表达[24],使得3-BrPA对大多数肿瘤细胞具有不错的治疗效果。本实验结果表明,MCT1蛋白在两株细胞上的表达存在明显差异,其在MDA-MB-231细胞中几乎不表达。因此,上调MCT1能否增强MDA-MB-231细胞对3-BrPA的敏感性引起了我们极大的兴趣。实验结果显示,3-BrPA对过表达MCT1的MDA-MB-231细胞具有明显的增殖抑制作用,并能显著降低ATP水平,证实上调MCT1能够增强乳腺癌MDA-MB-231细胞对3-BrPA的敏感性。另外,Toda等[25]研究发现,黑姜提取物中的黄酮类化合物能增加细胞MCT1蛋白的表达,这一发现将有望解决肿瘤细胞对于3-BrPA的耐药问题,为我们后续的实验提供指导意义。
综上所述,本实验证明了MCT1能够增强3-BrPA的抗肿瘤作用,其机制可能是上调MCT1表达后,更多的3-BrPA被转运进入细胞内, 通过靶向作用于糖酵解、减少细胞ATP生成,促使肿瘤细胞因能量供应不足而死亡。本研究为糖酵解抑制剂的临床应用提供了实验基础,也为乳腺癌治疗提供了新的治疗方法和思路。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI: 10.3322/caac.21262. |
| [2] | Capello M, Ferri-Borgogno S, Riganti C, et al. Targeting the warburg effect in cancer cells through ENO1 knockdown rescues oxidative phosphorylation and induces growth arrest[J]. Oncotarget, 2016, 7(5): 5598-612. |
| [3] | De Raedt T, Walton Z, Yecies JL, et al. Exploiting cancer cell vulnerabilities to develop a combination therapy for ras-driven tumors[J]. Cancer Cell, 2011, 20(3): 400-13. DOI: 10.1016/j.ccr.2011.08.014. |
| [4] | Xie J, Wu H, Dai C, et al. Beyond warburg effect--dual metabolic Nature of cancer cells[J]. Sci Rep, 2014, 24(4): 4927. |
| [5] | 徐高峰, 白晓斌, 王茂德, 等. 脑胶质瘤细胞糖酵解表型特征及对细胞增殖与凋亡的影响[J]. 南方医科大学学报, 2013, 33(3): 406-11. |
| [6] | Sun Y, Liu Z, Zou X, et al. Mechanisms underlying 3-bromopyruvate-induced cell death in colon cancer[J]. J Bioenerg Biomembr, 2015, 47(4): 319-29. DOI: 10.1007/s10863-015-9612-1. |
| [7] | Geschwind JF, Ko YH, Torbenson MS, et al. Novel therapy for liver cancer:direct intraarterial injection of a potent inhibitor of ATP production[J]. Cancer Res, 2002, 62(14): 3909-13. |
| [8] | Kim W, Yoon JH, Jeong JM, et al. Apoptosis-inducing antitumor efficacy of hexokinase II inhibitor in hepatocellular carcinoma[J]. Mol Cancer Ther, 2007, 6(9): 2554-62. DOI: 10.1158/1535-7163.MCT-07-0115. |
| [9] | Amorim R, Pinheiro C, Miranda-Gon alves V, et al. Mono-carboxylate transport inhibition potentiates the cytotoxic effect of 5-fluorouracil in colorectal cancer cells[J]. Cancer Lett, 2015, 365(1): 68-78. DOI: 10.1016/j.canlet.2015.05.015. |
| [10] | Bola BM, Chadwick AL, Michopoulos F, et al. Inhibition of monocarboxylate transporter-1(MCT1) by AZD3965 enhances radiosensitivity by reducing lactate transport[J]. Mol Cancer Ther, 2014, 13(12): 2805-16. DOI: 10.1158/1535-7163.MCT-13-1091. |
| [11] | Warburg O. On the origin of cancer cells[J]. Science, 1956, 123(3191): 309-14. DOI: 10.1126/science.123.3191.309. |
| [12] | 彭秋平, 梁后杰. 糖酵解代谢在恶性肿瘤细胞中的特异性表型及其意义[J]. 临床肿瘤学杂志, 2009, 14(5): 470-3. |
| [13] | 张媛媛, 刘哲, 张倩雯, 等. 3-溴丙酮酸诱导人乳腺癌SK-BR-3细胞凋亡及对细胞线粒体膜电位的影响[J]. 南方医科大学学报, 2013(9): 1304-7. |
| [14] | Wang TA, Zhang XD, Guo XY, et al. 3-bromopyruvate and Sodium citrate target glycolysis, suppress survivin, and induce mitochondrial-mediated apoptosis in gastric cancer cells and inhibit gastric orthotopic transplantation tumor growth[J]. Oncol Rep, 2016, 35(3): 1287-96. |
| [15] | Hulleman E, Kazemier KM, Holleman A, et al. Inhibition of glycolysis modulates prednisolone resistance in acute lympho-blastic leukemia cells[J]. Blood, 2009, 113(9): 2014-21. DOI: 10.1182/blood-2008-05-157842. |
| [16] | Schaefer NG, Geschwind JF, Engles J, et al. Systemic admini-stration of 3-bromopyruvate in treating disseminated aggressive lymphoma[J]. Transl Res, 2012, 159(1): 51-7. DOI: 10.1016/j.trsl.2011.08.008. |
| [17] | Icard P, Philippe I, Zhang XD, et al. Experimental results using 3-bromopyruvate in mesothelioma:in vitro and in vivo studies[J]. J Bioenerg Biomembr, 2012, 44(1): 81-90. DOI: 10.1007/s10863-012-9415-6. |
| [18] | Pereira da Silva AP, El-Bacha T, Kyaw N, et al. Inhibition of energy-producing pathways of HepG2 cells by 3-bromopyruvate[J]. Biochem J, 2009, 417(3): 717-26. DOI: 10.1042/BJ20080805. |
| [19] | 赵素容, 张媛媛, 吴成柱, 等. 3-溴丙酮酸增强肝癌细胞对顺铂敏感性的作用[J]. 南方医科大学学报, 2014(1): 25-30. |
| [20] | Gong L, Wei YH, Yu X, et al. 3-Bromopyruvic acid, a hexokinase II inhibitor, is an effective antitumor agent on the hepatoma cells:in vitro and in vivo findings[J]. Anticancer Agents Med Chem, 2014, 14(5): 771-6. DOI: 10.2174/1871520614666140416105309. |
| [21] | Huhta H, Helminen O, Palom ki S, et al. Intratumoral lactate metabolism in barrett's esophagus and adenocarcinoma[J]. Oncotarget, 2017, 8(14): 22894-902. |
| [22] | Gunnink LK, Busscher BM, Wodarek JA, et al. Caffeine inhibition of GLUT1 is dependent on the activation state of the transporter[J]. Biochimie, 2017, 17:pii:S0300-9084(17): 30062-7. |
| [23] | Birsoy K, Wang T, Possemato R, et al. MCT1-mediated transport of a toxic molecule is an effective strategy for targeting glycolytic tumors[J]. Nat Genet, 2013, 45(1): 104-8. |
| [24] | Baltazar F, Pinheiro C, Morais-Santos F, et al. Monocarboxylate transporters as targets and mediators in cancer therapy response[J]. Histol Histopathol, 2014, 29(12): 1511-24. |
| [25] | Toda K, Takeda S, Hitoe S, et al. Enhancement of energy production by black ginger extract containing polymethoxy flavonoids in myocytes through improving glucose, lactic acid and lipid metabolism[J]. J Nat Med, 2016, 70(2): 163-72. DOI: 10.1007/s11418-015-0948-y. |
 2017, Vol. 37
2017, Vol. 37

