2. 南开大学医学院,天津 300071;
3. 第二军医大学肿瘤研究所,上海 200433
2. College of Medicine, Nankai University, Tianjin 300071, China;
3. International Joint Cancer Institute, The Second Military Medical University, Shanghai 200433, China
肿瘤的免疫治疗近年来取得突破性进展,以CTLA-4、PD-1/PD-L1为代表的免疫卡控点抑制剂和以嵌合抗原受体修饰T细胞(CAR-T)为代表的过继细胞免疫治疗(ACT)在治疗多种实体及血液肿瘤中显示前所未有的抗肿瘤效应,使部分晚期肿瘤患者达到持久生存获益[1-2]。CAR-T细胞是一种融合现代免疫学及基因工程技术发展出来的新型合成生物学产物,通过基因转移技术(逆转录或慢病毒、电穿等)使T细胞携带由胞外抗原结合结构域(一般为单链抗体scFv)、跨膜区和胞内信号结构域(CD3ζ链和一个或多个来自CD28、41BB等共刺激分子的信号元件)组成的嵌合抗体受体(CAR),从而赋予CAR-T细胞MHC非限制性的肿瘤特异识别及杀伤特性[3-5]。以靶向CD19为代表的CAR-T细胞产品已经在治疗多种CD19阳性复发/难治性血液肿瘤中取得惊人的临床疗效,部分患者达到多年完全缓解[6],为治愈肿瘤带来希望。目前CAR-T治疗仍存在一些急需解决的问题:首先,为了取得有效的免疫治疗效果,需过继性回输足够数量CAR-T细胞(1×106~5×106/kg体质量),而部分晚期肿瘤患者自体免疫细胞功能缺陷,采用常规刺激方法体外不能有效扩增[7-8];其次,临床试验表明,CAR-T抗肿瘤效应的持久性与其体内存活时间正相关,而后者又与制备的CAR-T质量密切相关,研究发现具有较年轻表型的T细胞如naive T(Tn)或中心记忆性T细胞(Tcm)具有更好的体内持续性及抗肿瘤疗效[9]。因此,如何制备获得足够数量并具有较持久抗肿瘤疗效的T细胞亚群是CAR-T细胞疗法成败的关键因素之一。
通过病毒转染向骨架细胞(K562或NIH3T3)稳定导入肿瘤抗原递呈(如MHI-I分子)/肿瘤抗原、共刺激分子(如CD80、CD83、CD86、41BBL等),由此形成的人工抗原提呈细胞(aAPC)能模拟自然抗原提呈细胞(APC),提供T细胞活化所必需的双刺激信号,高效扩增特异性T细胞抗原特异性T细胞或CAR-T细胞[10],且扩增得到的T细胞具有较好的体内外功能,为部分解决ACT临床应用面临的问题提供了一种选择[11-13]。在本研究中,以NIH3T3作为骨架细胞,通过慢病毒转染方法使其稳定表达共刺激分子CD86和/或CD137L以及肿瘤相关抗原CD19,制备成CD19特异性aAPC,评价其体外扩增/激活CD19-CAR-T细胞能力,从而为制备临床级高质量CD19-CAR-T细胞提供技术支撑。
1 材料和方法 1.1 菌株、质粒和细胞系Escherichia coli strain DH5α购自北京全式金生物有限公司,用于构建和扩增质粒。质粒pCMV3-CD19(北京Sino Biological)、pGEM-CD137L(北京Sino Biological)、pDONR223-CD86(北京优保生物)包含相应目的基因的cDNA,作为PCR扩增的模板。pGEM-Teasy质粒作为慢病毒载体构建的中间质粒,购于美国Promega公司。pWPXL慢病毒表达质粒作为基因克隆的慢病毒载体,和其对应的包装质粒pMD2G、psPAX2,购自于addgene。293FT由本实验室保存,用于慢病毒的制备。NIH3T3购自中科院细胞库,作为构建aAPC的骨架细胞。
1.2 慢病毒载体构建通过PCR,分别从质粒pCMV3-CD19、pGEM-CD137L和pDONR223-CD86克隆CD19、CD137L、CD86基因全长,在引物上游和下游分别加入SpeⅠ和XhoⅠ黏性末端和保护碱基,3对引物依次为:CD19-F:CTCGAGATGCCACCTCCTCGCCTCCT;CD19-R:ACTAGTTTAGGCTCTTTGAAGATGAAGAATGCC CA;4-1BBL-F:CTCGAGATGGAATACGCCTCTGA CGCTTC;4-1BBL-R:ACTAGTTTATTCCGACCTC GGTGAAGGGA;CD86-F:CTCGAGATGGATCCCC AGTGCACTATG;CD86-R:ACTAGTTTAAAAACATGTATCACTTTTGTCGCATG;扩增出的目的基因接入pGEM-Teasy载体,测序正确后,SpeⅠ和XhoⅠ双酶切(美国NEB公司),回收纯化目的片段,克隆入pWPXL慢病毒表达质粒。
1.3 慢病毒包装及转染293FT细胞培养至70%密度备用,将重组pWPXL病毒载体或空载体与包装载体pMD2G和psPAX2按照4: 3: 1比例与Lipo2000混合进行感染,感染6 h后更换无血清的DMEM高糖培养基。24 h收集培养液同时加入新的无血清培养基,并于48 h再次收集,10 000 r/min离新10 min,滤膜过滤后备用。依次使用CD19、CD86、CD137L的病毒上清与适当体积的polybrene(Sigma,终浓度8 μg/mL)混匀,加人70%密度NIH3T3细胞培养皿,6 h后更换新的完全培养基,48 h后流式细胞术检测病毒转染效率。
1.4 CD19CAR结构及CAR-T细胞制备CD19CAR根据文献[14],由北京赛百盛公司全基因合成并装入pWPXL慢病毒载体中,图 1显示了CD19CAR的结构。表达CD19CAR基因的慢病毒包装同上。CD19-CAR-T细胞制备参照Michael C Milone等发表的文献[15],简述如下:采用Ficoll淋巴细胞分离液(国药集团)分离获得健康人外周血单核细胞(PBMC),在24孔板中培养,同时加入CD3/CD28抗体偶联磁珠(Invitrogen公司)刺激PBMC,24 h及48 h后加入CD19CAR病毒感染2次,病毒感染时加入IL-2(300 U/mL),CAR-T细胞扩增至第6或7天后检测CAR基因表达及用于后续实验。
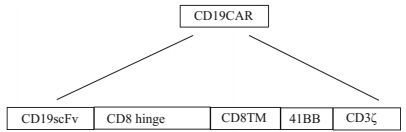
|
图 1 CD19CAR的结构 Figure 1 Structure of CD19CAR. |
aAPC以适宜密度接种在6孔板中,25 Gy射线照射,记为第0天。经24 h贴壁后,加入CD19-CAR-T细胞,更换T细胞培养基(PRIM 1640+10% FBS)并添加低浓度IL-2(50 U/mL)。第7天时,重复上述刺激过程。分别于第3天、第7天、第11天和第14天用台盼蓝对T细胞计数,绘制生长曲线。
1.6 生物发光细胞毒性法检测CD19-CAR-T细胞体外对靶细胞(NIH3T3-19/G-L)的杀伤作用参照文献[16],制备GFP-Luc双顺反子逆转录病毒,感染NIH3T3-CD19和NIH3T3,分别作为CD19-CAR-T体外杀伤的靶细胞和对照细胞;靶细胞或对照细胞铺于U型底的96孔板,每孔细胞数5×104,培养基体积100 μL,设3个复孔;以不同效靶比(E: T=0、1、2.5、5、10、20)向96孔板中加入刺激前或经过aAPC(NIH3T3-CD19/CD86/CD137L)14 d刺激的CD19-CAR-T细胞,使每孔总体积为200 μL;混匀,37℃、CO2培养箱培养;16 h后,吸去100 μL上清,向孔中剩余细胞悬浊液中100 μL luciferin(Promega),检测其中Luciferase的活性,以反应CD19-CAR-T细胞对靶细胞或对照细胞的特异性杀伤能力。
1.7 流式细胞术和细胞分选细胞于4 ℃和抗体混合,染色30 min,PBS洗两遍,使用CytomicsTM FC 500(Beckman Coulter)进行细胞表型分析,使用MoFloTM XDP进行细胞分选(Beckman Coulter)。荧光标记的CD19、CD86、CD137L和同型对照抗体购自美国eBioscience公司,用于分析aAPC表面共刺激分子和CD19抗原的表达和细胞分选;荧光标记的CD3、链霉亲和素标记的抗人IgG一抗和荧光标记的生物素二抗购自美国BioLegend公司,用于转染后T细胞CD19CAR的检测。流式相关数据采用Flowjo 7.6.1进行分析。
1.8 统计学分析应用SPSS19.0统计软件进行数据分析,计量资料以均数±标准差表示,组间差异采用重复测量的方差分析和多个样本两两比较,P < 0.05为差异有统计学意义。
2 结果 2.1 重组慢病毒载体构建人CD19/CD86/CD137L基因通过分子克隆,装载进慢病毒载体pWPXL的Spe Ⅰ和Xho Ⅰ酶切位点之间。可通过SpeⅠ、XhoⅠ双酶切和病毒质粒瞬转293T细胞验证。结果显示病毒表达载体构建成功(图 2A),并能在293T细胞表面瞬时表达(图 2B)。
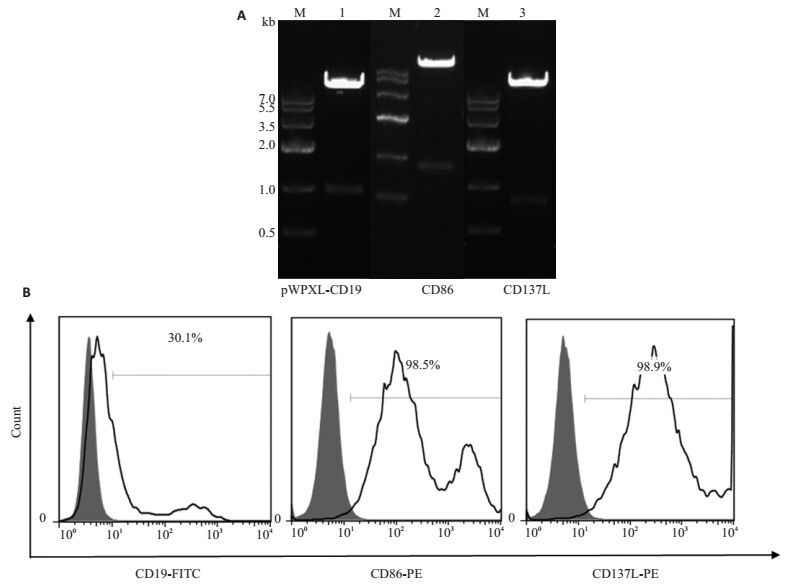
|
图 2 构建表达CD19、CD86和CD137L的重组慢病毒载体 Figure 2 Construction of recombinant lentiviral vectors expressing CD19, CD86 and CD137L. A: Electrophoresis of Spel and Xhol double enzyme digested product of recombinant lentiviral vectors, M: DNA maker IV 1: CD19 2: CD86 3: CD137L; B: Transient expression of target genes on 293T cell surface by flow cytometry. |
病毒三质粒系统(pWPXL、pMD2G、psPAX2)共转染293FT细胞,于24 h和48 h收集上清病毒原液;依次使用CD19、CD86、CD137L的病毒原液混合polybrene的方法感染NIH3T3细胞株,每次感染后,通过流式分选提高其表达率,直至表达率大于90%。由此,可得到NIH3T3-CD19,NIH3T3-CD19/86,NIH3T3-CD19/86/137L这3种稳定表达目的基因的细胞。NIH3T3-CD19由于高表达CD19,可作为杀伤实验的靶细胞;NIH3T3-CD19/86/137L(aAPC-A)和NIH3T3-CD19/86(aAPC-B)即为成功构建的aAPC(图 3)。
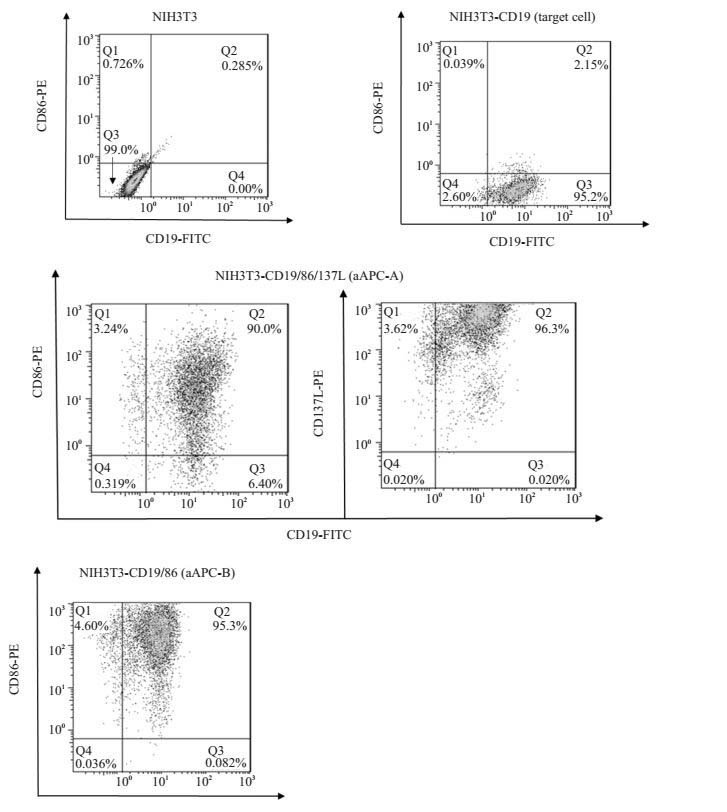
|
图 3 构建同时表达CD19、CD86和/或CD137L的aAPC Figure 3 Construction of aAPCs co-expressing CD19, CD86 and/or CD137L. NIH3T3 cells were sequentially infected by lentivirus encoding CD19, CD80 and/or CD137L and purified by fluorescence activated cell sorting until the expression rate of each target gene was more than 90%; 3 genetically modified cells were obtained, namely aAPC-A (NIH3T3-CD19/86/137L), aAPC-B (NIH3T3-CD19/86), and the target cells (NIH3T3-CD19). |
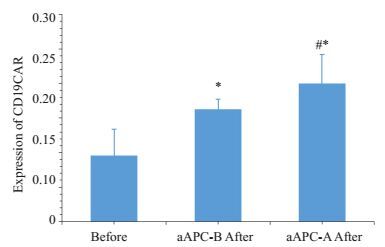
采用25 Gy剂量照射NIH3T3-CD19/86/137L(aAPC-A)和NIH3T3-CD19/86(aAPC-B)细胞后与T细胞按5: 1比例(aAPC: T)共培养2周,分别于3、7、10、14 d计算扩增T细胞数量并于14 d检测CD19CAR表达。在第7天时,aAPC-A显著刺激T细胞扩增,扩增效果好于aAPC-B,这种趋势一致延续至14 d,此时aAPC-A扩增T细胞数量显著高于aAPC-B(P < 0.05,图 4),而未转染的NIH3T3细胞对CD19-CAR-T细胞基本没有产生刺激效应,T细胞于第7天开始死亡;同时,经两种aAPC刺激的T细胞与刺激前相比,CD19CAR表达率显著增高(P < 0.05,图 5)。
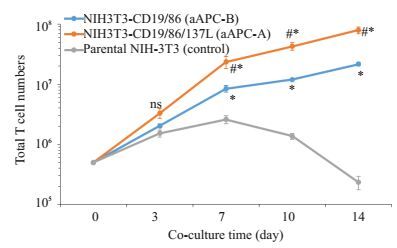
|
图 4 两种aAPC刺激CD19-CAR-T细胞的生长曲线 Figure 4 Growth curve of CD19-CAR-T cells stimulated by the two aAPCs. *P < 0.05 vs control group; #P < 0.05 vs aAPC-B group. |
|
图 5 aAPCs刺激前后,转染T细胞CD19CAR的表达情况 Figure 5 Expression of CD19CAR in transfected T cells before or after stimulation with aAPCs. *P < 0.05 vs T cells before transfection; #P > 0.05 vs aAPC-B group. |
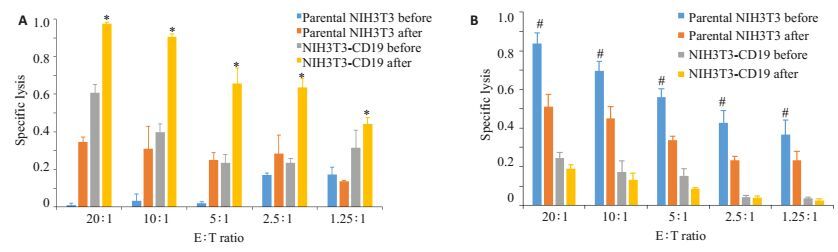
向靶细胞中转入GFP-Luc基因,通过检测效应细胞和靶细胞共陪养体系中Luc活性的变化,可以间接的反应效应细胞对靶细胞的杀伤效应。使用携带GFP-Luc的逆转录病毒转染靶细胞NALM-6(CD19+)、NIH3T3-CD19(CD19+)、K562(CD19-)及NIH3T3(CD19-),并用流式分选得到NALM-6/GL、NIH3T3-CD19/GL、K562-GL、NIH3T3-GL。NIH3T3-CD19/86/137L扩增前或扩增14 d后的CD19-CAR-T细胞分别与高表达luciferase的靶细胞混合培养,结果显示,经NIH3T3-CD19/86/137L刺激14 d后的CD19-CAR-T细胞有更强的杀伤活性(图 6)。
|
图 6 aAPC-A刺激前后,CD19-CAR-T对不同靶细胞的杀伤情况 Figure 6 Specific killing of different target cells by CD19-CAR-T before or after stimulation by aAPC-A. A: Parental NIH3T3 and NIH3T3-CD19, *P < 0.05 vs NIH3T3-CD19 before transfection; B: NALM-6 and K562 cells. #P < 0.05 vs NALM-6 before transfection. |
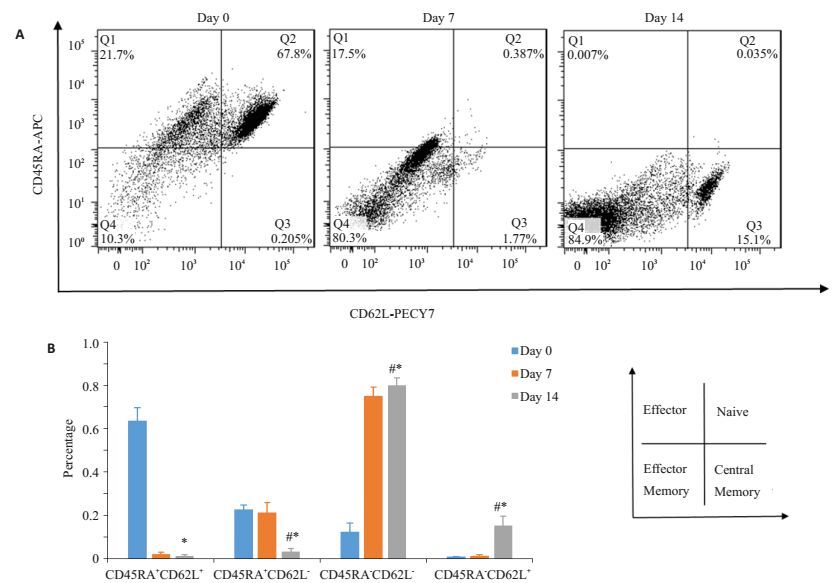
本研究评价了经过2轮(7 d/轮)NIH3T3-19/86/ 137L刺激的CD19-CAR-T细胞分化表型,发现经NIH3T3-19/86/137L刺激后,CD19-CAR-T逐渐由幼稚(CD45RA+CD62L+, Tn)和效应(CD45RA+CD62L-, Te)T细胞向效应记忆(CD45RA-CD62L-, Tem)T细胞分化,近20%细胞获得中心记忆性(CD45RA-CD62L +, Tcm)T细胞表型(图 7),而后者具有更好的体内存活及抗肿瘤效应。
|
图 7 aAPC刺激过程中不同时间点CD19-CAR-T细胞的表型分析 Figure 7 Phenotype analysis of CD19-CAR-T cells during stimulation of aAPC at different time points. A: Typical results of flow cytometric analysis; B: Statistical analysis of the results. *P < 0.05 vs Day 0 group, #P < 0.05 vs Day 7 group. |
目前在血液肿瘤治疗中CAR-T细胞疗法显示前所未有的治疗效果,Kite Pharma公司最近报道CD19-CAR-T治疗难治性弥散性大B细胞淋巴瘤(DLBCL)的临床试验中,客观应答率(OR)和完全应答率(CR)分别为71%和57%,部分患者CR持续1年以上[17]。为获得最佳的CAR-T治疗效果,制备获得临床级高质量CD19-CAR-T细胞是关键环节之一[9]。最近研究发现,采用aAPC能快速激活和扩增特异性T细胞。Zeng等[18]向K562细胞中转染MART-1、CD70、CD80和/或CD137L,构建MART-1特异性aAPC,其中表达全部外源性分子的aAPC能最高效地刺激MART-1特异性T细胞的增殖。为建立aAPC扩增CAR-T细胞的技术平台,我们初始采用较易转染的NIH3T3细胞为骨架,构建了同时表达CD19、CD86和/或CD137L的aAPC:NIH3T3-CD19/86(aAPC-B)、NIH3T3-CD19/86/137L(aAPC-A)。研究发现,额外表达CD137L的aAPC具有更好的扩增效果:体外经2轮扩增后,aAPC-A和aAPC-B分别使CD19-CAR-T细胞数量增加40倍和160倍左右;前者扩增的细胞CD19CAR表达增加且对靶细胞的杀伤作用明显增强;更重要的是,aAPC-A扩增的CAR-T细胞含有约20%左右Tcm细胞,提示经aAPC-A扩增的终末细胞产物可能具有较好的体内抗肿瘤特性。CD137L属于肿瘤坏死因子(TNF)配体超家族成员,表达于活化的APC,包括巨噬细胞、B细胞和树突状细胞等[19];CD137/CD137L是除CD28/B7外另一对重要的共刺激分子,除参与T细胞活化、增殖及效应细胞因子产生,在调控活化T细胞的生存/抗凋亡、记忆分化中发挥关键作用[20]。因此,额外表达CD137L很可能通过提供促生存、抗功能“耗竭”及促记忆分化等信号从而使扩增的CAR-T细胞具有更好的质和量[21]。
Cooper领导的研究团队以K562为骨架细胞构建了同时表达CD19/CD86/CD137L/mIL-15的临床级aAPC(clone#4),该aAPC体外能够极大扩增富集CD19-CAR-T细胞,4周内能够使CAR-T细胞扩增1100倍以上,从初始2~3 ×108 PBMC扩增获得2.65 ×1010 CD19-CAR-T细胞,并且终末CAR-T细胞产物近半数(45.6%)为CD62L+初始和中心记忆T细胞表型(Tn和Tcm),而基本不表达T细胞功能“耗竭”或“衰老”相关的PD-1、CD57等标志分子[22]。本研究制备了aAPC-A(NIH3T3-19/CD86/CD137L),与CD19-CAR-T细胞10: 1混合培养两周后,也获得了约15.3%的CD45RA-CD62L+Tcm。上述表型的T细胞能在体内长期保持静止状态,并保留自我复制的能力,在受到相同特异性抗原刺激时可更快地活化为效应记忆T细胞(Tem),因此具有更强的抗肿瘤活性[23]。
本研究摸索了建立成熟高效aAPC的技术体系,后续的研究将在此基础上采用K562作为骨架细胞构建适应于人体应用的临床级aAPC。此外,有研究显示表达膜结合型细胞因子如IL-15、IL-21等能够提高aAPC扩增效应细胞的效果[24-25],后续的研究也将对修饰分子组合进行优化,以期进一步提高aAPC质量。本研究只对aAPC扩增的CAR-T细胞进行了初步的体外表型及功能研究,其是否在体内真正获得了更好的抗肿瘤特性仍有待体内动物实验及临床试验检验。综上所述,合适的aAPC体系可高效地体外扩增特异性T细胞,若能建立起统一的生产质量管理规范,将aAPC体系应用于CAR-T细胞的制备过程中,有望显著提高ACT治疗效果。
| [1] | Gacerez AT, Arellano B, Sentman CL. How Chimeric Antigen Receptor Design Affects Adoptive T Cell Therapy[J]. J Cell Physiol, 2016, 231(12): 2590-8. DOI: 10.1002/jcp.25419. |
| [2] | Frigault MJ, Maus MV. Chimeric antigen receptor-modified T cells strike back[J]. Int Immunol, 2016, 28(7): 355-63. DOI: 10.1093/intimm/dxw018. |
| [3] | Sadelain M, Brentjens R, Riviere I. The basic principles of chimeric antigen receptor design[J]. Cancer Discov, 2013, 3(4): 388-98. DOI: 10.1158/2159-8290.CD-12-0548. |
| [4] | Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia[J]. N Engl J Med, 2013, 368(16): 1509-18. DOI: 10.1056/NEJMoa1215134. |
| [5] | Torikai H, Reik A, Liu PQ, et al. A foundation for universal T-cell based immunotherapy:T cells engineered to express a CD19-specific chimeric-antigen-receptor and eliminate expression of endogenous TCR[J]. Blood, 2012, 119(24): 5697-705. DOI: 10.1182/blood-2012-01-405365. |
| [6] | Holzinger A, Barden M, Abken H. The growing world of CAR T cell trials:a systematic review[J]. Cancer Immunol Immunother, 2016, 65(12): 1433-50. DOI: 10.1007/s00262-016-1895-5. |
| [7] | Voena C, Chiarle R. Advances in cancer immunology and cancer immunotherapy[J]. Discov Med, 2016, 21(114): 125-33. |
| [8] | Geyer MB, Brentjens RJ. Review:Current clinical applications of chimeric antigen receptor(CAR)modified T cells[J]. Cytotherapy, 2016. |
| [9] | Busch DH, Frassle SP, Sommermeyer D, et al. Role of memory T cell subsets for adoptive immunotherapy[J]. Semin Immunol, 2016, 28(1): 28-34. DOI: 10.1016/j.smim.2016.02.001. |
| [10] | Butler MO, Hirano N. Human cell-based artificial antigen-presenting cells for cancer immunotherapy[J]. Immunol Rev, 2014, 257(1): 191-209. DOI: 10.1111/imr.2013.257.issue-1. |
| [11] | Butler MO, Friedlander P, Milstein MI, et al. Establishment of antitumor memory in humans using in vitro-educated CD8+ T cells[J]. Sci Transl Med, 2011, 3(80): 80ra34. |
| [12] | Rushworth D, Jena B, Olivares S, et al. Universal artificial antigen presenting cells to selectively propagate T cells expressing chimeric antigen receptor independent of specificity[J]. J Immunother, 2014, 37(4): 204-13. DOI: 10.1097/CJI.0000000000000032. |
| [13] | Kebriaei P, Singh H, Huls MH, et al. Phase Ⅰ trials using Sleeping Beauty to generate CD19-specific CAR T cells[J]. J Clin Invest, 2016, 126(9): 3363-76. DOI: 10.1172/JCI86721. |
| [14] | Imai C, Mihara K, Andreansky M, et al. Chimeric receptors with 4-1BB signaling capacity provoke potent cytotoxicity against acute lymphoblastic leukemia[J]. Leukemia, 2004, 18(4): 676-84. DOI: 10.1038/sj.leu.2403302. |
| [15] | Milone MC, Fish JD, Carpenito C, et al. Chimeric receptors containing CD137 signal transduction domains mediate enhanced survival of T cells and increased antileukemic efficacy in vivo[J]. Mol Ther, 2009, 17(8): 1453-64. DOI: 10.1038/mt.2009.83. |
| [16] | Fu X, Tao L, Rivera A, et al. A simple and sensitive method for measuring tumor-specific T cell cytotoxicity[J]. PLoS One, 2010, 5(7): e11867. DOI: 10.1371/journal.pone.0011867. |
| [17] | Locke FL, Neelapu SS, Bartlett NL, et al. Phase 1 results of ZUMA-1:A multicenter study of KTE-C19 Anti-CD19 CAR T cell therapy in refractory aggressive lymphoma[J]. Mol Ther, 2017, 25(1): 285-95. DOI: 10.1016/j.ymthe.2016.10.020. |
| [18] | Zeng W, Su M, Anderson KS, et al. Artificial antigen-presenting cells expressing CD80, CD70, and 4-1BB ligand efficiently expand functional T cells specific to tumor-associated antigens[J]. Immunobiology, 2014, 219(8): 583-92. DOI: 10.1016/j.imbio.2014.03.003. |
| [19] | Alderson MR, Smith CA, Tough TW, et al. Molecular and biological characterization of human 4-1BB and its ligand[J]. Eur J Immunol, 1994, 24(9): 2219-27. DOI: 10.1002/(ISSN)1521-4141. |
| [20] | Wang C, Lin GH, McPherson AJ, et al. Immune regulation by 4-1BB and 4-1BBL:complexities and challenges[J]. Immunol Rev, 2009, 229(1): 192-215. DOI: 10.1111/imr.2009.229.issue-1. |
| [21] | Long AH, Haso WM, Shern JF, et al. 4-1BB costimulation ameliorates T cell exhaustion induced by tonic signaling of chimeric antigen receptors[J]. Nat Med, 2015, 21(6): 581-90. DOI: 10.1038/nm.3838. |
| [22] | Singh H, Figliola MJ, Dawson MJ, et al. Manufacture of clinical-grade CD19-specific T cells stably expressing chimeric antigen receptor using Sleeping Beauty System and artificial antigen presenting cells[J]. PLoS One, 2013, 8(5): e64138. DOI: 10.1371/journal.pone.0064138. |
| [23] | Berger C, Jensen MC, Lansdorp PM, et al. Adoptive transfer of effector CD8+ T cells derived from central memory cells establishes persistent T cell memory in primates[J]. J Clin Invest, 2008, 118(1): 294-305. DOI: 10.1172/JCI32103. |
| [24] | Singh H, Figliola MJ, Dawson MJ, et al. Reprogramming CD19-specific T cells with IL-21 signaling can improve adoptive immunotherapy of B-lineage malignancies[J]. Cancer Res, 2011, 71(10): 3516-27. DOI: 10.1158/0008-5472.CAN-10-3843. |
| [25] | Singh H, Manuri PR, Olivares S, et al. Redirecting specificity of T-cell populations for CD19 using the Sleeping Beauty system[J]. Cancer Res, 2008, 68(8): 2961-71. DOI: 10.1158/0008-5472.CAN-07-5600. |
 2017, Vol. 37
2017, Vol. 37

