2. 南方医科大学南方医院泌尿外科,广东 广州 510515
2. Deptment of Urinary Surgery, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
促肾上腺皮质激素(ACTH)非依赖性库欣综合征是由于肾上腺皮质肿瘤或增生导致糖皮质激素产生过量,后者对全身各组织及器官均可能产生不良影响。研究发现,即便是术后5年以上的库欣病患者,其心血管风险标记物的水平仍然较高[1]。因使用合成糖皮质激素而致医源性库欣综合征患者的心血管死亡率及发病率也显著增高[2]。炎症与纤维化是发生心血管疾病的重要机理,大型前瞻性研究提示,长期白介素-6(IL-6)水平升高与冠状动脉性心脏病呈高度相关[3],而循环纤维化标记物水平在老年患者中与死亡率相关[4]。不同部位的脂肪组织其结构及功能有差异[5],对糖皮质激素的反应可能亦不同。糖皮质激素可影响脂肪组织的发生、代谢及脂肪细胞分泌功能,研究提示糖皮质激素促进前脂肪细胞的分化并与胰岛素有协同作用[6]。ACTH非依赖性库欣综合征患者在长期高水平皮质醇刺激下,其不同部位脂肪组织功能可能产生炎症及纤维化异常,但目前该研究尚未见文献报道。因此,本研究拟初步探讨ACTH非依赖性库欣综合征患者不同部位脂肪组织炎症及纤维化因子的表达情况。
1 资料和方法 1.1 一般资料纳入ACTH非依赖性库欣综合征患者(n=8)进行研究。肾脏周围及皮下脂肪组织标本为2014年12月~ 2016年12月期间确诊ACTH非依赖性库欣综合征并行后腹腔镜下肾上腺肿物切除术患者手术过程中取得,取得组织标本后,立即快速剪碎放入冻存管后转移入小型液氮罐内速冻,转移到-80 ℃冰箱保存备用。所有患者均除外严重心脑血管、肝肾疾病。ACTH非依赖性库欣综合征患者的诊断标准[7]:排除医源性库欣综合征的情况下,至少两次24 h尿游离皮质醇检查结果异常和/或1 mg地塞米松抑制试验阳性,且肾上腺影像学提示肾上腺占位,血ACTH < 10 pg/mL(2 pmol/L)。本研究通过南方医科大学南方医院伦理委员会审查,所有纳入研究患者均已签署标本采集知情同意书。
1.2 RNA提取及RT-PCR采用RT-PCR检测脂肪因子包括CIDEA(cell death-inducing DFFA-like effector)、CEBP β(CCAAT/ enhancer binding protein β)、解偶联蛋白-1(UCP-1)及PPARγ共激活子α(PGC1α);炎症因子包括IL-6、肿瘤坏死因子-α(TNF-α);纤维化因子包括基质金属蛋白酶组织抑制子-1(TIMP-1)、早期生长反应因子1(EGR1)、基质金属蛋白酶2(MMP-2)mRNA表达。采用Trizol(TAKARA)提取肾脏周围脂肪组织及皮下脂肪组织的总RNA后,NanoDrop1000检测总RNA纯度及浓度,使用TAKARA的逆转录试剂盒合成cDNA,使用SYBR GreenI用LC480检测PCR产物。
1.3 统计分析使用SPSS 20.0统计软件,采用两独立样本t检验比较两组间差异,P < 0.05认为具有统计学差异。符合正态分布数据用均数±标准误表示。
2 结果 2.1 研究对象纳入研究的ACTH非依赖性库欣综合征患者的一般情况及生化指标见表 1,男1例,女7例,平均年龄40.12±13.64岁,体质量指数26.97±4.30 kg/m2,收缩压血压136.63±14.29 mmHg,舒张压92.88±9.57 mmHg。所有患者的肝肾功能均正常,血清肌酐63.87±6.89 μmol/L,谷丙转氨酶(ALT)32.63±21.39 U/L,谷草转氨酶(AST)23.00±12.53 U/L。空腹血糖(FPG)5.96±1.79 mmol/L,低密度脂蛋白(LDL)3.19±0.68 mmol/L,高密度脂蛋白(HDL)1.32±0.27 mmol/L,甘油三酯(TG)1.27± 0.66 mmol/L。所有患者的24 h尿游离皮质醇均> 825 μg/24 h(正常参考范围28.50~213.70 μg/24 h),皮质醇节律消失,8:00、16:00及0:00分别为24.09±5.68 μg/dl、24.13±4.60 μg/dL和23.37±3.79 μg/dL,血ACTH均 < 1.3 pg/mL。肾上腺增强CT均显示单/双侧肾上腺占位性病变。
| 表 1 ACTH非依赖性库欣综合征患者的一般情况及血生化指标 Table 1 Clinical and laboratory data of the 8 patients with ACTH-independent Cushing's syndrome |
CIDEAmRNA在患者肾脏周围脂肪组织的表达高于皮下脂肪组织,差异有统计学意义(P < 0.05,图 1)。脂肪因子CEBPβ、UCP-1及PGC1α mRNA的表达在肾脏周围脂肪及皮下脂肪组织中的表达相似。
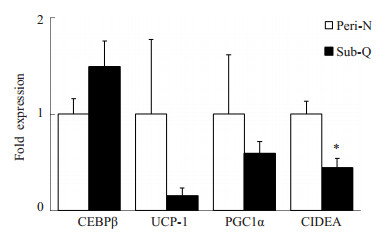
|
图 1 非ACTH依赖性库欣综合征患者肾周与皮下脂肪组织脂肪因子基因mRNA的表达 Figure 1 Expressions of adipokine mRNA in perinephric and subcutaneous adipose tissues in patients with ACTH-independent Cushing's syndrome. Peri-N: Perinephric adipose tissue; sub-Q: Subcutaneous adipose tissue. *P < 0.05 vs Peri-N. |
ACTH非依赖性库欣综合征患者皮下脂肪组织IL-6及TIMP-1、EGR1 mRNA的表达显著高于肾脏周围脂肪组织,差异均具有统计学意义(P < 0.05,图 2)。肾脏周围脂肪与皮下脂肪组织中TNF-α及MMP-2 mRNA的表达相似。
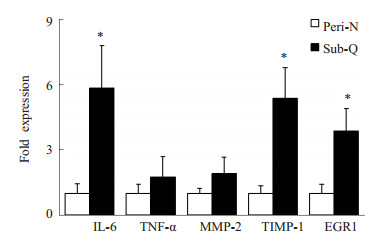
|
图 2 ACTH非依赖性库欣综合征患者肾周与皮下脂肪组织炎症及纤维化基因mRNA的表达 Figure 2 mRNA expressions of inflammation-and fibrosis-related genes in perinephric and subcutaneous adipose tissues in patients with ACTH-independent Cushing's syndrome. Peri-N: Perinephric adipose tissue; sub-Q: Subcutaneous adipose tissue. *P < 0.05 vs Peri-N. |
脂肪组织主要包括白色脂肪和棕色脂肪,前者储存能量,后者主要是消耗能量,而近年来发现在人类存在类似棕色脂肪特性的米色脂肪[8]。研究提示,与无功能垂体腺瘤患者比较,库欣病患者皮下脂肪T细胞激活减低[9]。因此,探索人类棕色/米色脂肪与肥胖及其相关代谢性疾病的研究已成为近年的热点。不同部位的脂肪组织可能具有不同的生物学特性,目前有两种假说解释不同部位脂肪组织功能不同的机制,其中一个假说认为不同部位脂肪库有特定的神经支配并与循环有特定的练习,另一个假说是细胞自主机制引起脂肪库细胞生理的特异差异[10]。糖皮质激素对脂肪细胞代谢有多重作用,在前体脂肪细胞分化过程中有重要作用[11],不同脂肪库对糖皮质激素的反应不同,能导致cushing综合征患者的脂肪组织重新分布而导致向心性肥胖。脂肪细胞分化过程中,CEBP β主要在分化早期发挥作用[12]。我们的结果中,患者肾周与皮下脂肪组织中CEBP β mRNA的表达相似。UCP1在控制能量平衡中有重要作用[13]。有研究报道,正常人及高血压患者其肾周脂肪组织中UCP1 mRNA表达显著高于皮下脂肪组织[8]。人类肾周脂肪组织中PGC1αmRNA的表达显著高于皮下脂肪组织(n=6),但是在该研究中尽管UCP1 mRNA在肾周脂肪组织中的表达有高于皮下脂肪组织中的趋势,但差异无统计学意义[14]。在本研究中显示,肾脏脂肪的棕色化相关基因UCP-1及PGC1α表达高于皮下脂肪,但可能由于例数所限,标准差较大,并未得出统计学差异,仅有CIDEA表现为肾脏比皮下脂肪显著增高(P < 0.05),而CIDEA在人类白色脂肪的表达下调与一系列的代谢综合征特征相关[15]。CIDEA在调节能量平衡及肥胖中有重要作用,CIDEA敲除小鼠有更高的代谢率,棕色脂肪组织中脂肪分解率更高,且能抵抗饮食诱导的肥胖及糖尿病[16]。
IL-6已经被证实是2型糖尿病(T2DM)独立预测因素并与心血管事件相关[17-18]。肥胖患者脂肪组织比BMI正常者分泌更多的IL-6[19]。TNF-α是对脂类代谢、脂肪细胞功能及胰岛素信号有重要调节作用的促炎症因子[20]。我们的结果提示,IL-6在ACTH非依赖性库欣综合征患者皮下脂肪组织中的表达显著高于肾脏周围脂肪。TNF-αmRNA的表达在皮下脂肪组织中的表达高于肾脏周围脂肪组织,但差异无统计学意义。既往的观察性研究报道,库欣综合征患者循环血中TNF-α水平在正常范围[21]。CRH刺激ACTH分泌腺瘤细胞培养后可观察到培养液中TNF-α浓度较刺激前显著增加[22]。结果提示肾周脂肪与皮下脂肪组织对高浓度的内源性皮质醇慢性刺激的反应不同,皮下脂肪组织炎症反应比肾脏周围脂肪组织明显。
EGR1是调控组织器官纤维化的重要因子,通过与靶基因的结合调控一系列分子的表达, 参与炎症及动脉粥样硬化等过程[23]。而TIMP1既参与纤维化,也有体外实验证实TIMP-1在过度营养状态下导致脂肪细胞的增大,其可能与不良代谢结局相关[24]。血管损伤的发展与细胞外基质蛋白在血管壁的沉积有关,研究提示,MMP-2基因多态性与冠状动脉性心脏病及大动脉粥样硬化相关[25]。我们的结果中,皮下脂肪组织中TIMP1及EGR1 mRNA的表达显著高于肾脏周围脂肪组织(P < 0.05),MMP-2mRNA的表达在肾脏周围脂肪组织的表达高于皮下脂肪组织,但无统计学意义(P>0.05)。结果提示,皮下脂肪组织的纤维化明显高于肾脏周围脂肪组织。因此,我们的结果进一步证实了ACTH非依赖性库欣综合征患者在慢性内源性高浓度皮质醇刺激下,对脂肪组织亦有重要作用,引起脂肪组织的炎症及纤维化的增加。
综上所述,本研究通过比较ACTH非依赖性库欣综合征患者肾周与皮下脂肪组织中脂肪因子、炎症及纤维化因子的表达水平,发现皮下脂肪组织的炎症及纤维化水平明显高于肾脏周围脂肪组织。
| [1] | Colao A, Pivonello R, Spiezia S, et al. Persistence of increased cardiovascular risk in patients with Cushing's disease after five years of successful cure[J]. J Clin Endocrinol Metab, 1999, 84 (8): 2664-72. |
| [2] | Wei L, Macdonald TM, Walker BR. Taking glucocorticoids by prescription is associated with subsequent cardiovascular disease[J]. Ann Intern Med, 2004, 141 (10): 764-70. DOI: 10.7326/0003-4819-141-10-200411160-00007. |
| [3] | Danesh J, Kaptoge S, Mann AG, et al. Long-term interleukin-6 levels and subsequent risk of coronary heart disease: two new prospective studies and a systematic review[J]. PLoS Med, 2008, 5 (4): e78. DOI: 10.1371/journal.pmed.0050078. |
| [4] | Agarwal I, Glazer NL, Barasch E, et al. Fibrosis-related biomarkers and risk of total and cause-specific mortality: the cardiovascular health study[J]. Am J Epidemiol, 2014, 179 (11): 1331-9. DOI: 10.1093/aje/kwu067. |
| [5] | Ibrahim MM. Subcutaneous and visceral adipose tissue: structural and functional differences[J]. Obes Rev, 2010, 11 (1): 11-8. DOI: 10.1111/obr.2010.11.issue-1. |
| [6] | Tomlinson JJ, Boudreau A, Wu D, et al. Modulation of early human preadipocyte differentiation by glucocorticoids[J]. Endocrinology, 2006, 147 (11): 5284-93. DOI: 10.1210/en.2006-0267. |
| [7] | Nieman LK, Biller BM, Findling JW, et al. The diagnosis of Cushing's syndrome: an Endocrine Society Clinical Practice Guideline[J]. J Clin Endocrinol Metab, 2008, 93 (5): 1526-40. DOI: 10.1210/jc.2008-0125. |
| [8] | Li X, Liu J, Wang G, et al. Determination of UCP1 expression in subcutaneous and perirenal adipose tissues of patients with hypertension[J]. Endocrine, 2015, 50 (2): 413-23. DOI: 10.1007/s12020-015-0572-3. |
| [9] | Hochberg I, Harvey I, Tran QT, et al. Gene expression changes in subcutaneous adipose tissue due to Cushing's disease[J]. J Mol Endocrinol, 2015, 55 (2): 81-94. DOI: 10.1530/JME-15-0119. |
| [10] | Rosen ED, Spiegelman BM. What we talk about when we talk about fat[J]. Cell, 2014, 156 (1/2): 20-44. |
| [11] | Hauner H, Schmid P, Pfeiffer EF. Glucocorticoids and insulin promote the differentiation of human adipocyte precursor cells into fat cells[J]. J Clin Endocrinol Metab, 1987, 64 (4): 832-5. DOI: 10.1210/jcem-64-4-832. |
| [12] | Rosen ED, Walkey CJ, Puigserver P, et al. Transcriptional regulation of adipogenesis[J]. Genes Dev, 2000, 14 (11): 1293-307. |
| [13] | Kopecky J, Clarke G, Enerbäck S, et al. Expression of the mitochondrial uncoupling protein gene from the aP2 gene promoter prevents genetic obesity[J]. J Clin Invest, 1995, 96 (6): 2914-23. DOI: 10.1172/JCI118363. |
| [14] | Chatterjee TK, Stoll LL, Denning GM, et al. Proinflammatory phenotype of perivascular adipocytes influence of High-Fat feeding[J]. Circ Res, 2009, 104 (4): 541-U237. DOI: 10.1161/CIRCRESAHA.108.182998. |
| [15] | Nordström EA, Rydén M, Backlund EC, et al. A human-specific role of cell death-inducing DFFA (DNA fragmentation factoralpha)-like effector A (CIDEA) in adipocyte lipolysis and obesity[J]. Diabetes, 2005, 54 (6): 1726-34. DOI: 10.2337/diabetes.54.6.1726. |
| [16] | Zhou Z, Yon Toh S, Chen Z, et al. Cidea-deficient mice have lean phenotype and are resistant to obesity[J]. Nat Genet, 2003, 35 (1): 49-56. |
| [17] | Lowe G, Woodward M, Hillis G, et al. Circulating inflammatory markers and the risk of vascular complications and mortality in People with type 2 diabetes and cardiovascular disease or risk factors: the ADVANCE study[J]. Diabetes, 2014, 63 (3): 1115-23. DOI: 10.2337/db12-1625. |
| [18] | Spranger J, Kroke A, Möhlig M, et al. Inflammatory cytokines and the risk to develop type 2 diabetes: results of the prospective population-based European Prospective Investigation into cancer and nutrition (EPIC)-potsdam study[J]. Diabetes, 2003, 52 (3): 812-7. DOI: 10.2337/diabetes.52.3.812. |
| [19] | Kern PA, Ranganathan S, Li C, et al. Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity and insulin resistance[J]. Am J Physiol Endocrinol Metab, 2001, 280 (5): E745-51. |
| [20] | Fasshauer M, Klein J, Krahlisch S, et al. GH is a positive regulator of tumor necrosis factor alpha-induced adipose related protein in 3T3-L1 adipocytes[J]. J Endocrinol, 2003, 178 (3): 523-31. DOI: 10.1677/joe.0.1780523. |
| [21] | Kristo C, Godang K, Ueland T, et al. Raised serum levels of interleukin-8 and interleukin-18 in relation to bone metabolism in endogenous Cushing's syndrome[J]. Eur J Endocrinol, 2002, 146 (3): 389-95. DOI: 10.1530/eje.0.1460389. |
| [22] | Merola B, Longobardi S, Colao A, et al. Tumor necrosis factoralpha increases after corticotropin-releasing hormone administration in Cushing's disease. In vivo and in vitro studies[J]. Neuroendocrinology, 1996, 64 (5): 393-7. |
| [23] | 李文琦, 关美萍, 郑宗基, 等. DPP4抑制剂西格列汀对ApoE基因敲除小鼠肾脏Egr-1及FN表达的影响[J]. 南方医科大学学报, 2016, 36 (1): 126-30. |
| [24] | Meissburger B, Stachorski L, Röder E, et al. Tissue inhibitor of matrix metalloproteinase 1 (TIMP1) controls adipogenesis in obesity in mice and in humans[J]. Diabetologia, 2011, 54 (6): 1468-79. DOI: 10.1007/s00125-011-2093-9. |
| [25] | Vasků A, Goldbergová M, Izakovicová Hollá L, et al. A haplotype constituted of four MMP-2 promoter polymorphisms (-1575G/ A, -1306C/T, -790T/G and-735C/T) is associated with coronary triple-vessel disease[J]. Matrix Biol, 2004, 22 (7): 585-91. DOI: 10.1016/j.matbio.2003.10.004. |
 2017, Vol. 37
2017, Vol. 37

