神经系统结构功能复杂,多种因素参与了其衰老的发生发展。现有各种抗衰老药物如维生素E、褪黑素等虽然能部分缓解机体其他系统如皮肤的衰老,但对中枢神经系统作用有限,是否有一种药物能特异性延缓神经系统的衰老尚不清楚[1]。我们既往在D-半乳糖衰老大鼠模型上研究发现促红细胞生成素(EPO)具有显著的抗神经系统衰老作用,通过补充重组人促红细胞生成素(rhEPO)可以显著改善大鼠学习记忆能力,其机制可能与增强神经细胞抗氧化能力,上调沉默信息调节因子1(SIRT1)表达,下调凋亡基因等有关[2-5],但是否存在其他通路目前尚不清楚。脑源性神经营养因子(BDNF)是由神经细胞自分泌的一种广泛分布于中枢神经系统和感觉神经及脊髓运动神经元的一种神经营养因子[6]。目前国内外多项研究已经证明BDNF对多种脑损伤具有保护作用[7-8],同时发现多种外源性药物可以通过上调内源性BDNF减轻神经损伤[9-10]。鉴于此,我们提出假设:外源性EPO通过上调内源性BDNF加强神经系统衰老保护作用。本研究拟以D-半乳糖衰老大鼠模型为研究对象,观察EPO干预后衰老大鼠脑组织各部位BDNF表达情况,以证实外源性EPO通过上调内源性BDNF加强神经保护作用的假设,为EPO抗神经系统衰老提高新思路。
1 材料和方法 1.1 实验动物及分组40只2月龄雄性SD大鼠,体质量231.54±11.50 g,由西安交通大学医学院实验动物中心提供(SCXK(陕)2012-003),饲养条件(室内温度22±2 ℃;湿度:55±5%;光照:12 h)。随机分为4组:阴性对照组(N),D-半乳糖组(D),EPO干预组(E),阳性对照组(P)每组10只。
1.2 主要试剂和仪器D-半乳糖(Sigma),rhEPO(三生制药),BDNF单克隆抗体(abcam),二抗(羊抗兔,购自abcam),SABC试剂和DAB显色试剂盒(中杉生物),自配0.01/L PBS缓冲液,4%多聚甲醛,10%水合氯醛。大鼠脑立体定位仪(上海精密仪器厂),石蜡切片机(Opitcal),图像信号采集与分析系统(CE ICA)。
1.3 衰老模型建立及干预D半乳糖干预组(D组),EPO干预组(E组)均给予5%D-半乳糖(125 mg/kg,1次/d)[3]颈背部皮下注射6周以建立衰老模型,E组自造模第5周开始给予rhEPO(3000 U/kg,1次/d)[3]腹腔注射,共2周。阴性对照组(N组)和阳性对照(P组)给予生理盐水(2.5 mL/kg,1次/d)颈背部皮下注射6周,P组自第5周开始给予EPO(3000 U/kg·d)腹腔注射,共2周。
1.4 切片制作及组织定位参照George Paxinos著大鼠立体定位图谱[11],轮转式石蜡切片机由前额开始向后连续行厚约6 μm的冠状切片,选取含额叶皮质、海马的切片。切片放入水中,捞至经多聚赖氨酸处理过的干净载玻片上,烤片24 h后进行染色。
1.5 免疫组化染色切片常规脱蜡、水化,3% H2O2室温封闭20 min,灭活过氧化物酶,常规抗原修复,正常山羊血清封闭,加入一抗(BDNF单克隆抗体,浓度为1:200)[12],4 ℃冰箱过夜。滴加二抗后37 ℃恒温下孵育40 min,应用PBS(0.01 mol)冲洗3次。滴加SABC后37 ℃恒温孵育20 min,PBS(0.01 M)冲洗4次,DAB室温下显色。蒸馏水洗涤并苏木素复染,最后脱水、透明、封片。
1.6 图像采集和分析光镜下对照图谱根据脑组织形态及各区域的细胞特点定位并观察4个部位:海马CA1、CA3区、DG区及额叶皮质区的各种细胞形态结构以及阳性细胞数目,应用图像信号采集分析系统随机测5个视野(10×40倍)下阳性细胞个数,取其平均值。
1.7 统计学分析所有数据用均数±标准差表示各指标水平。计量数据比较采用单因素方差分析(one-way, ANOVA)。应用SPSS19.0统计软件统计,P < 0.05具有统计学意义。
2 结果 2.1 BDNF阳性细胞表现及分布各组大鼠脑组织中各部位均有较强BDNF表达,光镜下主要在细胞浆内见黄色的BDNF免疫反应产物。光镜下发现在海马各区及额叶皮质区的BDNF阳性细胞主要是锥体细胞。
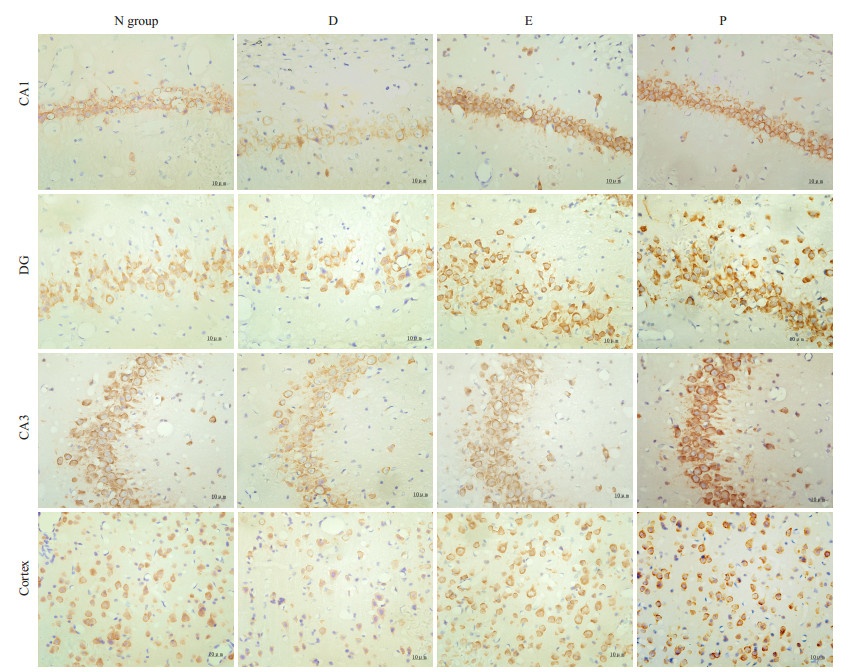
2.2 不同组大鼠相同部位BDNF表达差异不同组大鼠相同部位比较发现BDNF表达存在显著差异:D组大鼠海马CA1、CA3、DG及额叶皮质区BDNF阳性细胞计数较N组相同部位明显减少(P < 0.05),而应用rhEPO干预后的E组和P组大鼠海马CA1、CA3、DG及大脑皮质运动区BDNF阳性细胞计数较D组及N组相同部位显著增加(P < 0.05);但与E组和P组之间比较无差异(表 1,图 1)。
| 表 1 各组大鼠BDNF阳性细胞计数比较 Table 1 Comparison of BDNF-positive cell numbers among the groups (n=10, Mean±SD) |
|
图 1 各组不同部位BDNF表达情况BDNF免疫组化染色 Figure 1 Expression of BDNF in different brain regions (Immunohistochemistry, original magnification: ×400). |
同组大鼠不同部位BDNF阳性细胞比较发现:同组大鼠不同部位BDNF阳性细胞个数存在显著不同(P < 0.05),其中额叶皮质区阳性细胞数最多,其次是海马CA3区,海马DG区,海马CA1区(表 1,图 1)。
3 讨论目前国内外已经对BDNF的生物学作用进行了广泛的研究,证实它与酪氨酸激酶受体B(Trk B)结合,导致Trk B自身磷酸化,通过有丝分裂原激活蛋白激酶(MAPK)通路及磷脂酰肌醇3-激酶(PI3K)等信号通路激活c AMP反应元件结合蛋白(CREB),调控相关基因表达,最终促进神经细胞生存[13-14]。既往免疫组织化学法发现,BDNF阳性的神经元广泛分布在大脑皮质、海马、基底前脑、纹状体、隔区、下丘脑和小脑[15]。与前人研究一致,本研究也发现衰老大鼠与其他大鼠模型一样,脑组织内各部位神经细胞胞浆内均可见BDNF的存在。但是,我们更进一步比较衰老大鼠不同部位BDNF表达强度发现:同组大鼠不同部位BDNF的表达存在显著不同,其中额叶皮质区表达最强,其次是海马CA3区,海马DG区,海马CA1区。我们分析认为出现这种表达规律的首要原因在于BDNF阳性细胞主要是锥体细胞。而脑组织内各部位的锥体细胞以皮质区域最多见。其次,rhEPO干预后各部位BDNF表达也存在差异可能与EPO受体在脑组织不同部位分布不同相关。这种差异造成外源性EPO对脑组织内不同区域的作用强度存在不同,最终造成额叶皮质区BDNF表达较其他部位明显增强。除此之外,各部位脑组织的神经细胞功能差异可能也是内源性BDNF表达强度不同的内在原因之一。中枢胆碱能神经系统是动物学习记忆神经环路重要组成部分,其中海马CA1、CA3及DG区在学习记忆中扮演一个重要的角色,海马损伤可以造成学习记忆能力显著下降[16],而额叶皮质与空间记忆密切相关。现有研究显示BDNF能促进胆碱能神经元存活、生长、分化及保护受损的胆碱能神经元并减轻其退化。如Allen等发现阻断BDNF受体后基底前脑胆碱能神经元的乙酰胆碱转移酶(ChAT)和乙酰胆碱酯酶(AchE)活性明显的下降[17]。同时,BDNF参与并调节海马突触传递和长程时程增强(LTP)的形成机制,增加突触传递的可塑性[18],亦是增加学习和记忆能力的因素之一。本研究发现额叶皮质区的BDNF表达最强,推测它可能对导致空间记忆力下降的额叶胆碱能神经细胞及其神经突触的衰老损伤保护作用更强,具体机制有待进一步研究。
研究证明BDNF不仅在中枢神经系统发育过程中对神经元的生存、分化、生长和维持神经元正常的生理功能起关键作用,而且还具有抗伤害性刺激,促进神经元损伤后的再生等作用。如Phillips等[19]通过对阿尔茨海默患者海马细胞尸检提示海马细胞中BDNF含量减少可能加速阿尔茨海默病患者细胞死亡。Schabitz [20]的研究证实补充外源性BDNF对急性缺血性脑损伤具有保护作用,并且这种保护作用可能与调节细胞凋亡有关。这些研究结果提示BDNF有成为神经系统疾病的一种潜在治疗药物,但是其半衰期较短,不易通过血脑屏障[21]。正是基于此,如何促进内源性BDNF表达越来越引起广大研究者的注意。有研究显示环孢菌素A能上调神经细胞BDNF的表达[22]。Yang等[23]在脑缺血小鼠上发现地塞米松可调节BDNF的表达。但是这两种影响内源性BDNF的药物严重干扰机体免疫系统,存在较大副作用,难以在正常衰老人群中临床大规模应用。近年研究发现促红细胞生成素能够在缺血缺氧、外源性毒性物质损伤、原发性或继发性炎症反应等病理过程中发挥神经保护作用,甚至认为“EPO为神经保护提出了一个崭新的概念” [24]。我们既往在衰老大鼠模型上研究发现EPO具有显著的抗神经系统衰老作用,通过补充rhEPO可以显著改善大鼠学习记忆能力[3],其机制可能与增强神经细胞抗氧化能力,上调SIRT1表达,下调凋亡基因等有关[2],但是否能促进BDNF等内源性保护因子的表达达到抗神经系统衰老的作用目前尚不清楚。本研究以D-半乳糖衰老大鼠模型为研究对象,观察发现rhEPO干预后衰老大鼠脑组织各部位BDNF表达。首先发现D半乳糖大鼠各部位BDNF较正常大鼠均显著降低,提示BDNF与衰老存在相关性,可能参与加速了神经细胞的衰老。这与宋士军等人的研究结果相似[25]。进一步应用rhEPO干预后发现衰老大鼠脑组织内各部位BDNF表达均显著增强,提示EPO能够促进内源性BDNF表达,但其具体上游通路及BDNF下游机制有待进一步研究确定。除此之外,通过设定阳性对照组发现,rhEPO干预后假手术组大鼠脑组织各部位BDNF表达也显著增强,提示EPO对增强大鼠神经细胞BDNF的表达具有普遍性,不仅仅是对衰老大鼠模型具有该作用,对其他脑损伤模型可能也具有相似的作用,有待进一步实验观察。
本研究首先发现衰老大鼠脑组织各部位BDNF表达具有显著差异,其中额叶皮质区表达最强,且rhEPO干预后衰老大鼠各部位BDNF表达也存在差异,具体机制需要进一步研究。除此之外,我们还发现衰老大鼠各部位BDNF较正常大鼠均显著降低,但应用rhEPO干预后衰老大鼠与假手术组大鼠脑组织内各部位BDNF表达均显著增强,提示EPO对增强大鼠神经细胞BDNF的表达具有普遍性,除能够促进衰老大鼠内源性BDNF表达外,对其他大鼠模型可能也具有相似作用,但其具体上游通路及BDNF下游机制有待进一步研究确定。鉴于此,下一步我们拟在衰老神经细胞模型及衰老动物模型上应用各种细胞通路阻滞及基因敲除技术进行进一步研究,以明确EPO增强内源性BDNF的通路及BDNF对衰老神经细胞的保护作用机制,为临床应用提供进一步的实验依据。
| [1] | 王虎清, 吴海琴. 衰老过程中神经系统的作用[J]. 国外医学:老年医学分册, 2008, 29 (2): 53-6. |
| [2] | Wu H, Wang H, Zhang W, et al. rhEPO affects apoptosis in hippocampus of aging rats by upregulating SIRT1[J]. Int J Clin Exp Pathol, 2015, 8 (6): 6870-80. |
| [3] | 翟跃芬, 吴海琴, 吕多, 等. EPO的抗衰老作用及其作用机制的初步探讨[J]. 四川大学学报:医学版, 2012, 43 (5): 679-82, 719. |
| [4] | 严璞, 吴海琴, 王虎清. 促红细胞生成素通过P13K/Akt/Nrf2-ARE通路发挥其抗神经系统衰老作用[J]. 国际老年医学杂志, 2013, 34 (6): 265-9. |
| [5] | 吴海琴, 王虎清, 成红学, 等. 老龄大鼠脑组织不同部位HIF-1α的表达规律探讨[J]. 南方医科大学学报, 2008, 28 (10): 1897-9, 1902. DOI: 10.3321/j.issn:1673-4254.2008.10.027. |
| [6] | Reinhart V, Bove SE, Volfson D, et al. Evaluation of TrkB and BDNF transcripts in prefrontal cortex, hippocampus, and striatum from subjects with schizophrenia, bipolar disorder, and major depressive disorder[J]. Neurobiol Dis, 2015, 77 : 220-7. DOI: 10.1016/j.nbd.2015.03.011. |
| [7] | Eisen R, Perera S, Bawor M, et al. Association between BDNF levels and suicidal behaviour: a systematic review protocol[J]. Syst Rev, 2015, 4 (1): 56. DOI: 10.1186/s13643-015-0047-x. |
| [8] | Naumenko VS, Kulikov AV, Kondaurova EM, et al. Effect of actual long-term spaceflight on BDNF, TrkB, p75, BAX and BCL-XL genes expression in mouse brain regions[J]. Neuroscience, 2015, 284 : 730-6. DOI: 10.1016/j.neuroscience.2014.10.045. |
| [9] | 刘博会, 张素平, 凌莉, 等. 前列腺素E1上调血管性痴呆大鼠海马组织VEGF、BDNF的表达[J]. 中国神经精神疾病杂志, 2015, 41 (8): 471-6. |
| [10] | 杨云生. 艾地苯醌对癫痫患者BDNF、IGF-1水平及认知功能的影响[J]. 医学综述, 2015 (19): 3634-6. DOI: 10.3969/j.issn.1006-2084.2015.19.066. |
| [11] | PaxinosG. 大鼠脑立体定位图谱 (第3版)[M]. 北京: 人民卫生出版社, 2005. |
| [12] | 代沐华, 李德强, 韩阳. 文拉法辛对卒中后抑郁大鼠学习记忆及海马脑源性神经营养因子的影响[J]. 浙江大学学报:医学版, 2011, 40 (5): 527-34. |
| [13] | 张芳, 周新富, 肖志成. BDNF/TrkB通路与β-淀粉样蛋白的关系研究进展[J]. 中华神经医学杂志, 2013, 12 (8): 857-9. |
| [14] | 张萌, 吴海琴, 王虎清. BDNF在神经系统疾病中的作用机制[J]. 卒中与神经疾病, 2013, 20 (6): 384-7. |
| [15] | Kawamoto Y, Nakamura S, Nakano S, et al. Immunohistochemical localization of brain-derived neurotrophic factor in adult rat brain[J]. Neuroscience, 1996, 74 (4): 1209-26. DOI: 10.1016/0306-4522(96)00245-X. |
| [16] | 黄晓科, 银晓勇, 黄艳秋, 等. 大鼠海马损毁与学习记忆研究进展[J]. 中国老年学杂志, 2012, 32 (10): 2199-201. DOI: 10.3969/j.issn.1005-9202.2012.10.108. |
| [17] | Allen AT, Maher KN, Wani KA, et al. Coexpressed D1-and D2-like dopamine receptors antagonistically modulate acetylcholine release in Caenorhabditis elegans[J]. Genetics, 2011, 188 (3): 579-90. DOI: 10.1534/genetics.111.128512. |
| [18] | Carvalho AL, Caldeira MV, Santos SD, et al. Role of the brainderived neurotrophic factor at glutamatergic synapses[J]. Br J Pharmacol, 2008, 153 (Suppl 1): S310-24. |
| [19] | Phillips HS, Hains JM, Armanini M, et al. BDNF mRNA is decreased in the hippocampus of individuals with Alzheimer's disease[J]. Neuron, 1991, 7 (5): 695-702. DOI: 10.1016/0896-6273(91)90273-3. |
| [20] | Schäbitz WR, Sommer C, Zoder W, et al. Intravenous brain-derived neurotrophic factor reduces infarct size and counterregulates Bax and Bcl-2 expression after temporary focal cerebral ischemia[J]. Stroke, 2000, 31 (9): 2212-7. DOI: 10.1161/01.STR.31.9.2212. |
| [21] | Zhang Y, Pardridge WM. Neuroprotection in transient focal brain ischemia after delayed intravenous administration of brain-derived neurotrophic factor conjugated to a blood-brain barrier drug targeting system[J]. Stroke, 2001, 32 (6): 1378-84. DOI: 10.1161/01.STR.32.6.1378. |
| [22] | Miyata K, Omori N, Uchino H, et al. Involvement of the brainderived neurotrophic factor/TrkB pathway in neuroprotecive effect of cyclosporin A in forebrain ischemia[J]. Neuroscience, 2001, 105 (3): 571-8. DOI: 10.1016/S0306-4522(01)00225-1. |
| [23] | Yang JT, Chang CN, Lee TH, et al. Effect of dexamethasone on the expression of brain-derived neurotrophic factor and neurotrophin-3 messenger ribonucleic acids after forebrain ischemia in the rat[J]. Crit Care Med, 2002, 30 (4): 913-8. DOI: 10.1097/00003246-200204000-00034. |
| [24] | Subirós N, Del Barco DG, Coro-Antich RM. Erythropoietin: still on the neuroprotection road[J]. Ther Adv Neurol Disord, 2012, 5 (3): 161-73. DOI: 10.1177/1756285611434926. |
| [25] | 宋士军, 李怡秋, 李芳芳, 等. 实验性衰老大鼠海马和大脑脑源性神经营养因子表达的变化[J]. 中国老年学杂志, 2008, 28 (23): 2310-2. DOI: 10.3969/j.issn.1005-9202.2008.23.009. |
 2017, Vol. 37
2017, Vol. 37

