2. 长沙市第一医院神经医学中心,湖南 长沙 410005;
3. 湖南省脑科医院神经内三科,湖南 长沙 410007
2. Neuromedical Center, First Hospital of Changsha, Changsha 410005, China;
3. Third Department of Neurology, Hunan Provincial Brain Hospital, Changsha 410007, China
脂联素(adiponectin, ANP)是由脂肪细胞分泌的一种特异性蛋白。ANP受体广泛表达于中枢神经系统和周围组织中,其中在海马区表达最多,ANP可通过与ANP受体结合,激活中枢神经系统的信号通路,从而参与大脑功能的调控[1]。近年来,越来越多的研究证实脂联素在阿尔茨海默病(AD)的发病中扮演着重要角色。目前国外对脂联素与AD关系的研究尚未统一,国内相关研究极少。本研究通过对AD患者和健康对照组血浆APN水平进行检测和认知功能的评估,从而探讨AD患者血清脂联素水平及其与认知功能改变的相关性,为AD的早期诊疗、病情评估提供理论依据。
1 资料和方法 1.1 研究对象AD组为2012年8月~2016年8月在长沙市第一医院神经医学中心、中南大学湘雅三医院神经内科临床诊断很可能的AD患者,AD组的入选标准:
(1)发病年龄≥65岁,无痴呆家族遗传史;(2)所有患者均进行临床检查、简易精神状态量表(MMSE)筛查,MMSE得分低于临界值(文盲≤17分、小学文化程度≤20分、初中及以上文化程度≤24分);(3)患者无抑郁,汉密尔顿抑郁量表 < 7分(17项版本);(4)患者Hachinski缺血指数量表≤4分;(5)经过至少1名神经科医生诊断,符合美国国立神经病学、语言障碍和卒中-老年痴呆和相关疾病学会工作组(NINCDS-ADRAD)的“很可能AD”的诊断标准。AD组的排除标准(1)有痴呆家族遗传史的患者;(2)非“很可能AD”的患者;(3)有抑郁症状的患者(汉密尔顿抑郁量表评分>17分);(4)Hachinski缺血指数量表>4分的患者;(5)有心梗、心衰、2型糖尿病、脑卒中、自身免疫性疾病的患者。对照组分别来自于同期两家医院健康管理中心的非痴呆体检人群。收集上述两组人群的临床资料和外周血标本。AD组共90例,对照组共90例。
1.2 酶联免疫吸附实验抽取研究对象的清晨空腹抽静脉血约5 mL,选择EDTA作为抗凝剂,静置2 h后离心20 min(2000 r/min)。仔细收集上层血浆,-80 ℃冰箱保存。采用双抗体夹心酶联免疫吸附法检测血浆APN水平。血浆脂联素试剂盒购自武汉伊莱瑞特生物科技有限公司。检测板板内与板间变异系数均小于10%,所有标本均设有复孔,按照说明书步骤严格进行实验,测定吸光度,然后再根据标准曲线计算脂联素水平。
1.3 认知功能的评估所有患者均行MMSE评估,并根据MMSE评分将AD组分为轻度(大于或等于21分)12人;中度(10~20分)30人;重度(小于10分)48人。
1.4 统计方法运用SPSS19.0统计软件包、GraphPad Prism 5软件包进行统计分析及绘图。两组人群间的一般特征比较采用t检验或χ2检验,多个样本均数的比较运用GraphPad Prism 5软件采用单因素方差分析,多个样本均值间两两比较采用方差分析中Newman-Keuls Multiple Comparison Test法,两变量之间关系采用线性相关分析,定义P < 0.05认为差异具有统计学意义。
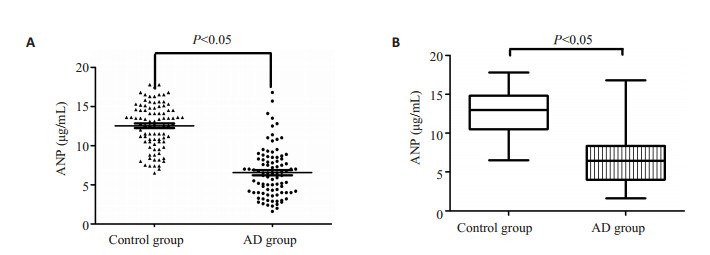
2 结果 2.1 AD组与对照组一般资料比较AD组与对照组在性别、年龄、丧偶、体质量指数、头部创伤史、高血压病史、甘油三酯、胆固醇、同型半胱氨酸、高密度脂蛋白、空腹血糖、吸烟史等方面比较无统计学差异(P>0.05)。AD组与对照组在文化程度、低密度脂蛋白值比较差异有统计学意义(P < 0.05),说明文化程度低、低密度脂蛋白高可能是AD的危险因素(表 1)。AD组血清脂联素水平显著低于对照组,差异有统计学意义(P < 0.05)。图 1A散点图和图 1B箱图分别说明AD组和对照组脂联素的分布情况及两组间脂联素水平的比较。
| 表 1 AD组与对照组的一般资料比较 Table 1 Clinical characteristics in AD group and control group |
|
图 1 AD组与对照组的血清ANP的离散分布与水平比较 Figure 1 Discrete distribution of serum ANP in AD group and control group (A) and comparison of serum ANP levels between the two groups (B). |
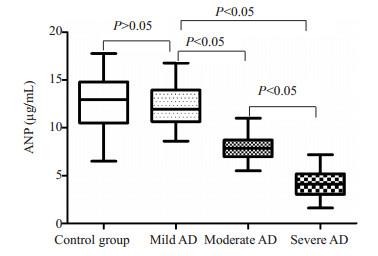
运用GraphPad Prism 5软件采用单因素方差分析,多个样本均值间两两比较采用方差分析中Newman-Keuls Multiple Comparison Test法分析比较AD组各亚组间及与对照组血清ANP的水平。AD亚组间血清ANP水平比较及各亚组与对照组的血清ANP水平比较见表 2和图 2。重度组与对照组比较:Mean Diff=-8.210,q=28.06,P < 0.001;重度组与轻度组比较:Mean Diff=-7.948,q=15.04,P < 0.001;重度组与中度组比较:Mean Diff=-3.533,q=9.272,P < 0.001;中度组与对照组:Mean Diff=-4.677,q=13.55,P < 0.001;中度组与轻度组:Mean Diff=-4.415,q=7.895,P < 0.001;轻度组与对照组:Mean Diff=-0.2617,q=0.5201,P>0.05;AD各亚组与对照组比较:F=142.2,P < 0.001。
| 表 2 AD各亚组与对照组的血清ANP水平相互比较 Table 2 Serum ANP in AD subgroups and control group |
|
图 2 AD各亚组及对照组之间的血清ANP水平相互比较 Figure 2 Comparison of the serum ANP in AD sub-groups and control group. |
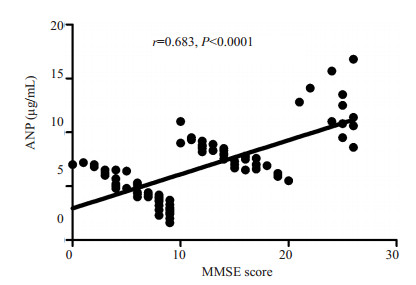
AD患者血清ANP水平与MMSE评分相关分析见图 3。直线相关分析结果显示:AD患者血清ANP水平与MMSE评分呈正相关性(r=0.683,P < 0.001)。
|
图 3 AD患者血清ANP水平与MMSE评分的直线相关分析 Figure 3 Linear correlation analysis of ANP level and MMSE score of the AD patients. |
ANP是脂肪组织分泌最为丰富的蛋白之一,近年来大量研究发现:较高的循环ANP水平对AD具有保护作用。Masaaki等[2]研究发现AD和MCI患者脑脊液的脂联素水平较正常对照组明显降低,且这种降低与颅内tau蛋白的过度磷酸化水平一致。Kamogawa等[3]通过对517名中老年社区居民的研究发现:在校正了腹部皮下脂肪含量、年龄等混杂因素干扰后,体内含高脂联素水平的MCI患者比低脂联素水平的MCI患者发展为AD的速度要慢,说明ANP是延缓AD进展的保护性因素。本课题组前期研究发现:脂联素基因rs266729、rs1501299基因多态性可能与湖南地区汉族人群迟发型阿尔茨海默病发病有关[4]。然而由Dukic[5]等和Kitagawa [6]等分别开展的两项研究却发现:血清脂联素水平可能与AD关系并不密切。本研究结果显示:AD组血清ANP水平较对照组显著降低,差异有统计学意义,我们的研究结果与以往的研究报道一致[3, 7-11]。Teixeira等[8]发现MCI、AD患者循环ANP水平较正常对照组普遍降低,认为低血清ANP水平参与了AD的认知功能紊乱的病理改变过程。Kálmán等[9]研究脂肪因子、胆碱酯酶抑制剂与AD关系时发现:服用多奈哌齐的AD患者其血清ANP显著升高,并伴认知功能改善,进一步说明了升高血清ANP对AD患者具有保护作用。2型糖尿病患者循环血清ANP越低,其颞区灰质的体积越小,同时颞区灰质葡萄糖代谢也会降低,并且在校正年龄、性别、教育、APOEε4基因等干扰因素后,这一结论仍然成立[7]。回顾相关文献我们发现ANP对AD保护作用的机制包括:减少Aβ的堆积和产生[12],抵抗由Aβ引发的中枢病理及毒性作用[13],改善中枢神经胰岛素抵抗[10],保护中枢神经细胞[14],改善血脑屏障功能[15],调节中枢免疫炎症反应[16-17],保护血管内皮细胞、对抗血管动脉粥样硬化、调节糖脂代谢等[18-20]。我们的研究与Dukic等[5]和Kitagawa [6]分别开展的两项研究发现不一致:Dukic对比了70例AD患者与50例认知功能正常的健康人群血清脂联素水平,然而并未发现两者脂联素分布存在统计学上的差异。Kitagawa [6]研究了466名存在明显血管危险因素的患者,在平均随访6.9年,他们发现拥有较高或较低血清脂联素的患者发展至AD的风险并无明显差异。由此认为血清脂联素与AD的发生发展无明显关系。我们认为样本量和人种不同是我们与Dukic研究不一致可能原因;而Kitagawa研究纳入的人群是存在明显血管危险因素的患者,这可能是导致我们研究结论不一致的主要原因。
根据MMSE评分,我们首次将AD组分成3个不同亚组进行研究,进一步探讨脂联素水平在不同亚组间的分布情况,结果发现:不同亚组AD患者血清ANP水平有差异,与对照组比较:中、重度AD患者血清ANP下降明显,而轻度AD患者血清ANP和对照组无差异,这提示轻度AD患者早期ANP代谢异常可能并不明显。对AD患者血清ANP水平和MMSE评分进行相关分析发现:AD患者MMSE评分越低(认知功能障碍越严重),其血清ANP水平越低,说明血清ANP水平与MMSE评分呈正相关性。可以推测,AD患者血清ANP降低的程度可以间接反映AD患者认知功能障碍的严重程度;ANP也可能是较好的AD血清学标记物和治疗的靶点;ANP血清浓度的检测可能对病情和治疗转归的评估具有重要的价值。但实验结果可能受检测样本量、样本人群身体基础疾病等因素的影响,有待于进一步规范研究方案如扩大样本量、剔除其他混杂因素等,使结果更可信。
| [1] | Psilopanagioti A, Papadaki H, Kranioti EF, et al. Expression of adiponectin and adiponectin receptors in human pituitary gland and brain[J]. Neuroendocrinology, 2009, 89 (1): 38-47. |
| [2] | Waragai M, Adame A, Trinh I, et al. Possible involvement of adiponectin, the Anti-Diabetes molecule, in the pathogenesis of alzheimer's disease[J]. J Alzheimers Dis, 2016, 52 (4): 1453-9. DOI: 10.3233/JAD-151116. |
| [3] | Kamogawa K, Kohara K, Tabara Y, et al. Abdominal fat, adipose-derived hormones and mild cognitive impairment: the J-SHIPP study[J]. Dement Geriatr Cogn Disord, 2010, 30 (5): 432-9. DOI: 10.1159/000321985. |
| [4] | Li W, Yu Z, Hou D, et al. Relationship between Adiponectin Gene Polymorphisms and Late-Onset Alzheimer's Disease[J]. PLoS One, 2015, 10 (4): e0125186. DOI: 10.1371/journal.pone.0125186. |
| [5] | Dukic L, Simundic AM, Martinic-Popovic I, et al. The role of human kallikrein 6, clusterin and adiponectin as potential blood biomarkers of dementia[J]. Clin Biochem, 2016, 49 (3): 213-8. DOI: 10.1016/j.clinbiochem.2015.10.014. |
| [6] | Kitagawa K, Miwa K, Okazaki S, et al. Serum high-molecularweight adiponectin level and incident dementia in patients with vascular risk factors[J]. Eur J Neurol, 2016, 23 (3): 641-7. DOI: 10.1111/ene.12915. |
| [7] | García-Casares N, García-Arnés JA, Rioja J, et al. Alzheimer's like brain changes correlate with low adiponectin plasma levels in type 2 diabetic patients[J]. J Diabetes Complications, 2016, 30 (2): 281-6. DOI: 10.1016/j.jdiacomp.2015.12.001. |
| [8] | Teixeira AL, Diniz BS, Campos AC, et al. Decreased levels of circulating adiponectin in mild cognitive impairment and alzheimer's disease[J]. Neuromolecular Med, 2013, 15 (1): 115-21. DOI: 10.1007/s12017-012-8201-2. |
| [9] | Pákáski M, Fehér A, Juhász A, et al. Serum adipokine levels modified by donepezil treatment in Alzheimer's disease[J]. J Alzheimers Dis, 2014, 38 (2): 371-7. |
| [10] | Ng RC, Cheng OY, Jian M, et al. Chronic adiponectin deficiency leads to Alzheimer's disease-like cognitive impairments and pathologies through AMPK inactivation and cerebral insulin resistance in aged mice[J]. Mol Neurodegener, 2016, 11 (1): 71. DOI: 10.1186/s13024-016-0136-x. |
| [11] | Xie HH, Huang DH, Zhang S, et al. Relationships between adiponectin and matrix metalloproteinase-9 (MMP-9) serum levels and postoperative cognitive dysfunction in elderly patients after general anesthesia[J]. Aging Clin Exp Res, 2016, 28 (6): 1075-9. DOI: 10.1007/s40520-015-0519-9. |
| [12] | Van Echten-Deckert G, Walter J. Sphingolipids: critical players in Alzheimer's disease[J]. Prog Lipid Res, 2012, 51 (4): 378-93. DOI: 10.1016/j.plipres.2012.07.001. |
| [13] | Chan KH, Lam KS, Cheng OY, et al. Adiponectin is Protective against Oxidative Stress Induced Cytotoxicity in Amyloid-Beta Neurotoxicity[J]. PLoS One, 2012, 7 (12): e52354. DOI: 10.1371/journal.pone.0052354. |
| [14] | Anderson NJ, King MR, Delbruck L, et al. Role of insulin signaling impairment, adiponectin and dyslipidemia in peripheral and central neuropathy in mice[J]. Dis Model Mech, 2014, 7 (6): 625-33. DOI: 10.1242/dmm.015750. |
| [15] | Liu M, Xiang R, Wilk SA, et al. Fat-specific DsbA-L overexpression promotes adiponectin multimerization and protects mice from diet-induced obesity and insulin resistance[J]. Diabetes, 2012, 61 (11): 2776-86. DOI: 10.2337/db12-0169. |
| [16] | Pei H, Yu Q, Xue Q, et al. Notch1 cardioprotection in myocardial ischemia/reperfusion involves reduction of oxidative/nitrative stress[J]. Basic Res Cardiol, 2013, 108 (5): 373. DOI: 10.1007/s00395-013-0373-x. |
| [17] | Luo Y, Liu M. Adiponectin: a versatile player of innate immunity[J]. J Mol Cell Biol, 2016, 8 (2): 120-8. DOI: 10.1093/jmcb/mjw012. |
| [18] | Grundy SM. Metabolic syndrome update[J]. Trends Cardiovasc Med, 2016, 26 (4): 364-73. DOI: 10.1016/j.tcm.2015.10.004. |
| [19] | Taskinen MR, Borén J. New insights into the pathophysiology of dyslipidemia in type 2 diabetes[J]. Atherosclerosis, 2015, 239 (2): 483-95. DOI: 10.1016/j.atherosclerosis.2015.01.039. |
| [20] | Shen L, Miao J, Yuan F, et al. Overexpression of adiponectin promotes focal angiogenesis in the mouse brain following middle cerebral artery occlusion[J]. Gene Ther, 2013, 20 (1): 93-101. DOI: 10.1038/gt.2012.7. |
 2017, Vol. 37
2017, Vol. 37

