2. 广东药科大学附属第一医院 检验科,广东 广州 510080;
3. 广东药科大学附属第一医院肿瘤科,广东 广州 510080
2. Clinical Laboratory, First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, China;
3. Department of Oncology, First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, China
热疗是一种将肿瘤组织温度加热至40~43 ℃的治疗方法,因其对肿瘤细胞具有直接的杀伤作用,通常作为肿瘤治疗的辅助手段[1-3]。热疗诱导细胞死亡的分子生物学机制仍然不清楚,可能与蛋白折叠错误、聚集有关[4]。然而,细胞在热应激的时候会产生一系列保护性反应,如如引起Hsp27、Hsp70和Hsp90等表达上升[5],其中Hsp90对折叠错误蛋白的命运起关键作用。Hsp90主要包括两种亚型,分别为应激诱导表达升高Hsp90α和结构性表达的Hsp90β [6]。Hsp90在细胞内主要是发挥分子伴侣功能,促进蛋白的折叠、稳定和介导蛋白降解[6],其底物蛋白超过200种,其中包括转录因子、激酶、类固醇激素受体等[7]。在热疗中发生变性的蛋白大部分被Hsp90重新折叠或者介导降解[8],而主要负责细胞内蛋白降解的是26S蛋白酶体[9-10]。26S蛋白酶体由核心复合物20S催化颗粒19S调节颗粒组成[9, 11]。近期发现,26S蛋白酶体的表达与Hsp90的功能相关[9],但是在热疗过程中26S蛋白酶体的变化以及是否同样受Hsp90调控尚未明。本研究以26S蛋白酶体的量及活性为标志,探索在热疗时Hsp90对26S蛋白酶体的影响。
1 材料和方法 1.1 材料与仪器HepG2细胞株为本实验室冻存保种;DMEM基础培养液、胎牛血清购自于Life technologies公司;Hsp90大鼠单抗、26S蛋白酶体小鼠多抗购于Santa Cruz公司;Brad-ford DC蛋白质定量试剂盒购自BIO-RAD公司;ROS探针DCFH-DA、MTT、蛋白酶体活性测定试剂盒均购于Sigma公司。
1.2 方法 1.2.1 热疗方法对照组细胞培养于37 ℃,热疗组细胞贴壁24 h后于42 ℃二氧化碳培养箱(Thermo 3111)培养不同时间(2、4、6、8、12和24 h)。
1.2.2 热疗后,细胞内ROS变化的测定热疗不同时间后,使用DCFH-DA 37 ℃染色15 min。PBS洗去多余的染料,然后消化细胞,PBS洗涤,流式细胞仪(Guava,Millipore)488 nm激发,535 nm检测荧光强度。
1.2.3 MTT法检测细胞数在96孔板中每孔加入1×104细胞,贴壁24 h后,热疗不同时间。加20 μL MTT培养4 h,吸去孔内培养液,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使用酶标仪(Thermo MK3)在波长490 nm处检测各孔的吸光度(A)值。
1.2.4 瞬时转染细胞贴壁24 h后(融合率约50%),使用Lipofectamine 2000将针对HSP90α的siRNA序列(5'-AAUCCGGUAUGAAAGCUUGAC-3)'或空白对照(NC)序列转染至细胞,24 h后换液并用于下游实验。
1.2.5 蛋白酶体活性测定在96孔黑板中每孔加入1× 104细胞,贴壁24 h后,热疗不同时间。热疗后立即使用蛋白酶体20 S活性检测试剂盒检测每孔的荧光值,每孔荧光值与对应热疗时间后的MTT值之比即为每个细胞的发光度。
1.3 统计学方法实验结果使用IBM SPSS 24作统计分析,数据使用重复测量的方差分析或析因设计的方差分析,两两比较使用LSD法,对于所有检验α=0.05。
2 结果 2.1 热疗对细胞内ROS的影响热疗能使蛋白变性[12],然而热疗过程中,是否还有其他因素协同作用使蛋白变性仍不清楚。因此,我们首先检测引起蛋白变性的常见物质—ROS [13]。HepG2细胞经过0~24 h热疗后,使用流式细胞仪测量每个细胞的ROS水平,结果如图 1所示。热疗后,细胞内ROS升高(重复测量的方差分析,F=28.958,P < 0.001),且随着热疗时间越长,ROS水平越高。热疗6 h后,细胞内ROS水平已较对照组多51%。此结果表明,热疗过程中,细胞内ROS会不断累积。
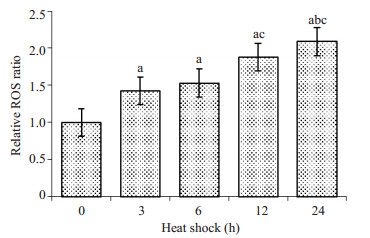
|
图 1 不同热疗时间对HepG2细胞内ROS的影响 Figure 1 Effect of heat shock to ROS production in HepG2 cells (Mean ± SD, n=3). a: Compared with 0 h, P < 0.05; b: Compared with 3 h, P < 0.05; c: Compared with 6 h, P < 0.05). |
为检测热疗是否会影响细胞的增殖,下一步我们检测HepG2细胞在热疗时的增殖情况。细胞经过0~24 h热疗后,使用MTT检测细胞数,结果如图 2所示。HepG2细胞经不同时间热疗后,细胞数逐渐下降(重复测量的方差分析,F=621.704,P < 0.001),经过24 h热疗后细胞数量减少至原来的51%。从结果可知,热疗能抑制细胞增殖,并使细胞数量减少。
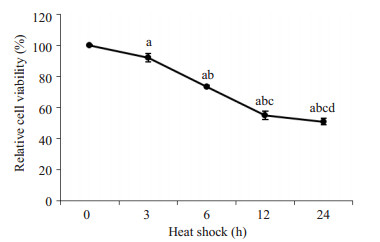
|
图 2 HepG2细胞经过不同时间后热疗后,细胞数的变化情况 Figure 2 Changes of HepG2 cell numbers after hyperthermia (Mean±SD, n=3). a: Compared with 0 h, P < 0.05; b: Compared with 3 h, P < 0.05; c: Compared with 6 h, P < 0.05; d: Compared with 12 h, P < 0.05. |
热应激以及大量ROS产生的过程中,细胞内蛋白会变性,变性后的蛋白如果不能及时复性或被降解,细胞则会发生非折叠蛋白反应而凋亡,而HSP90和蛋白酶体则对蛋白复性和降解起到关键作用[14]。下一步检测热疗过程中,HSP90α的变化情况,热疗后,细胞内Hsp90a表达量增加(重复测量的方差分析,F=27.403,P=0.035),12 h后增多最为明显,到24 h时稍有下降。26 S蛋白酶体是真核细胞内负责蛋白质降解的主要分子机器,因此通过检测26 S蛋白酶体的量可反映蛋白酶体的量。热疗过程中,26 S蛋白酶体(26 S proteasome)表达量随着热疗时间的延长而减少(重复测量的方差分析,F=164.174,P < 0.001)。结果提示,热疗过程中,26 S蛋白酶体的表达趋势与HSP90α相反,提示26 S蛋白酶体的表达可能与HSP90α功能相关。
2.4 HSP90α对26 S蛋白酶体表达的影响为进一步探索26 S蛋白酶体的量是否与HSP90功能相关,下一步使用HSP90α干扰序列干扰HSP90后,观察热疗24 h后的26 S蛋白酶体的变化,结果如图 4所示,数据使用释因设计的方差分析进行统计分析。热疗24 h后,HSP90α增多而26 S蛋白酶体减少,变化趋势跟上述一致;当干扰HSP90α后,HSP90α显著减少(F= 68.255,P < 0.001);但干扰HSP90α后,24 h热疗使HSP90α和26 S蛋白酶体进一步减少(F=180.231,P < 0.001)。以上结果表明,26 S蛋白酶体的量受HSP90α的量和功能密影响,HSP90α减少或者功能收限时,26 S蛋白酶体的量也随之而减少。
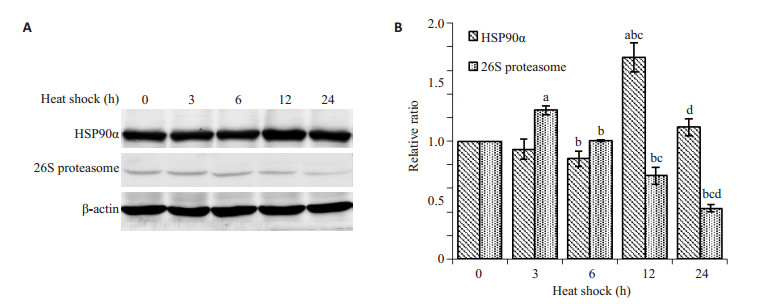
|
图 3 热疗对Hsp90α和26 S蛋白酶体的表达的影响 Figure 3 Effect of heat stress on expression of Hsp90α and 26 S proteasome. A: HSP90α and 26 S proteasome detected by Western blotting; B: Gray value analysis (Mean±SD, n=3). (a: Compared with 0 h, P < 0.05; b: Compared with 3 h, P < 0.05; c: Compared with 6 h, P < 0.05; d: compared with 12 h, P < 0.05). |
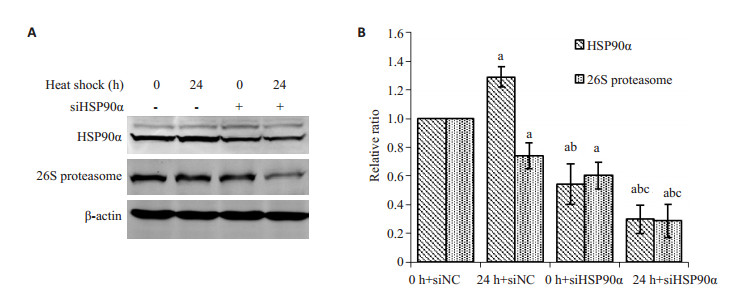
|
图 4 Hsp90α对26 S蛋白酶体的表达的影响 Figure 4 Effect of Hsp90α on the expression of 26 S proteasome. A: HSP90α and 26 S proteasome detected by Western blotting; B: Gray value analysis (Mean±SD, n=3). (a: Compared with 0 h, P < 0.05; b: Compared with 3 h, P < 0.05; c: Compared with 6 h, P < 0.05). |
26 S蛋白酶体的量在热疗过程中先升高而后下降,然而蛋白酶活性是否改变仍不清楚。下一步将检测热疗过程中26 S蛋白酶体活性的变化。热疗过程中,26S蛋白酶体活性变化如图 5所示。在热疗的过程中,26S蛋白酶体活性呈先升高后下降的趋势(重复测量的方差分析,F=133.043,P < 0.001)。在前6 h,26 S蛋白酶体活性较对照组稍有上升,而在6 h以后,蛋白酶体活性逐渐降低,热疗24 h时,蛋白酶体活性下降至对照组的49.98%。以上结果表明,长时程热疗除使蛋白酶体的量下降,也会抑制蛋白酶体活性。
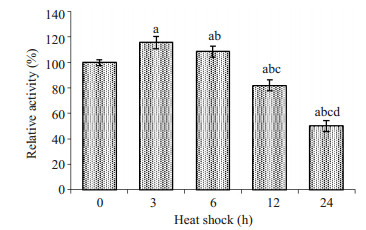
|
图 5 热疗不同时间后,26 S蛋白酶体活性的变化 Figure 5 Changes of 26 S proteasome activity at different time points of heat shock (Mean±SD, n=3). (a: Compared with 0 h, P < 0.05; b: Compared with 3 h, P < 0.05; c: Compared with 6 h, P < 0.05; d: Compared with 12 h, P < 0.05). |
热疗能使蛋白错误折叠和聚集,数分钟内的热疗能使大部分蛋白和RNA聚合在一起形成应激颗粒[4]。应激颗粒的形成可能是细胞对热疗的保护性反应之一,因为在热疗后的恢复期,这些应激颗粒会逐渐被打开,蛋白复性而且不会被降解,在蛋白复性过程中,需要众多热休克蛋白的参与[4]。大部分变性蛋白最终需要经过Hsp90的最后折叠才能恢复成正确的构象[15]。当热疗时间变长时,细胞内产生越来越多ROS。在ROS还原过程中可导致众多蛋白和脂质被氧化,使细胞发生氧化应激[16],导致蛋白进一步变性[17]。
细胞受应激后,Hsp90α会诱导性表达增多,使细胞适应应激,起到自我保护的作用。在应激过程中,变性的蛋白需要被重新折叠,Hsp70和Hsp40能联合识别变性蛋白,然后传递至Hsp90,由Hsp90完成最后的折叠过程[6]。若变性的蛋白不能重新折叠且蓄积过多,细胞就会发生未折叠蛋白反应[18]。UPR涉及3个方面:开始时中止蛋白翻译以恢复细胞功能;降解折叠错误的蛋白;上调涉及蛋白折叠的分子伴侣[19]。热疗使细胞产生大量变性的蛋白,这些蛋白若不能及时被修复或者降解,细胞就会因蛋白平衡紊乱然后凋亡。本研究发现,在热疗时,随着热和越来越多的ROS作用于细胞,虽然Hsp90α也有所升高,但是轻微升高的Hsp90α不能完全保护细胞对抗热环境,热疗24 h时,细胞数已显著下降。
热休克蛋白和泛素-蛋白酶系统紧密合作以维持细胞内的蛋白稳态。大部分细胞内的蛋白经泛素化后,由26 S蛋白酶体降解[20]。而变性蛋白可通过与HSP90结合而泛素化[21]。HSP90对底物蛋白的调节需要多种共伴侣分子的参与,其中共伴侣分子CHIP是一种泛素连接酶[22],当HSP90和底物蛋白结合后,CHIP与HSP90结合就会使底物蛋白泛素化[23-24],促进底物蛋白的降解。但是26 S蛋白酶体的组装也受HSP90调节,19 S调节颗粒与20 S核心颗粒的结合成26S蛋白酶体需要HSP90组装和维持,当缺乏HSP90的协助时,26 S蛋白酶体将变得不稳定[25]。热疗过程中,由于蛋白持续变性,大量HSP90被分配于稳定变性蛋白,导致26 S蛋白酶体缺乏HSP90协助组装,使26 S蛋白酶体随着热疗时间的延长而逐渐减少。虽然热疗12 h后,细胞内HSP90α表达大幅增多,但由于变性蛋白继续消耗新增加的HSP90α,导致26 S蛋白酶体同样不能得到HSP90的稳定,最终26 S蛋白酶体在热疗过程中逐渐减少。同样地,由于缺乏HSP90协助26 S蛋白酶体组装,使得26 S蛋白酶体活性在热疗中逐渐下降。最后导致变性蛋白不能被降解而堆积在细胞中。
综上所述,随着热疗时间延长,细胞内ROS含量越来越高,热和ROS共同使蛋白变性,是细胞发生未折叠蛋白反应;虽然热应激使细胞内Hsp90α上调有助于重新折叠变性了的蛋白,但是由于持续的热疗和越来越多的ROS,使细胞内变性蛋白越来越多,增多了的HSP90α不足以维持所有蛋白的稳定,因此,不能被重新折叠的蛋白只能通过蛋白酶体途径降解。然而热疗过程中由于Hsp90α主要被用于维持变性蛋白的稳定,致使26 S蛋白酶体缺乏Hsp90α的分子伴侣作用,26 S蛋白酶体最终数量减少,通过干扰Hsp90α进一步确证26 S蛋白酶体的组装依赖于Hsp90α;同时,20 S蛋白酶体活性也随着热疗时间的延长而降低,最终使得变性蛋白不能被有效降解,使细胞发生死亡。通过本研究,明确了在热疗过程中,依赖于Hsp90功能进行组装的20 S蛋白酶体数量和活性均下降,减少变性蛋白的降解,进一步加剧未折叠蛋白反应而使细胞死亡,为热疗杀灭肿瘤细胞的机理提供理论依据、为治疗肿瘤提供新的治疗策略。
| [1] | Wust P, Hildebrandt B, Sreenivasa G, et al. Hyperthermia in combined treatment of cancer[J]. Lancet Oncol, 2002, 3 (8): 487-97. DOI: 10.1016/S1470-2045(02)00818-5. |
| [2] | Ohtake M, Umemura M, Sato I, et al. Hyperthermia and chemotherapy using Fe (Salen) nanoparticles might impact glioblastoma treatment[J]. Sci Rep, 2017, 7 : 42783. DOI: 10.1038/srep42783. |
| [3] | Gao S, Zheng M, Ren X, et al. Local hyperthermia in head and neck cancer: mechanism, application and advance[J]. Oncotarget, 2016, 7 (35): 57367-78. |
| [4] | Wallace EW, Kear-Scott JL, Pilipenko EV, et al. Reversible, specific, active aggregates of endogenous proteins assemble upon heat stress[J]. Cell, 2015, 162 (6): 1286-98. DOI: 10.1016/j.cell.2015.08.041. |
| [5] | Wang X, Chen M, Zhou J, et al. HSP27, 70 and 90, anti-apoptotic proteins, in clinical cancer therapy (Review)[J]. Int J Oncol, 2014, 45 (1): 18-30. |
| [6] | Li J, Buchner J. Structure, function and regulation of the hsp90 machinery[J]. Biomed J, 2013, 36 (3): 106-17. DOI: 10.4103/2319-4170.113230. |
| [7] | https://www.picard.ch/downloads/Hsp90interactors.pdf. |
| [8] | Shrestha L, Patel HJ, Chiosis G. Chemical tools to investigate mechanisms associated with HSP90 and HSP70 in disease[J]. Cell Chem Biol, 2016, 23 (1): 158-72. DOI: 10.1016/j.chembiol.2015.12.006. |
| [9] | Nanduri P, Hao R, Fitzpatrick T, et al. Chaperone-mediated 26S proteasome remodeling facilitates free K63 ubiquitin chain production and aggresome clearance[J]. J Biol Chem, 2015, 290 (15): 9455-64. DOI: 10.1074/jbc.M114.627950. |
| [10] | Im E, Chung KC. Precise assembly and regulation of 26S proteasome and correlation between proteasome dysfunction and neurodegenerative diseases[J]. BMB Rep, 2016, 49 (9): 459-73. DOI: 10.5483/BMBRep.2016.49.9.094. |
| [11] | Livneh I, Cohen-Kaplan V, Cohen-Rosenzweig C, et al. The Life cycle of the 26S proteasome: from birth, through regulation and function, and onto its death[J]. Cell Res, 2016, 26 (8): 869-85. DOI: 10.1038/cr.2016.86. |
| [12] | Fang NN, Zhu M, Rose A, et al. Deubiquitinase activity is required for the proteasomal degradation of misfolded cytosolic proteins upon heat-stress[J]. Nat Commun, 2016, 7 : 12907. DOI: 10.1038/ncomms12907. |
| [13] | Sabeti P, Pourmasumi S, Rahiminia T, et al. Etiologies of sperm oxidative stress[J]. IntJ Reprod Biomed (Yazd, Iran), 2016, 14 (4): 231-40. |
| [14] | Ding G, Chen P, Zhang H, et al. Regulation of ubiquitin-like with plant homeodomain and RING finger domain 1 (UHRF1) protein stability by heat shock protein 90 chaperone machinery[J]. J Biol Chem, 2016, 291 (38): 20125-35. DOI: 10.1074/jbc.M116.727214. |
| [15] | Oroz J, Kim JH, Chang BJ, et al. Mechanistic basis for the recognition of a misfolded protein by the molecular chaperone Hsp90[J]. Nat Struct Mol Biol, 2017, doi: 10.1038/nsmb.3380.[Epubaheadofprint]. |
| [16] | Brookes PS, Yoon Y, Robotham JL, et al. Calcium, ATP, and ROS: a mitochondrial love-hate triangle[J]. Am J Physiol Cell Physiol, 2004, 287 (4): C817-33. DOI: 10.1152/ajpcell.00139.2004. |
| [17] | Ali I, Shah SZ, Yi J, et al. Reactive oxygen species-mediated unfolded protein response pathways in pre-implantation embryo[J]. J Vet Sci, 2017 Jan 4.[Epub ahead of print] |
| [18] | Sarvani C, Sireesh D, Ramkumar KM. Unraveling the role of ER stress inhibitors in the context of metabolic diseases[J]. Pharmacol Res, 2017, pii: S1043-6618(16)31289-0. |
| [19] | Ma Y, Hendershot LM. The role of the unfolded protein response in tumour development:friend or foe[J]. Nat Rev Cancer, 2004, 4 (12): 966-77. DOI: 10.1038/nrc1505. |
| [20] | Makhnevych T, Houry WA. The role of Hsp90 in protein complex assembly[J]. Biochim Biophys Acta, 2012, 1823 (3): 674-82. DOI: 10.1016/j.bbamcr.2011.09.001. |
| [21] | Muller P, Ruckova E, Halada P, et al. C-terminal phosphorylation of Hsp70 and Hsp90 regulates alternate binding to co-chaperones CHIP and HOP to determine cellular protein folding/degradation balances[J]. Oncogene, 2013, 32 (25): 3101-10. DOI: 10.1038/onc.2012.314. |
| [22] | Edkins AL. CHIP: a co-chaperone for degradation by the proteasome[J]. Subcell Biochem, 2015, 78 : 219-42. DOI: 10.1007/978-3-319-11731-7. |
| [23] | Zhang H, Amick J, Chakravarti R, et al. A bipartite interaction between Hsp70 and CHIP regulates ubiquitination of chaperoned client proteins[J]. Structure, 2015, 23 (3): 472-82. DOI: 10.1016/j.str.2015.01.003. |
| [24] | Han SY, Ko A, Kitano H, et al. Molecular chaperone HSP90 is necessary to prevent cellular senescence via lysosomal degradation of p14ARF[J]. Cancer Res, 2017, 77 (2): 343-54. DOI: 10.1158/0008-5472.CAN-16-0613. |
| [25] | Yamano T, Mizukami S, Murata S, et al. Hsp90-mediated assembly of the 26 S proteasome is involved in major histocompatibility complex class Ⅰ antigen processing[J]. J Biol Chem, 2008, 283 (42): 28060-5. DOI: 10.1074/jbc.M803077200. |
 2017, Vol. 37
2017, Vol. 37

