2. 南方医科大学病理教研室,广东 广州 510515;
3. 东莞市儿童医院新生儿科,广东 东莞 523325
2. Department of Pathology, Southern Medical University, Guangzhou 510515, China;
3. Department of Neonatal Medicine, Children's Hospital of Dongguan, Dongguan 523325, China
呼吸衰竭是新生儿常见的疾病,严重威胁患儿生命。呼吸衰竭病因包括围生期窒息、呼吸窘迫综合征、肺炎、吸入综合征、败血症、先天性膈疝、先天性心脏病、原发性肺动脉高压等[1],其中,窒息、呼吸窘迫综合征、肺炎、吸入综合征是造成新生儿呼吸衰竭的主要原因[2]。目前,随着高频振荡通气、肺表面活性物质、一氧化氮等血管扩张剂的广泛使用、外科手术等的开展,乃至体外膜肺的支持,由前几种原因造成的呼吸衰竭的死亡率已较前大大下降[3]。但是,仍有小部分患儿对上述治疗反应差,并发严重持续性肺动脉高压(PPHN)、缺氧死亡,且临床难以发现明确的窒息、感染等常见因素,对于这部分患儿病因,目前仍需探讨,肺血管疾病(PVD)导致的原发性肺动脉高压是重要病因之一[4]。新生儿期PVD包括由胎儿期或围生期异常因素导致的肺血管张力和反应性增高、肺血管管壁结构异常、重塑和肺血管生长、发育和再生过程障碍等一系列肺血管的病理性改变[5-6],而肺血管结构异常和生长发育异常是导致难治性、致死性低氧血症的病理基础,但因临床不易找到明确病因,需依靠病理诊断[7]。因此,对于难治性呼吸衰竭、死亡的患儿,PVD需要得到新生儿医生及病理学医生的高度重视及深刻的认识。虽然国外已经开展了相关研究并规范了疾病分类[8],PVD仍是尚未被充分认识的疾病[4]。尤其在我国,对于PVD的认识和关注更是远远不够。因新生儿肺活检在我国开展甚少、尸解率不高,故患儿生前诊断具有难度;因病理医生对该病认识不足,即使病理诊断也存在漏诊和误诊,目前仅有零星的个案报道[9]以及少量动物实验[10],而鲜有较大规模的临床病理学研究报道。
为研究PVD在呼吸衰竭死亡新生儿的存在情况,我们对38例呼吸衰竭死亡的新生儿肺部病理切片进行了重新检查及审阅。
1 资料和方法对1995~2015年南方医科大学南方医院、珠江医院、东莞市儿童医院呼吸衰竭死亡患儿肺部病理学切片38例进行整理复查,重新明确诊断。在HE染色基础上,部分标本采用SP法行CD34、CD68、CK、TTF-1免疫标记和六胺银特殊染色。
入院标准:活产新生儿,无胎粪吸入病史,无先天性心脏病,血培养阴性,出生4周内因呼吸衰竭死亡,且经家长同意行尸体解剖。共入选肺部标本38例,胎龄32~ 42周之间,男20例,女18例。
SP法行CD34、CD68、CK、TTF-1(广州深达生物制品技术有限公司。CD34,克隆号QBEnd/10;CD68,克隆号KP1;CK,克隆号AE1/AE3;TTF-1,克隆号SD66)免疫标记:切片脱蜡至水,微波修复抗原,3%过氧化氢及封闭血清孵育后,依次加入一抗、二抗,最后DAB显色,苏木精复染,常规脱蜡、封固,显微镜下观察。
六胺银特殊染色:切片脱蜡至水,1%过碘酸、5%铬酸、1%草酸分别浸泡水洗。加入六次甲基四胺混合液60 ℃ 40 min,0.2%氯化金调色,3%硫代硫酸钠固定,苏木精复染,常规脱蜡、封固,显微镜下观察。
2 结果病理学结果显示,38例患儿中,发现PVD5例,其中包含肺泡毛细血管发育不良2例,高血压性肺血管重塑3例。5例患儿均无胎粪或羊水吸入,血培养阴性,不伴有先天性心脏病或其它系统发育畸形。
2.1 肺泡毛细血管发育不良病例1为足月儿,生后5 h开始出现低氧血症、持续肺动脉高压,于生后第4天死亡。病例2为足月儿,出生1 d因呼吸衰竭死亡。上述病例,大体标本病例基本正常,沉浮实验阴性。镜下显示:肺组织发育不良,肺泡单位缩小,结构不清,部分呈萎陷状态,肺泡间隔明显增宽,毛细血管密度低且位置异常,与肺泡上皮之间间距增宽,肺静脉血管扩张明显,间质内可见中小动脉管壁肌层明显增厚。CD34、CK免疫标记和六胺银染色都显示肺泡间隔宽,肺泡单位缩小,间隔内毛细血管密度低且与肺泡上皮间距增宽,中小动脉壁增厚。CD68、TTF-1无特殊表达(图 1)。
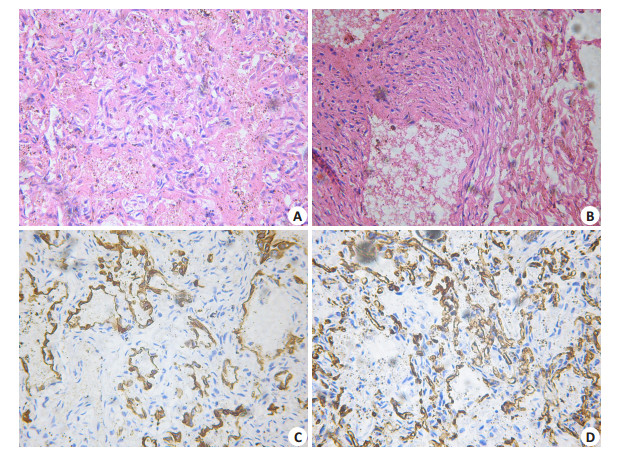
|
图 1 肺泡毛细血管发育不良患儿肺组织病理 Figure 1 Lung histology in neonates with alveolar capillary dysplasia. A: Histological feature of alveolar capillary dysplasia characterized by alveoli dysplasia and collapse, widened alveolar septa and low-density pulmonary capillaries (HE staining, Original magnification: × 200); B: Thickened wall of the medium sized pulmonary artery (HE staining, × 200); C: Alveolar septa widening (immunolabeling with CK, × 200); D: Low density of the pulmonary capillaries (immunolabeling with CD34, ×200). |
病例3为胎龄32周早产儿,出生后进行性呼吸困难、低氧血症、持续肺动脉高压,于出生后2 d死亡;病例4为足月儿,因反复肺炎、呼吸衰竭于出生24 d死亡。病例3肺部大体病理基本正常,沉浮实验阴性,病例4肺部大体病理见右上肺叶分页不全,沉浮实验阴性。上述病例镜下可见肺小动脉中膜平滑肌增生,外膜增厚(图 2),CD34染色显示肺血管密度正常。病例3伴有肺透明膜形成,病例4伴有肺出血及炎症细胞浸润。病例5为左侧先天性膈疝患儿,行膈疝修补术,因持续低氧血症、持续肺动脉高压,于出生第7天死亡。肺部大体病理见左右肺发育不对称,左肺较右肺体积明显减小(图 3),双肺沉浮实验阳性。镜下病理表现为中膜平滑肌轻度增生、外膜显著增厚,CD34染色显示肺血管密度正常。
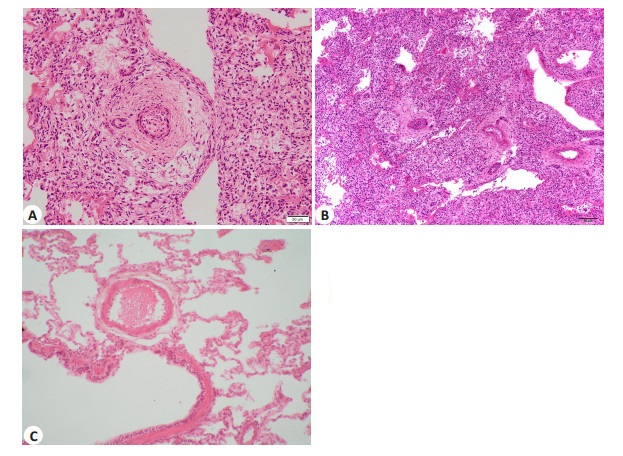
|
图 2 高血压性肺血管重构患儿肺组织病理 Figure 2 Lung histology in a patient with hypertensive arterial remodeling (HE staining, ×200). A: Adventitial thickening in the pulmonary arterioles; B: Smooth muscle cell hyperplasia in the pulmonary arterioles; C: Lung histology of a normal neonate. |
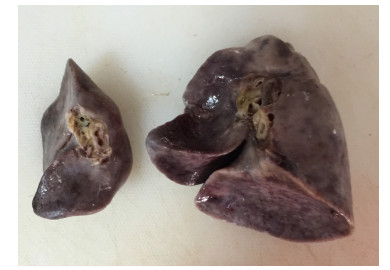
|
图 3 先天性膈疝患儿肺大体标本 Figure 3 Lung samples of a patient with congenital diaphragmatic hernia. Left: Right lung; Right: Left lung. |
对于新生儿期的PVD,国内目前认识程度并不高,仅有零星的个案报道[9]而鲜有较大规模的临床病理学研究报道新生儿期的PVD主要包括肺血管张力和反应性增高、肺血管管壁结构异常、重塑和肺血管生长、发育和再生过程障碍。一些学者称其为“进行性、毁灭性”的疾病[11]。在足月儿或近足月儿,高血压性肺血管重塑是PVD的重要病理改变。与成人肺动脉高压典型的肺血管内膜增殖不同,胎儿期或围生期高血压性肺血管重塑病理学表现主要为肺小血管管壁平滑肌增生和外膜增厚,导致无法用肺实质疾病解释的肺动脉压力增高[6, 8, 11]。肺动脉高压所致的肺循环功能的损伤和结构异常,使得胎儿循环向成人循环转变的过程受阻,致使患儿出现低氧血症、PPHN、结局不良[12-14]。高血压性肺血管重塑的发生机理尚不清楚,但是宫内应激,包括绒毛膜炎、胎盘血管损伤、宫内生长发育受限等,都与该病的发生有关[15-16]。气道上皮细胞、血管内皮细胞损伤以及它们之间的交互作用、血管内皮生长因子(VEGF)、内皮一氧化氮合成酶(eNOS)释放减少均导致血管生成和血管再生障碍,也是发病机制之一[17-18]。肺泡毛细血管发育不良(ACD)是一种伴有肺泡发育不良的致命性的先天性肺血管系统发育异常,有学者称其为“逻辑上致死性的疾病”,其病理学特点包括:肺动脉管壁中层增厚,肺泡及小叶发育异常,肺泡单位数量及肺毛细血管密度减少,肺泡间质增厚,部分肺静脉位置异常、附着于肺小动脉,其中,肺动脉管壁增厚和肺毛细血管密度低,是最突出的组织学特征[19-21]。ACD的病因尚未明确。肺血管的发育对肺泡发育有积极的存进作用,当肺血管发育不良,肺泡也往往存在发育不良[11]。推测可能胚胎肺血管生发不良阻止了肺泡发育成熟形成ACD [22]。基于血管内皮信号系统在肺血管发育中的作用,血管内皮因子信号转导系统紊乱可能是导致ACD的原因之一[23]。有研究表明40% ACD与FOX转录因子基因簇缺乏有关[24]。
目前认为,PVD是一种未被完全发现的疾病,在各种新生儿急性呼吸衰竭和PPHN中均可能存在,其真正的病例数目远超过现有数据,但由于肺活检尚未普及、部分死亡病例未能进行尸解,可能被漏诊。有文献报道,PVD在PPHN的发病率可高达27%,其中不乏漏诊、误诊病例[4]。而且,即使有少数明确因素的继发性PPHN,如致死性胎粪吸入综合征,也可能伴有宫内肺小动脉肌化、外膜增生等高血压性肺血管重塑在内[2]。ACD曾被认为是极其罕见的疾病,但是,Tibballs等[25]研究了澳大利亚皇家儿童医院NICU于1982年~2000年间收治的37例原发性PPHN患儿,在7例死亡病例中6例确诊为ACD,认为ACD在原发性PPHN中的发生率为1:6。而Cassidy等[26]对于173例诊断为致死性肺部疾病的新生儿行尸检,50%以上证实为ACD。
PVD患儿通常较少有出生胎粪吸入、窒息、感染等诱发因素,但在出生数小时~数天内发生进行性呼吸窘迫,大部分迅速发展为难以逆转的PPHN、严重的低氧血症、高碳酸血症及低血压,部分患儿伴有脓毒症的临床表现,最终死亡,氧疗、机械通气及血管活性药物治疗等均不能改变其结局,部分患儿X线胸片未见明显肺实质疾病表现[5-6, 8, 11]。但是,由于导致低氧血症的病因很多,而低氧血症可导致新生儿PPHN、以及包括肺部在内的多脏器功能损伤,因此单纯从临床症状上很难把原发性肺血管疾病所致的肺动脉高压、低氧血症与继发于窒息、肺实质疾病导致的急性肺血管收缩完全区分开来,最终诊断必须依靠病理检查,国外学者呼吁对于新生儿出现呼吸衰竭或者PPHN,机械通气和血管扩张剂等常规治疗无效时应该高度怀疑PVD,提倡常规进行开放式肺活组织检查确诊[27]。
本研究发现,PVD在呼吸衰竭死亡的新生儿中并不少见,且之前的病理诊断存在误诊、漏诊的情况。38例患儿呼吸衰竭死亡的新生儿肺组织标本经重新染色、分析后显示,有5例存在明确病理改变的肺血管疾病,发病率高达13%,与Tibballs等[25]的研究相似。值得注意的是,此5例患儿仅有1例膈疝患儿首次病理学诊断即为高血压性肺血管重塑,其他4例均为复查HE切片后,经免疫组化、六胺银染色等,推翻首次病理学诊结果。其中2例肺血管异常表现为肺动脉平滑肌增厚、毛细血管数量稀少,同时伴有肺泡发育不良、肺泡间隔增宽,符合ACD诊断[9],另外3例表现为肺小动脉内膜阻塞,中膜平滑肌增生,外膜增厚等不同程度的高血压性肺血管重塑。2例ACD患儿病理学一例曾诊断为心衰、肺炎,另一例可疑肺发育不良但未能确诊,另外2例高血压性肺血管重塑患儿均诊断为肺炎。这些误诊和漏诊也凸显了病理医生对于PVD的认识存在严重不足。
我们的研究结果表明,PVD导致是新生儿呼吸衰竭死亡的重要因素,但存在严重的误诊和漏诊,提示在我国临床医生和病理医生对其认识和重视程度远远不够。新生儿PVD导致的呼吸衰竭纠正困难、医疗资源消耗巨大,但预后差、死亡率高,是引发临床医患纠纷的高危因素。因此,临床医生应提高对此类疾病认识和警惕,重视病理检查,一旦出现难以逆转的低氧血症、肺动脉高压等临床表现,应及时与家属沟通尽量行肺活检或在患儿死亡后尸检;在病理检查中,注意寻找PVD的改变,必要时行血管标志物免疫组化和六胺银特殊染色,以免漏诊该病。
| [1] | Lakshminrusimha S, Saugstad OD. The fetal circulation, pathophysiology of hypoxemic respiratory failure and pulmonary hypertension in neonates, and the role of oxygen therapy[J]. J Perinatol, 2016, 36 (Suppl 2): S3-S11. |
| [2] | Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants-2013 update[J]. Neonatology, 2013, 103 (4): 353-68. DOI: 10.1159/000349928. |
| [3] | Goepel W, Kribs A, Ziegler A, et al. Avoidance of mechanical ventilation by surfactant treatment of spontaneously breathing preterm infants (AMV): an open-label, randomised, controlled trial[J]. Lancet, 2011, 378 (9803): 1627-34. DOI: 10.1016/S0140-6736(11)60986-0. |
| [4] | Konduri GG, Kim UO. Advances in the diagnosis and management of persistent pulmonary hypertension of the newborn[J]. Pediatr Clin North Am, 2009, 56 (3): 579-600, Table of Contents. DOI: 10.1016/j.pcl.2009.04.004. |
| [5] | Steinhorn RH. Advances in neonatal pulmonary hypertension[J]. Neonatology, 2016, 109 (4): 334-44. DOI: 10.1159/000444895. |
| [6] | Archer SL, Weir EK, Wilkins MR. Basic science of pulmonary arterial hypertension for clinicians: new concepts and experimental therapies[J]. Circulation, 2010, 121 (18): 2045-66. DOI: 10.1161/CIRCULATIONAHA.108.847707. |
| [7] | 杜立中. 新生儿持续肺动脉高压诊治的若干进展[J]. 临床儿科杂志, 2006, 24 (11): 869-72. DOI: 10.3969/j.issn.1000-3606.2006.11.003. |
| [8] | Cerro MJ, Abman S, Diaz G, et al. A consensus approach to the classification of pediatric pulmonary hypertensive vascular disease: Report from the PVRI Pediatric Taskforce, Panama 2011[J]. Pulm Circ, 2011, 1 (2): 286-98. DOI: 10.4103/2045-8932.83456. |
| [9] | 李宁, 周新华, 陈红武, 等. 肺泡毛细血管发育不良一例报告并文献复习[J]. 中华儿科杂志, 2010, 48 (9): 674-9. |
| [10] | 桑葵, 周英, 李明霞. 缺氧性肺动脉高压新生大鼠肺血管重塑的研究[J]. 中国当代儿科杂志, 2012, 14 (3): 210-4. |
| [11] | Abman SH, Baker C, Gien J, et al. The robyn barst memorial lecture: differences between the fetal, newborn, and adult pulmonary circulations: relevance for age-specific therapies (2013 grover conference series)[J]. Pulm Circ, 2014, 4 (3): 424-40. DOI: 10.1086/677371. |
| [12] | Abman SH. Bronchopulmonary dysplasia: "a vascular hypothesis"[J]. Am J Respir Crit Care Med, 2001, 164 (10 Pt 1): 1755-6. |
| [13] | Thébaud B, Abman SH. Bronchopulmonary dysplasia: where have all the vessels gone? Roles of angiogenic growth factors in chronic lung disease[J]. Am J Respir Crit Care Med, 2007, 175 (10): 978-85. DOI: 10.1164/rccm.200611-1660PP. |
| [14] | Stevens T, Phan S, Frid MG, et al. Lung vascular cell heterogeneity: endothelium, smooth muscle, and fibroblasts[J]. Proc Am Thorac Soc, 2008, 5 (7): 783-91. DOI: 10.1513/pats.200803-027HR. |
| [15] | Farkas L, Gauldie J, Voelkel NF, et al. Pulmonary hypertension and idiopathic pulmonary fibrosis: a tale of angiogenesis, apoptosis, and growth factors[J]. Am J Respir Cell Mol Biol, 2011, 45 (1): 1-15. DOI: 10.1165/rcmb.2010-0365TR. |
| [16] | Delaney C, Gien J, Roe G, et al. Serotonin contributes to high pulmonary vascular tone in a sheep model of persistent pulmonary hypertension of the newborn[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 304 (12): L89-901. |
| [17] | Jakkula M, Le Cras TD, Gebb S, et al. Inhibition of angiogenesis decreases alveolarization in the developing rat lung[J]. Am J Physiol Lung Cell Mol Physiol, 2000, 279 (3): L600-7. |
| [18] | Le Cras TD, Markham NE, Tuder RM, et al. Treatment of newborn rats with a VEGF receptor inhibitor causes pulmonary hypertension and abnormal lung structure[J]. Am J Physiol Lung Cell Mol Physiol, 2002, 283 (3): L555-62. DOI: 10.1152/ajplung.00408.2001. |
| [19] | Michalsky MP, Arca MJ, Groenman F, et al. Alveolar capillary dysplasia: a logical approach to a fatal disease[J]. J Pediatr Surg, 2005, 40 (7): 1100-5. DOI: 10.1016/j.jpedsurg.2005.03.067. |
| [20] | Alameh J, Bachiri A, Devisme L, et al. Alveolar capillary dysplasia: a cause of persistent pulmonary hypertension of the newborn[J]. Eur J Pediatr, 2002, 161 (5): 262-6. DOI: 10.1007/s00431-002-0927-7. |
| [21] | Bishop NB, Stankiewicz P, Steinhorn RH. Alveolar capillary dysplasia[J]. Am J Respir Crit Care Med, 2011, 184 (2): 172-9. DOI: 10.1164/rccm.201010-1697CI. |
| [22] | Hislop AA. Airway and blood vessel interaction during lung development[J]. J Anat, 2002, 201 (4): 325-34. DOI: 10.1046/j.1469-7580.2002.00097.x. |
| [23] | Galambos C, Demello DE. Molecular mechanisms of pulmonary vascular development[J]. Pediatr Dev Pathol, 2007, 10 (1): 1-17. DOI: 10.2350/06-06-0122.1. |
| [24] | Yu S, Shao L, Kilbride H, et al. Haploinsufficiencies of FOXF1 and FOXC2 genes associated with lethal alveolar capillary dysplasia and congenital heart disease[J]. Am J Med Genet A, 2010, 152A (5): 1257-62. DOI: 10.1002/ajmg.a.v152a:5. |
| [25] | Tibballs J, Chow CW. Incidence of alveolar capillary dysplasia in severe idiopathic persistent pulmonary hypertension of the newborn[J]. J Paediatr Child Health, 2002, 38 (4): 397-400. DOI: 10.1046/j.1440-1754.2002.00014.x. |
| [26] | Melly L, Sebire NJ, Malone M, et al. Capillary apposition and density in the diagnosis of alveolar capillary dysplasia[J]. Histopathology, 2008, 53 (4): 450-7. DOI: 10.1111/his.2008.53.issue-4. |
| [27] | Razak A, Mohanty PK, Nagesh NK. Alveolar capillary dysplasia as a cause of persistent pulmonary hypertension[J]. Indian Pediatr, 2015, 52 (11): 984-6. DOI: 10.1007/s13312-015-0759-y. |
 2017, Vol. 37
2017, Vol. 37

