2. 南方医科大学珠江医院心血管内科,广东 广州 510280;
3. 南方医科大学珠江医院肾内科,广东 广州 510280
2. Department of Cardiology, Zhujiang Hospital, Southern Medical University, Guangzhou 510280, China;
3. Department of Nephrology, Zhujiang Hospital, Southern Medical University, Guangzhou 510280, China
糖尿病性心肌病(DCM)作为糖尿病心血管并发症之一,由于其随后出现的心力衰竭并最终增加死亡率,已经受到越来越多的关注。许多研究表明各种不同机制参与了DCM的形成,包括微血管病变、氧化损伤、心脏肾素血管紧张素系统(RAS)激活, 心脏炎症,纤维化及凋亡[1-4]。其中炎症反应在DCM的发病和进展中起到了关键作用[5-6],心肌炎症可以直接和间接引起心脏组织损伤[7]。重视DCM的炎症反应可充分地促进该病的治疗。
db/db小鼠是目前国际上较常用的研究DCM的动物模型之一[8-10]。在糖尿病中,循环RAS被抑制[11]。脏RAS被激活[3],而心脏RAS的激活是心力衰竭发展中的关键因素[12-13]。AngⅡ是RAS的最重要组成部分,其在糖尿病诱导的器官损伤中具有重要作用[14]。Sarman等[15]研究发现,慢性的AngⅡ输注可增加大鼠左室NF-κB/DNA结合活性。Ang Ⅱ受体阻断剂(ARB)具有抑制AngⅡ的作用,已被广泛用作抗高血压药物,拥有阻滞AngⅡ1型受体阻滞剂(AT1R)的非血流动力学的心血管保护作用[16-17]。目前厄贝沙坦对心脏组织AngⅡ的抑制作用已明确,但其对糖尿病心肌病炎症反应的研究报道极少。本文旨在探讨厄贝沙坦对2型糖尿病db/db小鼠心肌组织炎症反应的保护作用,并初步探讨其心脏保护机制。
1 材料和方法 1.1 动物模型及分组10周龄db/db小鼠24只,雌雄各半(自发性2型DCM动物模型);同窝出生的10周龄db/+小鼠12只(正常对照组),雌雄各半。动物来源:南京大学-南京生物医药研究院,许可证号:SCXK(苏)2015-0001。(db/db、db/+)小鼠要求同龄、同批;db/+小鼠为正常对照组、db/ db小鼠随机分组为模型组、厄贝沙坦治疗组,各组均雌雄各半,根据文献实验结果[18],厄贝沙坦的剂量考虑为50 mg/(kg·d)。
1.2 主要仪器、药物及试剂主要仪器:由南方医科大学中医药学院提供;药物:厄贝沙坦(批号:5A173 Sanofi Winthrop industrie)主要试剂:P-IκBα(Ser32/36)小鼠源单克隆抗体(1:1000;货号:9246S美国Cell Signaling Technology);IκBα小鼠源单克隆抗体(1:1000;货号:4814P美国Cell Signaling Technology);β-actin小鼠源单克隆抗体(1: 1000;货号:E021020美国Earthox LLC);NF-κB p65小鼠源单克隆抗体(1:400;货号:6956S美国Cell Signaling Technology)。PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)(货号:RR047A大连TaKaRa公司);SYBR®Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)(货号:TRR820A大连TaKaRa公司)。
1.3 给药方法根据文献方法做适当修改,简单概述如下:厄贝沙坦溶于生理盐水中每日1次灌服(正常对照组、DCM模型对照组小鼠灌服等容积生理盐水)。实验期间所有动物普通饲料喂养,自由进食、进水,12 h交替照明[19]。
1.4 检测指标及方法16周后实验结束时,记录体质量,1%戊巴比妥钠腹腔注射麻醉,摘除小鼠眼球取血,制备血清,用Olimpus AU 600全自动生化分析仪测定空腹血糖(FBG)、血总胆固醇(TC)、血甘油三酯(TG)、取出心脏,PBS冲洗,吸水纸吸干,用电子天平精确称心脏质量,并垂直于心脏左室长轴横切成3块,被止血钳夹伤的心尖部分,存于冻存管,液氮速冻,-80 ℃保存,留作Western bloting检测;约1 mm厚度的中间部分,放入4%多聚甲醛固定,常规脱水石蜡包埋、切片,留作HE染色和P65免疫组化检测;余下部分放入RNA保护液,存于液氮罐,留作Real-time Quantitative PCR实验。
1.5 心肌组织HE染色观察小鼠心脏病理学改变,取材、固定、脱水透明、浸蜡、包埋、切片厚约4 μm、贴片、染色和封固,光镜下,观察小鼠心肌组织的一般形态结构。
1.6 免疫组化检测60 ℃烤石蜡切片,脱蜡,水化,微波修复抗原后,3%过氧化氢灭活内源性过氧化物酶, 正常山羊血清封闭非特异性抗原,室温20 min,滴加适当稀释的Ⅰ抗,4 ℃过夜,PBST洗片,滴加生物素标记的Ⅱ抗,37 ℃ 20 min,显微镜下控制DAB显色,苏木素复染(30 s),水洗,用盐酸酒精分化3 s,流水浸15 min,脱水、透明,中性树胶封片。显微镜拍照保存。使用Image-Pro Plus 6.0软件作统计分析,以P65阳性区域总积分光密度/总面积(%)[IOD sum/Area sum(%)]测量染色强度,阳性染色越深,该比值越大。
1.7 Western blotting检测取20 mg心肌组织,加入200 μL RIPA裂解液和2 μL PMSF并剪碎其中组织,冰上超声粉碎,12 000 r/min离心30 min,取上清,用BCA法测定蛋白质浓度,以2 μg/μL的标准蛋白为标准品,将样本蛋白浓度稀释50倍,计算出样本浓度,用10% SDS-聚丙烯酰胺凝胶电泳,每个泳道蛋白上样量为50 μg,转移至PVDF膜,5%脱脂牛奶室温封闭1 h;TBST冲洗;将膜放入I抗中4 ℃过夜,TBST冲洗,Ⅱ抗中室温孵育1 h,蛋白条带曝光,捕获并记录蛋白质条带。使用Adobe Photoshop CS5进行条带灰度值计算。
1.8 实时荧光定量测定实时荧光定量(qPCR)测定IL-6和TNF-α的转录水平。用RNAiso Plus(Takara)提取小鼠心脏总RNA。去除基因组DNA,按PrimeScriptTMRT reagent试剂盒(Takara)操作说明进行,10 μL反应体系。RT Primer Mix合成样品中的各种cDNA,SYBR® Green qPCR法,共20 μL反应体系。qPCR引物由武汉谷歌生物公司合成,IL-6上游引物:5'-TAGTCCTTCCTACCC CAATTTCC-3',下游引物:5'-TTGGTCCTTAGCCA CTCCTTC-3';TNF-α上游引物:5'-CCTGTAGCCCAC GTCGTAG-3',下游引物:5'-GGGAGTAGACAAGGT ACAACCC-3';β-actin上游引物:5'-GTGACGTTGAC ATCCGTAAAGA-3',下游引物:5'-GTAACAGTCCGC CTAGAAGCAC-3'。使用SYBR® Premix Ex Taq TM Ⅱ型qPCR,25 μL体系包括:SYBR酶混合液(TAKARA)12.5 μL,PCR上下游引物(10 μmol/L)各1 μL,cDNA模板2 μL,dH2O 8.5 μL。反应条件:95 ℃ 30s,一个循环;95 ℃ 15 s,60 ℃ 20 s,40个循环;95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s,一个循环。mRNA表达用2-∆∆Ct表示。
1.9 统计学方法采用SPSS20.0统计软件进行分析,计量资料用均数±标准差表示,采用单因素方差分析,方差齐时,采用LSD法进行组间多重比较,方差不齐时,采用Dunnett's T3方法进行组间多重比较。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况及生化指标变化取心脏标本时,因操作失误,正常组心脏丢失1个。部分小鼠取血量小无法检测出空腹血糖(FBG)、血总胆固醇(TC)或血甘油三酯(TG)值。最终各指标完成实验检测的小鼠数量分别为正常组9只,模型组12只,厄贝沙坦治疗组10只。小鼠HWT各组无差异;模型组和厄贝沙坦治疗组的BWT、FBG、TC和TG均高于正常组(表 1)。
| 表 1 db/db小鼠一般情况及生化指标 Table 1 Effect of irbesartan on heart weight, body weight and serum biochemical parameters in db/db mouse (Mean±SD) |
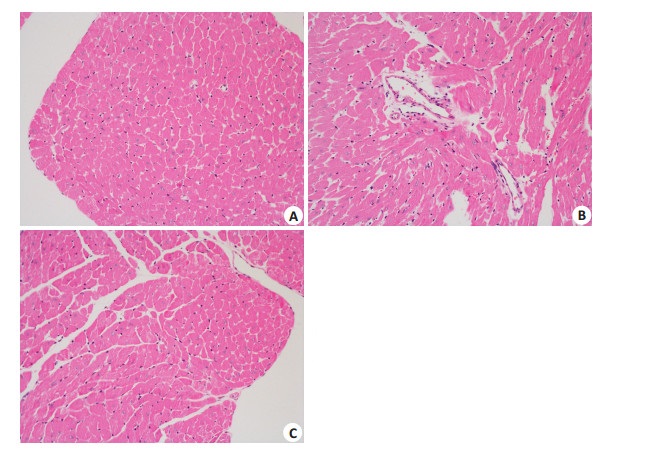
HE染色可见,正常组小鼠心肌心内膜正常、细胞排列整齐、致密,结构清晰,细胞外间质较少。模型组小鼠心肌心内膜退化、细胞排列紊乱、心肌细胞肥大,细胞间隙增大,间质和血管周围细胞外基质增多,并有炎症细胞浸润。厄贝沙坦治疗后有所改善,细胞排列较整齐,结构较清晰,炎症细胞浸润、心肌细胞大小、细胞外间质均减少(图 1)。
|
图 1 左室各组心肌组织HE染色 Figure 1 HE staining of the left ventricular myocardial tissue in different groups (Original magnification: ×200). A: db/+; B: db/ db; C: db/db+irbesartan. |
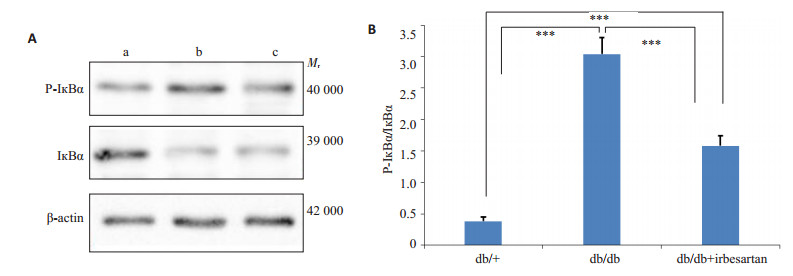
与正常组相比,糖尿病组心肌组织P-IкBα增加,IкBα被明显降解,P-IкBα/IкBα比值升高P < 0.001(P= 0.000002),导致P65入核激活。厄贝沙坦治疗使其得到改善P < 0.001(P=0.000061 vs db/db;P=0.000184 vs db/+),正常组、模型组和厄贝沙坦治疗组的P-IкBα/ IкBα比值分别为0.38±0.07,3.04±0.26,1.58±0.16(图 2)。
|
图 2 心肌组织P-IкBα,IкBα蛋白表达 Figure 2 Effect of irbesartan on P-IкBα and IкBα protein expression in the myocardial tissue. A: Western blotting (a: db/+; b: db/db; c: db/db+irbesartan); B: Semi-quantitative analysis of P-IкBα/IкBα protein expression. ***P < 0.001 (n=3). |
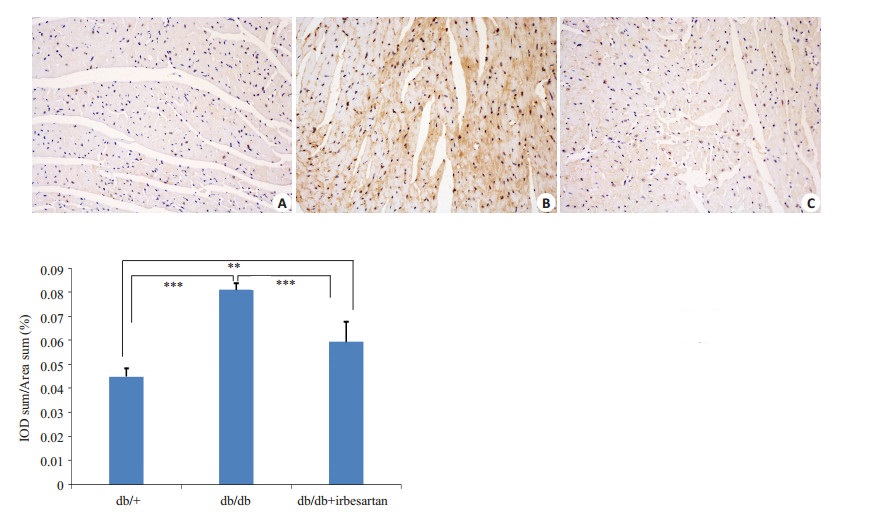
正常组小鼠心肌组织胞质内未见明显棕黄色P65表达;模型组心肌组织胞质内棕黄色P65表达增加,并入核激活明显P < 0.001(P=0.000000 vs db/+);厄贝沙坦治疗后P65表达降低,入核激活减少,效果介于两者之间P < 0.01(P=0.000046 vs db/db;P=0.001458 vs db/+);正常组、模型组和厄贝沙坦治疗组的IOD sum/Area sum(%)比值分别为4.49±0.34,8.09±0.28,5.93±0.85(图 3)。
|
图 3 各组小鼠心肌组织P65免疫组化及P65阳性区域总积分光密度/总面积(%) Figure 3 Activity and expression of p65 assessed by immunohistochemistry in different groups (× 200). A: db/+; B: db/db; C: db/db + irbesartan and semi-quantitative analysis of P65 measured by IOD sum/area sum (%). **P < 0.01, ***P < 0.001 (n=5). |
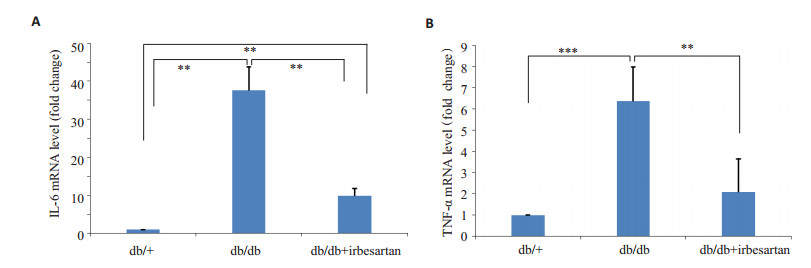
与正常组相比,模型组IL-6和TNF-α mRNA水平均明显升高P < 0.01(IL-6:P=0.003157;TNF-α:P= 0.000246)。与模型组比较,厄贝沙坦治疗组的db/db小鼠心肌组织IL-6和TNF-α mRNA水平均有所下降P < 0.01(IL-6:P=0.004188;TNF-α:P=0.001170,图 4)。
|
图 4 各组小鼠心肌组织IL-6,TNF-α mRNA表达 Figure 4 Expression of IL-6 (A) and TNF-α (B) mRNA in the myocardial tissues. **P < 0.01,***P < 0.001 (n=4). |
高血糖诱导的心肌组织炎症反应对心脏损伤至关重要, 因此,降低心肌组织炎症反应有利于糖尿病性心肌病的治疗[5, 20-21]。我们目前的研究旨在探究厄贝沙坦抑制高血糖诱导的心肌炎症反应是否可能与抑制心脏AngⅡ的作用和NF-кB通路有关。本研究中db/db小鼠心肌组织NF-кB通路被激活,诱导了IL-6、TNF-α mRNA表达,促进了心肌组织炎症反应;厄贝沙坦的慢性治疗抑制了db/db小鼠心肌组织NF-κB通路,并下调IL-6、TNF-α mRNA表达,改善了心肌组织炎症反应,但均未明显恢复至正常水平,可能与ARB仅能抑制心脏细胞外AngⅡ的作用有关[3]。心脏RAS与NF-кB通路可能共同参与了高血糖诱导的心肌组织炎症反应,而且心脏RAS可能是NF-кB通路的上游靶点之一。
有研究表明,在12周龄时,2型糖尿病db/db小鼠会形成肥胖、高血糖、高血脂等代谢异常情况[9]。本研究中,一般情况及生化指标检测显示,2型糖尿病db/db小鼠也出现了上述严重的代谢异常情况,即肥胖、高血糖、高血脂,而厄贝沙坦治疗后,db/db小鼠BWT、FBG、TC和TG水平均未下降。这些结果表明,厄贝沙坦的慢性治疗对db/db小鼠的糖脂代谢不产生影响。
NF-кB是一种重要的转录因子和关键炎症基因调节剂,阻断NF-кB通路具有多重的抗炎作用。Watanabe等[22]研究发现,厄贝沙坦可抑制心肌梗死伴肾衰竭大鼠心脏的炎症,减少心脏炎症相关蛋白NF-κB的激活,改善心功能障碍,发挥了心脏保护作用。Wen等[23]发现,具有抗炎作用的雷公藤内酯通过抑制NF-κB的活性和表达,明显改善了心脏炎症和纤维化,最终改善了DCM的大鼠左室功能。而IκBα是一种关键蛋白,在静息期,NF-κB未被激活时与IκBα形成一个复合物,以无活性状态存在于细胞质中。当炎症因子存在的情况下,NF-κB被激活,IκBα被磷酸化,随后被泛素-蛋白酶体途径降解。NF-κB和IκBα解聚后,其核定位序列被暴露,从而被转运到细胞核内促进NF-κB依赖的基因转录[24]。因此,通过Western blot检测IκBα是否被磷酸化激活而显著降解,是检测NF-κB是否激活的一个重要指标,而P65的免疫组化结果更能直观反映NF-κB的激活和表达情况。本研究Western blot和P65免疫组化结果显示:与正常组相比,模型组小鼠心肌组织的P-IкBα蛋白水平升高,IкBα蛋白水平降低,P-IкBα/IкBα明显升高,大量P65释放入核激活。说明2型糖尿病db/db小鼠心肌组织NF-кB通路被激活,这与Khanra等在2型糖尿病大鼠模型心脏组织中的发现一致[25]。与模型组比较,厄贝沙坦治疗组的db/db小鼠心肌组织的P-IкBα蛋白水平减低,IκBα蛋白水平升高,P-IкBα/IκBα明显降低,P65释放入核激活受到抑制。提示厄贝沙坦的慢性治疗可以抑制2型糖尿病心肌组织NF-κB信号通路。
有研究表明,ARB通过抑制心脏组织促炎细胞因子白细胞介素(IL)-1β蛋白含量,减少心脏炎症,改善DCM的心力衰竭[26]。Westermann等[27]研究证实,P38药理学抑制心肌组织促炎细胞因子TNF-α,IL-6,IL-1β的蛋白质含量,可预防心脏炎症并改善DCM的左室功能障碍。也有人报道,实验性DCM的心脏功能障碍与心脏炎症有关,白介素转化酶抑制剂治疗减轻了心脏功能障碍和心脏炎症,表明基于抗细胞因子的疗法可能有益于DCM [28]。可见抑制心肌组织促炎细胞因子表达可改善心肌组织炎症反应。我们的qPCR的研究结果表明,与正常组相比,模型组的IL-6、TNF-α mRNA表达水平升高。说明2型糖尿病诱导了心肌组织IL-6、TNF-α mRNA表达,促进了心肌组织炎症反应。与模型组比较,厄贝沙坦治疗组的IL-6、TNF-α mRNA表达水平降低,而且厄贝沙坦的慢性治疗可以抑制2型糖尿病心肌组织NF-κB信号通路。提示厄贝沙坦的慢性治疗抑制了心肌组织促炎细胞因子IL-6、TNF-α mRNA表达,改善心脏炎症反应,其机制可能与NF-кB通路有关。本研究的心脏病理形态学观察亦显示,未治疗的糖尿病小鼠心肌组织炎症细胞侵润明显,肌纤维结构模糊,排列紊乱,间隙增大, 而厄贝沙坦慢性治疗后,改善了2型糖尿病db/db小鼠心肌组织病理学变化。
在本实验中,我们还发现厄贝沙坦的慢性治疗虽然改善了DCM的心肌组织炎症反应和病理学变化,但均未明显恢复至正常水平,包括P-IкBα、IкBα蛋白表达,P65的免疫组化,IL-6、TNF-α mRNA的表达等半定量指标。已知高血糖可激活心脏RAS系统[3]。AngⅡ是RAS的最重要组成部分,其在糖尿病诱导的器官损伤中具有重要作用[14]。研究表明,高葡萄糖诱导的AngⅡ在心肌细胞内完全保留并移位到细胞核,而心脏成纤维细胞在细胞内和细胞外均合成AngⅡ,而细胞内AngⅡ的作用不被ARB阻断,因此,ARB仅阻断由心脏成纤维细胞胞外合成的和由胞内合成分泌在细胞外部分的Ang Ⅱ的作用,表明这些药物在高血糖状态中对心脏产生的AngⅡ的作用仅有部分功效[29]。即ARB仅能部分抑制DCM中的心脏RAS活化[3]。Nakano等[22]研究发现厄贝沙坦抑制心肌梗死伴肾衰竭大鼠心脏的炎症,减少了心脏炎症相关蛋白NF-κB的激活,发挥了心脏保护作用。有人报道,在糖尿病心脏中,NF-κB信号通路和RAS被强烈激活,从而促进心肌炎症反应[7]。同时也有人报道,慢性的AngⅡ输注增加大鼠左室NF-κB/DNA结合活性,而NF-κB抑制剂吡咯烷二硫代氨基甲酸酯(PDTC)消除了AngⅡ诱导的NF-κB活化和随后的TNF-α基因表达的增加,减弱了AngⅡ诱导的左室重塑[15]。可见,AngⅡ的作用和NF-кB信号通路关系密切。提示心脏RAS与NF-кB通路可能共同参与了2型糖尿病高血糖诱导的心肌组织促炎细胞因子的产生。ARB可部分抑制的心脏RAS可能是NF-кB通路的上游靶点之一。因此出现了厄贝沙坦的慢性治疗虽然改善了DCM的心肌组织炎症反应和病理学变化,但均未明显恢复至正常水平。
总之,厄贝沙坦的慢性治疗对心脏具有保护作用,ARB可能通过部分抑制心脏RAS,抑制AngⅡ的作用,影响了NF-κB(P65)的转录活性,进而抑制促炎细胞因子IL-6、TNF-a mRNA转录表达,减轻DCM心肌组织炎症反应,从而改善心肌组织的病理学变化,为临床干预DCM的发生和发展提供基础理论依据。但心脏RAS与NF-κB通路两者之间的相互作用机制尚有待进一步探讨,此外,小鼠施用胰岛素辅助性治疗可能是人类DCM的更好模型,因此必须评估胰岛素治疗对ARB效应的影响。
| [1] | Rani N, Bharti S, Bhatia J, et al. Chrysin, a PPAR-γ agonist improves myocardial injury in diabetic rats through inhibiting AGE-RAGE mediated oxidative stress and inflammation[J]. Chem Biol Interact, 2016, 250 : 59-67. DOI: 10.1016/j.cbi.2016.03.015. |
| [2] | Hotamisligil GS. Inflammation and metabolic disorders[J]. Nature, 2006, 444 (7121): 860-7. DOI: 10.1038/nature05485. |
| [3] | Dong B, Yu QT, Dai HY, et al. Angiotensin-converting enzyme-2 overexpression improves left ventricular remodeling and function in a rat model of diabetic cardiomyopathy[J]. J Am Coll Cardiol, 2012, 59 (8): 739-47. DOI: 10.1016/j.jacc.2011.09.071. |
| [4] | Thomas CM, Yong QC, Rosa RM, et al. Cardiac-specific suppression of NF-κB signaling prevents diabetic cardiomyopathy via inhibition of the renin-angiotensin system[J]. Am J Physiol Heart Circ Physiol, 2014, 307 (7): H1036-45. DOI: 10.1152/ajpheart.00340.2014. |
| [5] | Khan S, Zhang D, Zhang Y, et al. Wogonin attenuates diabetic cardiomyopathy through its anti-inflammatory and anti-oxidative properties[J]. Mol Cell Endocrinol, 2016, 428 : 101-8. DOI: 10.1016/j.mce.2016.03.025. |
| [6] | Lorenzo O, Picatoste B, Ares-Carrasco S, et al. Potential role of nuclear factor κB in diabetic cardiomyopathy[J]. Mediators Inflamm, 2011 : 652097. |
| [7] | Frati G, Schirone L, Chimenti I, et al. An overview of the inflammatory signalling mechanisms in the myocardium underlying the development of diabetic cardiomyopathy[J]. Cardiovasc Res, 2017, 113 (4): 378-88. DOI: 10.1093/cvr/cvx011. |
| [8] | Bugger H, Abel ED. Rodent models of diabetic cardiomyopathy[J]. Dis Model Mech, 2009, 2 (9/10): 454-66. |
| [9] | Plante E, Menaouar A, Danalache BA, et al. Oxytocin treatment prevents the cardiomyopathy observed in obese diabetic male db/db mice[J]. Endocrinology, 2015, 156 (4): 1416-28. DOI: 10.1210/en.2014-1718. |
| [10] | He Q, Pu J, Yuan A, et al. Liver X receptor agonist treatment attenuates cardiac dysfunction in type 2 diabetic db/db mice[J]. Cardiovasc Diabetol, 2014, 13 : 149. DOI: 10.1186/s12933-014-0149-0. |
| [11] | Giacchetti G, Sechi LA, Rilli S, et al. The renin-angiotensin-aldosterone system, glucose metabolism and diabetes[J]. Trends Endocrinol Metab, 2005, 16 (3): 120-6. DOI: 10.1016/j.tem.2005.02.003. |
| [12] | Sun Y. Intracardiac renin-angiotensin system and myocardial repair/ remodeling following infarction[J]. J Mol Cell Cardiol, 2010, 48 (3): 483-9. DOI: 10.1016/j.yjmcc.2009.08.002. |
| [13] | Zhang Y, Shao L, Ma A, et al. Telmisartan delays myocardial fibrosis in rats with hypertensive left ventricular hypertrophy by TGF-β1/Smad signal pathway[J]. Hypertens Res, 2014, 37 (1): 43-9. DOI: 10.1038/hr.2013.119. |
| [14] | Connelly KA, Boyle AJ, Kelly DJ. Angiotensin Ⅱ and the cardiac complications of diabetes mellitus[J]. Curr Pharm Des, 2007, 13 (26): 2721-9. DOI: 10.2174/138161207781662984. |
| [15] | Sármán B, Skoumal R, Leskinen H, et al. Nuclear factor-kappaB signaling contributes to severe, but not moderate, angiotensin Ⅱ-induced left ventricular remodeling[J]. J Hypertens, 2007, 25 (9): 1927-39. DOI: 10.1097/HJH.0b013e3281e66653. |
| [16] | Nagasawa K, Takahashi K, Matsuura N, et al. Comparative effects of valsartan in combination with cilnidipine or amlodipine on cardiac remodeling and diastolic dysfunction in Dahl salt-sensitive rats[J]. Hypertens Res, 2015, 38 (1): 39-47. DOI: 10.1038/hr.2014.136. |
| [17] | Akazawa H, Yabumoto C, Yano M, et al. ARB and cardioprotection[J]. Cardiovasc Drugs Ther, 2013, 27 (2): 155-60. DOI: 10.1007/s10557-012-6392-2. |
| [18] | Liu X, Xu Q, Wang X, et al. Irbesartan ameliorates diabetic cardiomyopathy by regulating protein kinase D and ER stress activation in a type 2 diabetes rat model[J]. Pharmacol Res, 2015, 93 : 43-51. DOI: 10.1016/j.phrs.2015.01.001. |
| [19] | 龙海波, 张辉, 钟娟, 等. 肾康丸对早期糖尿病肾病大鼠足细胞损伤的保护作用[J]. 南方医科大学学报, 2008, 28 (7): 1268-72. |
| [20] | Fang Q, Wang J, Wang L, et al. Attenuation of inflammatory response by a novel chalcone protects kidney and heart from hyperglycemia-induced injuries in type 1 diabetic mice[J]. Toxicol Appl Pharmacol, 2015, 288 (2): 179-91. DOI: 10.1016/j.taap.2015.07.009. |
| [21] | Raja L, Palanivelu S, Panchanatham S. Anti-inflammatory property of Kalpaamruthaa on myocardium in type 2 diabetes mellitus induced cardiovascular complication[J]. Immunopharmacol Immunotoxicol, 2013, 35 (1): 119-25. DOI: 10.3109/08923973.2012.712138. |
| [22] | Watanabe R, Suzuki J, Wakayama K, et al. Angiotensin Ⅱ receptor blocker irbesartan attenuates cardiac dysfunction induced by myocardial infarction in the presence of renal failure[J]. Hypertens Res, 2016, 39 (4): 237-44. DOI: 10.1038/hr.2015.141. |
| [23] | Wen HL, Liang ZS, Zhang R, et al. Anti-inflammatory effects of triptolide improve left ventricular function in a rat model of diabetic cardiomyopathy[J]. Cardiovasc Diabetol, 2013, 12 : 50. DOI: 10.1186/1475-2840-12-50. |
| [24] | Ting AY, Endy D. Signal transduction. Decoding NF-kappaB signaling[J]. Science, 2002, 298 (5596): 1189-90. DOI: 10.1126/science.1079331. |
| [25] | Khanra R, Dewanjee S, K Dua T, et al. Abroma Augusta L. (malvaceae) leaf extract attenuates diabetes induced nephropathy and cardiomyopathy via inhibition of oxidative stress and inflammatory response[J]. J Transl Med, 2015, 13 : 6. DOI: 10.1186/s12967-014-0364-1. |
| [26] | Westermann D, Rutschow S, Jäger S, et al. Contributions of inflammation and cardiac matrix metalloproteinase activity to cardiac failure in diabetic cardiomyopathy: the role of angiotensin type 1 receptor antagonism[J]. Diabetes, 2007, 56 (3): 641-6. DOI: 10.2337/db06-1163. |
| [27] | Westermann D, Rutschow S, Van Linthout S, et al. Inhibition of p38 mitogen-activated protein kinase attenuates left ventricular dysfunction by mediating pro-inflammatory cardiac cytokine levels in a mouse model of diabetes mellitus[J]. Diabetologia, 2006, 49 (10): 2507-13. DOI: 10.1007/s00125-006-0385-2. |
| [28] | Westermann D, Van Linthout S, Dhayat S, et al. Cardioprotective and anti-inflammatory effects of interleukin converting enzyme inhibition in experimental diabetic cardiomyopathy[J]. Diabetes, 2007, 56 (7): 1834-41. DOI: 10.2337/db06-1662. |
| [29] | Singh VP, Baker KM, Kumar R. Activation of the intracellular renin-angiotensin system in cardiac fibroblasts by high glucose: role in extracellular matrix production[J]. Am J Physiol Heart Circ Physiol, 2008, 294 (4): H1675-84. DOI: 10.1152/ajpheart.91493.2007. |
 2017, Vol. 37
2017, Vol. 37

