2. 重庆医科大学临床检验诊断学教育部重点实验室,重庆 400010
2. Key Laboratory of Diagnostic Medicine of the Ministry of Education, Chongqing Medical University, Chongqing 400010, China
急性肺损伤 (ALI) 主要由中性粒细胞介导的炎症反应触发,IL-17可以调节中性粒细胞的增殖、成熟和趋化,相关炎症-免疫机制可能为ALI新的调控靶点[1-2]。在由感染引起的患者和脂多糖 (LPS) 诱导的ALI动物模型中均可检测到IL-17的过度分泌[3-4]。前期研究发现,调控IL17相关的免疫应答有削弱炎症反应并改善ALI小鼠预后的作用[5-6]。但既往研究发现单纯的抗炎治疗获益有限,使用炎症因子拮抗剂或Toll样受体阻断剂并没有出现预期的降低死亡率的效果,是否IL-17还参与其他调控机制尚未可知[7-8]。肺泡上皮细胞是ALI时炎症损伤的主要靶点之一,其表面的钠通道 (ENaC) 蛋白缺失引起肺水清除受限最终导致的肺泡腔水肿液聚集是ALI时低氧血症难以纠正的重要原因[9-11]。我们以IL-17基因敲除鼠为主要研究对象,拟探讨IL-17在ALI小鼠肺水清除中的作用及可能机制。
1 材料和方法 1.1 动物分组及处理IL-17基因敲除鼠共享于重庆医科大学检验医学院,以C57BL/6小鼠为背景。选取6~8周龄、清洁级、雄性、18~20 g/只的IL-17基因敲除鼠和C57BL/6鼠各16只,随机各等分为两组 (一共4组,每组8只),分别给与磷酸缓冲盐溶液 (PBS) 和脂多糖 (LPS) 处理,即小鼠称体质量后,腹腔注射4%水合氯醛 (0.08 mL/10 g) 麻醉,气管内滴加PBS溶解的LPS (10 mg/kg)50 μL。其中,PBS处理组作为对照,LPS处理组为ALI动物模型的构建。在给药48 h后处死各组小鼠并收集各项标本。
1.2 药品与试剂LPS购自Sigma公司 (L4391 0111:B4)。钠通道α亚基 (α-ENaC) 和LKB1抗体购自abcam公司。检测IL-8水平的ELISA试剂盒购自R & D公司。余为国产分析纯。
1.3 支气管肺泡灌洗液中IL-8水平每组随机选取4只鼠,腹腔注射0.15 mL/10 g 4%水合氯醛麻醉,打开胸腔夹闭左肺,分离暴露气管并行气管插管。预冷PBS灌洗右肺,0.8 mL/次,共3次,总回收率80%以上为合格标本。所得支气管肺泡灌洗液 (BALF) 离心后取上层清液,ELISA法测定IL-8含量。
1.4 肺组织湿干质量比 (W/D)过量麻醉处死已行支气管肺泡灌洗的4只小鼠,剪取左肺,以滤纸轻轻吸干表面水分后称质量计湿质量 (W)。60°烤箱放置24 h后称质量计干质量 (D),计算湿干质量比 (W/D)。
1.5 肺组织病检每组未行支气管肺泡灌洗的其余4只小鼠过量麻醉处死,取左肺以10%的多聚甲醛固定,石蜡包埋,常规切片,HE染色,光镜下观察病理改变。采用Smith评分[12]方法由两位研究员对肺水肿、肺泡及间质炎症、肺泡及间质出血、肺不张和透明膜形成分别进行半定量分析:无损伤0分,病变范围 < 25%为1分,病变范围占25%~50%为2分,50% < 病变范围 < 75%为3分,病变满视野为4分,总分为上述各项之和。每个标本分析10个高倍视野,取其平均值。取两位研究员的平均分计算总肺损伤评分。
1.6 钠通道表达分析每组未行支气管肺泡灌洗的其余4只小鼠过量麻醉处死,取右肺提取膜蛋白,行Western blotting (WB) 法检测钠通道蛋白的表达。蛋白质电泳电转按常规进行,α-ENaC抗体 (1:500)4 ℃孵育过夜。PBST洗涤后二抗 (1:4000)37 ℃孵育2.5 h,再次PBST洗涤,然后ECL法显色成像,拍照留存。
1.7 LKB1免疫组化取石蜡标本,行4 μm连续切片,梯度酒精脱蜡复水,常规修复抗原处理后孵育LKB1一抗 (1:500)4 ℃过夜,同时以PBS代替一抗作阴性对照。孵育二抗 (1: 2000) 后DAB显色,苏木精复染细胞核,中性树脂封片,光镜下观察LKB1阳性表达情况。
1.8 统计学分析数据以均数±标准差表示,数据采集完毕后应用Graphpad 5.0软件进行数据分析。组间差异的比较采用单因素方差分析,双侧检验水准α=0.05,P < 0.05认为差异有统计学意义。
2 结果 2.1 肺组织湿干质量比 (W/D) 和IL-8水平两种鼠均接受PBS处理作为对照。分别经气管滴加LPS构建ALI动物模型。与各自对照组比较,两种鼠均有肺水集聚和炎症因子表达增加。但IL-17敲除鼠IL-8水平和肺内水肿液聚集均较IL-17野生型鼠减轻 (表 1)。
| 表 1 各组小鼠W/D值和IL-8水平 Table 1 W/D of the lungs and IL-8 in BALF in wild-type (WT) and IL-17-knockout (KO) mice challenged with PBS or LPS (n=4, Mean±SD) |
以PBS作空白处理的对照组鼠其肺组织能保持基本的肺泡结构完整。两组接受LPS处理的小鼠肺组织均可见炎症细胞浸润;肺泡壁断裂、融合;肺泡间隔水肿增厚;部分肺泡腔内可见均一的淡粉色水肿液集聚。而IL-17敲除型鼠比野生型鼠炎症反应轻,炎症细胞聚集不显著,肺泡腔内水肿液含量明显减少 (图 1)。
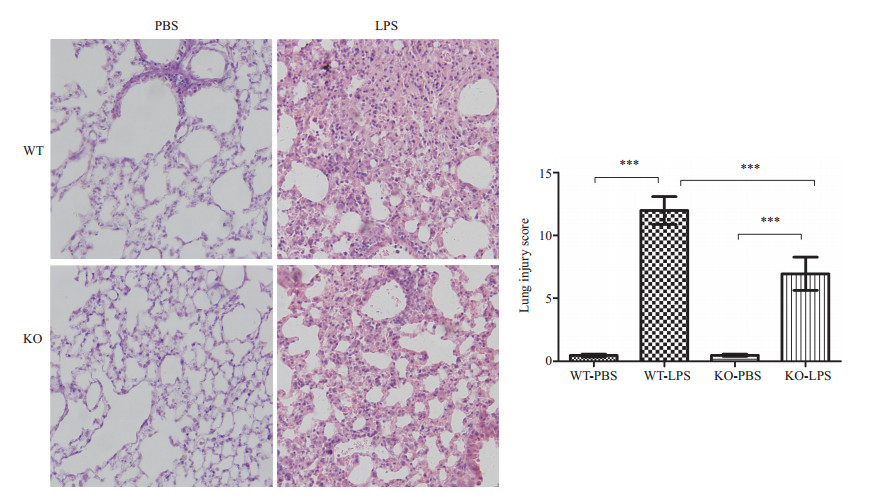
|
图 1 肺组织病理学光镜图及肺损伤Smith评分 Figure 1 Pathological examination of the lung tissues in wild-type (WT) and IL-17-knockout (KO) mice (HE staining, original magnification: ×200). ***P < 0.0001. |
PBS处理的对照组可见两种鼠的ENaC蛋白表达并无显著差异。而经LPS处理后,ENaC蛋白在IL-17野生型鼠的肺组织内表达显著减少,而敲除型鼠仅略有降低,仍维持着可观的丰度 (图 2)。
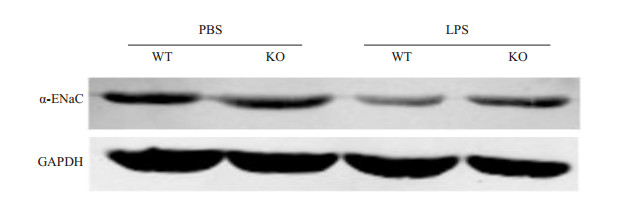
|
图 2 WB法测定钠通道表达清况 Figure 2 Expression level of α-ENaC detected by Western blotting in wild-type (WT) and IL-17-knockout (KO) mice. |
LKB1在肺组织中常规表达,经PBS处理的两组小鼠在此并无差异。而经LPS处理后,LKB1在野生型小鼠肺组织内表达显著降低,染成棕黄色的阳性细胞数比例大幅下降 (图 3)。
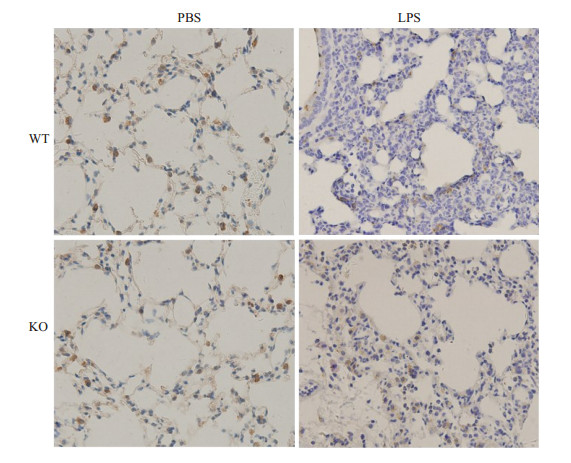
|
图 3 LKB1免疫组化染色结果 Figure 3 Immunohistochemical staining of LKB1 in WT and KO mice (×200). |
急性肺损伤的重要病理改变之一即富含蛋白的水肿液渗出并聚集于肺泡腔内,导致低氧血症顽固存在且难以纠正。过去常认为中性粒细胞介导的炎症损伤是引起肺通透性增加的主要原因[13]。现有研究支持Th17细胞具有卓越的募集中粒的功能。多项研究表明,削弱Th17细胞介导的免疫应答可以减轻ALI时肺内炎症,有一定的保护作用[14-15]。
新近研究发现,IL-17对ARDS/ALI时肺泡水肿液的清除 (AFC) 也有一定作用:中和ALI小鼠体内IL-17或敲除IL-17受体有降低肺通透性的保护作用,而外源IL-17A的刺激可以增加肺泡上皮细胞层的液体渗透[16]。IL-17A和TNF-α协同表达可促进Ⅱ型肺泡上皮细胞 (ATⅡ) 分泌CXCL5以募集中性粒细胞[17]。有趣的是,ATⅡ也是促进AFC的关键细胞,存在于ATⅡ顶膜的ENaC是转运肺泡腔内水肿液的限速环节[10]。ENaC由α、β、γ 3个亚基组成,因α亚基表达量最为丰富,我们以此为代表来衡量ENaC的表达。我们的研究发现,敲除IL-17对LPS诱导的ALI有一定保护作用,其α-ENaC的丢失较少,仍维持着较高水平的表达。这可能是IL-17敲除鼠发生ALI时肺泡腔内水肿液聚集减少的重要原因。
上皮细胞顶端-基底端 (A-B) 轴的正确建立是ENaC作为通道蛋白行使分泌功能的基础。LKB1属于丝氨酸/苏氨酸激酶,是公认的抑癌基因,通常认为与细胞增殖调控有关[18]。LKB1还可调控极性复合物的形成,是维持支气管上皮细胞顶膜极性的重要分子[19]。我们大胆假设:LKB1也是调控ENaC蛋白在ATⅡ上极性表达的关键分子。首先,LKB1与ENaC蛋白均常规表达于ATⅡ,我们的免疫组化结果也证实了这一点[20]。在BHD疾病模型中,LKB1丢失可引起ATⅡ表面张力增加,肺泡塌陷和肺功能受损[20]。其次,LKB1可与Nedd-4竞争结合14-3-3蛋白,使得ENaC降解减少[10, 21]。第三,我们前期研究发现mTORC1是调控Th17细胞活化和IL-17分泌的关键环节,而LKB1分子又处于mTORC1上游,其构建的LKB1-AMPK-mTORC1轴可能是链接IL-17和ENaC表达的桥梁[22]。研究结果可初步说明:小鼠在暴露于LPS时敲除IL-17可以负反馈激活并维持一定数量LKB1的表达,进而减少ENaC降解,促进肺水清除,发挥对ALI小鼠的保护作用。但LKB1对ENaC蛋白具体的极性调控还需进一步研究以待阐明。
另有研究报道,暴露于LPS环境的巨噬细胞内LKB1可发生亚硝基化和蛋白酶体降解[23]。革兰氏阴性杆菌是ALI时主要致病菌,而LPS恰恰是革兰氏阴性杆菌的最主要致病成分。不难理解,ALI时革兰氏阴性杆菌产生的大量LPS也是引起LKB1降低的元凶之一。
ALI病因复杂,死亡率居高不下,现行治疗手段有限。本研究发现IL-17除了有促进中性粒细胞募集活化的作用外,还对肺水清除有一定影响。中和ALI时过度表达的IL-17,维持极性调控分子LKB1的丰度以提高ATⅡ顶膜ENaC表达,促进肺水清除,可能是ALI治疗新的方向。
| [1] | Fossiez F, Djossou O, Chomarat P, et al. T cell interleukin-17 induces stromal cells to produce proinflammatory and hematopoietic cytokines[J]. J Exp Med, 1996, 183 (6): 2593-603. DOI: 10.1084/jem.183.6.2593. |
| [2] | Lee KY. Pneumonia, acute respiratory distress syndrome, and early Immune-Modulator therapy[J]. Int J Mol Sci, 2017, 18 (2): E388. DOI: 10.3390/ijms18020388. |
| [3] | Risso K, Kumar G, Ticchioni M, et al. Early infectious acute respiratory distress syndrome is characterized by activation and proliferation of alveolar T-cells[J]. Eur J Clin Microbiol Infect Dis, 2015, 34 (6): 1111-8. DOI: 10.1007/s10096-015-2333-x. |
| [4] | 刘军, 黄东亚, 于涛, 等. 急性肺损伤辅助性T细胞1和辅助性T细胞17失衡的研究[J]. 中华实验外科杂志, 2014, 31 (11): 2625-6. DOI: 10.3760/cma.j.issn.1001-9030.2014.11.092. |
| [5] | Yan Z, Xiaoyu Z, Zhixin S, et al. Rapamycin attenuates acute lung injury induced by LPS through inhibition of Th17 cell proliferation in mice[J]. Sci Rep, 2016, 6 : 20156. DOI: 10.1038/srep20156. |
| [6] | Li Q, Gu Y, Tu Q, et al. Blockade of interleukin-17 restrains the development of acute lung injury[J]. Scand J Immunol, 2016, 83 (3): 203-11. DOI: 10.1111/sji.2016.83.issue-3. |
| [7] | Riedemann NC, Guo RF, Ward PA. The enigma of sepsis[J]. J Clin Invest, 2003, 112 (4): 460-7. DOI: 10.1172/JCI200319523. |
| [8] | Tsujimoto H, Ono S, Efron PA, et al. Role of toll-like receptors in the development of sepsis[J]. Shock, 2008, 29 (3): 315-21. |
| [9] | He J, Qi D, Wang DX, et al. Insulin upregulates the expression of epithelial Sodium Channel in vitro and in a mouse model of acute lung injury: role of mTORC2/SGK1 pathway[J]. Exp Cell Res, 2015, 331 (1): 164-75. DOI: 10.1016/j.yexcr.2014.09.024. |
| [10] | Deng W, Li CY, Tong J, et al. Regulation of ENaC-mediated alveolar fluid clearance by insulin via PI3K/Akt pathway in LPS-induced acute lung injury[J]. Respir Res, 2012, 13 : 29. DOI: 10.1186/1465-9921-13-29. |
| [11] | Qi D, He J, Wang D, et al. 17β-estradiol suppresses lipopolysaccharide-induced acute lung injury through PI3K/Akt/SGK1 mediated up-regulation of epithelial Sodium Channel (ENaC) in vivo and in vitro[J]. Respir Res, 2014, 15 : 159. DOI: 10.1186/s12931-014-0159-1. |
| [12] | Smith KM, Mrozek JD, Simonton SC, et al. Prolonged partial liquid ventilation using conventional and high-frequency ventilatory techniques: gas exchange and lung pathology in an animal model of respiratory distress syndrome[J]. Crit Care Med, 1997, 25 (11): 1888-97. DOI: 10.1097/00003246-199711000-00030. |
| [13] | 贺志高, 黄显凯. 中性粒细胞在ALI/ARDS发生发展中的作用及对策研究进展[J]. 创伤外科杂志, 2012, 14 (2): 184-7. |
| [14] | Sakaguchi R, Chikuma S, Shichita T, et al. Innate-like function of memory Th17 cells for enhancing endotoxin-induced acute lung inflammation through IL-22[J]. Int Immunol, 2016, 28 (5): 233-43. DOI: 10.1093/intimm/dxv070. |
| [15] | Hou YC, Pai MH, Liu JJ, et al. Alanyl-glutamine resolves lipopolysaccharide-induced lung injury in mice by modulating the polarization of regulatory T cells and T helper 17 cells[J]. J Nutr Biochem, 2013, 24 (9): 1555-63. DOI: 10.1016/j.jnutbio.2013.01.004. |
| [16] | Li JT, Melton AC, Su G, et al. Unexpected role for adaptive αβTh17 cells in acute respiratory distress syndrome[J]. J Immunol, 2015, 195 (1): 87-95. DOI: 10.4049/jimmunol.1500054. |
| [17] | Liu Y, Mei J, Gonzales L, et al. IL-17A and TNF-α exert synergistic effects on expression of CXCL5 by alveolar type Ⅱ cells in vivo and in vitro[J]. J Immunol, 2011, 186 (5): 3197-205. DOI: 10.4049/jimmunol.1002016. |
| [18] | 张军华, 陈海泉. 抑癌基因LKB1在肺癌研究中的进展[J]. 中国癌症杂志, 2009, 19 (4): 309-12. |
| [19] | Xu X, Jin D, Durgan J, et al. LKB1 controls human bronchial epithelial morphogenesis through p114RhoGEF-dependent RhoA activation[J]. Mol Cell Biol, 2013, 33 (14): 2671-82. DOI: 10.1128/MCB.00154-13. |
| [20] | Goncharova EA, Goncharov DA, James ML, et al. Folliculin controls lung alveolar enlargement and epithelial cell survival through E-cadherin, LKB1, and AMPK[J]. Cell Rep, 2014, 7 (2): 412-23. DOI: 10.1016/j.celrep.2014.03.025. |
| [21] | Bai Y, Zhou T, Fu H, et al. 14-3-3 interacts with LKB1 via recognizing phosphorylated threonine 336 residue and suppresses LKB1 kinase function[J]. FEBS Lett, 2012, 586 (8): 1111-9. DOI: 10.1016/j.febslet.2012.03.018. |
| [22] | Mirouse V, Swick LL, Kazgan N, et al. LKB1 and AMPK maintain epithelial cell polarity under energetic stress[J]. J Cell Biol, 2007, 177 (3): 387-92. DOI: 10.1083/jcb.200702053. |
| [23] | Liu Z, Dai X, Zhu H, et al. Lipopolysaccharides promote S-Nitrosylation and proteasomal degradation of liver kinase B1 (LKB1) in macrophages in vivo[J]. J Biol Chem, 2015, 290 (31): 19011-7. DOI: 10.1074/jbc.M115.649210. |
 2017, Vol. 37
2017, Vol. 37

