2. 南方医科大学中西医结合医院,广东 广州 510315;
3. 南方医科大学南方医院,广东 广州 510515
2. Cancer Center, TCM-integrated Hospital, Southern Medical University, Guangzhou 510315, China;
3. Department of Oncology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
乳腺癌是世界各地女性癌症死亡主因中居首位的恶性肿瘤[1-4]。乳腺癌已经成为中国女性癌症发病率的第1位,且仍呈上升趋势[5-6]。乳腺癌的发生与发展具有激素依赖特性。临床认为[7],雌激素受体 (ER) 以及孕激素受体 (PR) 阴性者,组织异形性较高、分化差,易转移。而ER阴性的肿瘤细胞经过转染后能重新表达ER,并能控制其转移倾向,这一结论表明ER在乳腺癌转移中起保护作用。
丝裂原活化蛋白激酶激酶4(MAP2K4) 是MAPK信号通路的成员之一[8],其位于17号染色体上,由双特异性蛋白激酶磷酸化的丝氨酸和苏氨酸以及酪氨酸残基组成。MAP2K4通过激活P38 MAPK和C-JUN N末端激酶 (JNK) 来参与应激活化蛋白激酶途径[9],将细胞外刺激信号转导至细胞及其核内,并引起细胞的增殖、分化、转化及凋亡等生物学反应[10-11]。已有报道表明MAP2K4可以促进人前列腺癌的侵袭及转移[10-12],这些研究建议了MAP2K4在肿瘤的发生发展中发挥了重要作用。然而在乳腺癌研究中,目前尚无任何文献报道MAP2K4表达在临床中的作用。另外,MAP2K4与ER的相关性也未见报道。
在本次实验研究中,我们检测了102例乳腺癌中MAP2K4的表达及其与乳腺癌临床病理特征和预后发展的意义,最后分析了MAP2K4与ER之间的表达相关性及预后的关系。
1 资料和方法 1.1 材料乳腺癌组织芯片购自于上海芯超生物科技有限公司,标本收集来自于浙江省台州医院手术患者术后标本,收集时间为2001年1月~2004年8月,随访时间为108~150个月。在102例标本中,浸润性导管癌99例,浸润性导管癌伴浸润性小叶癌3例。患者年龄29~83岁 (平均年龄53岁),手术前均未行放疗、化疗及激素治疗。患者临床病理资料包括了年龄、病理分级、肿瘤大小、淋巴结远处转移、淋巴结侵犯和ER等。本次实验经浙江省台州医院伦理委员会批准,并征得患者的知情同意,并提供患者临床病理信息,由上海芯超公司归纳总结。纳入和排除标准都遵循乳腺癌临床病理分期 (2009年AJCC第七版)。
1.2 主要试剂兔抗人MAP2K4多克隆抗体购自Proteintech Group公司,工作浓度为1:50稀释。SP及DAB试剂盒购自北京中衫金桥科学技术有限公司。
1.3 免疫组织化学方法检测从4 ℃冰箱中取出玻片,放入60 ℃烤箱烘片4~5 h,趁热放进二甲苯Ⅰ中脱蜡20 min,放入二甲苯Ⅱ中30 min,然后高浓度梯度乙醇至低浓度乙醇中继续脱蜡,水洗后加入到柠檬酸抗原修复液中,置于微波炉中高火5 min,中低火15 min,冷却至室温取出。DAB显色后,用苏木素复染,水洗返蓝,封片继续拍照。
1.4 染色结果判定结果判定采用双盲法,同时由两位经验丰富的副高职称医师分别观察后进行判定。判定标准采用半定量法[13-14]在400×高倍显微镜下观察,连续选择5个高倍视野。细胞膜和细胞质上的棕色染色颗粒被视为阳性依据颜色的强度设定得分值:无着色,0分;淡黄色,1分;黄褐色,2分;褐色,3分。视野中的着色阳性细胞数 < 5%为0分,5%~25%为1分,25%~50%为2分时,51%~75%为3分, > 75%为4分。最后的比分是两种计分方法的乘积:0~4分为低表达和5~12为高表达。对于差错控制,其结果通过第三方病理学家判断。
1.5 统计学方法应用SPSS 20.0软件进行实验数据的统计与分析。MAP2K4在乳腺癌中的表达及其与临床病理参数之间的关系采用卡方检验。生存曲线用Kaplan-Meier法和Log-Rank统计检验进行分析;多因素生存分析采用Cox比例风险回归模型。各临床病理因素之间的相关性采用方差分析和Spearman等级相关检验。ER数据由上海芯超生物科技有限公司提供,MAP2K4和ER表达之间的相关性分析采用Spearman法。所有的检验均为双侧检验,P < 0.05为差异有统计学意义。
2 结果 2.1 MAP2K4在乳腺癌组织中表达及其与乳腺癌患者临床病理参数间的关系MAP2K4主要在胞浆中表达。在102例患者中,低表达57例 (57/102,55.9%,图 1A、B),高表达45例 (45/ 102,44.1%,图 1C、D)。卡方检验分析发现,MAP2K4表达虽与乳腺癌患者的年龄、肿瘤大小、淋巴结转移无明显相关,但与病理分级 (χ2=6.534,P=0.011) 正相关,具有明显统计学意义 (表 1)。
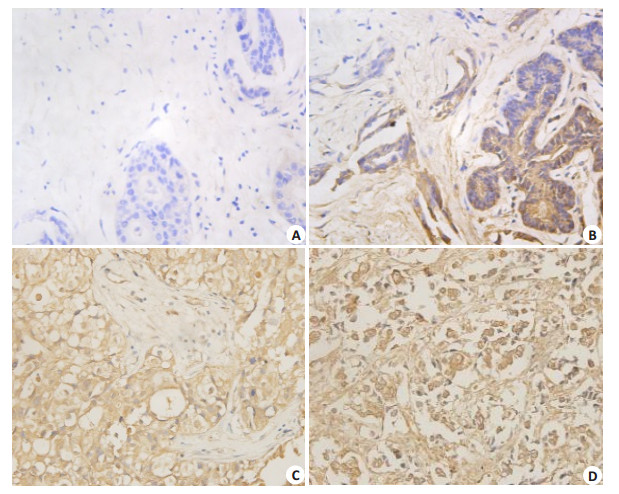
|
图 1 MAP2K4蛋白在乳腺癌中表达 Figure 1 Low (A, B) and high (C, D) expression of MAP2K4 protein in breast cancer tissue (Original magnification: × 400). A: negative expression; B: weak positive expression; C: positive expression; D: strong positive expression. |
| 表 1 MAP2K4的表达与乳腺癌临床病理参数之间的关系 Table 1 Correlationof MAP2K4 expression with clinicopathological characteristics of patients with breast cancer |
102例资料完整的乳腺癌患者病理随访108~150个月,其中复发或死亡38例,平均生存时间为82个月 (随访期间内),高表达组为89.7个月 (随访期间内),低表达组为152.5个月 (随访期间内),MAP2K4表达越高,患者综合生存时间越短 (P=0.002,图 2)。
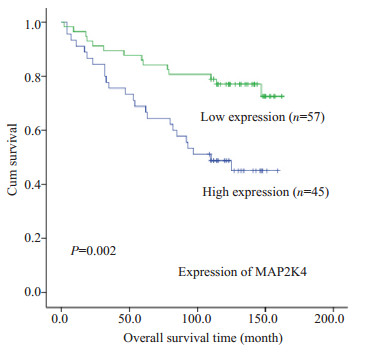
|
图 2 MAP2K4的表达与患者生存时间的关系 Figure 2 Correlation of MAP2K4 expression with the patients' overall survival time. |
将患者的年龄、病理分级、肿瘤大小、淋巴结转移、淋巴结侵犯、ER及MAP2K4的表达水平等可能影响乳腺癌预后的因素进行单因素分析,结果发现,病理分级 (P=0.004)、淋巴结转移 (P=0.024)、ER (P=0.043) 和MAP2K4的表达水平 (P=0.003) 与乳腺癌患者预后相关。将这些临床参数进行Cox比例风险回归模型多变量分析显示:病理分级 (P=0.016)、ER (P=0.041) 与MAP2K4的表达 (P=0.009) 仍是影响乳腺癌患者预后的独立因素 (表 2)。
| 表 2 MAP2K4乳腺癌单因素变量与多因素变量的COX回归分析 Table 2 Summary of univariate and multivariate Cox regression analysis |
Spearman等级相关分析显示,在乳腺癌组织中,MAP2K4与ER的表达相关系数为γ =-0.093,提示MAP2K4与ER表达存在着负相关性趋势,但无统计学意义 (P=0.366,表 3)。
| 表 3 MAP2K4与ER表达的相关性分析 Table 3 Correlation between MAP2K4 and ER expression |
为了进一步验证MAP2K4与ER在乳腺癌中的表达的相互关系,我们将MAP2K4和ER在乳腺癌中的表达情况分为4组,即 (1) ER阴性/MAP2K4高表达;(2) ER阴性/MAP2K4低表达 (3) ER阳性/MAP2K4高表达;(4) ER阳性/MAP2K4低表达。统计分析结果显示,这4种组合表达在乳腺癌中与肿瘤大小 (tumor scale > 7,P=0.025)、淋巴结转移数 (lymph node metastasis≥ 10,P=0.008,表 4) 存在着明显的相关性 (表 4)。随后我们绘制了4种组合表达模型的生存曲线 (图 2)。一组的平均生存时间为77.3个月 (随访期间内),明显低于其他3组的生存时间 (P=0.002)。
| 表 4 MAP2K4与ER共同表达模型与乳腺癌临床参数之间的关系 Table 4 Correlation between the clinicopathologic characteristics and MAP2K4 and ER co-expression patterns in breast cancer |
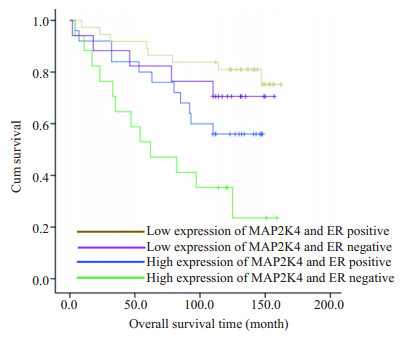
|
图 3 MAP2K4和ER共表达与患者总生存时间的相关性分析 Figure 3 Co-expression of MAP2K4 and ER predicts the patients' overall survival time. |
MAP2K4在肿瘤中的作用一直存在着争议。在卵巢癌中,过表达的MAP2K4抑制细胞增殖和转移,并诱导细胞的凋亡[15-16]。因此,其被认为是一个抑癌基因。与这些研究不一致的是,有报导表明MAP2K4作为候选癌基因,能被miR-27a直接靶击,促进了前列腺癌恶性表型的进展[17]。除此之外,MAP2K4在前列腺癌中激活p38蛋白,从而驱动转移级联的步骤,诱导上皮细胞向间质细胞转化 (EMT),从而导致肿瘤细胞转移[18]。在乳腺癌中,最初的研究支持MAP2K4作为抑癌候选基因[19-20]。但在随后的研究中,MAP2K4在乳腺中作为候选癌基因能促进细胞增殖,抑制细胞凋亡[21]。因此,MAP2K4在乳腺癌中似乎发挥了一个矛盾的作用。
为了进一步明确MAP2K4在乳腺癌中作用,在本次研究中,我们首先探讨了MAP2K4在乳腺癌中的表达模式以及与乳腺癌临床病理参数和预后之间的关系,这在以往研究中还未有报道。免疫组化结果显示,高表达的MAP2K4虽然与患者年龄、肿瘤大小、淋巴结转移和临床分期无明显的相关性,但与病理分级明显呈正相关,该结果提示MAP2K4促进了乳腺的恶性表型,这与Pan等在骨肉瘤细胞中的报道类似,支持了Wang等发现MAP2K4在乳腺癌作为候选癌基因的研究。进一步,我们观察到在乳腺癌组织中,MAP2K4表达越高,患者综合生存时间越短,进一步提示MAP2K4在乳腺癌中发挥了候选癌基因的作用。该结果与MAP2K4在前列腺癌中的作用类似。
Cox比例风险回归模型分析发现MAP2K4的表达可以作为预测乳腺癌独立预后因素,因此,监测MAP2K4的表达情况可能成为判断乳腺癌恶性病变程度和评估预后的参照因素,并且也提示我们高表达的MAP2K4可能参与了乳腺癌的恶性发展并影响其预后。
最后,我们还观察到雌激素受体ER与MAP2K4基因两者表达虽无明显相关性,但ER和MAP2K4在乳腺癌组织中的共同表达与肿瘤大小和淋巴结转移有明显统计学意义,且低表达的MAP2K4和ER阳性患者展示了最佳的预后。与之相反,高表达的MAP2K4和ER阴性患者则预后最差。该结果提示MAP2K4和ER联合表达可以作为监控乳腺癌患者的预后。
综合以上结果,我们首次揭示高表达的MAP2K4参与乳腺癌患者的临床进展并导致预后不良;除此之外,MAP2K4和ER表达水平与病理分级都是影响乳腺癌预后的独立因素。最为重要的是,ER和MAP2K4联合表达可以评估乳腺癌患者预后,但还需要更多的临床样本进行验证。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65 (2): 87-108. DOI: 10.3322/caac.21262. |
| [2] | Jemal A, Center MM, Desantis C, et al. Global patterns of cancer incidence and mortality rates and trends[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19 (8): 1893-907. DOI: 10.1158/1055-9965.EPI-10-0437. |
| [3] | Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127 (12): 2893-917. DOI: 10.1002/ijc.v127:12. |
| [4] | Li J, Zhang BN, Fan JH, et al. A nation-wide multicenter 10-year (1999-2008) retrospective clinical epidemiological study of female breast cancer in China[J]. BMC Cancer, 2011, 11 : 364. DOI: 10.1186/1471-2407-11-364. |
| [5] | 陈万青, 张思维, 曾红梅, 等. 中国2010年恶性肿瘤发病与死亡[J]. 中国肿瘤, 2014, 23 (1): 1-10. DOI: 10.3872/j.issn.1007-385X.2014.1.001. |
| [6] | Orlando L, Viale G, Bria E, et al. Discordance in pathology report after central pathology review: Implications for breast cancer adjuvant treatment[J]. Breast, 2016, 30 : 151-5. DOI: 10.1016/j.breast.2016.09.015. |
| [7] | Imoto S, Ohkura H, Sugano K, et al. Determination of cytosol c-erbB-2 protein in breast cancer by sandwich enzyme immunoassay[J]. Jpn J Clin Oncol, 1998, 28 (2): 92-6. DOI: 10.1093/jjco/28.2.92. |
| [8] | Yang SH, Sharrocks AD, Whitmarsh AJ. MAP kinase signalling cascades and transcriptional regulation[J]. Gene, 2013, 513 (1): 1-13. DOI: 10.1016/j.gene.2012.10.033. |
| [9] | Ahn YH, Yang Y, Gibbons DL, et al. Map2k4 functions as a tumor suppressor in lung adenocarcinoma and inhibits tumor cell invasion by decreasing peroxisome proliferator-activated receptor γ2 expression[J]. Mol Cell Biol, 2011, 31 (21): 4270-85. DOI: 10.1128/MCB.05562-11. |
| [10] | Pavese JM, Ogden IM, Voll EA, et al. Mitogen-Activated protein kinase kinase 4 (MAP2K4) promotes human prostate cancer metastasis[J]. PLoS One, 2014, 9 (7): e102289. DOI: 10.1371/journal.pone.0102289. |
| [11] | Pan W, Wang H, Jianwei R, et al. MicroRNA-27a promotes proliferation, migration and invasion by targeting MAP2K4 in human osteosarcoma cells[J]. Cell Physiol Biochem, 2014, 33 (2): 402-12. DOI: 10.1159/000356679. |
| [12] | Xu L, Ding Y, Catalona WJ, et al. MEK4 function, genistein treatment, and invasion of human prostate cancer cells[J]. J Natl Cancer Inst, 2009, 101 (16): 1141-55. DOI: 10.1093/jnci/djp227. |
| [13] | Liu Z, Yang H, Luo W, et al. Loss of cytoplasmic KLF4 expression is correlated with the progression and poor prognosis of nasopharyngeal carcinoma[J]. Histopathology, 2013, 63 (3): 362-70. DOI: 10.1111/his.2013.63.issue-3. |
| [14] | Pecina-Slaus N. Tumor suppressor gene E-cadherin and its role in normal and malignant cells[J]. Cancer Cell Int, 2003, 3 (1): 17. DOI: 10.1186/1475-2867-3-17. |
| [15] | Yeasmin S, Nakayama K, Rahman MT, et al. MKK4 acts as a potential tumor suppressor in ovarian cancer[J]. Tumour Biol, 2011, 32 (4): 661-70. DOI: 10.1007/s13277-011-0166-5. |
| [16] | Yamada SD, Hickson JA, Hrobowski Y, et al. Mitogen-activated protein kinase kinase 4 (MKK4) acts as a metastasis suppressor gene in human ovarian carcinoma[J]. Cancer Res, 2002, 62 (22): 6717-23. |
| [17] | Wan X, Huang W, Yang S, et al. Androgen-induced miR-27A acted as a tumor suppressor by targeting MAP2K4 and mediated prostate cancer progression[J]. Int J Biochem Cell Biol, 2016, 79 : 249-60. DOI: 10.1016/j.biocel.2016.08.043. |
| [18] | del Barco Barrantes I, Nebreda AR. Roles of p38 MAPKs in invasion and metastasis[J]. Biochem Soc Trans, 2012, 40 (1): 79-84. DOI: 10.1042/BST20110676. |
| [19] | Teng DH, Perry WL, Hogan JK, et al. Human mitogen-activated protein kinase kinase 4 as a candidate tumor suppressor[J]. Cancer Res, 1997, 57 (19): 4177-82. |
| [20] | Su GH, Song JJ, Repasky EA, et al. Mutation rate of MAP2K4/ MKK4 in breast carcinoma[J]. Hum Mutat, 2002, 19 (1): 81. |
| [21] | Wang L, Pan Y, Dai JL. Evidence of MKK4 pro-oncogenic activity in breast and pancreatic tumors[J]. Oncogene, 2004, 23 (35): 5978-85. DOI: 10.1038/sj.onc.1207802. |
 2017, Vol. 37
2017, Vol. 37

