结肠镜检查是监视和发现结肠病变的重要手段,特别是在结直肠肿瘤的筛查及随访中具有重要的临床应用价值。结肠镜检查可引起患者产生不适感,甚至可因患者疼痛难忍使肠镜检查被迫终止,导致结直肠病变不能及时被发现。镇静或麻醉结肠镜检查可减少患者不适感,但相关药物的使用存在某些缺点,如术中变换体位困难、术中操作者无法得到来自患者的疼痛警报、术后需要意识恢复和陪护人员、术后有禁忌活动如禁止驾驶、增加检查费用负担以及可能出现麻醉相关并发症等。而即使术中应患者要求使用镇静麻醉药物,效果仍远不如术前使用这类药物[1]。肠镜检查前判断是否使用这些药物,使检查者有充分的时间排查患者是否有麻醉镇静药物禁忌,因此,在肠镜检查前判断是否使用镇静麻醉药物十分重要。但目前国内尚缺乏内镜检查是否使用镇静麻醉药物的统一意见,内镜操作者通常对患者是否会在肠镜检查过程中出现疼痛的判断能力较差[2],仅根据个人经验和临床症状判断患者术前是否使用镇静麻醉药物是不严谨的。研究发现女性、低体质量指数 (BMI)、高龄、焦虑、不适预感、肠道准备不充分、盆腹腔手术史等因素[3-4]可能与肠镜检查过程中出现疼痛有关。本文旨在分析结肠镜检查过程中患者出现疼痛的危险因素,建立疼痛预测的多因素logistic回归模型,为肠镜检查前是否使用镇静麻醉药物提供理论参考。
1 资料和方法 1.1 一般资料选择2016年9~12月期间在南方医科大学南方医院消化内镜中心自愿接受常规结肠镜检查的患者为研究对象。纳入标准:年龄为18~85岁自愿接受常规结肠镜检查、未行左半结直肠手术、有能力签署知情同意书、能理解并自主回答调查问卷中相关内容;排除标准:年龄 < 18岁或 > 85岁、拒绝接受常规肠镜检查、要求行无痛肠镜检查、严重的肠腔狭窄或梗阻、妊娠或泌乳期妇女、严重的心功能衰竭、严重的慢性肾功能衰竭、严重的高血压 (收缩压 > 170 mmHg,舒张压 > 100 mmHg)、严重水电解质紊乱、消化道出血致生命体征不稳定者、吞咽困难、严重的胃肌轻瘫或胃流出道梗阻或闭塞、存在已知的或可能的肠穿孔、中毒性肠炎或巨结肠、精神疾病、无能力签署知情同意书、不能理解并自主回答调查问卷中相关内容者。所有入选患者肠镜检查前均已签署知情同意书。最终纳入283例患者,具体基线数据见表 1。本研已接受南方医科大学南方医院伦理委员会伦理审查,并在其监督之下开展本研究工作。
| 表 1 基线数据 Table 1 Baseline demographic data of the patients |
肠镜检查前所有患者采用统一的肠道准备方案,术前1 d晚上22点,将1袋复方聚乙二醇电解质散溶于1000 mL温开水中服用,2 h内服完,肠镜检查当天提前4~6 h再次服用同样剂量的复方聚乙二醇电解质散溶液。患者排出清水样便视为肠道准备完成。肠镜检查前记录患者年龄、性别、BMI、检查前有无腹痛主诉等资料;肠镜检查过程中记录肠镜操作者经验 (按完成肠镜例数分为 < 500例、500~1000例、1000~5000例和 > 5000例)、肠道清洁度 (Ottawa评分,总分14分,分别评估左、中、右三部分结肠的清洁度0~12分以及整个肠道的液体残余量0~2分,总分 < 6分为及格,≥6分为不及格)[5]、肠镜是否到达回盲部以及未到达的原因;采用问卷调查形式采集患者文化程度 (小学及以下、初中、高中、大学、研究生及以上)、盆腹部手术史、肠镜检查史、检查前自主估计肠镜检查是否会疼痛 (由患者根据自己的肠镜检查经验或对肠镜检查的认识进行回答,分为轻度、严重2个等级)、检查前焦虑程度 (分为轻度、严重2个等级)、检查过程的疼痛评分 (患者对检查过程中出现的疼痛进行评分,采用视觉模拟评分,为0~10分)。以上问卷调查由2位固定医师在检查前以及检查结束30 min内向患者说明情况然后由患者自主完成。临床资料收集完毕后,根据疼痛视觉模拟评分结果对患者进行分组,然后对各因素进行回顾性分析研究。
1.3 统计学分析评价肠镜是否到达回盲部与疼痛视觉模拟评分的关系用Mann-Whitney U检验和卡方检验分析。肠镜检查中出现疼痛的单因素分析用卡方检验,连续性变量用两独立样本t检验,等级变量用Mann-Whitney U检验,多因素分析用Logistic回归进行分析,得出预判方程并描绘ROC曲线图,得出正确率最高的判别概率。P < 0.05时,认为差异有统计学意义。最终产生的预测模型用Hosmer and Lemeshow Test检验拟合度。所有数据分析采用SPSS 19.0软件包完成。
2 结果 2.1 疼痛影响肠镜到达回盲部纳入的283例肠镜检查完成率为96.82%,其中有9例 (3.2%) 检查未到达回盲部,未到达原因均为患者疼痛难忍而无法继续进镜。根据肠镜是否到达回盲部把患者分为2组,用Mann-Whitney U检验分析2组患者的疼痛视觉模拟评分是否有差异,分析显示肠镜未到达回盲部的患者疼痛视觉模拟评分的平均秩次为236.72,高于到达回盲部的患者的疼痛视觉模拟评分的平均秩次138.89,且差异有统计学意义 (P < 0.000)。说明肠镜未到达回盲部患者的疼痛视觉模拟评分明显高于到达回盲部的患者。根据疼痛视觉模拟评分把患者分为轻度疼痛组 (0~4分) 和严重疼痛组 (5~10分),两组的回盲到达率存在明显差异 (Fisher's exact test, P=0.007),说明根据疼痛视觉模拟评分把患者分为0~4分组和5~10分组时,2组的肠镜回盲部到达率有明显的差异,因此把0~4分患者分为疼痛不明显组,把5~10分患者分为疼痛明显组。
2.2 疼痛危险因素的单因素分析对性别、文化程度、有无盆腹腔手术史、有无肠镜检查史、有无腹痛主诉、操作者经验、疼痛自主估计、紧张程度、肠道清洁评分等可能的危险因素进行卡方检验,分析结果显示与肠镜疼痛明显有关的危险因素 (P < 0.05) 分别是女性、有盆腹腔手术史、无肠镜检查史、有腹痛主诉、自主估计疼痛程度高,提示这些可能是肠镜检查过程中患者出现疼痛的危险因素 (表 2)。
| 表 2 肠镜中出现腹痛危险因素的单变量分析 Table 2 Univariate analysis of the risk factors associated with abdominal pain during colonoscopy |
另外,把两组患者的年龄、BMI、以往肠镜检查次数、肠道清洁评分 (Ottawa评分,总分14分) 共4个连续性变量进行用两独立样本t检验,结果显示疼痛明显组比疼痛不明显组BMI明显降低,差异有统计学意义 (P= 0.016)。对等级资料即操作者经验分级进行Mann-Whitney U检验分析,结果显示疼痛明显组的操作者经验明显低疼痛不明显组,且差异有统计学意义 (P < 0.000),说明操作者经验低可能与疼痛出现有关。
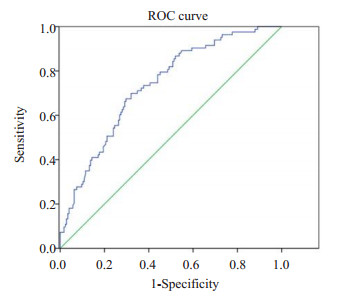
2.3 疼痛危险因素的多因素分析及判别模型的建立对有统计学意义的单因素分析变量进行多元Logistic回归分析,即把性别、有无盆腹腔手术史、有无肠镜检查史、有无腹痛主诉、操作者经验、自主估计疼痛程度、BMI共7个变量代入多因素Logistic回归模型 (后退法,Wald检验) 结果显示,BM (I SE=0.046,OR=0.884,P=0.007)、操作者经验 (A1,A2,A3的SE分别为0.457,0.506,0.503,OR值分别5.548,2.183,1.158,P≤0.000) 和自主估计疼痛程度 (SE=0.419,OR=2.639,P=0.021)3个变量进入回归模型 (表 3)。建立肠镜检查过程中出现腹痛的概率预测模型,根据回归分析的特点,判别函数系数等于回归系数。得到的判别函数如下:P=eY(/ 1+eY),Y=0.049-0.124×X1-0.97×X2+1.713×A1 +0.781×A2 +0.147×A3,其中X1:BMI值;X2:自主估计疼痛程度;A1、A2、A3:操作者经验。各变量赋值为:性别:1=女,2=男;腹腔手术史:1=有,2=无;肠镜检查史:1=有,2=无;腹痛主诉:1=有,2=无;疼痛预测:1=轻度,2=严重;操作者经验: < 500例时A1=1,A2=0,A3=0;500~1000例时A1=0,A2=1,A3=0;1000~5000例时A1=0;A2=0,A3=1; > 5000例时A1=0,A2=0,A3=0(A1、A2、A3为哑变量)。以不同的临界概率值作为判别界值,将模型判别分类情况与实际疼痛分组进行对比,计算敏感度和特异度,以“敏感度”为纵坐标,以“1-特异度”作为横坐标绘制ROC曲线 (图 1)。所绘ROC曲线下面积为0.734(95% CI:0.671~0.797),可以认为此模型的有中等的判断准确性。在判别临界值为P=0.314时,判别准确度最高,敏感性为70.3%,特异性为67.5%。Hosmer and Lemeshow Test P=0.724,说明模型拟合度好。
| 表 3 肠镜中出现腹痛危险因素的多变量分析 Table 3 Multivariate analysis for the risk factors associated with abdominal pain during colonoscopy |
|
图 1 概率预测模型ROC曲线 Figure 1 ROC curve of the modelfor abdominal pain during colonoscopy. Diagonal segments are produced by ties. |
疼痛可明显影响肠镜检查的进行,高达16%的肠镜检查未能完成的原因为检查过程中患者出现疼痛或镇静药物使用不足[6],对疼痛的恐惧也是患者拒绝进行结肠镜检查的主要原因[7]。疼痛视觉模拟评分系统是临床使用较为广泛的疼痛评价系统,能较反映患者疼痛程度的真实水平[3, 8],因此本研究用其评价患者在肠镜过程中出现的疼痛程度。283例肠镜检查中有9例未到达回盲部,原因均为患者疼痛难忍而无法继续进镜,未达回盲患者的疼痛视觉模拟评分明显高于其它患者,与国外研究基本一致,因此疼痛可明显影响肠镜的完成率,是本研究中导致肠镜检查不能完成的主要因素。根据疼痛视觉模拟评分把患者分为0~4分组和5~10分组时,两组的肠镜回盲部到达率有明显的差异,说明疼痛视觉模拟评分≥5分时肠镜回盲部到达率明显降低,因此以≥5分作为疼痛的判断标准把患者分为疼痛明显组和疼痛不明显组。
本研究根据文献以及临床经验把11个可能导致疼痛的危险因素进行单因素分析,女性、有盆腹腔手术史、无肠镜检查史、有腹痛主诉、自主估计疼痛程度高、操作者经验少以及BMI低可能为肠镜过程中出现疼痛的高危因素。不少研究发现,女性患者不仅与低内镜完成率和进境时间延长有关,而且女性比男性患者更容易在检查过程中出现疼痛[9-11],这与女性结肠在解剖学上长度更长、骨盆形状更圆、骨盆肌肉比男性少导致更容易形成肠袢有关[12]。以往的研究对盆腹腔手术史对肠镜检查的影响说法不一,有的研究认为盆腹腔手术特别是女性的盆腹腔手术与疼痛以及肠镜检查不能完成密切相关[2, 13-14],但也有研究持相反意见[15]。但普遍认为盆腹腔手术史可能使肠管之间形成粘连,因此可导致肠镜的通过受到更多阻碍使患者可能经历更多不适感。有研究发现以往有肠镜检查经验的患者对肠镜检查的总体满意度高于首次接受检查者[16],可能因为以往肠镜经验减少了患者对未知检查的恐惧并且使患者更懂得配合肠镜检查流程而减少疼痛的出现。肠镜检查前存在腹痛症状可能因炎症或疼痛敏感性增加等因素降低疼痛出现的阈值,以往的研究也支持这一点[2]。本研究中自主估计疼痛程度高的患者更容易在检查中出现疼痛,Elphic等[4]也发现对肠镜检查疼痛程度的预测高的患者,经历的疼痛程度也升高。自主估计疼痛程度在一定的程度上反映了患者对肠镜检查的认知与恐惧,同时估计疼痛程度高的患者疼痛阈值可能较低,这些都可能增加检查过程中疼痛的程度。本研究中疼痛明显的患者的操作者经验明显低于疼痛不明显患者,普遍认为肠镜操作者经验与患者的疼痛程度密切相关[17],操作时间短、懂得如何让患者配合检查以及熟练的、内镜技术都可能使高年资肠镜操作者在操作过程中减轻患者的痛苦。不少研究发现低BMI值患者与患者不适感增加、进镜时间延长和肠镜完成率降低有关[3, 18-19],本研究中低BMI也是疼痛的危险因素之一,这可能与低体质量患者容易形成肠袢以及对疼痛耐受力降低有关。
在多元logistic回归分析中,最后进入模型的变量为自主估计疼痛程度、操作者经验以及BMI,这些变量均为患者肠镜检查过程中出现疼痛的独立危险因素,建立的判别函数ROC曲线下面积为0.734,判别准确性为中等,说明可能还有某些危险因素未被纳入。其它危险因素包括肠道准备质量、进镜时间等未纳入研究原因是这些资料均在肠镜检查开始之后才能获得,而本研究目的是建立判别方程判断术前是否使用镇静麻醉药物,因此未纳入。本研究判别模型准确性最高时的敏感性为70.3%,特异性为67.5%,但同时也应该考虑其临床价值。若其临床应用倾向于减少镇静麻醉药物的使用以降低其并发症风险以及减少检查费用,那么其判别临界值可调节至特异性较高的位置,例如判别临界值为P= 0.231时,其特异性提高至79.5%;若其临床应用倾向于减少患者痛苦以及提高肠镜检查完成率,那么其判别临界值则可调节至敏感性较高的位置,如判别临界值为P=0.492时,其敏感性提高至85.7%。
总之,肠镜检查时患者疼痛视觉模拟评分≥5分时可影响肠镜检查完成率,对此类患者的特点进行危险因素分析发现,自主估计疼痛程度高、肠镜操作者经验少以及BMI低是患者进行肠镜检查时出现疼痛的独立危险因素,肠镜检查前应先了解是否存在这些危险因素,根据疼痛判别模型对高危患者术前使用镇静麻醉药物。
| [1] | Terruzzi V, Meucci G, Radaelli F, et al. Routine versus "on demand" sedation and analgesia for colonoscopy: a prospective randomized controlled trial[J]. Gastrointest Endosc, 2001, 54 (2): 169-74. DOI: 10.1067/mge.2001.113923. |
| [2] | Holme O, Bretthauer M, de Lange T, et al. Risk stratification to predict pain during unsedated colonoscopy: results of a multicenter cohort study[J]. Endoscopy, 2013, 45 (9): 691-6. DOI: 10.1055/s-00000012. |
| [3] | Park DI, Kim HJ, Park JH, et al. Factors affecting abdominal pain during colonoscopy[J]. Eur J Gastroenterol Hepatol, 2007, 19 (8): 695-9. DOI: 10.1097/01.meg.0000219097.32811.24. |
| [4] | Elphick DA, Donnelly MT, Smith KS, et al. Factors associated with abdominal discomfort during colonoscopy: a prospective analysis[J]. Eur J Gastroenterol Hepatol, 2009, 21 (9): 1076-82. DOI: 10.1097/MEG.0b013e32832357b3. |
| [5] | Rostom A, Jolicoeur E. Validation of a new scale for the assessment of bowel preparation quality[J]. Gastrointest Endosc, 2004, 59 (4): 482-6. DOI: 10.1016/S0016-5107(03)02875-X. |
| [6] | Brahmania M, Park J, Svarta S, et al. Incomplete colonoscopy: maximizing completion rates of gastroenterologists[J]. Can J Gastroenterol, 2012, 26 (9): 589-92. DOI: 10.1155/2012/353457. |
| [7] | Ghevariya V, Duddempudi S, Ghevariya N, et al. Barriers to screening colonoscopy in an urban population: a study to help focus further efforts to attain full compliance[J]. Int J Colorectal Dis, 2013, 28 (11): 1497-503. DOI: 10.1007/s00384-013-1708-7. |
| [8] | Jensen MP, Karoly P, Braver S. The measurement of clinical pain intensity: a comparison of six methods[J]. Pain, 1986, 27 (1): 117-26. DOI: 10.1016/0304-3959(86)90228-9. |
| [9] | Hull T, Church JM. Colonoscopy--how difficult, how painful[J]. Surg Endosc, 1994, 8 (7): 784-7. DOI: 10.1007/BF00593441. |
| [10] | Stermer E, Gaitini L, Yudashkin M, et al. Patient-controlled analgesia for conscious sedation during colonoscopy: a randomized controlled study[J]. Gastrointest Endosc, 2000, 51 (3): 278-81. DOI: 10.1016/S0016-5107(00)70355-5. |
| [11] | Macken E, Gevers AM, Hendrickx A, et al. Midazolam versus diazepam in lipid emulsion as conscious sedation for colonoscopy with or without reversal of sedation with flumazenil[J]. Gastrointest Endosc, 1998, 47 (1): 57-61. DOI: 10.1016/S0016-5107(98)70299-8. |
| [12] | Sadahiro S, Ohmura T, Yamada Y, et al. Analysis of length and surface area of each segment of the large intestine according to age, sex and physique[J]. Surg Radiol Anat, 1992, 14 (3): 251-7. DOI: 10.1007/BF01794949. |
| [13] | Cirocco WC, Rusin LC. Factors that predict incomplete colonoscopy[J]. Dis Colon Rectum, 1995, 38 (9): 964-8. DOI: 10.1007/BF02049733. |
| [14] | Dyson JK, Mason JM, Rutter MD. Prior hysterectomy and discomfort during colonoscopy: a retrospective cohort analysis[J]. Endoscopy, 2014, 46 (6): 493-8. DOI: 10.1055/s-00000012. |
| [15] | Kim WH, Cho YJ, Park JY, et al. Factors affecting insertion time and patient discomfort during colonoscopy[J]. Gastrointest Endosc, 2000, 52 (5): 600-5. DOI: 10.1067/mge.2000.109802. |
| [16] | Triantafyllou K, Gkolfakis P, Triantafyllou M, et al. Long-term patient satisfaction of gastrointestinal endoscopic procedures[J]. Ann Gastroenterol, 2016, 29 (2): 188-95. |
| [17] | Loeve AJ, Fockens P, Breedveld P. Mechanical analysis of insertion problems and pain during colonoscopy: why highly skill-dependent colonoscopy routines are necessary in the first place... and how they May be avoided[J]. Can J Gastroenterol, 2013, 27 (5): 293-302. DOI: 10.1155/2013/353760. |
| [18] | Anderson JC, Gonzalez JD, Messina CR, et al. Factors that predict incomplete colonoscopy: thinner is not always better[J]. Am J Gastroenterol, 2000, 95 (10): 2784-7. DOI: 10.1111/j.1572-0241.2000.03186.x. |
| [19] | Anderson JC, Messina CR, Cohn W, et al. Factors predictive of difficult colonoscopy[J]. Gastrointest Endosc, 2001, 54 (5): 558-62. DOI: 10.1067/mge.2001.118950. |
 2017, Vol. 37
2017, Vol. 37

