2. 蚌埠医学院第一附属医院妇瘤科,安徽 蚌埠 233004
2. Department of Gynecological Oncology, First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
宫颈癌是女性常见的恶性肿瘤,是仅次于乳腺癌的女性第二肿瘤[1]。宫颈癌的治疗以手术和放化疗为主,但由于恶性肿瘤具有侵袭性生长的特性,中、晚期宫颈癌的复发率、死亡率仍居高不下[2-3]。尤其宫颈腺癌,因易早期发生淋巴结转移,对放疗的敏感性差,对化疗易耐药,因此治疗难度大,预后差[4]。寻找一种科学、可行的途径来增强化疗疗效,改善预后成为宫颈癌治疗领域研究的热点问题。热休克蛋白 (HSP)70是热休克蛋白家族中的一员,其与肿瘤的发生、发展、肿瘤免疫与治疗以及机体对肿瘤治疗药物耐药性的发生和肿瘤的预后等都密切相关[5-6]。抑制HSP70的表达可以增强肿瘤对各种治疗措施的敏感性,可能成为肿瘤治疗的靶点[7-8]。宫颈癌既是女性最常见恶性肿瘤之一,同时又是HSP70高表达的肿瘤[9]。NCCN宫颈癌临床实践指南认为在宫颈癌的单药化疗中顺铂是最有效的化疗药物,被推荐作为一线单药药物治疗复发或转移性宫颈癌。本实验以人宫颈癌Hela229细胞为研究对象,观察HSP70蛋白表达被抑制后,细胞对顺铂敏感性的变化,初步讨论HSP70在宫颈癌细胞对顺铂敏感性中的作用。为宫颈癌的临床治疗提供一个新的思路。
1 材料和方法 1.1 主要试剂DMEM培养液、胰蛋白酶:Gibco公司;胎牛血清:浙江四季青公司;二甲基亚砜 (DMSO):Sigma公司;多克隆抗体caspase3:Enzo公司;鼠抗人HSP70:Santacruz公司;多克隆抗体bax,bcl-2抗体:proteintech;鼠抗人β-actin:santacruzbiotechnology;HSP70抑制剂,PFT-μ: selleck公司。
1.2 细胞株及细胞培养人宫颈癌Hela229细胞株,购于中科院上海细胞库。Hela细胞复苏后,于DMEM培养液 (含10%胎牛血清,3.7 g/L碳酸氢钠,1×105 U/L青霉素,100 mg/L链霉素),置37 ℃、饱和湿度、5% CO2培养箱中培养,0.25%胰酶消化后传代培养。
1.3 HSP70抑制剂PFT-μ与顺铂体外抗宫颈癌作用 1.3.1 MTT法取对数生长期细胞,0.25%胰蛋白酶消化制成单细胞悬液,并调整细胞密度为1×107/L,接种于96孔板中,每孔100 mL,于5% CO2、饱和湿度、37 ℃培养箱中培养24 h。不同浓度 (6.25、12.5、25、50、100 μmol/L) 顺铂处理,每组设3个复孔,继续培养24、48、72 h后每孔加入MTT (5 g/L)15 mL,继续培养4 h,弃去培养液,每孔加入DMSO 150 mL,培养箱内孵育30 min,微量振荡器振荡10 min使结晶物充分溶解,酶标仪在490 nm波长下检测每孔的吸光度 (A) 值,计算细胞存活率:细胞存活率/%=实验组A值/对照组A值× 100%。以上实验重复3次。
1.3.2 集落克隆实验取指数生长细胞Hela229,消化制成单细胞悬液,以每孔5000个的量接种于6孔培养板,贴壁培养24 h,给药处理,继续培养5 d,以后每3~4 d更换培养液。培养2周,弃培养液用1%结晶紫染色。
1.3.3 PI染色用24孔细胞培养板,接种细胞1×105/孔,培养24 h后加顺铂,继续培养24 h后,收集各孔培养液至对应流式管中,用预冷PBS清洗每孔,收集清洗液至对应培养液中,1200 r/min离心10 min,弃上清;培养板中加入PI缓冲液 (0.005 g PI、0.1 g柠檬酸钠、100 mL Triton X-100、100 mL ddH2O)750 mL/孔,37 ℃孵育10 min,吹打收集细胞至对应流式管中,轻轻摇动混匀。4 ℃避光保存,过夜,上流式细胞仪检测.
1.3.4 JC-1染色接种细胞至24孔板,1.0×105/孔,培养过夜后给予顺铂处理细胞24 h后,收集细胞按照试剂盒说明进行操作,荧光显微镜拍照分析。据JC-1染色试剂盒说明书,JC-1可由完整的线粒体膜进入线粒体内部形成多聚体,发出红色荧光,当线粒体膜电位降低时JC-1难进入线粒体内,而以JC-1单体的形式停留在细胞质内发出绿色荧光,因此,当线粒体膜电位降低时红色荧光减弱,绿色荧光增强。
1.3.5 DAPI染色将对数生长期的宫颈癌细胞株Hela229制成单细胞悬液接种于12孔细胞培养板,每孔1.2×105细胞,培养24 h后加入药物,达到作用时间后吸除培养液,用PBS溶液洗涤细胞3次,每次5 min,置于水平摇床上。每孔加1.00 mL 4%多聚甲醛于室温固定细胞5 min。用PBS溶液洗涤细胞3次,每次5 min,置于水平摇床上。每孔加10.00 mL DAPI染色液 (5.00 g/mL),用锡箔纸包裹培养板置于摇床上于室温孵育5 min。用PBS溶液洗涤细胞3次,每次5 min,置于水平摇床上。弃液体,但不可使细胞变干。封片,荧光拍照。
1.3.6 Western印迹检测蛋白用细胞全蛋白抽提试剂盒提取蛋白,BCA蛋白定量试剂盒测定蛋白浓度。SDS-PAGE电泳,转膜至PVDF膜;以5%脱脂牛奶封闭2 h后孵育一抗,于4 ℃孵育过夜;吐温磷酸盐缓冲液 (TPBS) 洗涤3次后孵育二抗,于室温孵育2 h;用Bio-Rad凝胶成像系统获取图像,实验重复3次。
1.4 HSP70抑制剂PFT-μ与顺铂对人宫颈癌裸鼠肿瘤模型的抑制作用取增殖旺盛的对数生长期的人宫颈癌细胞Hela229,制成细胞悬液,用PBS悬浮细胞。将细胞悬液接种于裸鼠腋下皮下,接种量为每只裸鼠1×108细胞 (100μL),整个接种过程中将细胞置于冰上。实验选用雌性裸鼠,4~5周龄。待移植瘤体积达到约200 mm3时,将荷瘤裸鼠随机分组,每组3只,即对照组 (PBS),顺铂组 (2.5 mg/kg),PFT-μ组 (5 mg/kg) 以及顺铂 (2.5 mg/kg) 与PFT-μ(5 mg/kg) 合用组。在裸鼠接种Hela229细胞悬液后的第7天开始腹腔注射给药,每隔4 d给药1次。并用游标卡尺测量瘤体积,分别记为a (最长径),b (最短径),瘤体积公式为V=ab2/2。28 d后将小鼠脱臼处死拍照,剥离肿瘤、肝脏、肾脏组织,称瘤重及肿瘤体积,计算抑瘤率。肿瘤组织及肝肾组织用4%多聚甲醛固定,HE染色观察组织变化。
1.5 统计学方法应用SPSS17.0统计软件对数据进行分析,近似正态分布的计量资料以均数±标准差表示,组间比较采用方差分析及Dunnette-t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 HSP70在人宫颈癌细胞Hela229中表达明显升高采用Western blot法检测正常宫颈细胞以及人宫颈癌细胞Hela229内HSP70表达,我们发现Hela229细胞内的HSP70表达明显高于人正常宫颈细胞 (图 1)。

|
图 1 HSP70在正常宫颈细胞及人宫颈癌细胞Hela229内表达 Figure 1 Expression of HSP70 in normal cervical cells and cervical cancer Hela229 cells. |
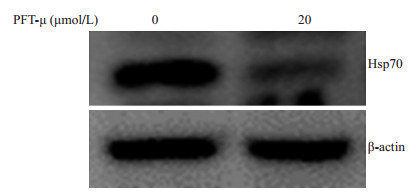
Western blotting实验表明,使用HSP70的抑制剂 (PFT-μ)(20 μmol/L) 处理后的细胞内HSP70蛋白表达水平明显降低 (图 2)。
|
图 2 PFT-μ对宫颈癌细胞Hela229内HSP70蛋白表达的影响 Figure 2 Effect of PFT-μ on HSP70 expression in Hela229 cells. |
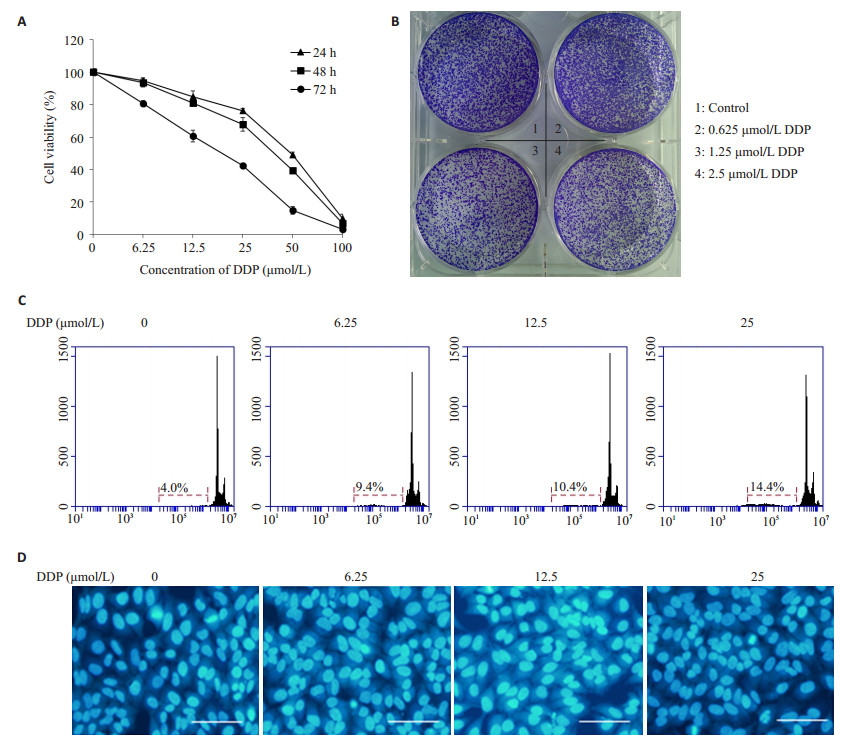
我们使用了一系列浓度的顺铂处理Hela229细胞24、48、72 h,随后发现细胞的存活率是随着浓度的增高以及时间的延长而降低 (图 3A),但是实验显示Hela229细胞对顺铂并不是敏感,集落克隆实验结果同样显示Hela229细胞对顺铂不敏感 (图 3B)。凋亡试验PI单染 (图 3C) 以及DAPI染色 (图 3D) 试验结果显示顺铂处理24 h的Hela229细胞凋亡率较低。
|
图 3 顺铂对Hela229增殖与凋亡的作用 Figure 3 Effect of different concentrations of DDP on growth and apoptosis of Hela229 cells in vitro (scale bar=100 μm). A: Cell viability changes; B: Result of colony forming assay; C: Apoptosis of Hela229 cells; D: Morphology of the cells (DAPI staining). |
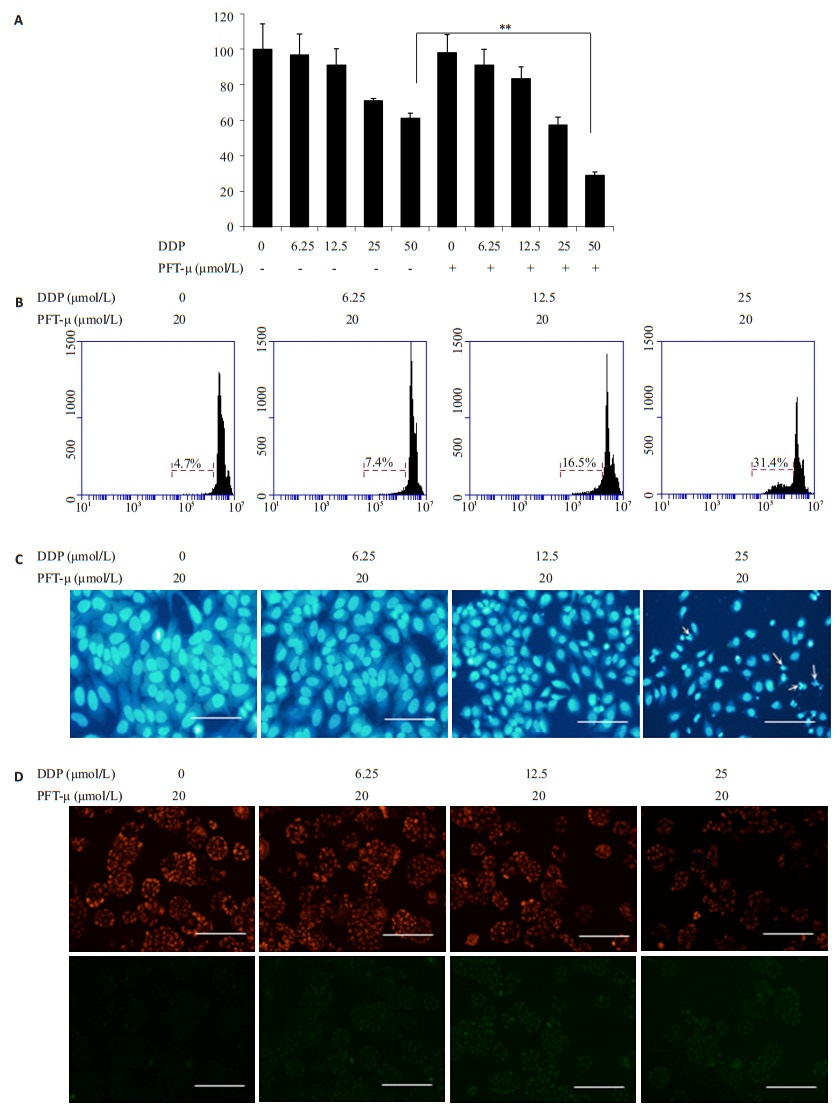
据文献报道[10-11],Pifithrin-m (PFT-μ) 是一种有高效的HSP70抑制剂,在细胞和动物水平上均有着很好的抑制作用。因此,选择PFT-μ来抑制Hela229细胞HSP70表达进行试验。根据文献报道及预实验结果采用20 mmol/L PFT-μ与顺铂进行合用,与单用顺铂比较,结果表明二者合用能增加顺铂对Hela229细胞的抑制作用 (图 4A)。PI及DAPI染色试验均表明二者合用可显著提高Hela229细胞的凋亡率 (图 4B,C)。JC-1染色实验测定细胞线粒体膜电位的变化试验显示合用组线粒体膜电位较顺铂组显著降低 (图 4D)。总之,当HSP70表达被抑制后,顺铂可通过诱导细胞发生明显的凋亡,进而抑制Hela229细胞增殖,即抑制HSP70表达能增加Hela229对顺铂的敏感性。
|
图 4 顺铂与PFT-μ合用后对Hela229细胞增殖与凋亡的影响 Figure 4 Effect of DDP and PFT-μ, alone or in combination, on growth and apoptosis of Hela229 cells (scale bar=100 μm). A: Cell viability of Hela229 cells (**P < 0.01 vs DDP group); B: Apoptosis of Hela229 cells treated by DDP, PFT-μ and their combination for 24 h; C: DAPI staining, apoptotic cells are shown in the arrows; D: Mitochondrial membrane potential measured with JC-1 staining. |
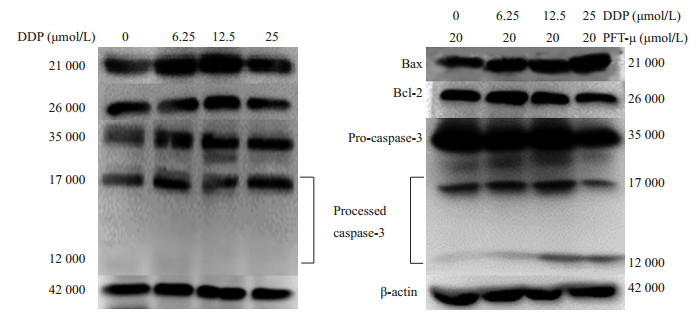
Western blotting结果显示顺铂与PFT-μ合用组Hela229细胞bcl-2表达水平降低,而Bax/caspase-3明显增加,且caspase-3被活化 (图 5)。
|
图 5 顺铂及其合用PFT-μ对Hela229细胞Bcl-2/Bax/caspase-3的影响 Figure 5 Effect of DDP and PFT-μ, alone or in combination, on expression of Bcl-2, Bax, and caspase-3 in Hela229 cells. |
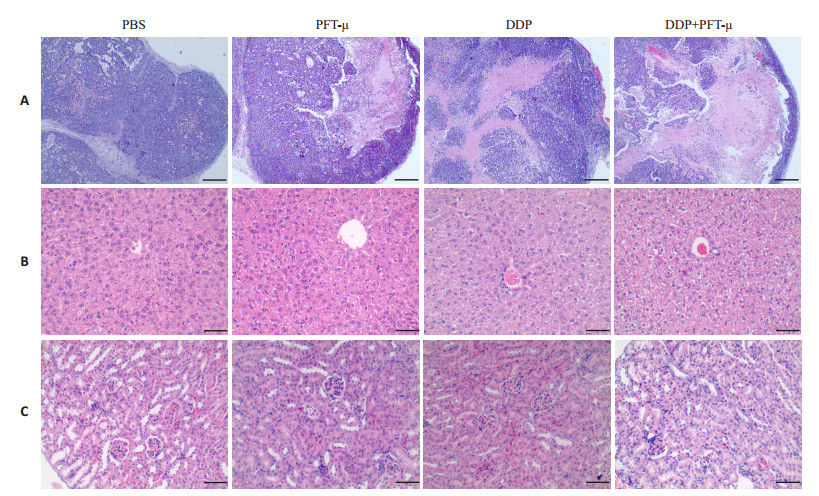
为考察PFT-μ和顺铂在体内抑制肿瘤生长的能力,建立人宫颈癌Hela229细胞裸鼠肿瘤模型。结果表明合用组的肿瘤体积生长速度明显慢于单用药组 (表 1),肿瘤平均质量最低。PBS组平均瘤质量为0.428±0.085 g,PFT-μ组平均瘤质量为0.328±0.018 g,顺铂组平均瘤质量为0.185±0.007 g,合用药组0.079± 0.013 g。抑瘤率PFT-μ组达到23.286%,顺铂组为56.697%,合用组为81.386%。苏木精-伊红染色法 (HE染色) 结果表明,合用组裸鼠瘤体细胞皱缩变小,血管分布减少,出现大面积坏死的区域 (图 6A)。这说明,合用药在裸鼠体内具有更好的抗肿瘤效果。而相对于PBS组与单用药组,合用药组的肝肾组织并未出现明显的坏死 (图 6B-6C)。
| 表 1 肿瘤体积生长速度 Table 1 Changes of tumor volumes in nude mice with different treatments (mm3, Mean±SD) |
|
图 6 小鼠肿瘤及肝肾组织HE染色 Figure 6 HE staining of tumor (A), hepatic tissue (B) and renal tissues (C) of the tumor-bearing nude mice (scale bar=100 μm). |
HSP70家族作为一种重要的非特异性细胞保护蛋白,广泛参与各种保护机体和细胞的功能,增强机体的应激耐受性、提高细胞存活率[12]。研究表明HSP70能通过抑制细胞色素C与Apaf-1结合,阻断功能性凋亡小体的形成,干扰细胞色素C/dATP介导的Caspase激活[13];还可与caspase-3结合,直接抑制其功能,进而抑制细胞凋亡过程。HSP70作为抗凋亡蛋白,在肿瘤细胞中优先大量地表达,抑制细胞调亡,促进细胞增殖[14-15]。HSP70还通过与Bcl-2、Bcl-xL、CrmA等抗凋亡蛋白协调作用,下调与细胞凋亡相关基因和蛋白表达,从而达到拮抗细胞凋亡的作用[16-17]。在肿瘤化疗方面HSP70可能参与肿瘤的耐药机制。研究发现对化疗药物用的人敏感的细胞系,若HSP70高表达,无论在体内还是在体外,都对化疗药物产生耐受[18-19]。HSP70与肿瘤的发生、转移、耐药、预后等方面均有密切的关系。
宫颈癌是女性最常见恶性肿瘤之一。研究表明,HSP70在宫颈癌和宫颈原位癌组织中的表达比其在癌旁组织及正常组织中的表达显著增多,与宫颈癌的发生、发展、预后等密切相关[20]。化学药物治疗己经作为宫颈癌主要的辅助治疗,对肿瘤的治疗、预防复发有明显疗效。顺铂广泛应用于恶性肿瘤的治疗,是宫颈癌化疗中的一线药物[21-22]。研究表明,诱导恶性肿瘤细胞调亡是化疗药物发挥杀伤作用的重要机制之一,而凋亡抑制基因的过度表达使肿瘤细胞对化疗药物敏感性下降,HSP70作为抗调亡蛋白,其表达随着重复刺激次数的增加,使肿瘤细胞对抗肿瘤药的敏感性降低,产生耐药性[6, 23-24]。本课题使用的人宫颈癌Hela229细胞体内外对顺铂表现出较低的敏感性,单用时顺铂对Hela229细胞增殖抑制和诱导凋亡作用较弱。但当与HSP70抑制剂PFT-μ合用时,Hela229细胞增殖活性降低,凋亡率大幅提高。说明HSP70表达影响Hela229细胞对顺铂的敏感性。实验结果提示PFT-μ增加宫颈癌Hela229细胞对顺铂的敏感性主要通过促进顺铂诱导的细胞凋亡实现。其机制可能是通过抑制HSP70,调节下游凋亡控制蛋白Bcl-2,Bax及caspase-3表达及活性,降低细胞线粒体膜电位使细胞发生凋亡。
总之,本课题通过将HSP70蛋白表达抑制剂PFT-μ与顺铂合用于宫颈癌细胞Hela229,表明PFT-μ可增强顺铂在体内外的抗肿瘤作用。其机制主要通过下调HSP70,调控下游凋亡控制蛋白Bcl-2,Bax及caspase-3表达及活性,促进细胞的凋亡。本研究提示应用抗试剂或阻断基因的方法,可能解决宫颈癌对顺铂耐药性问题。本研究为临床实践提供了理论依据,具体机制还有待进一步研究。
| [1] | Li H, Wu X, Cheng X. Advances in diagnosis and treatment of metastatic cervical cancer[J]. J Gynecol Oncol, 2016, 27 (4): e43. DOI: 10.3802/jgo.2016.27.e43. |
| [2] | Zhu HY, Luo H, Shen ZJ, et al. Transforming growth factor-beta 1 in carcinogenesis, progression, and therapy in cervical cancer[J]. Tumor Biology, 2016, 37 (6): 7075-83. DOI: 10.1007/s13277-016-5028-8. |
| [3] | Wieringa HW, Van Der Zee AG, De Vries EG, et al. Breaking the DNA damage response to improve cervical cancer treatment[J]. Cancer Treat Rev, 2016, 42 (7): 30-40. |
| [4] | Karamurzin YS, Kiyokawa T, Parkash VA, et al. Gastric-type Endocervical Adenocarcinoma An Aggressive Tumor With Unusual Metastatic Patterns and Poor Prognosis[J]. Am J Surg Pathol, 2015, 39 (11): 1449-57. DOI: 10.1097/PAS.0000000000000532. |
| [5] | Kaigorodova EV, Bogatyuk MV. Heat shock proteins as prognostic markers of cancer[J]. Curr Cancer Drug Targets, 2014, 14 (8): 713-26. DOI: 10.2174/1568009614666140926122846. |
| [6] | Yoshidomi K, Murakami A, Yakabe K, et al. Heat shock protein 70 is involved in malignant behaviors and chemosensitivities to cisplatin in cervical squamous cell carcinoma cells[J]. J Obstet Gynaecol Res, 2014, 40 (5): 1188-96. DOI: 10.1111/jog.12325. |
| [7] | Kumar S, Stokes IJ, Singh UP, et al. Targeting Hsp70: A possible therapy for cancer[J]. Cancer Lett, 2016, 374 (1): 156-66. DOI: 10.1016/j.canlet.2016.01.056. |
| [8] | Black JD, Rezvani K. Heat shock protein 70s as potential molecular targets for colon cancer therapeutics[J]. Curr Med Chem, 2016, 23 (28): 3171-88. DOI: 10.2174/0929867323666160627105033. |
| [9] | 赵恩锋, 鲍嫘, 梁龙, 等. 热休克蛋白在宫颈癌和癌前病变中的表达[J]. 中国应用生理学杂志, 2006, 22 (2): 250-3. |
| [10] | Mckeon AM, Egan A, Chandanshive J, et al. Novel improved synthesis of HSP70 inhibitor, pifithrin-μ. in vitro synergy quantification of pifithrin-μ combined with Pt drugs in prostate and colorectal cancer cells[J]. Molecules, 2016, 21 (7): 949-59. DOI: 10.3390/molecules21070949. |
| [11] | Sekihara K, Harashima N, Tongu M, et al. Pifithrin-mu, an inhibitor of Heat-Shock protein 70, can increase the antitumor effects of hyperthermia against human prostate cancer cells[J]. PLoS One, 2013, 8 (11): 0078772. DOI: 10.1371/journal.pone.0078772. |
| [12] | Radons J. The human HSP70 family of chaperones: where do we stand[J]. Cell Stress Chaperones, 2016, 21 (3): 379-404. DOI: 10.1007/s12192-016-0676-6. |
| [13] | Saleh A, Srinivasula SM, Balkir L, et al. Negative regulation of the Apaf-1 apoptosome by Hsp70[J]. Nat Cell Biol, 2000, 2 (8): 476-83. DOI: 10.1038/35019510. |
| [14] | Shukla AK, Pragya P, Chaouhan HS, et al. Heat shock protein-70 (Hsp-70) suppresses Paraquat-Induced neurodegeneration by inhibiting JNK and caspase-3 activation in drosophila model of parkinson's disease[J]. PLoS One, 2014, 9 (6): 0098886. DOI: 10.1371/journal.pone.0098886. |
| [15] | Ko SK, Kim J, Na DC, et al. A small molecule inhibitor of ATPase activity of HSP70 induces apoptosis and has antitumor activities[J]. Chem Biol, 2015, 22 (3): 391-403. DOI: 10.1016/j.chembiol.2015.02.004. |
| [16] | Franco L, Terrinca J, Rodriguez AB, et al. Extracellular heat shock proteins protect U937 cells from H2O2-induced apoptotic cell death[J]. Mol Cell Biochem, 2016, 412 (1/2): 19-26. |
| [17] | Ishaq M, Ojha R, Sharma K, et al. Functional inhibition of Hsp70 by Pifithrin-mu switches Gambogic acid induced caspase dependent cell death to caspase Independent cell death in human bladder cancer cells[J]. Biochimica et Biophysica Acta, 2016, 1863 (11): 2560-73. DOI: 10.1016/j.bbamcr.2016.07.001. |
| [18] | Yue L, Xiang JY, Sun P, et al. Relationship between HSP70 and ERBB2 expression in breast cancer cell lines regarding drug resistance[J]. Anticancer Res, 2016, 36 (3): 1243-9. |
| [19] | Blatzer M, Blum G, Jukic E, et al. Blocking Hsp70 enhances the efficiency of amphotericin B treatment against resistant aspergillus terreus strains[J]. Antimicrob Agents Chemother, 2015, 59 (7): 3778-88. DOI: 10.1128/AAC.05164-14. |
| [20] | Sulistyowati S, Ardhianto A, Hadi S. The effect of logotherapy on the expressions of cortisol, HSP70, Beck Depression Inventory (BDI), and pain scales in advanced cervical cancer patients[J]. Health Care Women Int, 2017, 38 (2): 91-9. DOI: 10.1080/07399332.2016.1237952. |
| [21] | Sebastiao AM, Da Silva Rocha LS, Gimenez RD, et al. Carboplatinbased chemoradiotherapy in advanced cervical cancer: An alternative to cisplatin-based regimen[J]. Eur J Obstet Gynecol Reprod Biol, 2016, 201 : 161-5. DOI: 10.1016/j.ejogrb.2016.03.016. |
| [22] | Hashmi H, Maqbool A, Ahmed S, et al. Concurrent Cisplatin-Based chemoradiation in squamous cell carcinoma of cervix[J]. J Coll Physicians Surg Pak, 2016, 26 (4): 302-5. |
| [23] | Ding LH, He SH, Sun XL. HSP70 desensitizes osteosarcoma cells to baicalein and protects cells from undergoing apoptosis[J]. Apoptosis, 2014, 19 (8): 1269-80. DOI: 10.1007/s10495-014-0995-y. |
| [24] | Ciocca DR, Calderwood SK. Heat shock proteins in cancer: diagnostic, prognostic, predictive, and treatment implications[J]. Cell Stress Chaperones, 2005, 10 (2): 86-103. DOI: 10.1379/CSC-99r.1. |
 2017, Vol. 37
2017, Vol. 37

