2. 广东省人民医院//广东省医学科学院病理科,广东 广州 510080;
3. 南方医科大学实验动物中心,广东 广州 510515
2. Department of Pathology, Guangdong General Hospital/Guangdong Academy of Medical Sciences, Guangzhou 510080, China;
3. Department of Laboratory Animal Center, Southern Medical University, Guangzhou 510515, China
结外NK/T细胞淋巴瘤属于非霍奇金淋巴瘤的一种罕见病理类型,具有显著的人群和地理分布差异,在亚洲及拉丁美洲国家发病率高,好发于中青年[1-2]。临床上具有高度侵袭性[3],采用全身性化疗联合局部放疗,60%~80%分期为Ⅰ/Ⅱ病人的可获得完全缓解,而对于进展期 (Ⅲ/Ⅳ) 及难治复发的患者,以蒽环类为基础的化疗效果极差,1年总生存期不到50%。近年来,以左旋-门冬酰胺酶为基础的化疗治疗进展期及难治复发结外NK/T细胞淋巴瘤被证实有明显疗效[4-5],但仍有一部分患者对左旋-门冬酰胺酶治疗产生耐药,导致治疗失败[6-7]。既往认为天冬酰胺合成酶通过直接、间接补偿机制导致肿瘤细胞对左旋-门冬酰胺酶耐药[8-10],在难治/复发的NK/T细胞淋巴瘤中,天冬酰胺合成酶表达水平及其他因素对以左旋-门冬酰胺酶为基础的化疗有何临床意义目前不清楚,国内外也未见明确报道。因此,本文回顾性分析以左旋-门冬酰胺酶为基础的化疗在10例难治/复发的结外NK/T细胞淋巴瘤的疗效并探索天冬酰胺合成酶表达量与疗效的关系,拟为左旋-门冬酰胺酶临床应用提供依据。
1 资料和方法 1.1 临床资料收集我科从2013年1月~2016年1月经病理形态学和免疫组化确诊的10例经其他方案化疗失败的复发/难治的结外NK/T细胞淋巴瘤 (表 1)。其中男7例,女3例;平均年龄18~65岁,年龄 < 60岁的8例,≥60岁的2例,中位年龄38岁,所有患者完善以下相关检查:血常规、血生化、心电图、头颈部CT或MRI、胸片、腹部B超或胸腹部CT、骨髓穿刺、ECT或PET/CT等。确定无化疗禁忌症,均接受至少2周期挽救性化疗。
| 表 1 患者治疗及生存情况 Table 1 Data of treatments and outcomes of the 10 patients with relapsed or refractoryextranodal NK/T cell lymphoma |
参考夏忠军教授报道的Pg-GEOX方案[11],每例患者至少接受2个周期改良的Pg-GEOX-RT方案:(1) 培门冬酶2500 U/m2肌注,分2个部位,第1天;(2) 第1、8天盐酸吉西他滨1000 mg/m2加入0.9%生理盐水100 mL中,静脉滴入;(3) 奥沙利铂130 mg/m2加入5%葡萄糖250 mL中静脉滴入,21 d为一疗程,期间接受局部放疗 (R),放射治疗是采用能量为6 MV直线加速器,单独放疗照射剂量≥50 Gy,放疗中位照射剂量45~50 Gy,采用常规分割2 Gy/d,5次/周。照射野包括原发部位及边缘区域。每次化疗前半小时给予苯海拉明、地塞米松预处理。定期复查血常规、肝肾功能。至少完成2周期后评价疗效,疗效评估参考2007年修订的标准执行[12]。
1.3 疗效评估2个周期化疗后进行全身疗效评估 (影像学资料、实验室检查、症状、体征)。按WHO疗效评价标准,治疗反应包括完全缓解、部分缓解、稳定、进展,同时将完全缓解、部分缓解、稳定定义为效果佳,将进展定义为不佳。
1.4 支链DNA液相芯片技术 (bDNA-LCT)bDNA-LCT技术用于检测NK/T细胞淋巴瘤组织中天冬酰胺合成酶mRNA表达水平。石蜡包埋的淋巴瘤组织样品溶解,溶解后的组织释放RNA,球形粒子捕捉靶向RNA,RNA信号被扩大,Luminex系统检测靶向mRNA表达水平。多功能流式点阵仪检测、处理并统一分析原始数据。根据天冬酰胺合成酶mRNA表达量的中位数 (0.695),将大于或等于中位数的定义为高表达组 (6例患者),而低于中位数的定义为低表达组 (4例患者)。
1.5 研究终点和统计学分析选择复发后总生存期为研究终点,计算从首次复发到死亡时间。所有的数据由SPSS 16.0软件处理。Pearson's χ2值或者Fisher's确切概率法用于分析天冬酰胺合成酶表达量与临床病理特征的关系。Kaplan-Meier法评估生存概率。P < 0.05为差异有统计学意义。
2 结果 2.1 治疗反应及生存情况治疗及生存情况详见列表 1。10例患者中2例完全缓解 (20%),1例部分缓解 (10%),1例稳定 (10%),6例进展 (60%)。平均中位随访17个月 (2~28个月),半年总生存期及无进展生存期分别为60%和60%。到目前为止,4例患者仍存活,其中1例患者复发。5例患者死于疾病进展,另1例患者因年龄大伴体能状态差,最终因感染性休克死亡。
2.2 天冬酰胺合成酶在复发/难治的结外NK/T细胞淋巴瘤中的表达情况利用bDNA-LCT分析10例经石蜡包埋的复发/难治的NK/T细胞淋巴瘤组织及5例慢性鼻炎中天冬酰胺合成酶mRNA表达量。复发/难治的NK/T细胞淋巴瘤组织与慢性鼻炎组织中天冬酰胺合成酶mRNA表达存在差异 (0.751±0.061、0.515±0.014,P < 0.05)。
2.3 天冬酰胺合成酶表达量与临床病理特征之间的关系我们收集资料并分析10例复发/难治的NK/T细胞淋巴瘤组织中天冬酰胺合成酶表达量与临床病理的关系 (表 2),Pearson's χ2 test证实在复发/难治的NK/T细胞淋巴瘤患者中天冬酰胺合成酶表达量与国际预后指数有一定的关联 (P=0.002),其他临床特征与天冬酰胺合成酶表达量无密切联系,其中包括年龄、性别、病灶累及部位、分期、EB病毒载量、血清乳酸脱氢酶水平等。
| 表 2 10例复发/难治的结外NK/T细胞淋巴瘤患者临床病理特征与天冬酰胺合成酶表达之间的关系 Table 2 Correlation of ASNS expression with the clinicopathological features of 10 patients with relapsed or refractory extranodalNK/T cell lymphoma |
利用Kaplan-Meier生存曲线分析了天冬酰胺合成酶不同表达量下患者总生存期及无疾病进展期情况 (图 1)。分析显示平均的无疾病进展期在天冬酰胺合成酶低表达组和天冬酰胺合成酶高表达组分别是216.5d (95% CI,146.0-286.9) 和127.1d (95% CI,79.9-174.3,P=0.08);平均总生存期在低表达组是380d (95% CI,250.9-509.0),在高表达组是182d (95% CI,128.5-1235.4,P=0.15)。
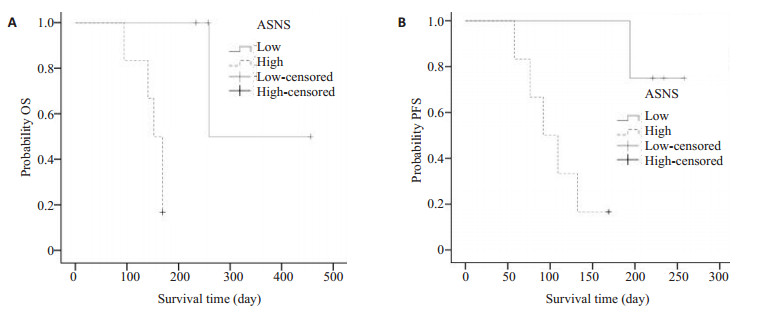
|
图 1 天冬酰胺合成酶低及高表达组Kaplan-Meier生存曲线 Figure 1 Kaplan-Meiersurvival curves of patients with high and low ASNS expression levels. A: Overall survival; B: Progression-free survival. |
NK/T细胞淋巴瘤作为恶性克隆性血液肿瘤具有恶性肿瘤所共有的疾病特点,侵袭性强,生存期短,预后差[13-14]。由于NK/T细胞淋巴瘤存在多重耐药的特性,常规方案对难治/复发的结外NK/T细胞淋巴瘤治疗效果差[15]。研究认为以左旋门冬酰胺酶为基础的化疗明显提高疗效及改善预后,其机制认为左旋门冬酰胺酶一方面消耗胞内门冬酰胺,诱导肿瘤细胞凋亡,另一方面抑制门冬酰胺的合成,而达到良好的临床疗效[16]。令人遗憾的是,部分患者接受左旋门冬酰胺酶为基础的化疗依然无效,目前对这些病人无更多措施,其具体机制也不明确。既往研究认为天冬酰胺合成酶的表达水平反映了白血病细胞对左旋门冬酰胺酶的敏感性[17-18]。此外,Rotoli等[19]使用谷氨酰胺合成酶的抑制剂抑制该酶的活性,诱导对左旋门冬酰胺酶耐药的细胞凋亡。由此可见,天冬酰胺合成酶的表达水平与对左旋门冬酰胺酶的敏感性存在一定的关联。那么它在NK/T细胞淋巴瘤中的临床意义如何呢?有研究认为大多数淋巴样肿瘤中天冬酰胺合成酶启动子甲基化水平与左旋门冬酰胺酶的敏感性呈负相关,但并未阐明左旋门冬酰胺酶对复发/难治的NK/T细胞淋巴瘤耐药的机制[20]。本文回顾性分析既往以门冬酰胺酶为基础化疗的病例,结果表明高表达天冬酰胺合成酶的淋巴瘤组治疗效果较低表达组差。Chien等[21]研究认为可能是天冬酰胺合成酶通过直接、间接补偿机制导致肿瘤细胞对门冬酰胺酶耐药,本研究通过分析天冬酰胺合成酶在组织中的表达量及与其它病理特征的关系,证实天冬酰胺合成酶表达量与国际预后指数呈正相关 (P=0.023),而其他临床特征与天冬酰胺合成酶表达量无密切相关,包括年龄、性别、病灶累及部位、分期、EB病毒载量、血清乳酸脱氢酶水平等,这与Li等[22]研究结果不一致,可能与我们的样本量少有关。此外,我们利用Kaplan-Meier生存曲线分析天冬酰胺合成酶表达量与预后的关系,结果发现高表达天冬酰胺合成酶的患者总生存期及无疾病进展期较低表达组短,表明这些患者预后较差且对含门冬酰胺酶为基础化疗无效,其机制可能是天冬酰胺合成酶在调节细胞周期中扮演重要角色,高表达天冬酰胺合成酶导致肿瘤细胞周期紊乱,对治疗不敏感[23]。此外,NK/T细胞淋巴瘤经门冬酰胺酶处理后胞内低表达的天冬酰胺合成酶会激活GCN2-eIF2-ATF4信号,促进天冬酰胺合成酶的表达及天冬酰胺的合成,进一步导致淋巴瘤对左旋门冬酰胺酶耐药[24-25]。综上所述,低表达天冬酰胺合成酶的淋巴瘤更适合以左旋门冬酰胺酶为基础的方案治疗。这样有利于避免因盲目使用左旋门冬酰胺酶而带来的副作用及经济负担。下一步我们将通过大样本和体内外验证左旋门冬酰胺酶治疗前后天冬酰胺合成酶表达的差异,为解决难治/复发的结外NK/T细胞淋巴瘤耐药提供新的思路。
| [1] | Au WY, Weisenburger DD, Intragumtornchai T, et al. Clinical differences between nasal and extranasal natural killer/T-cell lymphoma: a study of 136 cases from the International Peripheral T-Cell Lymphoma Project[J]. Blood, 2009, 113 (17): 3931-7. DOI: 10.1182/blood-2008-10-185256. |
| [2] | Takata K, Hong ME, Sitthinamsuwan P, et al. Primary cutaneous NK/T-cell lymphoma, nasal type and CD56-positive peripheral T-cell lymphoma: a cellular lineage and clinicopathologic study of 60 patients from Asia[J]. Am J Surg Pathol, 2015, 39 (1): 1-12. DOI: 10.1097/PAS.0000000000000312. |
| [3] | Lee J, Suh C, Park YH, et al. Extranodal natural killer T-cell lymphoma, nasal-type: A prognostic model from a retrospective multicenter study[J]. J Clin Oncol, 2006, 24 (4): 612-8. DOI: 10.1200/JCO.2005.04.1384. |
| [4] | Jaccard A, Gachard N, Marin B, et al. Efficacy of L-asparaginase with methotrexate and dexamethasone (AspaMetDex regimen) in patients with refractory or relapsing extranodal NK/T-cell lymphoma, a phase 2 study[J]. Blood, 2011, 117 (6): 1834-9. DOI: 10.1182/blood-2010-09-307454. |
| [5] | Yong W. Clinical study of l-asparaginase in the treatment of extranodal NK/T-cell lymphoma, nasal type[J]. Hematol Oncol, 2016, 34 (2): 61-8. DOI: 10.1002/hon.v34.2. |
| [6] | Yamaguchi M, Kwong YL, Kim WS, et al. Phase Ⅱ study of SMILE chemotherapy for newly diagnosed stage Ⅳ, relapsed, or refractory extranodal natural killer (NK)/T-cell lymphoma, nasal type: the NK-Cell Tumor Study Group study[J]. J Clin Oncol, 2011, 29 (33): 4410-6. DOI: 10.1200/JCO.2011.35.6287. |
| [7] | Bi XW, Jiang WQ, Zhang WW, et al. Treatment outcome of patients with advanced stage natural killer/T-cell lymphoma: elucidating the effects of asparaginase and postchemotherapeutic radiotherapy[J]. Ann Hematol, 2015, 94 (7): 1175-84. DOI: 10.1007/s00277-015-2336-9. |
| [8] | Chen SH. Asparaginase therapy in pediatric acute lymphoblastic leukemia: a focus on the mode of drug resistance[J]. Pediatr Neonatol, 2015, 56 (5): 287-93. DOI: 10.1016/j.pedneo.2014.10.006. |
| [9] | Zhang B, Dong LW, Tan YX, et al. Asparagine synthetase is an Independent predictor of surgical survival and a potential therapeutic target in hepatocellular carcinoma[J]. Br J Cancer, 2013, 109 (1): 14-23. DOI: 10.1038/bjc.2013.293. |
| [10] | Haskell CM, Canellos GP. L-asparaginase resistance in human leukemia--asparagine synthetase[J]. Biochem Pharmacol, 1969, 18 (10): 2578-80. DOI: 10.1016/0006-2952(69)90375-X. |
| [11] | Wang L, Wang ZH, Chen XQ, et al. First-line combination of gemcitabine, oxaliplatin, and L-asparaginase (GELOX) followed by involved-field radiation therapy for patients with stage IE/ⅡE extranodal natural killer/T-cell lymphoma[J]. Cancer, 2013, 119 (2): 348-55. DOI: 10.1002/cncr.27752. |
| [12] | Cheson BD. The international harmonization project for response criteria in lymphoma clinical trials[J]. Hematol Oncol Clin North Am, 2007, 21 (5): 841-54. DOI: 10.1016/j.hoc.2007.06.011. |
| [13] | Qi S, Yahalom J, Hsu M, et al. Encouraging experience in the treatment of nasal type extra-nodal NK/T-cell lymphoma in a non-Asian population[J]. Leuk Lymphoma, 2016, 57 (11): 2575-83. DOI: 10.1080/10428194.2016.1180689. |
| [14] | Lim ST, Hee SW, Quek R, et al. Comparative analysis of extranodal NK/T-cell lymphoma and peripheral T-cell lymphoma: significant differences in clinical characteristics and prognosis[J]. Eur J Haematol, 2008, 80 (1): 55-60. |
| [15] | Wang B, Li XQ, Ma X, et al. Immunohistochemical expression and clinical significance of P-glycoprotein in previously untreated extranodal NK/T-cell lymphoma, nasal type[J]. Am J Hematol, 2008, 83 (10): 795-9. DOI: 10.1002/ajh.v83:10. |
| [16] | Ando M, Sugimoto K, Kitoh T, et al. Selective apoptosis of natural killer-cell tumours by l-asparaginase[J]. Br J Haematol, 2005, 130 (6): 860-8. DOI: 10.1111/bjh.2005.130.issue-6. |
| [17] | 李本尚, 何映谊, 罗长缨, 等. 人白血病细胞株对L-门冬酰胺酶敏感性与门冬酰胺合成酶表达水平的相关性[J]. 中国实验血液学杂志, 2010, 18 (3): 559-63. |
| [18] | Aslanian AM, Fletcher BS, Kilberg MS. Asparagine synthetase expression alone is sufficient to induce l-asparaginase resistance in MOLT-4 human leukaemia cells[J]. Biochem J, 2001, 357 (Pt 1): 321-8. |
| [19] | Rotoli BM, Uggeri J, Dall'asta V, et al. Inhibition of glutamine synthetase triggers apoptosis in asparaginase-resistant cells[J]. Cell Physiol Biochem, 2005, 15 (6): 281-92. DOI: 10.1159/000087238. |
| [20] | Smallwood TL, Small GW, Suter SE, et al. Expression of asparagine synthetase predicts in vitro response to L-asparaginase in canine lymphoid cell lines[J]. Leuk Lymphoma, 2014, 55 (6): 1357-65. DOI: 10.3109/10428194.2013.842980. |
| [21] | Chien WW, Le Beux C, Rachinel N, et al. Differential mechanisms of asparaginase resistance in B-type acute lymphoblastic leukemia and malignant natural killer cell lines[J]. Sci Rep, 2015, 5 : 8068. DOI: 10.1038/srep08068. |
| [22] | Li Y, Zhang X, Hu T, et al. Asparagine synthetase expression and its potential prognostic value in patients with NK/T cell lymphoma[J]. Oncol Rep, 2014, 32 (2): 853-9. |
| [23] | Yang H, He X, Zheng Y, et al. Down-regulation of asparagine synthetase induces cell cycle arrest and inhibits cell proliferation of breast cancer[J]. Chem Biol Drug Des, 2014, 84 (5): 578-84. DOI: 10.1111/cbdd.2014.84.issue-5. |
| [24] | Balasubramanian MN, Butterworth EA, Kilberg MS. Asparagine synthetase: regulation by cell stress and involvement in tumor biology[J]. Am J Physiol Endocrinol Metab, 2013, 304 (8): E789-99. DOI: 10.1152/ajpendo.00015.2013. |
| [25] | Bunpo P, Dudley A, Cundiff JK, et al. GCN2 protein kinase is required to activate amino acid deprivation responses in mice treated with the anti-cancer agent L-asparaginase[J]. J Biol Chem, 2009, 284 (47): 32742-9. DOI: 10.1074/jbc.M109.047910. |
 2017, Vol. 37
2017, Vol. 37

