2. 重庆三峡中心医院百安分院普外科,重庆 404000;
3. 重庆重庆市第九人民医院普外科,重庆 400799;
4. 重庆医科大学附属第二医院肝胆外科,重庆 400010
2. Department of General Surgery, Bai'an Branch of Chongqing Three Gorges Central Hospital, Chongqing 404000, China;
3. Department of General Surgery, Ninth People's Hospital of Chongqing, Chongqing 400799, China;
4. Department of Hepatobiliary Surgery, Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
同种异体肝移植是终末期肝病最有效的治疗措施,尽管免疫抑制剂的的应用已大大改善了肝移植的预后,但由此引起的一系列副反应以及急性排斥反应的发生仍然是造成患者生存质量降低的主要因素[1-2]。人体内大部分自身免疫性疾病都涉及到辅助性T细胞 (Th)/调节性T细胞 (Treg) 数量和功能上的失衡。TIM分子作为一种新型共刺激分子,在Th细胞的激活和分化上发挥着重要的作用。TIM基因家族在小鼠由8个成员 (TIM-1~4和4个假象蛋白TIM-5~8),在人类由3个成员组成 (TIM-1、3、4),两者氨基酸序列具有高度同源性[3-4]。TIM-1主要表达于CD4+T细胞以及树突状细胞,TIM-3是Th1细胞上的特异性表面分子[5]。与其他TIM成员不同的是,TIM-4不表达在T细胞,而是高表达于抗原提呈细胞 (APC),与其假定配体结合能够促进Th2细胞应答,从而参与免疫调节过程[4, 6]。目前对TIM-4的研究主要集中在变态反应性疾病以及肿瘤免疫调节[3, 7-8],而其在肝移植免疫调节的作用未有相关报道。KCs是定居于肝血窦内的巨噬细胞,作为体内最大的抗原提呈细胞群,是肝脏具有致耐受免疫原性的重要组成,因此其功能状态在Th1/Th17以及Th2/Treg平衡偏移上由着至关重要的调节作用[9-10]。因此,我们猜想阻断Kupffer细胞 (KCs) TIM-4的功能能有效改善肝移植后导致的急性排斥反应,并探讨其可能机制,从而阐明TIM-4对肝移植术后急性排斥反应的影响。
1 材料和方法 1.1 实验动物和主要试剂实验动物:供体为健康雄性C57BL/6小鼠,受体为健康雄性C3H小鼠,鼠龄均8~10周,体质量均16~22 g,各54只 (均购自重庆医科大学实验动物中心),饲养于重庆医科大学实验动物中心SPF实验室。主要试剂:Ⅳ型胶原酶购自美国Sigma;Percoll小鼠淋巴细胞分离液购自上海新睿生物科技有限公司;TIM-4 mAb (RMT4-53) 购自美国GeneTex;总RNA提取试剂盒购自日本Takara;PCR引物由上海生工生物工程公司合成;Foxp3-PE、CD25-FITC购自美国eBioscience;肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)、CC族趋化因子2 (CCL2) 单克隆抗体购自美国GeneTex;CD163、p-P65、p-P38单克隆抗体购自美国Abcam;氯膦酸二钠脂质体 (CL) 购自上海起福生物科技公司;ELISA试剂盒购自美国Active motif;总蛋白提取试剂购自上海碧云天生物技术有限公司。
1.2 小鼠原位肝移植模型的建立和分组采用改良的Kamad“a二袖套管”法建立C57BL/6→C3H小鼠配对组合的原位肝移植急性排斥模型。为了防止肝窦内皮细胞机械性损伤,以2 mL/min灌洗0~4 ℃ 6 mL乳酸钠林格氏液灌注供肝。热缺血时间控制在0 min,冷缺血时间控制在1 h,无肝期控制在20 min。在单纯原位肝移植急性排斥模型中,于术后1、2、3、4、7 d处死小鼠,取肝脏提取细胞,余下肝脏液氮保存。在处理实验动物中,随机分为3组:Sham组,小鼠开腹手术暴露门静脉,并经门静脉注入1 mL磷酸缓冲盐溶液 (PBS);Control mAb组,于供体冷血期经门静脉注入含TIM-4同型对照抗体 (0.35 mg/只)1 mL PBS;TIM-4 mAb组,于供体冷血期经门静脉注入含抗TIM-4抗体 (0.35 mg/只) 的1 mL PBS。各组均于术后3 d经尾静脉再次分别注入上述液体。术后记录小鼠的精神状况、活动情况、对外界刺激源反映情况。每组6只小鼠作为观察生存期之用,观察期以小鼠死亡为终点;另6只小鼠在移植后7 d麻醉状态下,开腹后腹主动脉穿刺取血0.5 mL,离心5 min,上清液-80 ℃保存,取下中叶肝组织备检、液氮保存。余部分固定包埋。
术前24 h,乙醚麻醉下经C57BL/6小鼠门静脉注入CL (10 mg/kg),24 h后再将供肝移植到C3H大鼠体内,之后处理如上述分组处理情况,实验动物随机分为CL + Sham组,CL + Control mAb组,CL + TIM-4 mAb组。移植后7 d麻醉状态下,取下中叶肝组织备检、液氮保存。余部分固定包埋。
1.3 免疫组织化学检测KCs浸润石蜡切片,按试剂盒步骤进行。正常山羊血清封闭液,室温20 min,滴加纯化抗小鼠CD163或Foxp3单克隆抗体 (工作浓度为1:100),湿盒中4 ℃过夜。滴加辣根过氧化物酶标记的抗兔IgG二抗 (1:200稀释),37 ℃孵育30 min。二氨基联苯胺显色30 min。苏木素复染,树脂封片,镜下观察,细胞核呈紫蓝色,阳性产物呈棕黄色或黄色颗粒。
1.4 激光共聚焦检测KCs TIM-4表达取移植术后7 d受体小鼠肝脏,参照Dai等[11]介绍的胶原酶肝脏原位灌注法分离KCs,将细胞浓度调整至1×106/mL。将提取的各组贴壁KCs进行细胞爬片,将爬片的细胞用4%多聚甲醛固定10 min,PBS洗3次,爬片置于1% BSA封闭液、10%山羊血清和含0.3 mol/L甘氨酸的0.1% PBS-TWEEN的混合封闭液封闭1 h,PBS洗3次,加入一抗TIM-4工作液 (1:200),4 ℃孵育过夜。PBS溶液洗3次×3 min,将细胞爬片置于TRITC标记的二抗工作液 (1:200),4 ℃避光孵育30 min。PBS溶液洗3次×3 min。然后封片,封片剂为含有4',6-二脒基-2-苯基吲哚的抗荧光淬灭的封片剂。激光共聚焦显微镜下观察各组TIM-4表达情况。
1.5 肝组织病理观察取移植肝组织放入10%中性甲醛中固定→常规脱水→二甲苯透明→石蜡包埋→3 μm厚切片→脱蜡、脱水→HE染色,400倍光学显微镜观察肝组织病变情况;根据Banff等制定的急性排斥反应标准进行病理分级。
1.6 血清肝功能及细胞因子测定使用全自动生化分析仪检测小鼠血清肝功能血清谷草转氨酶 (AST)、谷丙转氨酶 (ALT)、总胆红素 (TBIL) 水平;根据ELISA检测试剂盒说明书检测小鼠肝组织匀浆TNF-α、IFN-γ、CCL2表达水平。每组实验重复3次。
1.7 Western blot和Real-time PCR分析采用Trizol试剂,参照说明对各组总RNA进行提取。每个样本取5 μg总RNA逆转录成cDNA后行荧光定量PCR,每组PCR反应均连续重复3次。采用2-△△CT法计算原始CT值数据。空白对照组数据归一化处理,以其他组数据与空白对照组的比值为纵坐标作柱状图。
按照总蛋白提取试剂盒说明提取各组总蛋白,并进行蛋白浓度测定,蛋白经变性后,40 μg加入上样孔于12% SDS-PAGE进行电泳分离,电转至聚偏二氟乙烯膜,5%脱脂奶粉4 ℃下封闭1.5 h,TBST缓冲液 (Tris buffered saline with Tween 20) 冲洗3次×10 min,一抗4 ℃过夜孵育,TBST冲洗3次×10 min,二抗37 ℃孵育1 h,TBST冲洗3次×10 min,加增强化学发光液,X线曝光、显影、定影,然后用UVP凝胶图像处理系统软件分析目的条带的灰度值
1.8 流式细胞仪检测提取各组小鼠肝组织T细胞,分别向细胞悬液中加入荧光素标价的抗体 (PE-Foxp3、FITC-CD25),室温避光孵育30 min,再加入2 mL含0.09%叠氮化钠的PBS,震荡混匀后1000 r/min,离心5 min,弃上清,PBS重悬细胞上流式细胞仪检测。
1.9 统计学分析应用SPSS 18.0进行统计学分析。计量资料以均数±标准差表示,满足方差齐性时,组间比较用单因素方差分析和独立样本的t检验,不满足方差齐性时,组间比较用秩和检验,生存资料分析用Log-Rank方法。P < 0.05为差异有统计学意义。
2 结果 2.1 肝移植术后Kupffer细胞活化数以及TIM-4表达增多免疫组化检测各时间点肝组织KCs细胞活化数发现,KCs的活化数随着时间变化逐渐增多 (图 1)。提取肝脏KCs,Western blot以及PCR结果示,随着时间的变化,KCs表达TIM-4逐渐增加,3 d表达达高峰,之后处于一个较高的水平,1、3、7 d TIM-4蛋白相对表达水平分别为0.48 ± 0.05、0.97 ± 0.05、0.92 ± 0.03,明显高于Sham组的0.14±0.02(P < 0.05),mRNA相对表达水平分别1.96±0.07、5.25±0.23、4.02±0.17,显著高于Sham组的0.98±0.03(P < 0.05,图 2)。
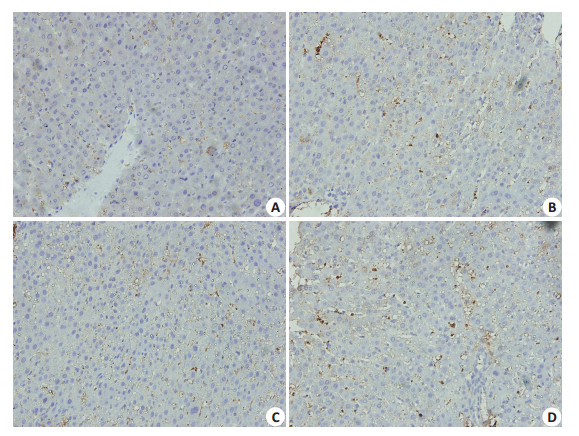
|
图 1 移植术后肝脏Kupffer细胞活化 Figure 1 Activated Kupffer cells in the liver graft (Original magnification: × 400). A-D: 1, 2, 3, and 4 days after operation, respectively. The activated Kupffer cells were stained brown. |
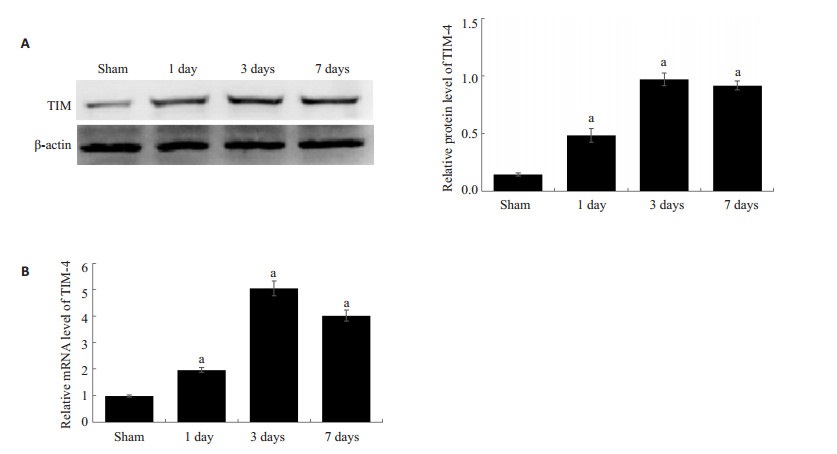
|
图 2 移植术后肝脏Kupffer细胞TIM-4表达 Figure 2 TIM-4 expression of Kupffer cells in liver grafts. A: Western blotting for TIM-4 expressions at different time points; B: Quantitative analysis of TIM-4 mRNA expression detected with RT-PCR. aP < 0.05 vs sham group. |
提取各组肝脏KCs,激光共聚焦检测KCs TIM-4表达情况发现,TIM-4 mAb组TIM-4荧光表达强度明显低于Control mAb组 (P < 0.05),提示阻断KCs TIM-4成功 (图 3)。
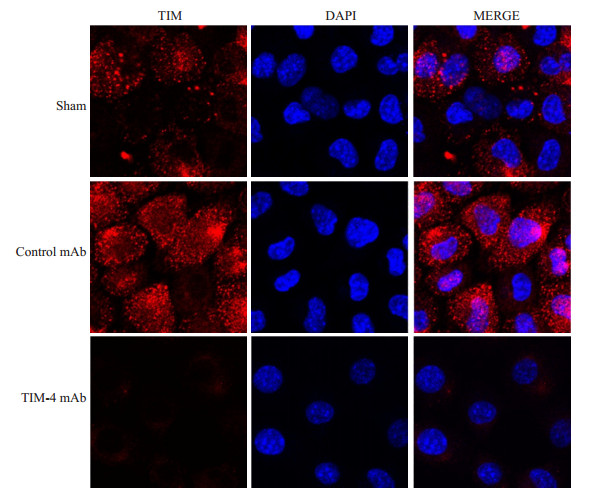
|
图 3 术后7 d各组Kupffer细胞TIM-4荧光表达 Figure 3 TIM-4 fluorescent expression in Kupffer cells in each group 7 days after transplantation. TIM-4: Red fluorescence (membrane); DAPI: Blue fluorescence (nucleus). |
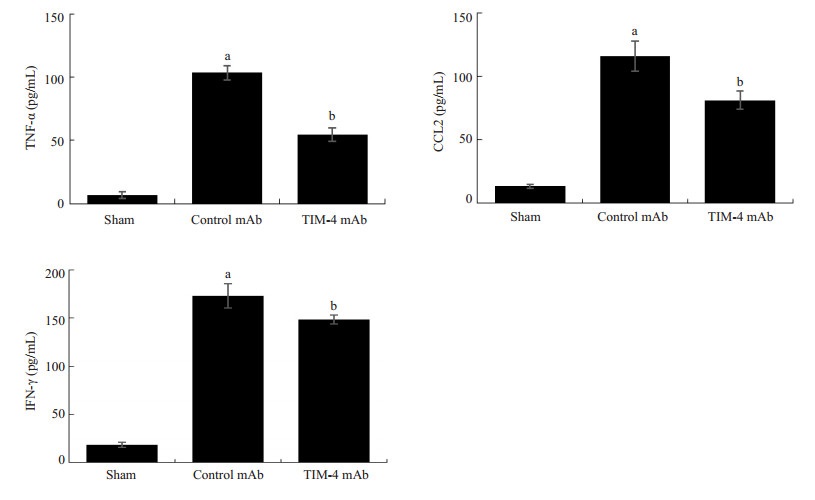
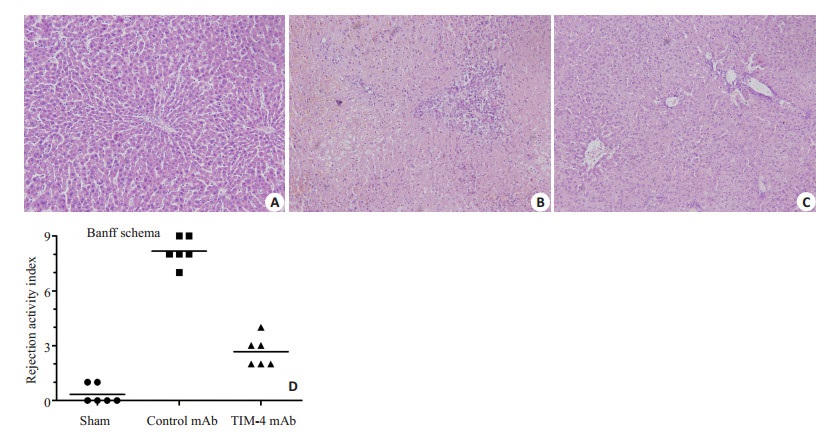
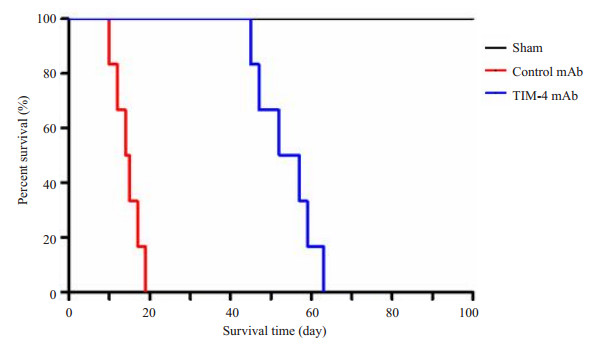
通过门静脉灌注TIM-4 mAb,阻断肝脏TIM-4的表达,术后7 d检测受体肝功能指标以及炎症因子发现,与Sham组比较,Control mAb组血清肝功AST、ALT、TBIL以及肝组织匀浆炎症因子TNF-α、IFN-γ、CCL2水平明显增高与相比,且差异具有统计学意义 (P < 0.05) 而TIM-4 mAb组上述指标水平明显低于Control mAb组,且差异具有统计学意义 (P < 0.05,图 4、5)。Western blot检测肝脏组织炎症因子蛋白表达和上述结果一致 (图 6)。肝移植术后7 d分别对各组肝脏行HE染色发现:Sham组肝脏组织未见排斥反应改变;Control mAb组病理改变排斥活动指数 (RAI) 平均得分为8.17±0.69,集中于重度排斥反应;TIM-4 mAb组RA平均得分为2.67±0.75,集中于轻度排斥反应,与Control mAb组,差异具有统计学意义 (P < 0.05,图 7)。且TIM-4 mAb组小鼠平均存活时间 (53.8±6.4) d明显长于Control mAb组平均存活时间 (14.5±2.9) d,差异具有统计学意义 (P < 0.05,图 8),这说明阻断KCs TIM-4的表达有利于免疫耐受环境的形成。
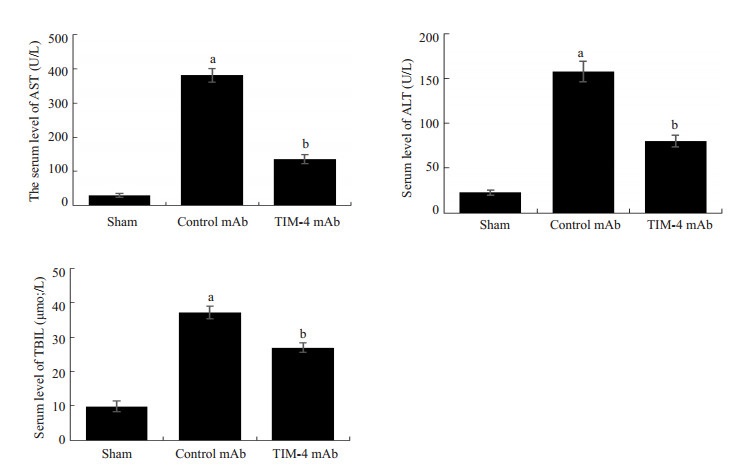
|
图 4 术后7 d各组肝功能比较 Figure 4 Comparison of hepatic function among the 3 groups on day 7 after transplantation. aP < 0.05 vs Sham group; bP < 0.05 vs Control mAb group. |
|
图 5 术后7 d各组血清炎症因子比较 Figure 5 Comparison of serum inflammatory factors among the 3 group on day 7 after transplantation. aP < 0.05 vs Sham group; bP < 0.05 vs Control mAb group. |

|
图 6 术后7 d各组肝组织炎症因子蛋白表达比较 Figure 6 Protein expression of inflammatory factors on day 7 after transplantation. aP < 0.05 vs Sham group; bP < 0.05 vs Control mAb group. |
|
图 7 术后7 d肝脏HE染色 Figure 7 HE staining of the liver grafts on day 7 after transplantation (× 400). A: Sham group; B: Control mAb group; C: TIM-4 mAb group; D: Banff schema. |
|
图 8 术后各组小鼠生存曲线 Figure 8 Survival curves of the mice after transplantation. |
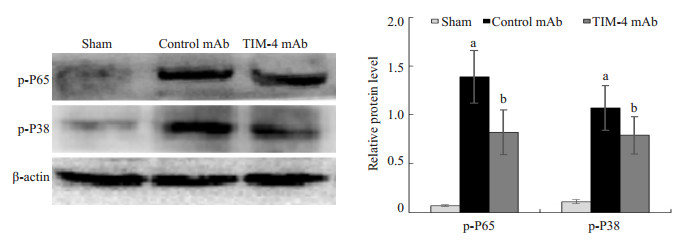
Western blot检测各组KCs NF-κB通路关键因子P65以及MAPK通路关键因子P38发现,TIM-4 mAb组p-P65以及p-P38蛋白表达水平分别为0.82±0.23、0.54± 0.10,与Control mAb组1.39±0.27、1.07±0.23比较,差异具有统计学意义 (P < 0.05,图 9)。这也说明阻断KCs TIM-4表达可能通过影响NK-κB以及MAPK信号通路来减少肝移植后炎症反应的产生。
|
图 9 术后7 d各组NF-κB以及MAPK通路相关蛋白表达比较 Figure 9 Expressions of NF-κB and MAPK pathway-related proteins on day 7 after transplantation in each group. aP < 0.05 vs Sham group; bP < 0.05 vs Control mAb group. |
CL具有高性能巨噬细胞耗遏功能[7]。我们预先用CL处理供体小鼠,破坏KCs作用。移植术后7d病理结果发现,CL+TIM-4 mAb组和CL+Control mAb组RAI平均得分分别为8.01±0.64、7.93±0.56,属于重度排斥反应,两者比较差异无统计学意义 (P > 0.05,图 10)。因此,TIM-4 mAb主要是阻断了KCs TIM-4的功能影响肝脏排斥反应,并且KCs在诱导肝移植免疫耐受中发挥了主要的作用。
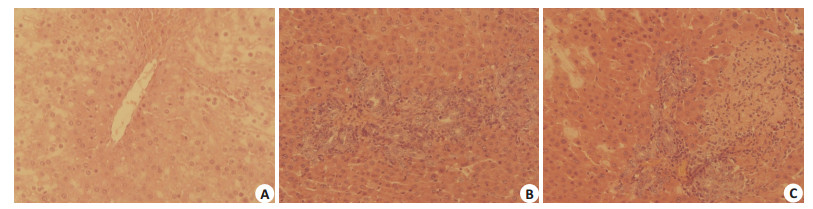
|
图 10 术后7 d肝脏HE染色 Figure 10 HE staining in each group on day 7 after transplantation (Chlorine phosphonic acid disodium pretreatment, ×400). A: CL+ Sham group; B: CL+Control mAb group; C: CL+ TIM-4 mAb group. |
从流式结果来看,TIM-4 mAb组肝组织Foxp3+ iTreg细胞的产生明显多于Control mAb组 (P < 0.05,图 11),这也提示了阻断KCs TIM-4可能通过某种途径诱导iTreg细胞的产生,从而形成免疫耐受。
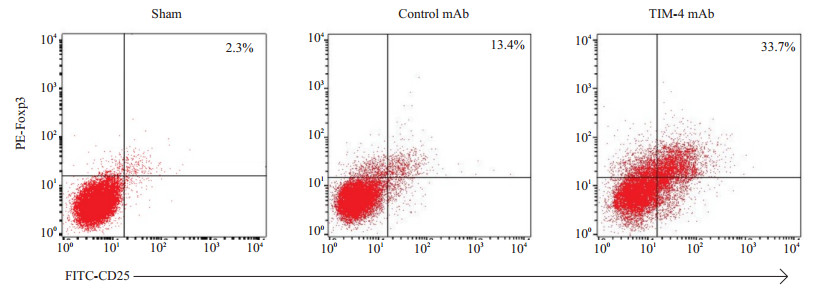
|
图 11 术后7 d各组肝组织CD25+Foxp3+T细胞产生情况 Figure 11 Production of CD25+Foxp3+T cells in each group on day 7 after transplantation. |
TIM-4主要高表达于APC成员中的巨噬细胞,KCs作为体内最大的APCs,选择性的高表达TIM-4分子。有研究显示,用脂多糖体外刺激小鼠肝脏单个核细胞,TIM-4表达上调,此外,体内注射脂多糖后脾脏CD11b+细胞表达Tim-4上调,即巨噬细胞活化后TIM-4表达上调[12-13]。本实验中,我们通过建立小鼠原位肝移植急性排斥模型发现,小鼠肝脏KCs的活化数随着时间的变化逐渐增加,并且活化后的KCs TIM-4表达上调,移植术后3 d达到高峰,之后处于较高的水平,这说明了随着急性排斥反应的加重,炎症环境处于活化状态的KCs高表达TIM-4。
TIM-4是TIM-1的天然配体,TIM-4/TIM-1的相互作用可以调节Th1/Th2细胞平衡[4, 14]。在肾脏缺血再灌注损伤中发现,TIM-1/TIM-4通路参与了CD4+T细胞的激活与分化,抑制此通路能够保护肾功能以及减小缺血再灌注的损伤[15]。另外,肝脏缺血再灌注发现,阻断小鼠肝脏TIM-4的表达,可有效减少巨噬细胞的浸润、吞噬以及Toll样受体2/4/9所依赖的信号通路的激活,减少相关炎症因子的产生 (白介素6、白介素1β、TNF-α),从而减轻缺血再灌注损伤[15]。由此推测,阻断KCs TIM-4有可能在肝移植排斥反应中发挥一定的作用。本研究中我们通过门静脉注射TIM-4 mAb阻断肝脏KCs TIM-4发现,小鼠肝功明显改善,血清TNF-α、IFN-γ、CCL2炎症因子分泌减少,并且能有效改善肝组织病理变化,小鼠术后生存率明显提高。我们还通过门静脉注射CL破坏了供体小鼠KCs功能,发现CL + TIM-4 mAb组和CL + Control mAb组肝脏病理组织RAI平均得分比较差异无统计学意义。以上结果也说明了阻断KCs TIM-4的功能能够明显改善肝组织损伤程度,并且KCs TIM-4的功能阻断在肝移植免疫耐受的形成中发挥了主要的作用。
NF-κB是近年来发现的细胞内最重要的转录因子,NF-κB的活化是KCs产生炎症因子必不可少的重要环节[16]。Toll样受体的激活可以通过MyD88/TRIF-IRF3通路促进固有免疫的应答,这两种通路能够促进下游NF-κB的激活,导致炎症反应以及缺血再灌注损伤的加重[15-16]。同时,近年来在手术、应激、缺血再灌注等研究发现,KCs的激活与P38MAPK关系密切[17]。研究发现TIM-4Fc能够影响初始T细胞的增殖和分化,这主要是通过抑制MAPK信号通路来实现的[18]。我们通过检测KCs NF-κB以及MAPK通路关键蛋白P65以及P38磷酸化水平发现,TIM-4 mAb组p-P65以及p-P38蛋白表达明显低于对照组,这也说明了阻断KCs TIM-4表达可能通过影响NK-κB以及p38MAPK信号通路实现肝移植免疫耐受环境的形成。
Th1/Th2/Treg细胞的免疫平衡与肝移植耐受环境的形成密切相关。我们实验还发现阻断KCs TIM-4可明显诱导Foxp3+T细胞的产生,参与了肝移植免疫耐受环境的形成,但对其如何诱导Treg细胞的产生尚需进一步实验证明。但有研究发现,阻断树突状细胞TIM-4的功能能够抑制初始T细胞向Th2细胞的分化,从而减少Th2细胞因子白介素4的分泌,初始T细胞信号传导及转录激活因子6磷酸化减少,从而诱导其向Treg细胞分化[19],Treg细胞主要通过分泌白介素10、转化生长因子β等抑炎因子来抑制毒性T细胞反应,从而维持自体和异体抗原的免疫耐受[20-21]。
综上所述,阻断KCs TIM-4的功能对于移植免疫耐受环境的形成具有重要作用,能够明显改善肝移植急性排斥反应的程度,延长小鼠生存时间,并且这一保护效应可能是通过影响KCs NK-κB以及p38MAPK信号通路来实现的。近年来在研究移植耐受反应的分子机制中,TIM-1和TIM-3分子成为研究的热潮[22-25],而TIM-4在移植耐受的作用研究极少。因此,TIM-4有望在肝移植排斥反应的治疗中发挥潜在作用。但对于其通过何种机制来诱导Treg细胞的产生尚需进一步实验证明。
| [1] | Yoshida O, Dou L, Kimura S, et al. CD39 deficiency in murine liver allografts promotes inflammatory injury and immune-mediated rejection[J]. Transpl Immunol, 2015, 32 (2): 76-83. DOI: 10.1016/j.trim.2015.01.003. |
| [2] | Knechtle SJ, Kwun J. Unique aspects of rejection and tolerance in liver transplantation[J]. Semin Liver Dis, 2009, 29 (1): 91-101. DOI: 10.1055/s-0029-1192058. |
| [3] | Freeman GJ, Casasnovas JM, Umetsu DT, et al. TIM genes: a family of cell surface phosphatidylserine receptors that regulate innate and adaptive immunity[J]. Immunol Rev, 2010, 235 (1): 172-89. DOI: 10.1111/j.0105-2896.2010.00903.x. |
| [4] | Li Z, Ju Z, Frieri M. The T-cellimmunoglobulin and mucin domain (Tim) gene family in asthma[J]. Allergy Asthma Proc, 2013, 34 (1): e21-6. DOI: 10.2500/aap.2013.34.3646. |
| [5] | Meyers JH, Sabatos CA, Chakravarti S, et al. The TIM gene family regulates innate and adaptive immunity[J]. Trends Mol Med, 2005, 11 (8): 362-9. DOI: 10.1016/j.molmed.2005.06.008. |
| [6] | Tietjen GT, Gong Z, Chen CH, et al. Molecular mechanism for differential recognition of membrane phosphatidylserine by the immune regulatory receptor Tim4[J]. Proc Natl Acad Sci USA, 2014, 111 (15): E1463-72. DOI: 10.1073/pnas.1320174111. |
| [7] | Abe Y, Kamachi F, Kawamoto T, et al. TIM-4 has dual function in the induction and effector phases of murine arthritis[J]. J Immunol, 2013, 191 (9): 4562-72. DOI: 10.4049/jimmunol.1203035. |
| [8] | Baghdadi M, Yoneda A, Yamashina T, et al. TIM-4 glycoprotein-mediated degradation of dying tumor cells by autophagy leads to reduced antigen presentation and increased immune tolerance[J]. Immunity, 2013, 39 (6): 1070-81. DOI: 10.1016/j.immuni.2013.09.014. |
| [9] | Chen GS, Qi HZ. Effect of kupffer cells on immune tolerance in liver transplantation[J]. Asian Pac J Trop Med, 2012, 5 (12): 970-2. DOI: 10.1016/S1995-7645(12)60184-9. |
| [10] | Ikarashi M, Nakashima H, Kinoshita M, et al. Distinct development and functions of resident and recruited liver Kupffer cells/ macrophages[J]. J Leukoc Biol, 2013, 94 (6): 1325-36. DOI: 10.1189/jlb.0313144. |
| [11] | Dai LL, Gong JP, Zuo GQ, et al. Synthesis of endotoxin receptor CD14 protein in Kupffer cells and its role in alcohol-induced liver disease[J]. World J Gastroenterol, 2003, 9 (3): 622-6. DOI: 10.3748/wjg.v9.i3.622. |
| [12] | Rodriguez-Manzanet R, Meyers JH, Balasubramanian S, et al. TIM-4 expressed on APCs induces T cell expansion and survival[J]. J Immunol, 2008, 180 (7): 4706-13. DOI: 10.4049/jimmunol.180.7.4706. |
| [13] | Kim HS, Kim HS, Lee CW, et al. T cell Ig domain and mucin domain 1 engagement on invariant NKT cells in the presence of TCR stimulation enhances IL-4 production but inhibits IFN-gamma production[J]. J Immunol, 2010, 184 (8): 4095-106. DOI: 10.4049/jimmunol.0901991. |
| [14] | Yeung MY, Mcgrath M, Najafian N. The emerging role of the TIM molecules in transplantation[J]. Am J Transplant, 2011, 11 (10): 2012-9. DOI: 10.1111/ajt.2011.11.issue-10. |
| [15] | Ji H, Liu Y, Zhang Y, et al. T-cell immunoglobulin and mucin domain 4 (TIM-4) signaling in innate immune-mediated liver ischemia-reperfusion injury[J]. Hepatology, 2014, 60 (6): 2052-64. DOI: 10.1002/hep.v60.6. |
| [16] | Gong XW, Xu YJ, Yang QH, et al. Effects of soothing liver and invigorating spleen recipes on the IKKβ-NF-κB signaling pathway in kupffer cells of nonalcoholic steatohepatitis rats[J]. Evid Based Complement Alternat Med, 2015, 35 (7): 687690. |
| [17] | Liu LM, Liang DY, Ye CG, et al. The UⅡ/UT system mediates upregulation of proinflammatory cytokines through p38 MAPK and NF-κB pathways in LPS-stimulated Kupffer cells[J]. PLoS One, 2015, 10 (3): e0121383. DOI: 10.1371/journal.pone.0121383. |
| [18] | Cao W, Ryan M, Buckley D, et al. Tim-4 inhibition of T-cell activation and T helper type 17 differentiation requires both the immunoglobulin V and mucin domains and occurs via the mitogen-activated protein kinase pathway[J]. Immunology, 2011, 133 (2): 179-89. DOI: 10.1111/imm.2011.133.issue-2. |
| [19] | Yeung MY, Mcgrath MM, Nakayama M, et al. Interruption of dendritic cell-mediated TIM-4 signaling induces regulatory T cells and promotes skin allograft survival[J]. J Immunol, 2013, 191 (8): 4447-55. DOI: 10.4049/jimmunol.1300992. |
| [20] | Toscano MA, Bianco GA, Ilarregui JM, et al. Differential glycosylation of TH1, TH2 and TH-17 effector cells selectively regulates susceptibility to cell death[J]. Nat Immunol, 2007, 8 (8): 825-34. DOI: 10.1038/ni1482. |
| [21] | Hou X, Song J, Su J, et al. CD4(+) Foxp3(+) tregs protect against innate immune cell-mediated fulminant hepatitis in mice[J]. Mol Immunol, 2015, 63 (2): 420-7. DOI: 10.1016/j.molimm.2014.09.015. |
| [22] | Nogare AL, Dalpiaz T, Veronese FJ, et al. Noninvasive analyses of kidney injury molecule-1 messenger RNA in kidney transplant recipients with graft dysfunction[J]. Transplant Proc, 2012, 44 (8): 2297-9. DOI: 10.1016/j.transproceed.2012.07.047. |
| [23] | Boenisch O, D'addio F, Watanabe T, et al. TIM-3: a novel regulatory molecule of alloimmune activation[J]. J Immunol, 2010, 185 (10): 5806-19. DOI: 10.4049/jimmunol.0903435. |
| [24] | Zhu C, Anderson AC, Schubart A, et al. The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity[J]. Nat Immunol, 2005, 6 (12): 1245-52. DOI: 10.1038/ni1271. |
| [25] | Cheng L, Ruan Z. Tim-3 and Tim-4 as the potential targets for antitumor therapy[J]. Hum Vaccin Immunother, 2015, 11 (10): 2458-62. DOI: 10.1080/21645515.2015.1056953. |
 2017, Vol. 37
2017, Vol. 37

