2. 上海交通大学附属第一人民医院麻醉科,上海 200080
2. Department of Anesthesiology, Shanghai General Hospital Affiliated to Shanghai Jiaotong University, Shanghai 200080, China
脓毒症是一种全身性的炎性综合症,可导致包括呼吸功能损伤在内的多器官功能障碍。脓毒症膈肌损伤会加重呼吸功能障碍,延长机械通气时间[1-2]。然而,脓毒症引起膈肌功能障碍的机制仍不十分明确。脓毒症不仅会引起的线粒体氧化应激损伤和能量代谢异常,同时会导致胞内钙稳态失衡[3-4]。钙是骨骼肌收缩和舒张循环的重要介质,而肌浆网钙释放通道RyR和钙回摄通道SERCA为调节肌肉收缩和胞内钙水平的最重要的蛋白,SERCA下调会导致舒张功能障碍[5]。研究表明脓毒症晚期RyR下降引起晚期的收缩功能异常,而膈肌舒张功能障碍要早于收缩功能障碍的出现[6-7],但具体机制不清,其舒张功能和肌浆网SERCA的改变需进一步研究,因此设想脓毒症早期舒张功能异常可能由于SERCA的抑制导致胞内钙的持续高水平,使肌钙蛋白不能变构复原,引起骨骼肌早期舒张功能障碍,进而引起收缩功能异常。本研究通过对脓毒症大鼠的膈肌功能、肌浆网钙摄取动力学和通道蛋白变化来探讨脓毒症早期膈肌功能障碍的机制。
1 材料和方法 1.1 主要试剂及设备HEPES、Fura-2 pentapotassium salt、ATP-Na2和AgNO3均购至Sigma,SERCA1、SERCA2、RyR一抗和二抗均购至Abcam。手术器械 (上海手术器械厂),组织匀浆机 (BIOSPEC),低温离心机 (Eppendorf),凝胶成像系统 (BIO-RAD),ALC-MPA2000m型多导联生理监测仪 (上海奥尔科特生物科技有限公司) 等 (由上海市第一人民医院实验中心提供)。
1.2 动物分组及模型制作清洁级健康雄性SD大鼠36只,体质量215~240 g,由上海市第一人民医院动物实验中心提供 (许可证号:SCXK (沪)2007-0005)。采用随机数字表法,将其分为3组 (n=12):假手术组 (S组)、脓毒症6 h组 (CLP-6 h组)、脓毒症12 h组 (CLP-12 h组)。对待动物遵循动物伦理学标准。术前大鼠正常饲养自由饮食。采用盲肠结扎穿孔法 (CLP) 制作中等强度脓毒症模型[8],CLP-6 h组和CLP-12 h组大鼠腹腔注射1%戊巴比妥钠50 mg/kg,麻醉成功后,消毒后取下腹部中线2 cm切口开腹,游离盲肠。在距离回盲瓣远侧结扎盲肠,用18 G的套管针穿透盲肠后,从穿孔处挤出少许粪便,后将盲肠回纳入腹腔,3-0丝线分层缝合。S组在游离盲肠后回纳关腹。术毕背部皮下注射3 mL/100 g生理盐水,观察大鼠情况,为避免术后进食对实验干扰,大鼠均禁食禁饮。
1.3 膈肌功能测定取左侧膈肌 (包含中心腱和肋骨,去除膈神经),修剪成约6 mm宽的肌条。取左侧膈肌条迅速置于预先饱和95%O2-5% CO2混合气的Krebs液中 (mmol/L:137 NaCl,4 KCl,2 CaC12,1 MgCl2,1 KH2PO4,12 NaHCO3,和6.5葡萄糖,pH值7.4)[9],修剪肌条,去除脂肪。将肌条置于37 ℃恒温水浴系统的储液槽中 (含12 mmol/L筒箭毒碱)[10],膈肌中心腱一端用丝线固定后连接张力换能器,另一端肋骨固定于L型支架上。平衡20 min后,测定肌条的最适初长度 (L0),然后采用ALC-MPA2000m型多导联生理监测仪测定肌肉功能。参数如下:(1) 单刺激肌颤搐 (Pt刺激电压15 V,刺激频率1 Hz,波宽0.2 ms)、半舒张时间 (1/2RT),收缩达峰时间 (TTP),最大收缩期上升速率 (+dF/dt) 和最大舒张期下降速率 (-dF/dt);(2) 最大强直收缩力 (Po):给予肌条2次刺激电压15V,刺激频率120 Hz、刺激时间250 ms、串间隔670 ms的强直刺激,取其平均值;(3) 张力-频率曲线:给予肌条从10、20、40、60、80、100和120 Hz的定时刺激,刺激电压15 V,刺激时间250 ms,串间隔670 ms,测定不同刺激频率下的膈肌张力,绘制张力-频率曲线;(4) 疲劳指数 (FI):给予肌条刺激频率40 Hz,刺激电压15 V,刺激时间330 ms,串间隔670 ms的刺激,共计300串刺激,计算第120个肌颤搐与第1个肌颤搐的比值,即为疲劳指数。每种刺激方式结束后肌条平衡15 min后再进行下一个模式的刺激。最后结束时将肌条用滤纸吸干称质量。所有力学参数采用肌条横截面积 (CSV) 进行校正[9]。
1.4 骨骼肌SR匀浆提取骨骼肌SR匀浆提取造模后完成后取右侧部分膈肌于液氮中保存留做蛋白测定,其余膈肌吸干表面水分称重后置入10倍冰缓冲液中匀浆 (mmol/L:250蔗糖,20 4-羟乙基哌嗪乙磺酸,0.2苯甲基磺酰氟和0.2%叠氮钠,pH 7.5)[11],转速15 000 r/min,15 s×3个来回,立即4 ℃ 1500 g离心15 min。取上清分装液氮速冻后-80 ℃保存,测定肌浆网Ca2+-ATP酶钙摄取释放和活性。
1.5 肌浆网Ca2+-ATP酶活性测定用定磷法测定酶活性以每小时mmol/mg蛋白表示 1.6 肌浆网钙摄取释放功能测定参考Ingalls CP等肌肉匀浆标准测定方法[12],采用Thermo多功能酶标仪微板读数法[13]测定荧光。孵育缓冲液组成为 (mmol/L:100 KCl,204-羟乙基哌嗪乙磺酸,7.5焦磷酸钠,和0.5 Mg2+,pH 7.0),测定时加入2 μmol/L的Ca2+、1 μmol/L Fura-2五钾盐,ATP-Na2和AgNO3。取10 μL匀浆液与190 μL孵育液于黑色多孔荧光测定板,测定摄取时自动分液器加入10 μL的20 mmol/L浓度的ATP-Na2持续震荡混匀,监测4 min,后自动分液器加入10 μL的500 μmol/L浓度的AgNO3震荡混匀摄取开始,监测4 min。完成后加入终浓度3.5 mmol/L的EGTA和5.0 mmol/L的CaCl2测定零钙和饱和钙时候的荧光。连续测定激发波长340 nm和380 nm,发射波长为500 nm时的荧光强度,并扣除背景值。荧光比值法计算自由钙的浓度,计算方程为[Ca2+]f=Kd×(Sf2/ Sb2)×(R-Rmin)(/ Rmax-R),式中Kd为Fura-2与Ca2+结合的解离常数,为224 nmol/L,Rmin和Rmax为零钙和饱和钙时两激发波长的荧光比值,R为测定的荧光比值,Sf2和Sb2为零钙和饱和钙时测定的荧光值。肌浆网最大摄取率和释放率通过绘制[Ca2+]f变化与时间关系曲线,分别计算曲线的最大斜率,用蛋白含量进行标化来表示。
1.7 RyR和SERCA蛋白表达测定RyR和SERCA表达蛋白电泳取右侧膈肌组织迅速转移至液氮速冻后至-80 ℃冰箱保存备用。(1) 裂解 (RIPA,碧云天公司);(2) 配制12%聚丙烯酰胺凝胶;(3) 蛋白上样;(4) 电泳;(5) 转膜;(6) 封闭后洗膜3次,分别进行RyR,SERCA1和SERCA2一抗孵育,摇床4℃过夜;(7) 洗膜和二抗孵育;(8) 显影;用GAPDH做内参重复上述步骤,使用Image J进行各蛋白灰度分析。
1.8 统计学分析所有数据均采用SPSS20.0统计软件进行处理。各组结果以均数±标准差表示,采用单因素方差分析和Dunnett t检验比较组间差异,以P < 0.05表示差异具有统计学意义。
2 结果脓毒症造模术后6 h大鼠出现活动减少,竖毛和寒战。12 h大鼠呼吸急促,眼部出现分泌物增多,四肢湿冷。CLP组12 h内有1只大鼠死亡,退出本研究。
2.1 膈肌功能测定Pt、Po、+dF/dt和-dF/dt在CLP术后12 h显著低于S组 (P < 0.01),而6hCLP组大鼠-dF/dt即出现了显著下降 (P < 0.01)。半舒张时间1/2RT在造模后CLP-6 h和CLP-12 h组均较对照组延长 (P < 0.05),而TTP在造模后12 h出现延长 (P < 0.01),上述参数在两模型组组间差异显著 (P < 0.01,表 1)。膈肌收缩力-频率曲线见图 1,各频率下膈肌收缩力均使用CSV标化。结果显示CLP-6 h和S组大鼠各频率下膈肌条收缩力均高于CLP-12 h组大鼠 (P < 0.05),CLP-6 h和S组间未见统计学差异。疲劳指数3组间无差异。
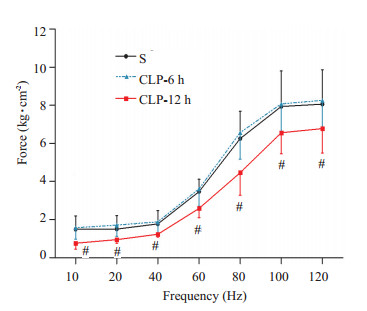
|
图 1 各组大鼠膈肌收缩力-频率曲线比较 Figure 1 Force-frequency relationship of the diaphragm strips inthe sham-operated (S), CLP-6 h and CLP-12 h groups. #P < 0.05 vs group S. |
| 表 1 各组大鼠膈肌收缩和舒张功能比较 Table 1 Comparison of the contractile parameters of the diaphragm among the 3 groups (n=12, Mean±SD) |
如图 2所示,典型的肌浆网钙摄取、释放快速项和慢速项的全过程图[12](图 2A),图 2B显示为3组通过Fura-2测定的全过程拟合图比较。通过测定和计算,如图 2C,CLP-6 h和CLP-12 h组大鼠膈肌肌浆网ATP诱导的钙摄取峰值率较S组显著下降 (P < 0.01),而AgNO3触发的钙释放峰值率方面,CLP-12 h组较CLP-6 h和S组降低显著 (P < 0.01),S组和CLP-6 h组间差异不显著。各组大鼠Ca2+ATP酶活性在各组间未见差异 (P > 0.05)。
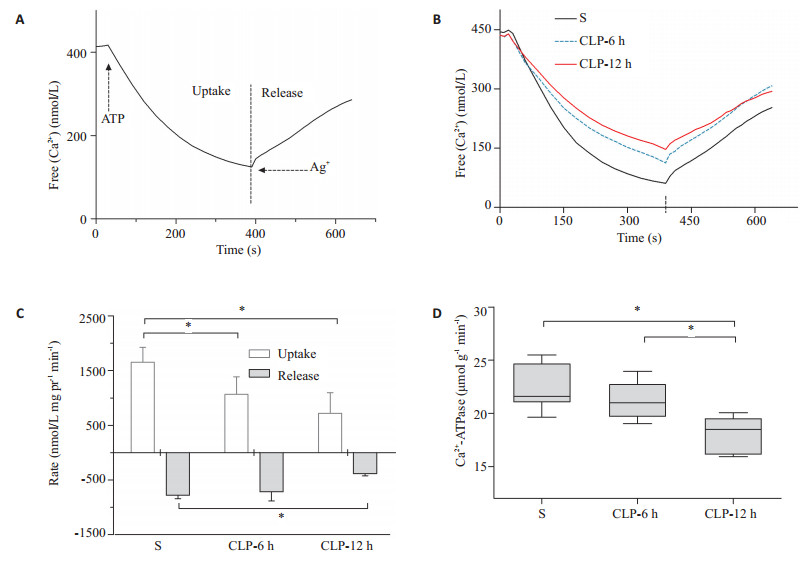
|
图 2 膈肌肌浆网钙摄取和释放测定、峰值率和Ca2+-ATPase活性的比较 Figure 2 Measurement of the calciumkinetics in the SR of the diaphragm in different groups. A: Typical curve fitted by calcium level of crude muscle homogenate showing Ca2 + fluxes over timemeasured with Fura-2; B: Three fitted curves of the entire process; C: Peak rates of Ca2 + uptake activated by ATP and AgNO3-stimulated release in the diaphragmatic SR; D: SERCA activity measurement. *P < 0.01. |
钙释放和摄取通道蛋白表达结果见图 3,在造模后6 h,各组大鼠膈肌SERCA1、SERCA2和RyR蛋白水平均未出现显著变化 (P > 0.05);在CLP-12 h组大鼠膈肌表达SERCA1通道蛋白出现显著下降 (P < 0.01),但是SERCA2与S组比较无差异 (P > 0.05)。钙释放通道RyR蛋白在CLP后12 h出现下降 (P < 0.01),6 h组表达无变化。
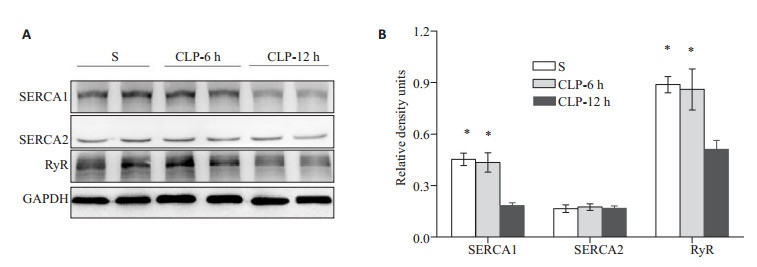
|
图 3 各组大鼠SERCA1、SERCA2和RyR蛋白表达水平 Figure 3 Expression of proteins related to Ca2+ release and uptake in the diaphragm muscles. A: Representative blots for SERCA1, SERCA2, and RyR; B: Relativedensitometricunits for SERCA1, SERCA2and RyR. *P < 0.01 vs CLP-12hgroup. |
脓毒症是一种高致死率的全身炎症反应综合症,其中危重病肌病 (CIM) 的发病率率高达60%~80%,但是该疾病的早期诊断和治疗仍未能得到足够的重视。危重病可影响全身肌肉系统,对呼吸系统的膈肌影响最为明显,易引起呼吸衰竭等严重并发症。因此,探讨危重病膈肌的早期病变发生机制,阻断肌病的恶性循环,对于预防和治疗危重病肌病都有显著的意义。
研究表明炎症反应、氧自由基和线粒体损伤均可以引起膈肌功能障碍[14]。脓毒症CLP模型中,腹腔炎症能减低膈肌的最大收缩力。在造模后的12 h张力达峰时间和最大收缩期上升速率均显著下降,然而在6 h无明显改变。表明中等强度的脓毒症模型下,膈肌收缩力的下降要早于既往研究的24 h。另外,在6 h和12 h两个时点,膈肌半舒张时间显著延长,最大舒张期下降速率显著下降。说明在脓毒症急性期膈肌舒张功能损害较早出现。
肌搐颤张力的变化可以反应肌细胞内钙摄取和释放功能,而且SERCA活性的高低也调节着肌肉松弛的时间,因此肌搐颤和最大舒张速率的下降以及舒张时间的延长可能与肌浆网钙摄取和释放的紊乱有关[11]。然而,脓毒症下肌肉收缩和舒张至关重要的肌浆网钙释放和摄取功能还属未知。生理条件下肌浆网SERCA耗能方式回摄取钙进入肌浆网,引起肌肉松弛的同时为下一次收缩舒张循环做储备。因此,包括自由基、肌浆网钙水平、钙释放摄取过程和肌丝本身损伤均可以引起脓毒症膈肌功能障碍[15]。本研究通过动态测定肌浆网的钙摄取和释放功能以及SERCA活性,发现脓毒症6 h和12 h肌浆网钙的最大摄取率显著下降,12 h出现SERCA活性降低。同时脓毒症后6 h即出现了钙峰值摄取率的下降,而脓毒症模型心肌肌浆网18 h才出现钙摄取下降,可能由于肌肉类型和两者的全身及局部炎症状态不一致所致。因此,脓毒症早期6 h膈肌肌浆网钙摄取功能显著下降。
成年大鼠膈肌Ⅱ型纤维和Ⅰ型纤维比约为67%和33%[7]。成年哺乳动物的主要亚型SERCA 1型主要表达在Ⅱ型纤维 (快肌纤维),SERCA2型主要表达在Ⅰ型纤维 (慢肌纤维)[16]。成年大鼠SERCA水平可以通过两个亚型的测定来反应总体SERCA的水平[17],同时SERCA低水平可以导致肌松弛功能下降[18]。脓毒症24 h大鼠SERCA1和SERCA2在心肌和骨骼肌均出现显著低表达[7, 19]。本研究发现脓毒症12 h即出现了SERCA1表达下降,而SERCA2型变化不显著。这种表达不一致可能由于快肌Ⅱ型纤维对多种病理过程极为敏感导致[20]。脓毒症进展后期24 h亦会出现SERCA2型的下降[14]。脓毒症12 h膈肌舒张功能和肌浆网摄取率的下降可能与SERCA1的蛋白表达下降有关。然而,脓毒症6 h组并未出现SERCA蛋白表达的变化,SERCA的调节蛋白磷酸化水平的改变可能导致了此时膈肌舒张功能下降[21]。另外,肌浆网钙储库的钙释放功能主要依赖肌浆网钙的回摄取,因此膈肌SERCA低表达导致的舒张功能障碍亦会导致膈肌收缩功能损害。
随着脓毒症的进展,RyR受到抑制[22],同时内毒素及自由基损害了膈肌收缩功能及肌浆网钙释放功能[23-24],以至12 h后收缩功能出现障碍。作为肌浆网钙释放通道,RyR的激活引起钙的大量释放产生肌肉收缩。RyR主要有3种亚型,膈肌纤维主要表达RyR蛋白1型,RyR2在骨骼肌系统缺如,同时脓毒症对含量3%亚型的RyR3影响极小[24],因此RyR水平可以反应RyR1型的蛋白含量变化。研究发现脓毒症12 h后膈肌收缩力出现显著下降,而且肌浆网峰值释放率显著降低,RyR蛋白表达水平显著下降,与本课题组前期研究一致[6],因此,膈肌收缩力的下降及肌浆网钙释放率的下降可能与肌浆网RyR水平下降有关。
终上所述,脓毒症早期膈肌舒张功能障碍早于收缩功能障碍,舒张功能的下降与肌浆网钙摄取功能和SERCA1亚型表达的下降有关,同时和RyR低表达共同促成了膈肌收缩功能损害。本课题组在后期将对脓毒症早期大鼠膈肌PLB和SLN的表达及磷酸化水平进行研究,同时进行早期干预来进一步探讨脓毒症早期SERCA功能损伤的机制。
| [1] | Maes K, Stamiris A, Thomas D, et al. Effects of controlled mechanical ventilation on sepsis-induced diaphragm dysfunction in rats[J]. Crit Care Med, 2014, 42 (12): e772-82. DOI: 10.1097/CCM.0000000000000685. |
| [2] | Kress JP, Hall JB. ICU-acquired weakness and recovery from critical illness[J]. N Engl J Med, 2014, 370 (17): 1626-35. DOI: 10.1056/NEJMra1209390. |
| [3] | Griffiths RD, Hall JB. Intensive care unit-acquired weakness[J]. Crit Care Med, 2010, 38 (3): 779-87. DOI: 10.1097/CCM.0b013e3181cc4b53. |
| [4] | Latronico N, Bolton CF. Critical illness polyneuropathy and myopathy: a major cause of muscle weakness and paralysis[J]. Lancet Neurol, 2011, 10 (10): 931-41. DOI: 10.1016/S1474-4422(11)70178-8. |
| [5] | Soller KJ, Yang J, Veglia G, et al. Reversal of phospholamban inhibition of the sarco (endo) plasmic reticulum Ca2+-ATPase (SERCA) using short, protein-interacting RNAs and oligonucleotide analogs[J]. J Biol Chem, 2016, 291 (41): 21510-8. DOI: 10.1074/jbc.M116.738807. |
| [6] | Wu J, Zhang JY, Gong Y, et al. Slowed relaxation of diaphragm in septic rats is associated with reduced expression of sarco-endoplasmic reticulum CA (2+)-ATPase genes SERCA1 and SERCA2[J]. Muscle Nerve, 2016, 54 (6): 1108-13. DOI: 10.1002/mus.v54.6. |
| [7] | Qiu YW, Chen D, Xu MY, et al. Beneficial effects of dantrolene on sepsis-induced diaphragmatic dysfunction are associated with downregulation of high-mobility group box 1 and calpain-caspase-3 proteolytic pathway[J]. J Surg Res, 2016, 200 (2): 637-47. DOI: 10.1016/j.jss.2015.09.026. |
| [8] | Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4 (1): 31-6. |
| [9] | 邱郁薇, 李士通, 徐美英. 丹曲林预先给药对脓毒症大鼠膈肌功能的影响[J]. 中华麻醉学杂志, 2014, 34 (3): 322-4. |
| [10] | Nishikawa K, Narimatsu E, Igarashi M, et al. Effects of sepsis on the neuromuscular blocking actions of d-tubocurarine on rat adductor and abductor laryngeal muscles[J]. J Anesth, 2009, 23 (4): 520-5. DOI: 10.1007/s00540-009-0816-6. |
| [11] | Nethery D, Dimarco A, Stofan D, et al. Sepsis increases contraction-related Generation of reactive Oxygen species in the diaphragm[J]. J Appl Physiol (1985), 1999, 87 (4): 1279-86. |
| [12] | Russ DW, Grandy JS, Toma K, et al. Ageing, but not yet senescent, rats exhibit reduced muscle quality and sarcoplasmic reticulum function[J]. Acta Physiol (Oxf), 2011, 201 (3): 391-403. DOI: 10.1111/apha.2011.201.issue-3. |
| [13] | Robinson JA, Jenkins NS, Holman NA, et al. Ratiometric and nonratiometric Ca2+ indicators for the assessment of intracellular free Ca2+ in a breast cancer cell line using a fluorescence microplate reader[J]. J Biochem Biophys Methods, 2004, 58 (3): 227-37. DOI: 10.1016/j.jbbm.2003.11.002. |
| [14] | 葛敏, 马丽, 方迎艳, 等. 肝硬化大鼠膈肌骨架蛋白和肌浆网钙泵基因表达的变化[J]. 南方医科大学学报, 2013, 33 (12): 1796-800. DOI: 10.3969/j.issn.1673-4254.2013.12.19. |
| [15] | Reid MB, Lännergren J, Westerblad H. Respiratory and limb muscle weakness induced by tumor necrosis factor-alpha: involvement of muscle myofilaments[J]. Am J Respir Crit Care Med, 2002, 166 (4): 479-84. DOI: 10.1164/rccm.2202005. |
| [16] | Lamboley CR, Murphy RM, Mckenna MJ, et al. Endogenous and maximal sarcoplasmic reticulum Calcium content and calsequestrin expression in type Ⅰ and type Ⅱ human skeletal muscle fibres[J]. J Physiol, 2013, 591 (23): 6053-68. DOI: 10.1113/jphysiol.2013.265900. |
| [17] | Shortt CM, Fredsted A, Bradford A, et al. Diaphragm muscle remodeling in a rat model of chronic intermittent hypoxia[J]. J Histochem Cytochem, 2013, 61 (7): 487-99. DOI: 10.1369/0022155413490947. |
| [18] | Guglielmi V, Vattemi G, Gualandi F, et al. SERCA1 protein expression in muscle of patients with Brody disease and Brody syndrome and in cultured human muscle fibers[J]. Mol Genet Metab, 2013, 110 (1/2): 162-9. |
| [19] | Akasaki Y, Ouchi N, Izumiya Y, et al. Glycolytic fast-twitch muscle fiber restoration counters adverse age-related changes in body composition and metabolism[J]. Aging Cell, 2014, 13 (1): 80-91. DOI: 10.1111/acel.2014.13.issue-1. |
| [20] | Wang Y, Pessin JE. Mechanisms for fiber-type specificity of skeletal muscle atrophy[J]. Curr Opin Clin Nutr Metab Care, 2013, 16 (3): 243-50. DOI: 10.1097/MCO.0b013e328360272d. |
| [21] | Pant M, Bal NC, Periasamy M. Sarcolipin: a key thermogenic and metabolic regulator in skeletal muscle[J]. Trends Endocrinol Metab, 2016, 27 (12): 881-92. DOI: 10.1016/j.tem.2016.08.006. |
| [22] | Friedrich O, Yi B, Edwards JN, et al. IL-1α reversibly inhibits skeletal muscle ryanodine receptor. a novel mechanism for critical illness myopathy[J]. Am J Respir Cell Mol Biol, 2014, 50 (6): 1096-106. DOI: 10.1165/rcmb.2013-0059OC. |
| [23] | Danjo W, Fujimura N, Ujike Y. Effect of pentoxifylline on diaphragmatic contractility in septic rats[J]. Acta Med Okayama, 2008, 62 (2): 101-7. |
| [24] | Jiao GY, Hao LY, Gao CE, et al. Reduced DHPRα1S and RyR1 expression levels are associated with diaphragm contractile dysfunction during sepsis[J]. Muscle Nerve, 2013, 48 (5): 745-51. DOI: 10.1002/mus.v48.5. |
 2017, Vol. 37
2017, Vol. 37

