2. 上海中医药大学附属曙光医院 肿瘤科,上海 201203;
3. 上海市中医药研究院骨伤科研究所,上海 201203;
4. 上海中医药大学附属曙光医院 中国中医科学院望京医院,北京 100102
2. Department of Medical Oncology, Shuguang Hospital Affiliated to Shanghai University of TCM, Shanghai 201203, China;
3. Institute of Traumatology and Orthopedics, Shanghai Academy of TCM, Shanghai 201203, China;
4. Wangjing Hospital, China Academy of Chinese Medical Sciences, Beijing100102, China
半月板、滑膜、关节软骨、韧带和软骨下骨等是关节力学失稳后引起早期软骨退变以及骨关节炎发生的初始因素,在膝骨关节炎形成的病理过程中起到关键角色[1-2]。而在这些因素中,由于半月板作为特殊的组织,在膝关节内部具有力学转移、吸收震荡和关节稳定的作用[3-4],因此半月板在关节力学失稳与软骨退变的发生中起到“桥梁性”作用。体外实验已经证明,异常的机械压力刺激导致了半月板组织细胞死亡、蛋白多糖丢失和基质降解酶的产生及半月板所受力学载荷的增多[5],说明异常力学刺激导致了半月板发生病理性退变。在我们的前期实验结果已经证实异常的压力刺激能够导致半月板发生病理性过度肥大和钙化相关基因和蛋白表达的上调,且是膝骨关节炎的发生的重要因素[6]。因此防治异常力学刺激引起的半月板的病理性过度肥大和钙化,成为了治疗膝骨关节炎的新的靶点和方向,寻找新的有效药物来抑制半月板病理性过度肥大和钙化相关基因和蛋白表达的上调,是本研究的重点。
课题组前期研究发现0.3、0.6 mg/mL的河蚌葡聚糖 (HBP-A) 能抑制软骨细胞死亡及MMP13蛋白的过度表达[7],而MMP13蛋白的过度表达是半月板过度肥大和钙化的重要标志物[6],故本次实验选择0.6 mg/mL HBP-A作为首次药物浓度。通过观察0.6 mg/mL HBP-A对半月板病理性退变以及病理性过度肥大和钙化相关基因和蛋白表达的影响,为中药单体河蚌葡聚糖防治半月板病理性退变进而保护膝关节软骨退变提供实验依据。
1 材料和方法 1.1 动物、试剂及仪器实验动物:24月龄成熟牛的膝关节,总共6个膝关节,将其内侧和外侧半月板进行提取,共12个。
主要药品与试剂:河蚌葡聚糖 (上海中医药大学中药研究所分离并提取),碘化丙啶 (Abcam),荧光素二乙酰酯 (Abcam), 硫酸软骨素 (Abcam), 培养基DMEM (Biowest),胎牛血清 (Biowest),总RNA抽提试剂盒 (Applied Biosystems),反转录试剂盒 (Applied Biosystems),MMP13一抗、IL-1一抗 (CST),ANKH一抗、ALP一抗 (Santa Cruz),兔荧光二抗 (Santa Cruz),0.25% Coomassie Brilliant blue R-250 (Bio-Red Laboratories),SYBR (Applied Biosystems),Na2EDTA、Na2HPO (4 Sigma),0.25%胰蛋白酶 (Biowest),BCA定量试剂盒 (Pierce)。组织研磨及力学加载装置 (美国布朗大学),荧光倒置显微镜 (奥林巴斯公司),37 ℃ 5% CO2培养箱 (Labconco),扫膜 (Odyssey),酶标仪 (基因公司)。
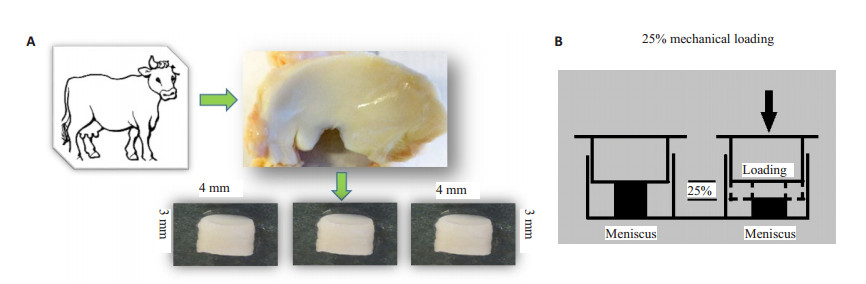
1.2 半月板组织提取及异常压力刺激3只24月龄成熟牛的膝关节,取下后立即放在培养液中保存,避免细胞出现死亡。总共6个膝关节,将其内侧和外侧半月板进行提取,共12个,将半月板从表面至底部切割成直径4 mm,厚3 mm的圆柱形,每个半月板内、中、外1/3可用于进一步实验的标本15个,共180个。每次实验可用60个标本。随机分为不同的组别。
将半月板组织随机分为对照组、力学压力刺激3 h组、药物组 (力学压力刺激3 h+0.6 mg/mL HBP-A)。半月板放置于24孔板内,加入1 mL的培养基,异常力学加载装置由布朗大学骨科生物力学实验室设计并提供[8]。我们采用使组织发生可压缩25%的异常压力刺激 (垂直加压)3 h,0.3 Hz频率,之所以采用25%的异常压力,是因为前期报道25%的异常压力刺激能够超过牛的半月板正常的生理性压力,能够引起半月板的损伤及退变[9]。正常对照组无压力刺激,但同样放在1 mL培养基里培养。在压力循环过程中,最大25%压力将持续10 s,然后回到最初位置,进入下一个循环。如此反复刺激3 h,在药物组同时给予0.6 mg/mL HBP-A,然后各组样本分别在37 ℃、5% CO2的培养箱内培养72 h。各组分别收集样本和培养液并冻存于-80 ℃冰箱内 (图 1)。
|
图 1 半月板组织提取及力学加载过程 Figure 1 Preparation of bovine meniscus explant (A) and the impact loading (B). |
各组半月板组织在25%压力刺激3 h并培养72 h后用于细胞活性检测。细胞活性成分评定方法主要由碘化丙啶 (PI) 和荧光素二乙酰酯 (FDA) 联合作用。碘化丙啶能通过损伤的质膜而使死细胞呈现红色荧光,荧光素二乙酰酯通过细胞的新陈代谢而使细胞呈现绿色荧光。半月板样本从培养液中取出后被立刻被沉浸于40 µg/mL PI和1 µmol FDA溶液中10 min,注意避光。然后将样本切割成200 µm的薄片,使用荧光显微镜观察活细胞和死细胞的数目并拍照。
1.4 各组半月板组织蛋白多糖丢失检测由于半月板经过25%异常的力学刺激,其组织内蛋白多糖的含量会发生相应变化,组织中的蛋白多糖同时也会释放进入培养基中,因此我们采用二甲基亚甲基蓝实验法检测培养基中蛋白多糖的含量以此来定量各组半月板组织蛋白多糖的丢失程度。
1.5 检测各组半月板病理性过度钙化相关因子在mRNA水平上的表达病理性钙化相关因子包括进行性关节僵硬蛋白 (ANKH),焦磷酸酶/磷酸二酯酶 (ENPP1) 和碱性磷酸酶 (ALP) 在mRNA水平上的表达通过RT-qPCR来检测。具体方法如下:(1) 组织研磨:将各组样品随机从-80 ℃取出3个,装在EP管内放于冰上。使用组织研磨器将各组半月板研磨成粉。其整个过程放于液氮内。各组加入700vLQIAzol,然后再超声打磨,反复3次。继续放于-80 ℃冰箱内冻存,以致组织裂解充分;(2) 总RNA提取:将各组样本解冻,组织总RNA提取按照Applied Biosystems RNA提取试剂盒具体操作过程;(3) CDNA反转录:利用PrimeScript®® RT reagent Kit试剂盒进行RNA反转录;(4) 引物设计:采用Primers Express software (Bio Tools Incorporated, Edmonton, AB, Canada) 设计引物序列 (表 1),以18S引物作为内参照,反应条件:具体温度条件设置根据每个引物不同而设定。
| 表 1 荧光定量逆转录多聚酶链反应引物序列 Table 1 Primer sequences for RT-qPCR |
病理性过度肥大和钙化相关标志物在蛋白水平上的表达量,通过蛋白免疫印迹法 (WB) 来定量。将各组样本随机从-80 ℃取出3个,解冻。使用组织研磨器将半月板组织研磨成粉,加入蛋白裂解液100 µL (含蛋白酶抑制剂)。将各组样本反复超声研磨3次,整个过程在低温下操作,避免蛋白降解。-80 ℃再次冷冻,以致裂解充分。解冻后将样品在低温离心机下离心12 000 g,5 min。提取上清备用,沉淀丢弃。BCA蛋白定量试剂盒测定各组细胞蛋白浓度,等量分装后加入上样缓冲液,蛋白变性10 min,4 ℃冷却,-20 ℃保存备用。经SDS-PAGE胶电泳后转膜,封闭1 h,加入基质蛋白酶-13(MMP-13)、白介素-1(IL-1) 和ANKH、ALP抗体孵育过夜;缓冲液洗膜3次,每次10 min,加入与一抗相对应二抗孵育1 h,缓冲液 (TBST) 洗膜3次,每次10 min。扫膜过程使用Odyssey方法,并进行灰度值定量,计算各组蛋白表达相对值。各组相等总蛋白定量采用考马斯蓝染色方法[10]。
1.7 统计学方法所有数据以均值±标准差表示;采用SPSS 18.0统计软件进行数据分析,组间差异比较采用配对T检验,检验水准α=0.05。P < 0.05为差异具有统计学意义。
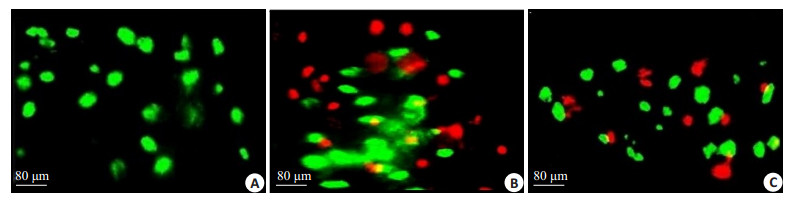
2 结果 2.1 各组半月板细胞活性25%的异常压力刺激3 h并培养72 h,在正常对照组,细胞均为活细胞 (绿色),没有出现细胞死亡 (图 2A)。在力学压力刺激3 h组,细胞出现死亡 (红色),且数量明显增多 (图 2B),而在药物组,细胞死亡的数量明显低于异常压力刺激3 h组 (图 2C)。说明0.6 mg/mL的HBP-A能够减缓细胞死亡,提示HBP-A能够阻止组织的损伤,在预防半月板退变性疾病中发挥着重要作用。
|
图 2 各组半月板细胞活性 Figure 2 Cell viability in the meniscus explants. Green fluorescence indicates living cells, and red fluorescence indicates dead cells. A: Control group; B: Loading 3 h group; C: Loading 3 h+drug group. |
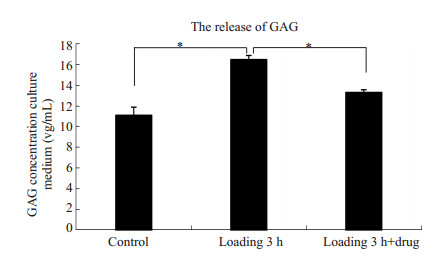
二甲基亚甲基蓝 (DMMB) 检测半月板组织培养液中蛋白多糖的含量,以此来证明半月板组织蛋白多糖丢失的程度。力学压力刺激3 h组培养液中蛋白多糖的含量是正常对照组的1.4倍 (P < 0.05),而是药物HBP-A组蛋白多糖含量的1.3倍 (P < 0.05),药物组培养液中蛋白多糖的含量明显低于异常压力刺激组,具有统计学差异。说明药物0.6 mg/mL HBP-A预防并降低了由于异常力学刺激引起的半月板组织蛋白多糖的丢失。提示该药物能够延缓半月板组织的病理性退变,为治疗组织退变的潜在性药物 (图 3)。
|
图 3 各组半月板组织培养液中蛋白多糖含量 Figure 3 GAG release in the explant culture medium (n=3, *P < 0.05). |
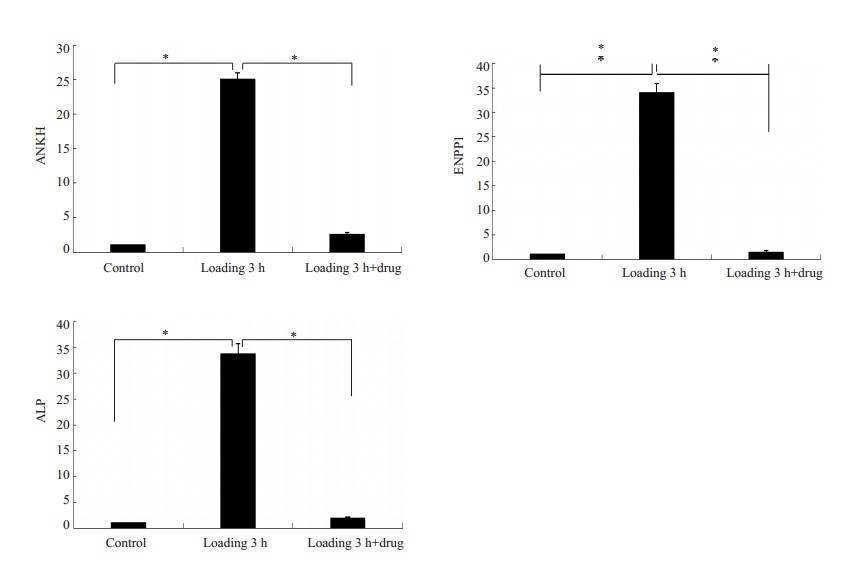
25%的异常压力刺激引起了组织钙化相关影响因子ANKH、ENPP1和ALP在mRNA水平上表达的上调 (P < 0.05),从而能够引起组织的钙化。而在药物组,钙化相关基因ANKH、ENPP1和ALP在mRNA水平上的表达明显低于力学压力刺激3 h组 (P < 0.05,图 4)。说明HBP-A能够抑制半月板病理性钙化相关影响因子ANKH、ENPP1和ALP的表达,从而起到治疗半月板钙化的作用。
|
图 4 各组半月板组织钙化相关因子ANKH、ENPP1和ALP在mRNA水平上的表达 Figure 4 mRNA expression levels of ANKH, ENPP1 and ALP associated with pathological calcification of the meniscus (n=3, *P < 0.05). |
25%的异常压力刺激引起了组织过度肥大和钙化相关影响因子MMP13、IL-1和ANKH、ALP在蛋白水平上表达的上调 (P < 0.05,图 5),而在药物组,肥大和钙化相关蛋白MMP13、IL-1和ANKH、ALP的表达明显低于力学压力刺激3 h组 (P < 0.05,图 5)。提示我们HBP-A能够有效抑制半月板过度肥大和钙化相关影响因子MMP13、IL-1和ANKH、ALP在蛋白水平上的表达,从而起到治疗半月板病理性过度肥大和钙化的作用。
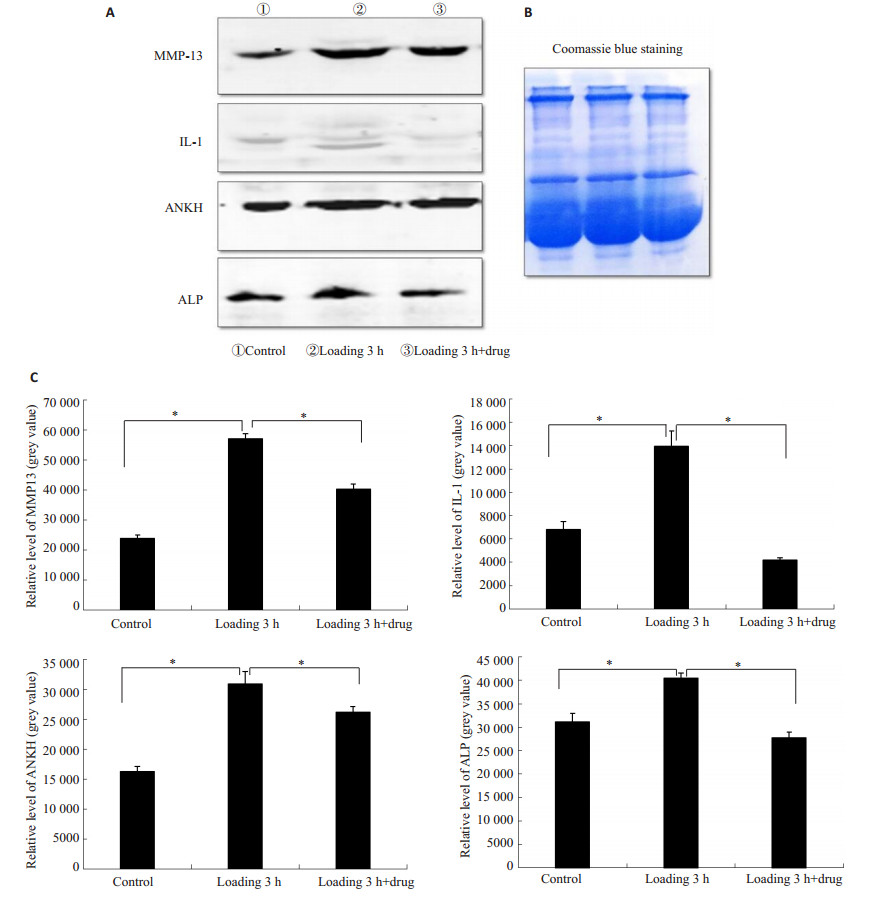
|
图 5 各组半月板过度肥大和钙化相关蛋白MMP13、IL-1和ANKH、ALP的表达 Figure 5 Proteins expressions of MMP13, IL-1, ANKH, and ALP associated with pathological hypertrophy and calcification of the meniscus (n=3, *P < 0.05). A: Protein bands; B: Coomassie blue staining; C: Gray value analysis. |
在我们前期动物体内、体外实验中已经证实异常的压力刺激是引起半月板病理性过度肥大和钙化相关基因、蛋白表达上调的直接原因[6]。而半月板所承受不同角度、不同大小的力学刺激[11],因我们只探讨半月板受异常力学刺激后其病理性改变,故我们前期及本次实验只单纯模拟半月板25%的垂直压力,观察其对半月板病理性过度肥大和钙化的作用。同时我们关注的是异常力学刺激引起半月板发生病理性过度肥大和钙化相关基因蛋白的表达,故我们没有模拟更多角度、大小的力学刺激。而更主要的是半月板的病理性过度肥大和钙化是引起膝骨关节炎发生的主要初始因素[6]。目前西医和祖国医学治疗膝骨关节炎的方法众多[12],而主要针对半月板病理性过度肥大和钙化的治疗未见报道,因此本课题主要探索河蚌葡聚糖对半月板病理性过度肥大和钙化相关基因和蛋白表达的影响,进而起到治疗膝骨关节炎的作用,也是本文的创新之处。
组织病理性过度肥大和钙化受局部和系统多种因素的影响[13-14]。在本次实验中,体外异常的压力刺激导致了MMP-13、IL-1和ENPP1、ANKH、ALP在蛋白和基因水平上不同程度表达的增加。这些基因和蛋白标志物能够引起组织及细胞肥大、降解以及钙化[15-16]。MMP-13是细胞肥大的基本标志物,其浓度的增加能够导致软骨的破坏[17]。炎性因子,如IL-1是引起骨关节炎的关键因素之一[18]。这些因素的增加不仅可以导致细胞及组织的病理性肥大,也可引起关节软骨的破坏进而增加骨关节炎的发生与发展。
组织病理性钙化也受到局部钙化抑制剂焦磷酸盐PPi和促进剂磷酸盐Pi之间相互平衡的影响[19-20]。钙化抑制剂与促进剂关系也极其复杂,受多方面因素的影响,其中包括:进行性关节僵硬蛋白ANKH,焦磷酸酶/磷酸二酯酶ENPP1和碱性磷酸酶ALP。ANKH作为一种膜内蛋白,能够调节细胞内PPi至细胞外环境中,从而影响细胞内外PPi的浓度[21]。ENPP1能够增加细胞外PPi浓度能够有效抑制羟基磷灰石的形成,在生理和病理性钙化中扮演着主要角色[22]。然而,ALP通过裂解PPi而增加了Pi的浓度,进而促进组织钙化[23]。在我们的实验中,发现这些半月板钙化相关因素在异常力学压力刺激下都同时受到上调。这些因素的改变一定程度上影响了组织内PPi和Pi的含量,进而导致了不同程度的组织钙化。
在本实验中,同时还证明了在异常力学压力刺激3 h后,在半月板组织表面出现细胞死亡,以及半月板组织蛋白多糖的丢失。可见异常的压力刺激不仅导致了半月板病理性过度肥大和钙化相关基因和蛋白表达的上调,同时直接加重了半月板的病理性退变。因此,在防治半月板的病理性退变中,不仅要抑制半月板病理性过度肥大和钙化相关基因和蛋白表达的上调,而且还要防止半月板细胞的死亡和组织内蛋白多糖的丢失。
我们在前期研究中发现,河蚌肉提取物河蚌葡聚糖 (HBP-A) 对兔膝骨关节炎有治疗作用,如体外添加对软骨细胞有促进增殖作用,体内实验还具有止痛效果,近期研究发现HBP-A在体内外都具有促进软骨细胞增殖和Ⅱ型胶原的合成作用,促进Col-II的表达,抑制MMP-13的表达,并对Cox-2的基因表达水平也有着明显的抑制作用,进而具有促进软骨细胞合成,有效抑制软骨细胞的降解与破坏及一定抑炎的作用,达到保护软骨细胞及抗炎镇痛改善OA相关症状的目的[24]。因此我们认为河蚌多糖是治疗膝骨关节炎的潜在性药物,然而HBP-A是否能够抑制半月板病理性过度肥大和钙化相关基因和蛋白表达的上调,以及防止半月板细胞的死亡和组织内蛋白多糖的丢失未曾报道。
我们在体外模拟25%的异常压力刺激加载于半月板组织,同时给予0.6 mg/ml的HBP-A治疗。经细胞活性实验数据显示在0.6 mg/mL HBP-A药物组,死细胞数量明显减少,再一次证实了该药物能够减少细胞死亡防止细胞退变的作用。在0.6 mg/mL HBP-A药物组蛋白多糖丢失的数量明显低于力学压力刺激3 h组,说明HBP-A具有防止蛋白多糖丢失,进而对关节软骨退变的发生具有保护性作用。该药物能够同时有效抑制异常力学刺激引起的半月板组织过度钙化相关基因ANKH、ENPP1和ALP在mRNA水平上的表达和半月板组织过度肥大和钙化相关蛋白MMP13、IL-1和ANKH、ALP的表达,而先前已经证实这些基因蛋白是引起半月板组织出现病理性过度肥大和钙化的直接原因,是导致膝骨关节炎发生的重要原因,并且这些基因和蛋白的表达是治疗膝骨关节炎的新靶点,因此我们认为HBP-A是抑制半月板出现病理性退变进而保护软骨退变的潜在性治疗药物。
| [1] | Guess TM, Razu S. Loading of the medial meniscus in the ACL deficient knee: A multibody computational study[J]. Med Eng Phys, 2017, 41 : 26-34. DOI: 10.1016/j.medengphy.2016.12.006. |
| [2] | Crane DM, Oliver KS, Bayes MC. Orthobiologics and knee osteoarthritis: recent literature review, treatment algorithm, and pathophysiology discussion[J]. Phys Med Rehabil Clin N Am, 2016, 27 (4): 985-1002. DOI: 10.1016/j.pmr.2016.07.004. |
| [3] | Sun Y, Mauerhan DR, Honeycutt PR, et al. Analysis of meniscal degeneration and meniscal gene expression[J]. BMC Musculoskelet Disord, 2010, 11 : 19. DOI: 10.1186/1471-2474-11-19. |
| [4] | Yuan Z, Liu S, Hao C, et al. AMECM/DCB scaffold prompts successful total meniscus Reconstruction in a rabbit total meniscectomy model[J]. Biomaterials, 2016, 111 : 13-26. DOI: 10.1016/j.biomaterials.2016.09.017. |
| [5] | Hufeland M, Schünke M, Grodzinsky AJ, et al. Response of mature meniscal tissue to a single injurious compression and interleukin-1 in vitro[J]. Osteoarthritis Cartilage, 2013, 21 (1): 209-16. DOI: 10.1016/j.joca.2012.10.003. |
| [6] | Du G, Zhan H, Ding D, et al. Abnormal mechanical loading induces cartilage degeneration by accelerating meniscus hypertrophy and mineralization after ACL injuries in vivo[J]. Am J Sports Med, 2016, 44 (3): 652-63. DOI: 10.1177/0363546515621285. |
| [7] | 韦宋谱. 基于Wnt-β-catenin信号通路探讨柔肝中药防治骨关节炎的作用机制研究[D]. 上海: 上海中医药大学, 2013. |
| [8] | Bilgen B, Chu D, Stefani R, et al. Design of a biaxial mechanical loading bioreactor for tissue engineering[J]. J Vis Exp, 2013, 25 (74): e50387. |
| [9] | Upton ML, Chen J, Guilak F, et al. Differential effects of static and dynamic compression on meniscal cell gene expression[J]. J Orthop Res, 2003, 21 (6): 963-9. DOI: 10.1016/S0736-0266(03)00063-9. |
| [10] | Wei F, Zhou J, Wei X, et al. Activation of Indian hedgehog promotes chondrocyte hypertrophy and upregulation of MMP-13 in human osteoarthritic cartilage[J]. Osteoarthritis Cartilage, 2012, 20 (7): 755-63. DOI: 10.1016/j.joca.2012.03.010. |
| [11] | Dangelmajer S, Familiari F, Simonetta R, et al. Meniscal transplants and scaffolds: a systematic review of the literature[J]. Knee Surg Relat Res, 2017, 29 (1): 3-10. DOI: 10.5792/ksrr.16.059. |
| [12] | He Z, Wang B, Hu C, et al. An overview of hydrogel-based intra-articular drug delivery for the treatment of osteoarthritis[J]. Colloids Surf B Biointerfaces, 2017, 154 : 33-9. DOI: 10.1016/j.colsurfb.2017.03.003. |
| [13] | Lønnebakken MT, Izzo R, Mancusi C, et al. Left ventricular hypertrophy regression during antihypertensive treatment in an outpatient clinic (the campania salute network)[J]. J Am Heart Assoc, 2017, 6 (3): e004152. DOI: 10.1161/JAHA.116.004152. |
| [14] | Rothe H, Brandenburg V, Haun M, et al. Ecto-5'-Nucleotidase CD73 (NT5E), vitamin D receptor and FGF23 gene polymorphisms May play a role in the development of calcific uremic arteriolopathy in dialysis patients-data from the German calciphylaxis registry[J]. PLoS One, 2017, 12 (2): e0172407. DOI: 10.1371/journal.pone.0172407. |
| [15] | Zhang C, Wei X, Chen C, et al. Indian hedgehog in synovial fluid is a novel marker for early cartilage lesions in human knee joint[J]. Int J Mol Sci, 2014, 15 (5): 7250-65. DOI: 10.3390/ijms15057250. |
| [16] | Mikami Y, Tsuda H, Akiyama Y, et al. Alkaline phosphatase determines polyphosphate-induced mineralization in a cell-type Independent manner[J]. J Bone Miner Metab, 2016, 34 (6): 627-37. DOI: 10.1007/s00774-015-0719-6. |
| [17] | Furuta J, Ariyoshi W, Okinaga T, et al. High molecular weight hyaluronic acid regulates MMP13 expression in chondrocytes via DUSP10/MKP5[J]. J Orthop Res, 2017, 35 (2): 331-9. DOI: 10.1002/jor.v35.2. |
| [18] | Attur M, Statnikov A, Samuels J, et al. Plasma levels of interleukin-1 receptor antagonist (IL1Ra) predict radiographic progression of symptomatic knee osteoarthritis[J]. Osteoarthritis Cartilage, 2015, 23 (11): 1915-24. DOI: 10.1016/j.joca.2015.08.006. |
| [19] | Villa-Bellosta R. Vascular calcification revisited: a new perspective for phosphate transport[J]. Curr Cardiol Rev, 2015 . |
| [20] | Clement T, Salone V, Charpentier B, et al. Identification of new microRNAs targeting genes regulating the Pi/PPi balance in chondrocytes[J]. Biomed Mater Eng, 2014, 24 (1 Suppl): 3-16. |
| [21] | Liu MH, Sun C, Yao Y, et al. Matrix stiffness promotes cartilage endplate chondrocyte calcification in disc degeneration via miR-20a targeting ANKH expression[J]. Sci Rep, 2016, 6 : 25401. DOI: 10.1038/srep25401. |
| [22] | Sortica DA, Buffon MP, Souza BM, et al. Association between the ENPP1 K121Q polymorphism and risk of diabetic kidney disease: a systematic review and meta-analysis[J]. PLoS One, 2015, 10 (3): e0118416. DOI: 10.1371/journal.pone.0118416. |
| [23] | Kaji H. Pyrophosphate and mineralization[J]. Clin Calcium, 2007, 17 (10): 1574-9. |
| [24] | 韦宋谱, 丁道芳, 王学宗, 等. 河蚌提取物葡聚糖对软骨细胞Wnt通路的调控作用研究[J]. 中国骨伤, 2014 (6): 461-5. |
 2017, Vol. 37
2017, Vol. 37

