2. 南方医科大学 南方医院神经内科,广东 广州 510515;
3. 南方医科大学 南方医科大学珠江医院检验医学部,广东 广州 510282
2. Department of Environmental Health, Department of Neurology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
3. Department of Environmental Health, Division of Laboratory Medicine, Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China
随着近年来生活水平的提高和饮食习惯的改变,我国肥胖率逐年上升。2010年我国60岁及以上老年人的超重率为32.1%,肥胖率为12.4%[1],人体机能组份随着体质量指数 (BMI) 升高而下降[2],癌症和糖尿病风险也随之增加[3-4],60岁及以上肥胖人群的心血管代谢性危险因素聚集比例高达88.4%[1]。
肠道菌群作为宿主体内的共生者,参与机体的营养吸收代谢、免疫调节等活动。不同的饮食模式可以塑造不同特征的肠道菌群,高脂饮食所诱导的肠道菌群紊乱可能是引起肥胖以及代谢性疾病的病因之一[5],肠道菌群可通过提高食物能量的摄取、增加脂肪酸合成、促进甘油三酯在肝脏和脂肪组织中沉积等途径导致肥胖[6]。另一方面,断食和卡路里限制也能改变肠道菌群,有效降低血压和炎症因子水平、提高胰岛素敏感性,抑制多种疾病发生[7-8],断食对机体的影响具有整体性,包括降低肠动力、削弱免疫系统功能、改变营养代谢方式等[9]。长期性的卡路里限制饮食有效地改善肠道菌群并延长小鼠寿命[10]。断食能重塑2型糖尿病小鼠的β细胞,增加胰岛素分泌,致血糖稳定[11]。但以上的研究均以青壮年的动物模型为研究对象,间歇性断食对老年或老年前期的肥胖个体肠道菌群如何影响以及是否能改善肥胖相关指标尚无任何报道。因此,本研究使用高脂高糖饲料饲养Wistar大鼠构建老年前期肥胖模型,探究间歇性断食是否通过改变肠道菌群结构,从而改善老年前期肥胖大鼠的生理状况。
1 材料和方法 1.1 实验动物和饲料雌性Wistar大鼠,6~8周,36只。大鼠和普通饲料由南方医科大学实验动物中心提供。
高脂高糖饲料:普通饲料53.6%、蔗糖16%、猪油11%、蛋黄粉6%、干酪素5%、奶粉5%、植物油2%、胆固醇1.2%、胆盐0.2%[12-13](委托南方医科大学实验动物中心加工)。
1.2 老年前期肥胖大鼠模型造模及分组大鼠适应环境1周后,根据体质量分层随机抽出7只为正常对照组 (NC),继续普通饲料饲养;其余29只给予高脂高糖饲料饲养造模,42周后再根据体质量均数±标准差范围选出16只纳入实验,随机分为模型对照组 (HFD, n=8) 和断食组 (IF, n=8)。
1.3 干预断食组给予高脂高糖饲料饲养,每2周断食72 h,总干预时间18周。每周称量体质量并收集粪便样本。干预结束1周后,禁食不禁水12 h,给予腹腔注射10%水合氯醛麻醉 (3 mL/kg),心脏采血处死动物,留取血液样本和肝脏。
1.4 观察指标及检测方法(1) 每周记录大鼠体质量及饲料消耗量。
(2) 口服葡萄糖耐量测试 (OGTT):大鼠禁食不禁水12 h,尾尖采血用微量血糖测定仪测定空腹血糖 (GLU) 后,每只大鼠灌服50%葡萄糖,2.5 g/kg,测定灌服葡萄糖后30、60、90、120 min的血糖值,计算血糖曲线下面积 (AUC)。
AUC=15×(GLU0+2GLU30+2GLU60+2GLU90+GLU120)
(3) 血脂四项:全自动生物化学分析仪用生化法测定甘油三酯 (TG)、总胆固醇 (TC)、高密度脂蛋白胆固醇 (HDL-C)、低密度脂蛋白胆固醇 (LDL-C)。
(4) 组织形态学检测:取肝脏组织固定,石蜡包埋切片,HE染色,镜下观察肝脏组织形态学变化并对脂肪变性进行评估。每张切片观察5个视野,根据光镜下每面积见的肝脂肪病变对肝脏脂肪变性程度分级:正常 (0,-):肝小叶结构良好,基本无脂肪病变;轻度 (1,+):小于1/3肝细胞发生脂肪变;中度 (2,++):即1/3~2/3以上的肝细胞脂变;重度 (3,+++);即大于2/3肝细胞发生脂肪变,每组选取5个样本进行评分。
(5) 肠道菌群细菌16S rDNA测序分析:粪便样本按照易瑞粪便细菌总DNA磁珠法提取试剂盒的操作手册进行操作,提取细菌DNA。再以获得的细菌DNA为模板进行细菌16S rDNA V4可变区PCR扩增。V4上游引物F-5'GTGTGCCAGCMGCCGCGGTAA3'和V4下游引物R-5'CCGGACTACHVGGGTWTCTAAT3',本研究使用带有barcode的通用引物[14]。采用Illumina HiSeq2000测序技术对16S rDNA V4区PCR产物进行测序 (华大基因)。得到的原始数据和reads进行去除接头序列、低复杂度序列和低质量序列的处理,得到高通量下机原始碱基序列,采用BIPES分析流程分析数据。BIPES生物分析主要包括操作分类单元 (OTU) 的生成及主成分分析 (PCoA)、进化树分析及菌群特征性分析、菌属丰富度分析、群落结构多样性分析、菌群间差异比较分析 (LEfSe在线统计分析工具) 等。
1.5 统计学处理采用SPSS 20.0软件进行数据分析,数据结果以均数±标准差表示;两组之间均数比较采用两样本t检验;3组及以上均数比较采用One-way ANOVA,多个处理组两两比较用LSD比较,矫正检验水准。P < 0.05具有统计学差异。
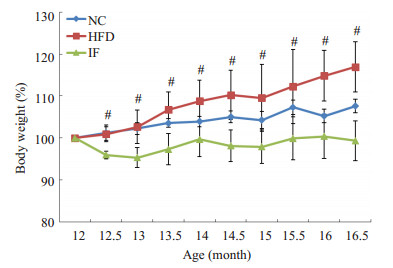
2 结果 2.1 间歇性断食对肥胖大鼠体质量的影响经42周高脂高糖饲养造模,大鼠逐渐从成年期进入老年前期。3组初始体质量分别为:正常对照组 (NC) 297.47±23.03 g,模型对照组 (HFD)348.76±15.85 g,断食组 (IF)369.34±19.49 g。其中NC组显著低于其余两组 (P < 0.01),而HFD组与IF组间无统计差异 (P > 0.05)。从第1次断食开始,IF组体质量变化与HFD组呈现明显差异 (图 1)。在高脂高糖饮食饲养下,IF组体质量始终维持在原来的95%~100%,而HFD组体质量仍继续上升。干预结束后,HFD组增加16.9%,达到407.5±23.16 g,而IF组为366.7±22.10 g,正常对照组体质量增加了7%,为320.29±27.90 g。3组中,IF组体质量增加最少,并与HFD组存在显著差异 (P < 0.01)。
|
图 1 大鼠体质量变化 Figure 1 Body weight changes of rats. NC: Normal chow group; HFD: High-fat diet group; IF: Intermittent fasting group. HFD compared with IF, #P < 0.01. |
实验结束时,HFD组大鼠血脂CHOL、HDL-C水平显著高于NC组 (P < 0.05,图 2)。经过间歇性断食,IF组大鼠HDL-C、LDL-C显著下降 (P < 0.05,图 2),CHOL、HDL-C和LDL-C恢复到NC组水平。实验干预前3组OGTT测试曲线下面积相当,但是经过间歇性断食后IF组空腹血糖显著上升 (P < 0.01,图 3),OGTT测试曲线下面积显著高于HFD组,呈现糖耐量减退 (P=0.02,图 3)。

|
图 2 间歇性断食对肥胖大鼠血脂的影响 Figure 2 Blood lipid levels in the rats (mmol/L). A: Total cholesterol; B: High-density lipoprotein; C: Triglyceride; D: Low-density lipoprotein. **P < 0.05. |

|
图 3 口服葡萄糖耐量实验 (OGTT) 结果及空腹血糖 Figure 3 OGTT results and fasting blood glucose level in the rats. A: OGTT results before intervention; B: OGTT results after intervention; C: Area under curve (AUC) before intervention; D: AUC after intervention; E: Fasting blood glucose (GLU). ***P < 0.01. |
如图 4所示,NC组的肝脏组织结构正常,肝小叶结构明显,肝细胞索呈放射状排列,肝细胞内未见气球样变性,肝脏脂肪变性评分均为0。HFD组的肝细胞弥漫脂肪空泡变性,重度水样变性,细胞核被挤压变性部分消失,脂肪变性评分中位数为2。经过间歇性断食,IF组的肝脏细胞可见少量脂肪变性和水样变性,肝脏脂肪变程度评分中位数为1.5,优于HFD组。

|
图 4 大鼠肝脏组织HE染色观察 Figure 4 HE staining of liver tissues (Original magnification:×100). A: NC group; B: HFD group; C: IF group; D: Liver steatosis of rats. |
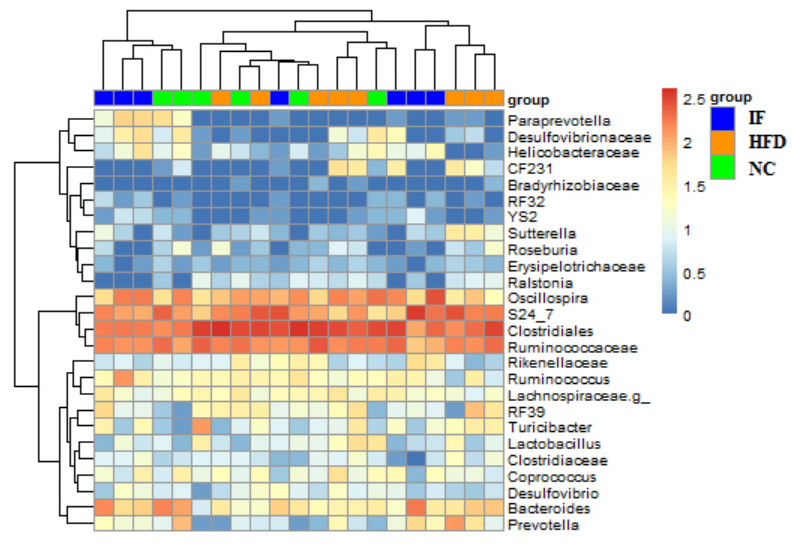
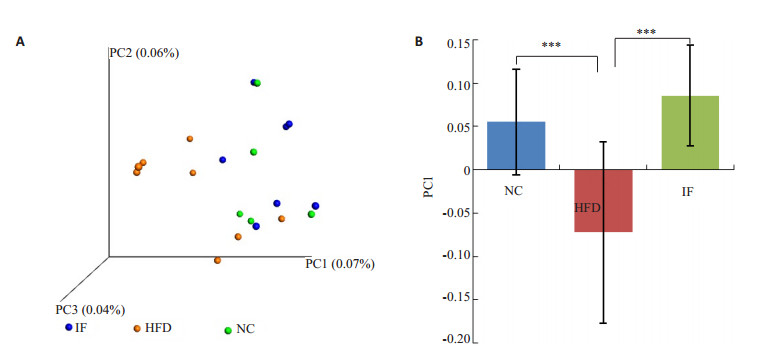
肠道菌群分析结果显示,3组大鼠肠道菌群构成均以Clostridiales (梭菌目)、S24_7、Ruminococcaceae(瘤胃球菌科)、Oscillopira(颤螺菌属) 为主 (图 5)。基于unweighted UniFrac距离计算,对肠道菌群β多样性进行主成分分析 (principal component analysis, PCoA),高脂高糖饮食饲养下,HFD组菌群构成与NC组差异显著 (P < 0.01,图 6A),断食能使肠道菌群结构恢复到正常饮食状态 (P < 0.01,图 6B)。
|
图 5 大鼠肠道菌群主要菌属构成 Figure 5 Structure of gut microbiota in the rats at the genus level. |
|
图 6 β多样性 Figure 6 β diversity in unweightedunifrac. A: PCoA; B: Comparison of relative distance between groups in PCoA PC1. ***P < 0.01. |
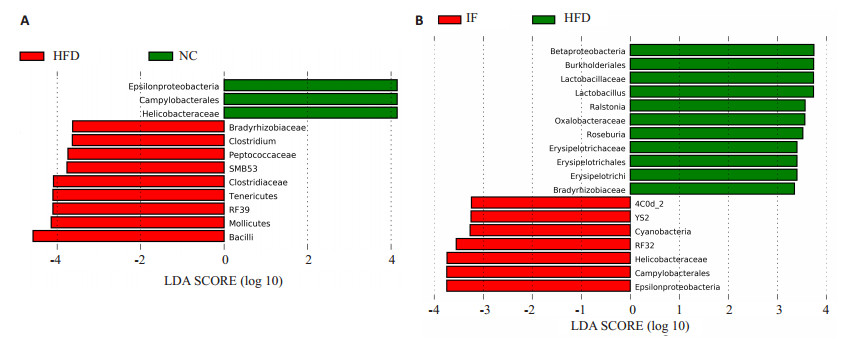
运用LEfSe统计比较各组间差异菌属,结果显示,NC组Helicobacteraceae (螺杆菌科) 较多;HFD组Clostridium(梭菌属)、RF39(柔膜菌)、SMB53、Peptococcaceae(消化球菌科) 和Bradyrhizobiaceae(慢生根瘤菌科) 较多 (图 7A)。HFD与IF组比较,IF组的YS2、RF32、Helicobacteraceae较多;而HFD组的Lactobacillus(乳杆菌属)、Roseburia(罗氏菌属)、Erysipelotrichaceae(韦荣球菌科)、Ralstonia(青枯菌属) 较多 (图 7B)。
|
图 7 LEfSe统计比较各组间差异菌属 Figure 7 Biomarkers of different groups. A: NC group compared with HFD; B: HFD group compared with IFgroup. |
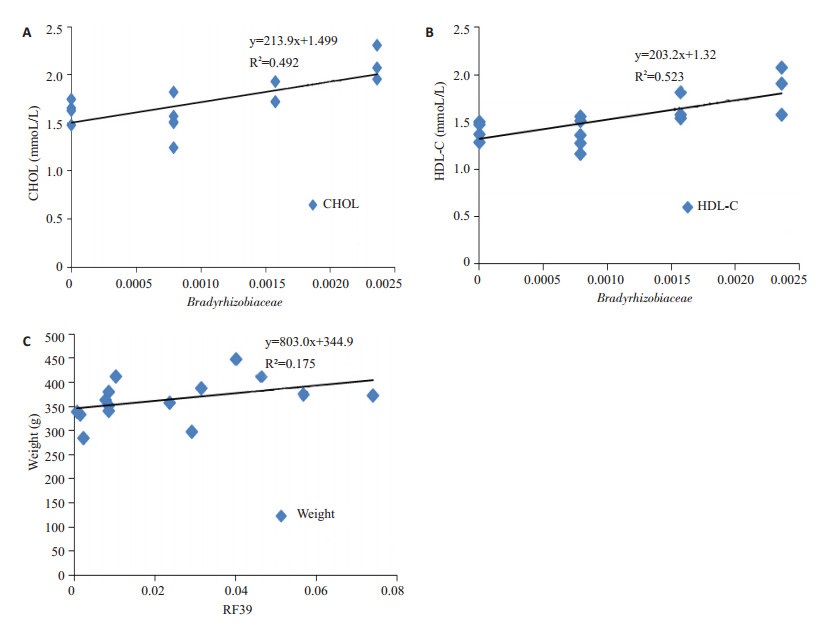
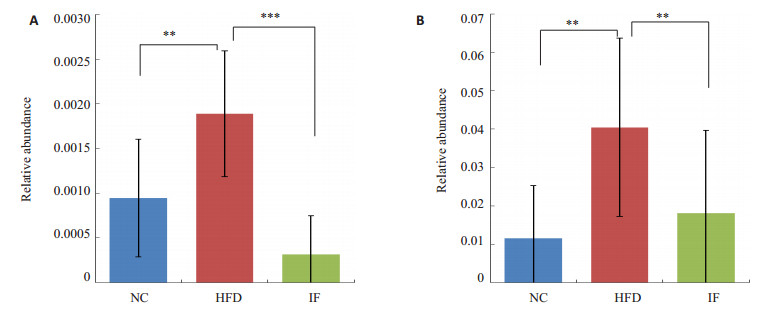
运用Spearman相关性分析,寻找与大鼠生理指标变化相关的细菌。其中Bradyrhizobiaceae与CHOL、HDL-C呈正相关。RF39与大鼠体质量呈负相关 (图 8)。如图 9,高脂高糖饮食使大鼠肠道菌群中的Bradyrhizobiaceae、RF39明显提高。经过间歇性断食后,两种细菌相对丰度均下降。结果表明间歇性断食能抑制Bradyrhizobiaceae和RF39的生长。
|
图 8 体征指标相关的细菌 Figure 8 Correlation between bacteria and the weight or blood lipids. A: Correlation between CHOL and Bradyrhizobiaceae; B: Correlation between HDL and Bradyrhizobiaceae; C: Correlation between weight and RF39. |
|
图 9 Bradyrhizobiaceae、RF39的相对丰度 Figure 9 Relative abundance of Bradyrhizobiaceae and RF39. A: Bradyrhizobiaceae; B: RF39. **P < 0.05, ***P < 0.01. |
我国2010年有4.4亿成人超重或肥胖,研究发现肥胖人群的危险因素聚集、心血管疾病和代谢性疾病流行普遍高于体质量正常人群,其中60岁以上肥胖人群的糖尿病、高血压和高脂血症患病率显著高于60岁以下肥胖人群[15],因此年龄被考虑为肥胖人群的危险因素之一。动物实验发现随着鼠龄增加,大鼠体质量也相应增加,皮下及内脏脂肪和胰岛素水平均显著增加[16]。本研究发现,老年前期大鼠的体质量仍继续增长,老年前期肥胖大鼠的体质量增长尤为显著,而间歇性断食能有效控制老年前期肥胖大鼠的体质量增长。
间歇性断食能够有效预防和改善青壮年大鼠的腹性肥胖、炎症和高血压,提高胰岛素敏感度,降低血糖[17-18]。原因可能是长时间能量摄入受限,为了保证重要器官的运作,机体会调整能量代谢通路,减缓新陈代谢,代偿性地增加内源性能量产生[19]。如脂肪酸经过β-氧化作用生成乙酰辅酶A,进入三羧酸循环产生大量能量[20]。本研究发现,老年前期肥胖大鼠在间歇性断食作用下,降低血脂中的LDL-C、HDL-C和CHOL,可能是将体内富余的脂质用于能量代谢。
研究发现,断食能抑制IGF1、mTOR和PKA的表达,令细胞发生重编程,再生更多可分泌的胰岛β细胞,分泌胰岛素并稳定血糖水平[11]。但我们发现老年前期肥胖大鼠在间歇性断食后,空腹血糖显著升高,葡萄糖耐受性减弱,与青壮年大鼠断食结果不一。其原因可能是,在断食期间,机体为满足能量需求,在糖异生作用下生成大量葡萄糖[21-22],而老年机体胰岛组织受损严重,胰岛素敏感性下降,应对断食期间糖异生作用形成的高血糖水平,胰岛细胞代偿性分泌胰岛素不足,导致血糖控制失衡。
肠道菌群与机体的能量代谢密切相关,研究发现Bacteroides(拟杆菌) 能调节营养吸收和外源物质代谢,主要功能在于吸收和降解多糖[23]。Clostridium能分解多糖产生短链脂肪酸,还可以促进脂多糖吸收、抑制肠道饥饿诱导脂肪因子等[24]。本研究发现长期高脂高糖饮食作用下,使老年前期肥胖大鼠肠道菌群中Clostridium、RF39、SMB53、Peptococcaceae和Bradyrhizobiaceae增加,Helicobacteraceae减少。间歇性断食能够改善肠道菌群,使YS2、RF32、Helicobacteraceae增加,Lactobacillus、Roseburia、Erysipelotrichaceae、Ralstonia、Bradyrhizobiaceae、RF39减少。
本研究发现Bradyrhizobiaceae与CHOL、HDL-C呈正相关,RF39与大鼠体质量呈负相关。RF39所属的Tenericutes门由mollicutes纲构成,mollicutes纲只包含RF39目。经发现随着宿主成长,其消化能力增强的同时,Tenericutes的相对丰度也增加[25]。高脂高糖饮食促使Tenericutes丰度增加,令宿主更容易吸收糖分[26]。间歇性断食使宿主食物摄入大量减少,Tenericutes丰度因肠道环境改变而下降。Bradyrhizobiaceae,首次发现与脂肪代谢相关联,具体代谢途径仍不清晰,需要进一步的探索研究。
本研究使用老年前期肥胖大鼠模型研究间歇性断食对衰老个体代谢及肠道菌群的影响。结果表明长期的间歇性断食能改变老年前期肥胖大鼠的肠道菌群,改善其血脂水平和控制体质量增长,但会提高血糖水平,降低葡萄糖耐受能力,说明间歇性断食对老年前期肥胖大鼠的影响具有两面性。本研究从改善肠道菌群角度,为肥胖患者揭示断食影响机制提供新的视角。
| [1] | 李晓燕, 姜勇, 胡楠, 等. 2010年我国成年人超重及肥胖流行特征[J]. 中华预防医学杂志, 2012, 46 (8): 683-6. |
| [2] | Korhonen PE, Seppälä T, Järvenpää S, et al. Body mass index and health-related quality of Life in apparently healthy individuals[J]. Qual Life Res, 2014, 23 (1): 67-74. DOI: 10.1007/s11136-013-0433-6. |
| [3] | Kim S, Sohn I, Ahn JI, et al. Hepatic gene expression profiles in a long-term high-fat diet-induced obesity mouse model[J]. Gene, 2004, 340 (1): 99-109. DOI: 10.1016/j.gene.2004.06.015. |
| [4] | Choi JW, Liu H, Song H, et al. Plasma marker proteins associated with the progression of lung Cancer in obese mice fed a high-fat diet[J]. Proteomics, 2012, 12 (12): 1999-2013. DOI: 10.1002/pmic.201100582. |
| [5] | Zhang C, Zhang M, Wang S, et al. Interactions between gut microbiota, host genetics and diet relevant to development of metabolic syndromes in mice[J]. ISME J, 2010, 4 (2): 232-41. DOI: 10.1038/ismej.2009.112. |
| [6] | Bäckhed F, Manchester JK, Semenkovich CF, et al. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice[J]. Proc Natl Acad Sci USA, 2007, 104 (3): 979-84. DOI: 10.1073/pnas.0605374104. |
| [7] | Longo VD, Mattson MP. Fasting: molecular mechanisms and clinical applications[J]. Cell Metab, 2014, 19 (2): 181-92. DOI: 10.1016/j.cmet.2013.12.008. |
| [8] | Lee C, Safdie FM, Raffaghello L, et al. Reduced levels of IGF-I mediate differential protection of normal and Cancer cells in response to fasting and improve chemotherapeutic index[J]. Cancer Res, 2010, 70 (4): 1564-72. DOI: 10.1158/0008-5472.CAN-09-3228. |
| [9] | Flint HJ, Duncan SH, Scott KP, et al. Interactions and competition within the microbial community of the human colon: links between diet and health[J]. Environ Microbiol, 2007, 9 (5): 1101-11. DOI: 10.1111/emi.2007.9.issue-5. |
| [10] | Zhang C, Li S, Yang L, et al. Structural modulation of gut microbiota in life-long calorie-restricted mice[J]. Nat Commun, 2013, 14 (2): 2163. |
| [11] | Cheng CW, Villani V, Buono R, et al. Fasting-Mimicking Diet promotes Ngn3-Driven β-Cell regeneration to reverse diabetes[J]. Cell, 2017, 168 (5): 775-788. DOI: 10.1016/j.cell.2017.01.040. |
| [12] | Reaven GM. Role of insulin resistance in human disease[M]. Springer Netherlands, 1992: 1595-607. |
| [13] | 吕建敏, 应华忠, 徐孝平, 等. 高脂血症动物模型研究进展[J]. 浙江中医学院学报, 2005, 29 (4): 87-9. |
| [14] | 盛华芳, 周宏伟. 微生物组学大数据分析方法、挑战与机遇[J]. 南方医科大学学报, 2015 (7): 931-4. |
| [15] | 姜勇. 我国成人超重肥胖流行现状、变化趋势及健康危害研究[D]. 北京: 中国疾病预防控制中心, 2013. |
| [16] | 姜明红. 衰老及肥胖大鼠肝脏糖代谢相关基因的表观遗传学研究[D]. 上海: 复旦大学, 2008: 157. |
| [17] | Wan R, Camandola S, Mattson MP. Intermittent fasting and dietary supplementation with 2-deoxy-D-glucose improve functional and metabolic cardiovascular risk factors in rats[J]. FASEB J, 2003, 17 (9): 1133-4. |
| [18] | Castello L, Froio T, Maina M, et al. Alternate-day fasting protects the rat heart against age-induced inflammation and fibrosis by inhibiting oxidative damage and NF-kB activation[J]. Free Radic Biol Med, 2010, 48 (1): 47-54. DOI: 10.1016/j.freeradbiomed.2009.10.003. |
| [19] | Jiang J, Bakan A, Kapralov AA, et al. Designing inhibitors of cytochrome c/cardiolipin peroxidase complexes: mitochondriatargeted imidazole-substituted fatty acids[J]. Free Radic Biol Med, 2014, 71 (6): 221-30. |
| [20] | 倪菊华, 郏弋萍, 刘观昌. 医学生物化学[M]. 北京: 北京大学医学出版社, 2014. |
| [21] | Matschinsky FM. Glucokinase, glucose homeostasis, and diabetes mellitus[J]. Curr Diab Rep, 2005, 5 (3): 171-6. DOI: 10.1007/s11892-005-0005-4. |
| [22] | Balm PM. Stress physiology in animals[M]. Stress physiology in animals, 1999: 753-4. |
| [23] | Hooper LV, Wong MH, Thelin A, et al. Molecular analysis of commensal host-microbial relationships in the intestine[J]. Science, 2001, 291 (555): 881-4. |
| [24] | Clausen MR, Mortensen PB. Kinetic studies on colonocyte metabolism of short chain fatty acids and glucose in ulcerative colitis[J]. Gut, 1995, 37 (5): 684-9. DOI: 10.1136/gut.37.5.684. |
| [25] | Niu Q, Li P, Hao S, et al. Dynamic distribution of the gut microbiota and the relationship with apparent crude fiber digestibility and growth stages in pigs[J]. Sci Rep, 2015, 5 (9938): 9938. |
| [26] | Manurung S. Fermented whey permeate for piglets:as a strategy to reduce post weaning diarrhoea[J]. DTU Orbit, 2012, 35 (7): 48. |
 2017, Vol. 37
2017, Vol. 37

