结缔组织病相关间质性肺炎(CTD-ILD)为一类继发于系统性红斑狼疮,类风湿性关节炎、干燥综合征和硬皮病等结缔组织病的肺组织间质的疾病[1-2]。据统计,大约20%的间质性肺炎继发于结缔组织病[3]。CTD-ILD的病死率较高[4-5],但其临床表现及影像学特征都和非结缔组织病相关间质性肺炎(NCTD-ILD)十分相似[6-7],加上部分CTD-ILD患者在发病初期往往以单一的肺部表现为主,导致呼吸内科医师忽略并漏诊结缔组织病,导致病情难以控制,错过最佳治疗时机[8-9],做到早期诊断及早期治疗显得十分重要。目前国内外并没有特异性协助诊断CTD-ILD的实验室检验指标,因此联合相关指标来协助诊断CTD-ILD就尤为重要。C反应蛋白(CRP)有助于提高肺炎确诊的概率[10]。Arinzon等[11]则认为CRP是诊断肺炎和判断肺炎预后的重要工具。Mooiweer等[12]进一步指出超敏反应蛋白(Hs-CRP)比CRP更能动态预测肺炎患者的死亡率。血清D-二聚体(D-DI)和社区获得性肺炎的严重性相关[13]。D-DI能预测社区获得性肺炎的死亡率[14]。由一项随机临床试验进行分析指出D-DI浓度能用来评估社区获得性肺炎的病情严重性和临床预后[15]。在营养不良小鼠模型中成功使用凝血激活的方法制成肺炎模型,证明凝血功能参与了肺炎的形成[16]。社区获得性肺炎患者的止血和血管内皮功能存在不同程度的障碍[17]。徐悦利等的研究表明不同严重程度社区获得性肺炎与凝血及纤溶指标密切相关[18]。庄其宏等进一步指出纤维蛋白原可以作为社区获得性肺炎预后的判断指标[19]。由此,我们推测这三个与肺炎确诊及预后的密切相关的指标,应该在CTD-ILD和NCTD-ILD中也有明显的升高,但这三个指标在CTD-ILD和NCTD-ILD升高的程度是否一致,哪些指标更有助于提高确诊率CTD-ILD呢?为了解答上述问题,本研究选取2010年1月~2016年4月南方医科大学珠江医院收治的间质性肺炎患者69例,分为CTD-ILD组(30例)和NCTD-ILD组(39例),同期纳入25例健康人作为对照组,行血浆Hs-CRP、纤维蛋白原(Fg)和D-DI检测。
1 资料和方法 1.1 一般资料南方医科大学珠江医院自2010年1月~2016年4月以来收治的间质性肺炎患者72例,入选标准:患者为成年人,间质性肺炎诊断符合2008年英国胸科学会颁布的肺间质病诊断指南内的诊断标准[20],各种结缔组织病诊断符合美国风湿病学协会或国际分类标准。排除标准:(1)外源性感染;(2)冠心病;(3)急性心功能不全;(4)慢性肾功能不全;(5)肾病综合征;(6)肺栓塞;(7)肿瘤。入组患者男34例,女35例,分为两组:(1)CTD-ILD组:男16例,女14例,平均年龄61.57±15.93岁;(2)NCTD-ILD组:男18例,女21例,平均年龄64.64±14.05岁;另外纳入32名健康人作为对照组:男16例,女9例,平均年龄54.60±14.38岁。本研究我们已经向患者及家属详细告知并得到取得患者同意,我们承诺绝不会对外泄露患者信息并取得医院伦理证明。
1.2 Hs-CRP、Fg和D-DI检测方法所有患者均在入院24 h内于当日或次日清晨在空腹状态下完成抽血送检测hs-CRP、Fg和D-DI。以普通无抗凝管抽取3 mL血液,在德国西门子医疗诊断有限公司的BNProSpec全自动特定蛋白分析系统及hs-CRP检测试剂盒下,运动免疫散射比浊法测定Hs-CRP浓度(正常范围(正常范围:0~5 mg/L))。再以枸橼酸盐抗凝管留取2 mL血液,在法国STAGO公司的全自动凝血分析仪,分别在Fg检测试剂盒下利用凝固法测定Fg(正常范围:2~4 g/L),在D-DI检测试剂盒下利用免疫比浊法测定D-DI(正常范围:0~1.0 mg/L)。
1.3 统计学方法利用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差表示,超出检验指标正常范围的受检者即被定义为高于正常浓度。各组间数据比较利用单因素方差分析进行,组间方差齐时利用LSD-t检验进行两两比较,不齐时利用Tamhane's T2(M)检验。检验结果以P<0.05作为差异有统计学意义。
2 结果 2.1 hs-CRP的浓度比较在纳入研究的患者组中,一共收集到66名患者的hs-CRP浓度(CTD-ILD组30名,NCTD-ILD组36名),对照组25名健康人的hs-CRP浓度。各组数据分布呈正态分布,方差齐性检验(F检验)提示各组间方差齐。CTD-ILD组的hs-CRP浓度32.69±32.13 mg/L高于NCTD-ILD组4.99±3.48 mg/L,NCTD-ILD组的hs-CRP浓度高于对照组1.21±0.28 mg/L,差异均有统计学意义(P<0.05)。由此可知hs-CRP值在CTD-ILD组及NCTD-ILD组均明显高于健康对照组,且hs-CRP值在CTD-ILD组明显高于NCTD-ILD组,差异均有统计学意义(表 1)。
| 表 1 3组患者hs-CRP浓度 Table 1 Plasma concentration of hs-CRP in the 3 groups (Mean±SD) |
在纳入研究的患者组中,一共收集到69名患者的hs-CRP浓度(CTD-ILD组30名,NCTD-ILD组39名),对照组25名健康人的Fg浓度。各组数据分布呈正态分布,方差齐性检验(F检验)提示各组间方差齐。CTD-ILD组的4.58±1.24 mg/L和NCTD-ILD组的4.25±1.16 mg/L Fg浓度均高于对照组3.84±1.38 mg/L,差异有统计学意义(P<0.05),但其两组之间的差异没有统计学意义(P>0.05),Fg高于正常浓度患者率的差异也没有统计学意义(P>0.05,表 2)。
| 表 2 3组患者Fg浓度 Table 2 Plasma concentration of Fg in the 3 groups (Mean±SD) |
在纳入研究的患者组中,一共收集到40名患者的D-DI浓度(CTD-ILD组19名,NCTD-ILD组21名),和对照组13名健康人的D-DI浓度。各组数据分布呈正态分布,方差齐性检验(F检验)提示各组间方差齐。CTDILD组的1.69±1.78 mg/L和NCTD-ILD组的1.46±1.64 mg/L D-DI浓度均高于对照组0.13±0.04 mg/L,差异有统计学意义(P<0.05),但CTD-ILD组和NCTDILD组的D-DI浓度差异没有统计学意义(P>0.05),D-DI高于正常浓度患者率的差异也没有统计学意义(P>0.05,表 3)。
| 表 3 3组患者D-DI浓度 Table 3 Plasma concentration of D-DI in the 3 groups (Mean±SD) |
Hs-CRP浓度分别与D-DI浓度、Fg浓度呈正相关(r=0.539,r=0.534,P均<0.01)。Hs-CRP浓度与D-DI浓度、Fg浓度的线性相关方程分别为:“y=0.0179x+0.632”和“y=0.0306x+3.363”(图 1)。
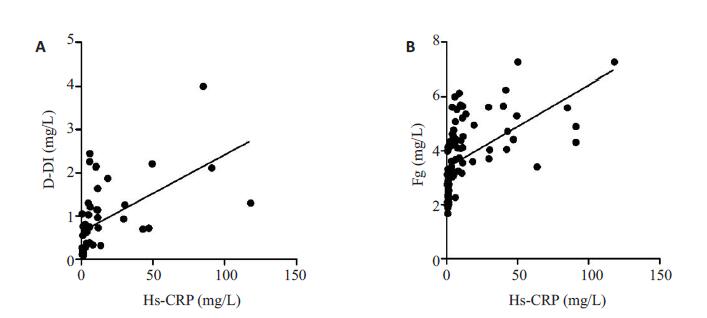
|
图 1 Hs-CRP分别与D-DI、Fg的相关性分析 Figure 1 Correlation analysis of serum Hs-CRP level with D-DI and Fg. A: Hs-CRP was positively correlated with D-DI (r=0.539, P < 0.01); B: Hs-CRP was positively correlated with Fg (r=0.534, P < 0.01). |
CTD为一组以结缔组织非感染性发炎、增生及变性,可全身多系统多脏器受累的自身免疫病,其导致机体免疫功能紊乱,免疫复合物沉积于病变部位,激活补体系统和抗体依赖细胞街道细胞毒性等途径引起内脏损伤和小血管炎。当累及肺脏的时候以ILD最多见。ILD主要累及肺泡间隔,病理表现为肺泡间隔炎症细胞浸润及纤维化改变,微血管炎症及栓塞,偶可伴有肺实质受累,表现为肺泡渗出和出血[4]。本研究发现,ILD患者的hs-CRP、Fg和D-DI均比健康人群高,其内在机制可能为机体炎症反应,以及肺部小血管栓塞和纤维化所导致,而当合并CTD时,全身炎症反应加重,导致hs-CRP显著升高。
Hs-CRP是早期反应全身炎症的重要指标[21],在机体出现感染、肿瘤、创伤以及自身免疫疾病时异常升高[7]。Hs-CRP在白细胞介素-6、肿瘤坏死因子α等促炎因子的作用下由肝脏合成,6~12 h达到最高峰,参与全身炎症反应,其浓度与炎症反应的程度成正比,而且不会因为使用皮质激素等治疗措施的干扰[22]。CTD和ILD在急性活动期时通常伴有一定程度的全身炎症反应,本研究发现,CTD-ILD患者组和NCTD-ILD患者组的hs-CRP都较对照组明显升高,特别是CTD-ILD组的hs-CRP浓度比NCTD-ILD组明显升高,以及拥有更高的高于正常浓度患者率,在排除外源性感染、肿瘤、心脏病、肾病等疾病后,可以说明hs-CRP与CTD和ILD的急性活动度有关,因此,hs-CRP作为一个经济简便的临床参考指标,能在早期浓度显著升高的情况下提示ILD患者存在CTD的可能,引起呼吸内科医师的警惕,及时检验患者各项自身抗体指标,从而达到早期诊断、早期治疗的目的。另外,既往的研究提出,血栓的形成不单只是血液凝固的过程,还是炎症发生的过程[8],我们通过线性分析发现hs-CRP浓度分别与Fg浓度及D-DI浓度呈线性相关,提示hs-CRP可能参与到血栓形成的病理过程,CTD-ILD患者hs-CRP浓度明显升高,除了提示患者体内较严重的炎症反应外,还提示肺间质微血管血栓病情要比NCTD-ILD患者重,应该引起警惕,尽快干预病情的进展。
Fg又称为凝血因子Ⅰ,是由肝脏合成的一种不可或缺的具有凝血功能的血浆糖蛋白,在血液凝固过程中起到重要作用。Fg属于急性期反应蛋白,与血小板膜蛋白相结合,使血小板激活,促进血小板聚集,使机体处于高凝状态,有利于肺部微血管的血栓形成。同时,Fg浓度的升高导致机体继发纤溶亢进,引起D-DI浓度的升高。本研究发现,CTD-ILD及NCTD-ILD[23]组的Fg浓度均比对照组高,其内在机制为ILD患者在病情急性活动期时,肺部微血管的血栓加速形成以及微血管炎的纤维化,可见在排除感染、肿瘤及大血管栓塞等病后,Fg对于ILD能起到早期协助诊断的作用。然而,我们同时发现CTD-ILD的Fg浓度与NCTD-ILD相比的差异没有统计学意义(P>0.05),两组之间的Fg高于正常浓度患者率差异也没有统计学意义,可能与以下机制有关:CTD为全身性免疫疾病,其病理过程主要表现为全身炎症反应,小血管血栓及纤维化并非其主要病理过程,因此,Fg对于CTD-ILD早期诊断仍缺乏特异性。
D-DI是纤维蛋白单体经活化因子交联后,再经纤溶酶水解所产生的一种特异性降解产物, 是唯一反映凝血酶和纤溶酶的理想标志,其浓度高低和血栓病情的严重程度相关[20-21]。由于D-DI对血栓的形成的敏感性极高(95%),呼吸内科医师多用于排除肺部大血管栓塞病情[22],但对于经常伴有微血管血栓形成的ILD的诊断价值的临床研究一直比较缺乏[9]。本研究发现,大部分ILD患者都出现D-DI升高超过正常浓度,而且都较健康人明显升高,研究结果和Kinder等[23]的研究一致。ILD患者的D-DI浓度升高,反应机体凝血和纤溶系统的激活,表明ILD活动期存在肺间质小血管炎,而反复血管炎性病变引起血管内皮细胞受损、血小板聚集增加及活化,加速微血栓的形成,并最终导致肺间质微血管的纤维化[24]。需要注意的是,D-DI在临床上的诊断价值在于排除血栓性疾病[25],而CTD的小血管炎导致的血管栓塞累及的器官不单在于肺脏,因此D-DI浓度的升高对于诊断CTD-ILD的特异性还比较欠缺,呼吸内科医师应注意排除其他脏器小血管栓塞的可能。
综上所述,ILD患者体内存在全身炎症反应及血液高凝状态,从而导致hs-CRP、Fg和D-DI均较健康人明显升高。而全身炎症反应在CTD-ILD患者中表现更为突出,hs-CRP升高浓度明显大于NCTD-ILD组,且两组有明显的统计学差异,这提示hs-CRP比Fg和D-DI在确诊CTD-ILD方面更有价值,如果早期患者hs-CRP明显增高更应警惕CTD-ILD的存在。另外hs-CRP分别与Fg、D-DI均呈正相关,提示全身炎症反应是导致Fg和D-DI升高的重要原因。
| [1] | Disayabutr S, Calfee CS, Collard HR, et al. Interstitial lung diseases in the hospitalized patient[J]. BMC Med, 2015, 13 (1): 245. DOI: 10.1186/s12916-015-0487-0. |
| [2] | Matěj R, Nová M, Hornychová H. Histopathology of interstitial lung diseases[J]. Cesk Patol, 2016, 52 (2): 76-84. |
| [3] | 张奉春. 弥漫性结缔组织病的肺间质病变[J]. 中华临床免疫和变态反应杂志, 2008, 2 (3): 171-2. |
| [4] | Antoniou KM, Margaritopoulos G, Economidou F, et al. Pivotal clinical dilemmas in collagen vascular diseases associated with interstitial lung involvement[J]. Eur Respir J, 2009, 33 (4): 882-96. DOI: 10.1183/09031936.00152607. |
| [5] | Bradley B, Branley HM, Egan JJ, et al. Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society[J]. Thorax, 2008, 63 (Suppl 5): v1-58. |
| [6] | Ferrari R, Tanni SE, Caram LM, et al. Three-year follow-up of Interleukin 6 and C-reactive protein in chronic obstructive pulmonary disease[J]. Respir Res, 2013, 14 (1): 24. DOI: 10.1186/1465-9921-14-24. |
| [7] | Crop MJ, Siemes C, Berendes P, et al. Influence of C-reactive protein levels and age on the value of D-dimer in diagnosing pulmonary embolism[J]. Eur J Haematol, 2014, 92 (2): 147-55. DOI: 10.1111/ejh.2014.92.issue-2. |
| [8] | Chirinos JA, Heresi GA, Velasquez H, et al. Elevation of endothelial microparticles, platelets, and leukocyte activation in patients with venous thromboembolism[J]. J Am Coll Cardiol, 2005, 45 (9): 1467-71. DOI: 10.1016/j.jacc.2004.12.075. |
| [9] | Han Q, Luo Q, Xie JX, et al. Diagnostic yield and postoperative mortality associated with surgical lung biopsy for evaluation of interstitial lung diseases: a systematic review and meta-analysis[J]. J Thorac Cardiovasc Surg, 2015, 149 (5): 1394-401. DOI: 10.1016/j.jtcvs.2014.12.057. |
| [10] | Markun S. Pneumonia or notCRP helps to distinguish with average probability[J]. Praxis, 2013, 102 (20): 1263-4. DOI: 10.1024/1661-8157/a001415. |
| [11] | Arinzon Z, Peisakh A, Schrire S, et al. C-reactive protein (CRP): an important diagnostic and prognostic tool in nursing-homeassociated pneumonia[J]. Arch Gerontol Geriatr, 2011, 53 (3): 364-9. DOI: 10.1016/j.archger.2011.01.006. |
| [12] | Mooiweer E, Luijk B, Bonten MM, et al. C-Reactive protein levels but not CRP dynamics predict mortality in patients with pneumococcal pneumonia[J]. Journal of Infection, 2011, 62 (4): 314-6. DOI: 10.1016/j.jinf.2011.01.012. |
| [13] | Mikaeilli H, Zarghami N, Yazdchi M, et al. On-admission level of serum d-dimer and the severity of community-acquired pneumonia[J]. Pak J Biol Sci, 2009, 12 (6): 514-7. DOI: 10.3923/pjbs.2009.514.517. |
| [14] | Nastasijević Borovac D, Radjenović Petković T, Pejčić T, et al. Role of D-dimer in predicting mortality in patients with communityacquired pneumonia[J]. Med Glas (Zenica), 2014, 11 (1): 37-43. |
| [15] | Snijders D, Schoorl M, Schoorl M, et al. D-dimer levels in assessing severity and clinical outcome in patients with community-acquired pneumonia. A secondary analysis of a randomised clinical trial[J]. Eur J Intern Med, 2012, 23 (5): 436-41. DOI: 10.1016/j.ejim.2011.10.019. |
| [16] | Zelaya H, Haro C, Laiño J, et al. Coagulation activation in an experimental pneumonia model in malnourished mice[J]. Can J Physiol Pharmacol, 2011, 89 (1): 41-9. DOI: 10.1139/Y10-102. |
| [17] | Bedilo NV, Vorob'eva NA, Ismaílova NV, et al. Evaluation of haemostasis and endothelial dysfunction characteristics in patient with community-acquired pneumonia[J]. Anesteziol Reanimatol, 2014 (1): 33-8. |
| [18] | 徐悦利, 张阳, 姜锋, 等. 不同严重程度社区获得性肺炎患者凝血及纤溶相关指标的比较[J]. 中华医学杂志, 2015, 95 (24): 1925-9. |
| [19] | 庄其宏, 曾奕明, 史永红. 社区获得性肺炎凝血功能异常对预后的影响[J]. 中华结核和呼吸杂志, 2014, 37 (6): 406-10. |
| [20] | Sagastagoitia JD, Sáez Y, Vacas M, et al. Association between inflammation, lipid and hemostatic factors in patients with stable angina[J]. Thromb Res, 2007, 120 (1): 53-9. DOI: 10.1016/j.thromres.2006.06.013. |
| [21] | Harb TS, Zareba W, Moss AJ, et al. Association between inflammatory markers, hemostatic, and lipid factors in postinfarction patients[J]. Am J Cardiol, 2003, 91 (9): 1120-3. DOI: 10.1016/S0002-9149(03)00162-0. |
| [22] | Adams DM, Stevens SM, Woller SC, et al. Adherence to PIOPED II investigators' recommendations for computed tomography pulmonary angiography[J]. Am J Med, 2013, 126 (1): 36-42. DOI: 10.1016/j.amjmed.2012.05.028. |
| [23] | Kinder BW, Collard HR, King J. Anticoagulant therapy and idiopathic pulmonary fibrosis[J]. Chest, 2006, 130 (1): 302-3. |
| [24] | Andersen CU, Mellemkjær S, Nielsen-Kudsk JE, et al. Diagnostic and prognostic role of biomarkers for pulmonary hypertension in interstitial lung disease[J]. Respir Med, 2012, 106 (12): 1749-55. DOI: 10.1016/j.rmed.2012.09.003. |
| [25] | Rathbun SW, Whitsett TL, Raskob GE. Exclusion of first-episode deep-vein thrombosis after-hours using D-dimer[J]. Blood Coagul Fibrinolysis, 2007, 18 (8): 795-800. DOI: 10.1097/MBC.0b013e3282f10145. |
 2017, Vol. 37
2017, Vol. 37

