肾缺血再灌注损伤(ischemia-reperfusion injury, IRI)是肾移植常见的病理生理现象,是影响移植肾早期功能恢复的重要因素,以后更会增加急性排斥和慢性移植物失功的发生率。肾脏发生缺血事件时,会导致“炎症瀑布”激活,细胞间黏附分子1(ICAM-1)大量表达并作为缺血的“记忆分子”持续存在一定时间[1-2]。靶向超声分子成像技术可有效评价血管内皮炎症/损伤。但由于“轴流作用”的影响,在体内高剪切应力条件下靶向微泡不能达到很好的粘附,限制了其在分子显像中应用[3-4]。研究表明超声辐射力(USRF)能够使微泡偏离轴流中心,向血管对侧偏移实现靶向粘附[5-6]。然而联合超声辐射力和靶向超声分子成像对肾脏的“记忆分子”进行显像早期检测肾IRI,目前国内外研究尚未报道。本实验探讨超声辐射力结合携ICAM-1单抗靶向微泡提高检测小鼠肾IRI的敏感性及可行性。
1 材料和方法 1.1 实验动物昆明小鼠60只,体质量为25~30 g,雄性,由南方医科大学实验动物中心提供。合格证号:scxk(粤)2006-0015。
1.2 主要试剂和仪器平面型非聚焦超声治疗仪(绵阳索尼电子有限责任公司,CSY-01 型)、飞利浦IU22 超声仪(philips,Holland)、小鼠用无创动脉夹(上海奥尔科特生物科技有限公司)、二棕榈酰磷脂酰胆碱(DPPC,美国Sigma 公司)、聚乙二醇(PEG,德国Applichem 公司)、生物化脂质(DSPE-PEG2000-biotin,美国Avanti 公司)、FITC-抗生蛋白链菌素(FITC-Streptavidin,美国Pierce 公司)、生物素化的大鼠抗小鼠ICAM-l 单克隆抗体(Biotin conjugated Rat Anti-mouse ICAM-l Monoclone Antibody,美国BD公司);库尔特计数仪。
1.3 超声微泡的制备各种相关脂质材料按一定质量比例在75 ℃水浴溶解于适量蒸馏水中,同时通全氟丙烷(C3F8)气体,超声振荡至形成乳白色液体,4 ℃静置分层,弃下清并加入等量蒸馏水,去除未结合脂质纯化,制得普通生物素化脂质微泡。而后按一定比例加入抗生蛋白链菌素得到表面结合有抗生蛋白链菌素脂质微泡。在此基础上加入生物素化的抗小鼠ICAM-1单抗,4 ℃静置分层,弃下清并加入等量蒸馏水,去除未结合抗体纯化,制得抗ICAM-1单抗靶向微泡(MBICAM)。4°冰箱静置,备用。
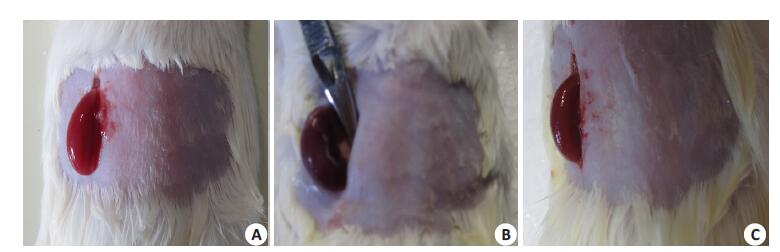
1.4 肾缺血再灌注模型的制备60只小鼠采用戊巴比妥钠(50 mg/kg)腹腔注射麻醉。将小鼠俯卧位固定四肢于鼠板上,4号头皮针穿刺尾静脉。小鼠背部脱毛备皮后随机取一侧行背部切开游离肾脏,无损伤动脉夹夹闭肾蒂,造成肾缺血达30 min 后再灌注,制作缺血再灌注模型(图 1)。或仅背部脱毛备皮,不开腹的正常组(10只)。IR模型根据灌注时间不同分为IRl h、IR3 h、IR6 h、IR12 h、IR24 h五组,每组10只。
|
图 1 肾缺血再灌注损伤模型制备 Figure 1 Mouse model of renal ischemia-reperfusion injury. The kidney of the mouse was bright red before ischemia (A), became dull purple and enlarged after ischemia (B), and recovered its normal color and size after ischemia-reperfusion(C). |
对所有实验小鼠行对比超声成像检查,并根据有无超声辐射力作用随机分为靶向微泡+超声辐射力组(MBICAM+USRF)和靶向微泡组(MBICAM)。动物模型制备后,经小鼠尾静脉团注入5×106个微泡同时超声辐照5 min 后进行CEU或5 min 后直接进行CEU。超声治疗仪为非聚焦平面超声发射器,直径2.2 cm,面积3.8 cm2,探头发射频率为:l MHz,声压:73.9 kPa。超声对比成像:应用飞利浦IU22 彩色多普勒超声诊断仪,L9-3 型高频线阵探头。采用相干脉冲序列成像技术实时观察,探头发射频率为7.0 MHZ,机械指数(MI)为0.18。获取第一帧图像后给予高MI 的连续超声发射2~3 s 以破坏微泡,继续存储本底图像5帧,全部声学造影图像存于CD盘,以备脱机分析。
1.6 图像分析取图结束后,应用Q-Lab图像分析软件对图像进行分析,测量小鼠肾脏造影的VI值。
1.7 病理学及免疫组化检查图像采集完成后,取出小鼠肾脏,10%甲醛固定以备病理学及免疫组化检查。
1.8 统计学分析使用SPSS13.0统计分析软件进行统计学分析,所有数据均以均数±标准差表示,采用析因设计的方差分析对不同处理组(Nomal组、IR1 h、IR3 h、IR6 h、IR12 h、IR24 h)肾脏VI值进行分析,进一步对各时间点内两种实验方法肾脏VI值比较用配对t检验(Paired-Samples T Test)。差异性检验水准设为α=0.05(双侧)。
2 结果 2.1 超声微泡制备情况库尔特计数仪测得MBICAM浓度为6.2×108/mL,微泡平均粒径为2.26±0.89 μm。
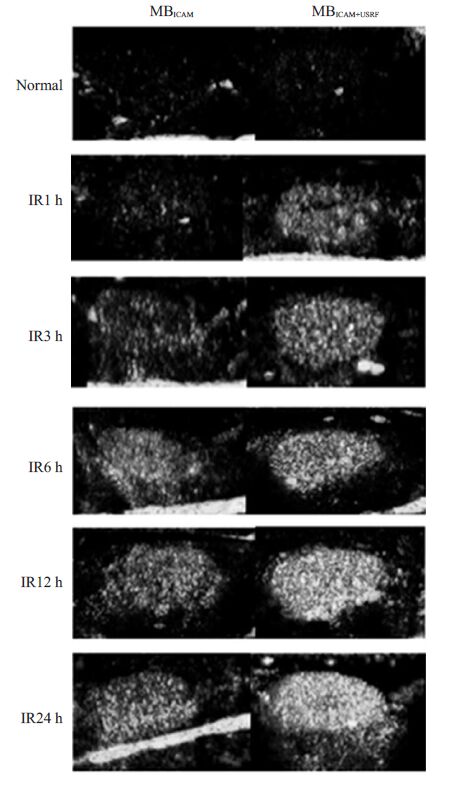
2.2 肾CEU检查结果MBICAM+USRF组及MBICAM组在正常肾脏均未见明显显影增强。两组在超声造影后第一帧造影图像显示:在肾脏IRI不同时间窗下均可见显影增强,并且随着时间的推移,显影强度逐渐增高,但MBICAM+USRF组肾脏显影增强较MBICAM组相应时间窗更加显著(图 2)。
|
图 2 正常及缺血再灌注后不同时间窗肾脏对比超声图像 Figure 2 Contrast ultrasound images of normal and ischemia-reperfusion kidneys at different time points. |
MBICAM 和MBICAM+USRF 各组肾脏VI 值见表 1。MBICAM和MBICAM+USRF两种方法间肾脏VI值有显著差异(F=1593.594,P=0.000),MBICAM + USRF组肾脏VI 值(均数为33.989 dB)显著高于MBICAM组(均数为16.278dB)。对肾脏处理后不同时间之间有显著差异(F=463.437,P=0.000),且多重比较结果显示肾脏VI 随着时间的延长呈递增趋势,IR12 h和IR24 h之间肾脏VI 值无显著差异。正常组MBICAM和MBICAM+USRF肾脏VI值无显著差异(6.47±0.42 对6.45±0.62,P=0.923)。但在缺血再灌注各时间窗肾脏VI值MBICAM+USRF组较MBICAM 组明显增高,两者之间均存在显著性差异(P 均=0.000)。而在MBICAM+USRF组IR1 h肾脏VI值显著高于正常组(23.25±1.21 对6.45±0.62,P=0.000),亦显著高于MBICAM组IR1 h 肾脏VI 值。在MBICAM和MBICAM+USRF,IR12 h 和IR24 h 肾脏VI 值之间无显著差异(P=1.000),其余各组之间均存在显著差异(P<0.05)。
| 表 1 MBICAM和MBICAM+URF各组肾脏VI值 Table 1 Renal VI values in MBICAM group and MBICAM+URF group (dB, MeanSD, n=5) |
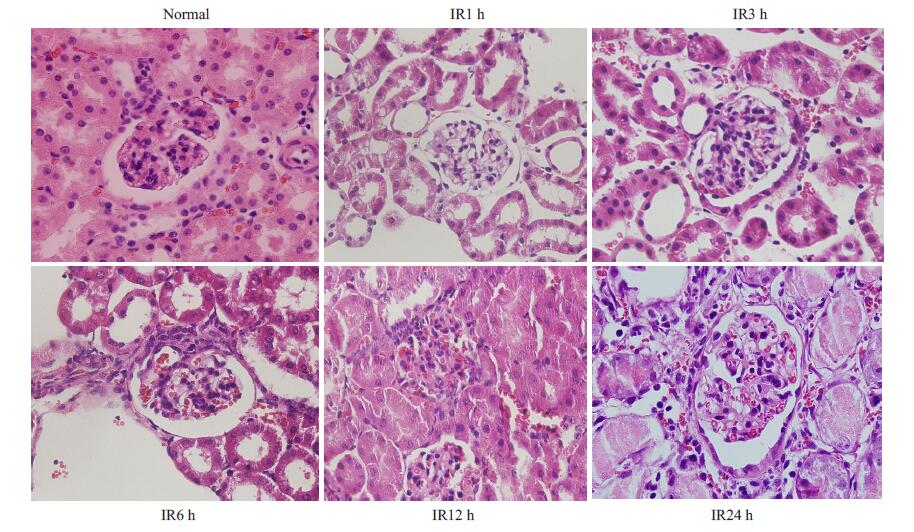
HE切片结果显示正常组肾组织肾小管排列整齐,形态正常,间质无充血、水肿。缺血再灌注各时间窗肾组织可见不同程度间质水肿及炎性细胞浸润,肾小管内可见管型及坏死脱落细胞,并随着时间的延长可见肾小管上皮细胞肿胀变性(图 3)。
|
图 3 HE染色结果 Figure 3 Pathological changes in the renal tissue of the mice in each group (HE staining, original magnification: × 400). Renal tubules arranged regularly in normal renal tissues without renal interstitial hyperemia or edema, inflammatory cells infiltration or red blood cells seepage. Renal interstitial edema and a small amount of neutrophil infiltration appeared at 1 h after reperfusion, and slightly increased neutrophil infiltration and massive red blood cell seepage occurred at 3 h and 6 h; renal tubular edema, morphological disorder and massive neutrophil infiltration and red blood cells seepage within the glomeruli and interstitial tissue were seen at 12 and 24 h. |
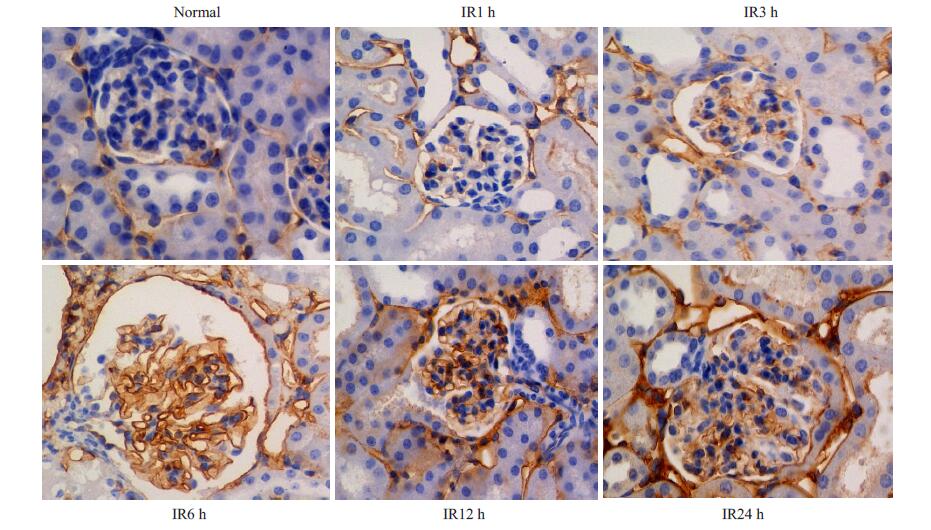
免疫组化检查可见缺血再灌注各时间窗肾内血管内皮ICAM-1表达量增加,并随着时间延长表达量呈递增趋势,IR12 h及IR24 h血管内皮ICAM-1表达量差异不明显。而正常组肾内血管内皮无明显ICAM-1表达(图 4)。
|
图 4 免疫组化结果 Figure 4 Immunohistochemical results in the renal tissue in each group (DAB chromogenic, × 400; the positive reactant was stained yellow). The expression of ICAM-1 in mouse renal vascular endothelium in creased progressive as the reperfusion time extended. No ICAM-1 expression was found in the normal control group. |
随着超声诊断技术的发展,靶向超声分子成像显像日益受到超声医生及临床医生的重视[7-8]。但在活体相应特异性受体组织表面黏附的靶向微泡数量不足,使得靶向显影达不到预期效果[9]。作为促进靶向微泡粘附方法之一的超声辐射力近年来倍受关注[10]。本研究借助超声辐射力将靶向微泡向对侧移位、聚集,以便提高靶向微泡粘附率,为临床评价肾缺血再灌注损伤时肾脏靶向显影奠定实验基础。
研究显示[11]微血管损伤/炎症是缺血再灌注损伤的重要发病机制之一,肾再灌注时中性粒细胞的化学趋向作用被激活,其释放多种炎症介质或促炎细胞因子,导致肾微血管及细胞损伤,从而造成肾缺血再灌注损伤。其中ICAM-1及其介导的中性粒细胞与内皮细胞粘附在肾IRI中发挥着重要的作用[12],并且有可能贯穿于整个疾病的发生发展过程。因此本实验在制作缺血再灌注损伤模型时选取了不同时间窗进行观察,以便对ICAM-1在炎症/血管内皮损伤中不同时间窗内的表达水平有进一步了解。
病理结果显示肾缺血再灌注各时间窗肾组织发生细胞肿胀、间隙增宽,白细胞活化和浸润,释放炎症介质,造成组织损伤,说明30 min的缺血条件可以造成细胞、组织形态上的改变[13]。免疫组化结果显示,对照组肾脏无明显ICAM-1表达。再灌注后肾脏血管内皮细胞出现ICAM-1表达,并且不同时间窗血管内皮ICAM-1分子表达逐渐增强,特别是IR12 h、IR24 h表达显著,充分证明了粘附分子ICAM-1参与了局部炎细胞的浸润及由此引发的组织损伤[14-15]。而造影结果显示MBICAM组和MBICAM+USRF组缺血再灌注肾脏Ⅵ值亦是随时间延长而增加,病理结果同造影结果具有良好相关性。
本实验通过“抗生蛋白链菌素/生物素复合体”化学桥接作用在脂质微泡基础上成功构建了MBICAM,并在肾缺血再灌注模型上应用超声辐射力联合靶向超声微泡,结果显示在对照组肾组织中,由于不存在缺血再灌注所介导的血管内皮炎症和ICAM-1 表达,MBICAM 组及MBICAM+USRF组肾脏并未显示明显的超声显影,两组间差异不显著。而在肾脏IRI不同时间窗下均可见显影增强,并且显影强度随着时间的推移逐渐增高,表明肾缺血再灌注后ICAM-1表达上调,这与早期研究结果相一致[16]。MBICAM+USRF组肾脏Ⅵ值在相应时间窗内远高于MBICAM组,这充分证明在超声辐射力作用下靶向微泡粘附效能远高于单纯靶向微泡。我们认为,在小鼠肾缺血再灌注损伤后ICAM-1大量表达,MBICAM在缺血再灌注肾组织通过其外壳抗ICAM-1单抗与血管内皮细胞表达的ICAM-1特异结合而黏附、滞留于肾组织中,而通过USRF的作用,使得靶向微泡粘附数量增多[17],从而增加肾脏显影强度。
肾脏作为机体主要高血流灌注器官之一,对缺血再灌注十分敏感。在肾移植过程中缺血再灌注损伤表现尤为突出,它不仅影响患者肾功能的恢复,而且直接关系到移植的成功率[18]。因此早期诊断肾IRI 并进行干预,可以避免肾IRI对肾功能造成的损伤。在肾脏缺血再灌注早期血管内皮已有ICAM-1的表达[19],但表达量较低,靶向超声造影并不敏感,而穿刺活检为有创检查,不能反复进行。我们利用声辐射力对微泡的推动作用,使大量聚集于靶向区域,提高靶向造影效果[20-21],从而提高了炎症的检出率,可以早期、无创、高效的诊断肾缺血再灌注损伤。
| [1] | Stefanutti G, Pierro A, Smoth W, et al. Peroxynitrite decomposition catalyst FeTMPyP provides partial protection against intestinal ischemia andreperfusion injury in infant rats[J]. Pediatr Res, 2007, 62 (1): 43-8. DOI: 10.1203/PDR.0b013e31806790c0. |
| [2] | Li M, Luo Z, Chen X, et al. Use of contrast-enhanced ultrasound to monitor rabbit renal ischemia-reperfusion injury and correlations between time-intensity curve parameters and renal ICAM-1 expression[J]. Clin Hemorheol Microcirc, 2015, 59 (2): 123-31. |
| [3] | 吴爵非, YangL, 宾建平, 等. 在生理血流条件下靶向超声微泡对P-选择素的靶向黏附效能[J]. 中国医学影像技术, 2008, 24 (7): 981-4. |
| [4] | Takalkar AM, Klibanov AL, Rychak JJ, et al. Binding and detachment dynamics of microbubbles targeted to P-selectin under controlled shear flow[J]. J Control Release, 2004, 96 (3): 473-82. DOI: 10.1016/j.jconrel.2004.03.002. |
| [5] | 王宝平, 吴凤林, 纪丽景, 等. 超声辐射力促靶向微泡黏附的在体实验研究[J]. 中华超声影像学杂志, 2013, 22 (3): 255-8. |
| [6] | Rychak JJ, Klibanov AL, Ley KF. Enhanced targeting of ultrasound contrast agents using acoustic radiation force[J]. Ultrasound Med Biol, 2007, 33 (7): 1132-9. DOI: 10.1016/j.ultrasmedbio.2007.01.005. |
| [7] | Schutt EG, Klein DH, Mattrey RM, et al. Injectable microbubbles as contrast agents for diagnostic ultrasound imaging: The key role of perfluorochemicals[J]. Angew Chem Int Ed Engl, 2003, 42 (28): 3218-35. DOI: 10.1002/anie.200200550. |
| [8] | Lanza GM, Wickline SA. Targeted ultrasonic contrast agents for molecular imaging and therapy[J]. Prog Cardiovasc Dis, 2001, 44 (1): 13-31. DOI: 10.1053/pcad.2001.26440. |
| [9] | Lindner JR, Song J, Christiansen J, et al. Ultrasound assessment of inflammation and renal tissue injury with microbubbles targeted to P-selectin[J]. Circulation, 2001, 104 (17): 2107-12. DOI: 10.1161/hc4201.097061. |
| [10] | Liu J, Zhang P, Liu P, et al. Endothelial adhesion of targeted microbubbles in both small and great vessels using ultrasound radiation force[J]. Mol Imaging, 2012, 11 (1): 58-66. |
| [11] | Bataille A, Abbas S, Semoun O, et al. Plasma neutrophil Gelatinase- Associated lipocalin in kidney transplantation and early renal function prediction[J]. Transplantation, 2011, 92 (9): 1024-30. |
| [12] | De Greef KE, Ysebaert DK, Persy V, et al. Icam-1 expression and leukocyte accumulation in inner stripe of outer medulla in early phase of ischemic compared to hgcl2-induced ARF[J]. Kidney Int, 2003, 63 (5): 1679-707. |
| [13] | Ren KX, Jin C, Ma PF, et al. Ginsenoside Rd alleviates mouse acute renal ischemia/reperfusion injury by modulating macrophage phenotype[J]. J Ginseng Res, 2016, 40 (2): 196-202. DOI: 10.1016/j.jgr.2015.12.003. |
| [14] | 刘百成, 刘荣耀. 大鼠肾缺血再灌注损伤中ICAM-1表达的变化[J]. 中国中西医结合肾病杂志, 2006, 7 (8): 419-21. |
| [15] | Tong F, Luo L, Liu DJ. Effect of intervention in mast cell function before reperfusion on renal Ischemia-Reperfusion injury in rats[J]. Kidney Blood Press Res, 2016, 41 (3): 335-44. DOI: 10.1159/000443437. |
| [16] | 纪丽景, 王宝平, 罗利红, 等. 细胞间黏附分子-1靶向微泡超声造影成像评价肾移植后急性排异反应[J]. 中华超声影像学杂志, 2011, 20 (12): 1070-3. |
| [17] | 杨阳, 乔璐, 严飞, 等. 超声辐射力推移靶向微泡的参数设置研究[J]. 中国超声医学杂志, 2015, 31 (2): 170-3. |
| [18] | Hussein A, El-Dken ZH, Barakat N, et al. Renal ischaemia/reperfusion injury: possible role of aquaporins[J]. Acta Physiologica, 2012, 204 (3): 308-16. DOI: 10.1111/apha.2012.204.issue-3. |
| [19] | van Rooij T, Daeichin V, Skachkov I, et al. Targeted ultrasound contrast agents for ultrasound molecular imaging and therapy[J]. Int J Hyperthermia, 2015, 31 (2): 90-106. DOI: 10.3109/02656736.2014.997809. |
| [20] | Wang SY, Wang CY, Unnikrishnan S, et al. Optical verification of microbubble response to acoustic radiation force in large vessels with in vivo results[J]. Invest Radiol, 2015, 50 (11): 772-84. DOI: 10.1097/RLI.0000000000000185. |
| [21] | Herbst EB, Unnikrishnan S, Wang SA, et al. The use of acoustic radiation force Decorrelation-Weighted pulse inversion for enhanced ultrasound contrast imaging[J]. Invest Radiol, 2017, 52 (2): 95-102. DOI: 10.1097/RLI.0000000000000313. |
 2017, Vol. 37
2017, Vol. 37

