前列腺癌是男性常见的恶性肿瘤,随着人口老龄化及生活习惯改变,包括中国在内的亚洲地区,前列腺癌发病率呈逐年上升趋势,已位居该地区泌尿系肿瘤的第2位[1]。研究表明前列腺癌的发生、发展与雄激素受体密切相关,随着前列腺癌细胞恶性程度的增加,雄激素受体(AR)表达减少,早期前列腺癌组织中AR的表达高于晚期,高度及中度分化的前列腺癌组织中AR的表达高于低分化前列腺癌[2-4]。Bombardelli等[5]发现上皮来源的肿瘤细胞分泌免疫球蛋白IgG,并通过抑制抗体依赖的细胞介导的细胞毒作用产生免疫逃逸,促进肿瘤细胞生长[6-7]。在前期研究中,我们发现前列腺癌中表达免疫球蛋白IgG,且随着肿瘤恶性程度增加,IgG表达增高[8],提示免疫球蛋白IgG可能在前列腺癌发病过程中起重要作用。那么,前列腺癌AR与IgG之间是否存在相关性及其作用机制?目前国内外尚未有相关研究报道。我们拟通过干预前列腺癌细胞株中AR的表达,检测IgG表达及前列腺癌细胞增殖、迁移等生物学特性的变化,明确前列腺癌AR与IgG之间关系。
1 材料和方法 1.1 材料 1.1.1 细胞株人雄激素依赖型前列腺癌(LNCap)和去势抵抗性前列腺癌细胞株(PC-3)购自广州莱德尔生物科技有限公司。
1.1.2 主要试剂高表达AR载体pCDNA3.1+-AR由广州莱德尔生物科技有限公司提供;RPMI 1640培养基、DMEM培养基、胎牛血清、磷酸盐缓冲液均采购自美国Hyclone;Fixation Buffer、Permeabilization Buffer购自美国eBioscience;Anti-Human IgG antibody、Anti-Androgen Receptor antibody[AR 441]均购自英国Abcam;Lipofectamine2000及SYBR Green qPCR SuperMix购自Invitrogen;Silencer siRNA Construction Kit购自Ambion;ABI PRISM® 7500Sequence Detection System全自动荧光定量PCR仪。
1.2 方法 1.2.1 细胞培养取处于对数生长期的PC-3、LNCap细胞,0.25%的胰蛋白酶消化细胞3~5 min,镜下观察细胞大部分变形后,弃消化液,加入RPMI 1640,反复轻柔吹打细胞悬液并移入10 mL离心管,1000 r/min离心1 min,弃上清,加入10%胎牛血清的RPMI 1640培养液3 mL吹打混匀。使用血球计数板计数细胞总数,取1滴细胞悬液滴于血球计数板计数格上,光镜下计数4个大格细胞数。细胞密度(个/mL)=4个大格细胞数×2500。PC-3、LNCap细胞用含10%胎牛血清、100 mg/L链霉素,1×105 U/L青霉素和0.3 mg/L谷氨酰胺的RPMI 1640培养基培养,置于37 ℃、5% CO2饱和湿度培养箱中常规培养,待细胞生长充满培养瓶底90%时,用0.25%的胰蛋白酶消化、传代备用。按2×105/孔铺孔密度在12孔板中分别接种PC-3和LNCap细胞,铺孔后24 h换含2%体积分数胎牛血清的DMEM培养,取对数生长期的细胞进行试验。
1.2.2 AR cDNA的合成根据NCBI中AR基因CDS序列,设计扩增引物:ARBamHIF:5'cgcggatccgccaccATGGAAGTGCAGTTAGGGCTGG3',ARXhoIR:5'ccgctcgagTCACTGGGTGTGGAAATAGATGGG3',采用Trizol法提取细胞的总RNA,逆转录RNA得到cDNA,利用扩增引物GeneAmp PCR System 2400型PCR扩增仪中扩增AR基因,PCR产物用含溴化乙啶的1%琼脂糖凝胶电泳80 V×20 min,在电泳成像仪成像后用图像处理仪分析处理结果后用DNA凝胶回收试剂盒(DONGSHENG BIOTECH)回收PCR产物。
1.2.3 高表达AR载体构建用BamHⅠ与XhoⅠ双酶切AR PCR回收产物与pCDNA3.1+载体并回收,使用T4DNA Ligase酶(购自TaKaRa)将目标片段与载体连接,构建pCDNA3.1+-AR载体。将连接产物加入至50 μL DH5α感受态细胞中,LB平板培养筛选氨苄青霉素阳性克隆并提取,质粒酶切鉴定AR阳性质粒送测序。
1.2.4 高表达AR载体转染PC-3细胞转染前1 d对细胞株进行传代,在不包含抗生素的适量的培养基中接种细胞,使其汇合度为70%~90%。分为3组,A组PC-3细胞采用AR载体转染(PC-3-AR),B组PC-3细胞采用空载体转染(PC-3-V),C组PC-3细胞不进行转染转染。使用24孔板,每孔加入1 μg质粒,稀释到100 μL Opti-MEM(invitrogen)培养基为A液,取1 μL Lipofectamine 2000(invitrogen)溶解于Opti-MEM培养基为B液,B液混合5 min后,A液和B液混合,静止20 min后加到细胞培养板中。37 ℃孵育4 h后换为细胞生长培养基。37 ℃培养48 h后收样。
1.2.5 siRNA的设计根据NCBI中AR基因的CDS序列,设计siRNA靶序列siAR、1条无效序列siRNA-NC作为阴性对照。siAR:正义链:AAACAGGTACTTCTGTTTCCC,反义链:AAGGGAAACAGAAGTACCTGT。
1.2.6 siRNA的合成采用Ambion的Silencer siRNA Construction Kit合成上述siRNA,按试剂说明书操作如下。将正 (反) 义寡核苷酸模板与T7启动子引物混合,经加热退火后结合,加入Klenow DNA聚合酶,形成双链DNA转录模板。利用T7 RNA聚合酶进行体外转录后,将正义和反义转录产物混合形成双链形式的siRNA。最后用DNA酶及专一核糖核酸酶消化5'的引导序列,并进行2次离心过滤纯化,得到的产物即是所需的21 bp的双链siRNA,19对碱基互补,3'端各有2个UU碱基突出。用2%琼脂糖凝胶电泳检测产物,在紫外光度分光仪测其浓度,并调整浓度至20 μmol /L,-20 ℃保存备用。
1.2.7 siAR转染LNCap细胞按试剂说明书操作,转染前1 d,接种适当数量的细胞至96孔板中,待细胞密度达到30%~50%时,制备siRNA-lipo2000混合液,以siRNA终浓度20、50、100、200 nmol/L分组及阴性对照组,进行siAR及siCon转染。
1.2.8 Western blot蛋白表达检测转染48 h后用细胞裂解液提取各组细胞上清总蛋白,按1 mL裂解液加10 μL PMSF(100 mM)和10 μL Cocktail,摇匀置于冰上,各瓶中加入400 μL含PMSF的裂解液,于冰上裂解30 min。于4 ℃下14 000 r/min离心5 min。SDS-PAGE电泳转移至PVDF膜,用含5%脱脂奶粉封闭液室温封闭4 h后再漂洗,与一抗37 ℃孵育2 h,TBST漂洗后与二抗孵育1 h,加入ECL显影剂,在暗盒中显影。
1.2.9 Q-PCR IgG mRNA表达检测按照Trizol(Invitrogen)试剂说明书提取细胞中RNA,并检测RNA浓度及纯度。取总RNA 1 μg,逆转录反应(Promega试剂盒)合cDNA,并用于实时荧光定量PCR。设计Q-PCR引物:IgG-F: 5'-GCAGCCGGAGAACAACTA CA-3',IgG-R: 5'-TGGTTGTGCAGAGCCTCATG-3';18srRNA-F为内参对照,引物为:5'-CCTGGATACC GCAGCTAGGA-3',18srRNA-R:5'-GCGGCGCAATACGAATGCCCC-3'。在Q-PCR仪中先50 ℃ 2 min激活;95 ℃ 2 min变性;然后95 ℃ 15 s,60 ℃ 32 s读板,共40个循环。融解曲线分析:温度60~95 ℃。每个样品实验重复3次。Q-PCR所得Ct值以2-ΔΔCt法计算相对表达量。
1.2.10 生长曲线试验PC-3细胞和对照PC-3-AR细胞,LNCap细胞和对照LNCap-siAR细胞,经消化后计数,以4000/孔的密度接种至96孔板,每孔200 μL,设5个复孔。各分2组培养,1组用完全培养基,1组用雄激素浓度为l×10-6 mol的培养基。培养1、2、3、4、5 d后加入5%四氮甲基唑蓝溶液20 μL,继续培养4 h,后吸去上清,每孔加入DMS0溶液150 μL,室温摇床溶解10 min,酶标仪检测490 nm处A值。绘制生长曲线。
1.2.11 细胞划痕试验分别接种适量PC-3-AR细胞和PC-3细胞于6孔板中,每孔加入2 mL完全培养基,融合度达到80%~90%时,用0.5 mm中性笔尖行“十”字划痕,磷酸盐缓冲液漂洗2次,更换低血清培养基,实验分组同前,倒置显微镜下观察照相,记为0 h。37 ℃、5%CO2的饱和湿度箱中继续培养,于24 h取出孔板,在同一观察点处观察划痕愈合情况。比较各组细胞的愈合情况,通过测量多个点划痕宽度,计算平均划痕愈合率。同样方法进行LNCap细胞和LNCap-siAR细胞细胞划痕试验。
1.3 统计学方法采用SPSS20.0统计软件进行数据处理,数据用均数±标准差表示,PC-3,PC-3-V,PC-3-AR及LNCap,LNCap-siCon,LNCap-siAR多组细胞间IgG mRNA及蛋白表达量采用单因素方差分析(采用Bonferroni方法),P<0.05为差异有统计学意义。
2 结果 2.1 LNCap细胞较PC-3细胞AR表达增高,IgG表达降低LNCap细胞AR蛋白表达量高于PC-3细胞,差异具有显著性(P<0.05)。PC-3细胞IgG蛋白表达量高于LNCap细胞,差异具有显著性(P<0.05,图 1)。
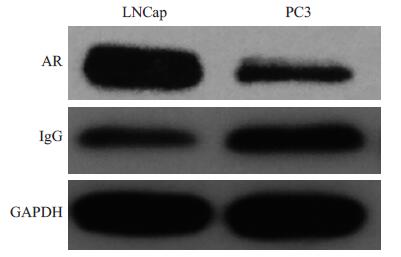
|
图 1 Western blot检测LNCap、PC-3细胞的AR、IgG蛋白表达 Figure 1 Expression of AR and IgG protein in LNCap and PC-3 cells detected by Western blotting. |
采用Western blot方法分别检测PC-3、PC-3-V、PC-3-AR细胞株的AR及IgG蛋白表达(图 2A),PC-3-AR细胞AR蛋白表达量大于PC-3细胞,差异具有显著性(P<0.01)。PC-3细胞IgG表达量高于PC-3-V细胞及PC-3-AR细胞,差异具有显著性(P<0.01)。Q-PCR检测PC-3,PC-3-V,PC-3-AR细胞IgG mRNA表达量分别为1±0.11、0.85±0.04、0.27±0.01(图 2B);与PC-3-AR比较,PC-3、PC-3-V表达差异具有显著性(P<0.01)。四氮甲基唑蓝的细胞生长曲线显示,PC-3细胞转染AR基因后,增殖明显减弱(图 2C)。细胞划痕实验显示,PC-3-AR细胞较PC-3细胞迁移能力减弱(图 2D)。2.3 LNCap细胞沉默AR基因后,AR蛋白表达降低,LNCap-siAR细胞较LNCap细胞高表达IgG mRNA及IgG蛋白,LNCap-siAR细胞较LNCap细胞增殖、迁移能力增强
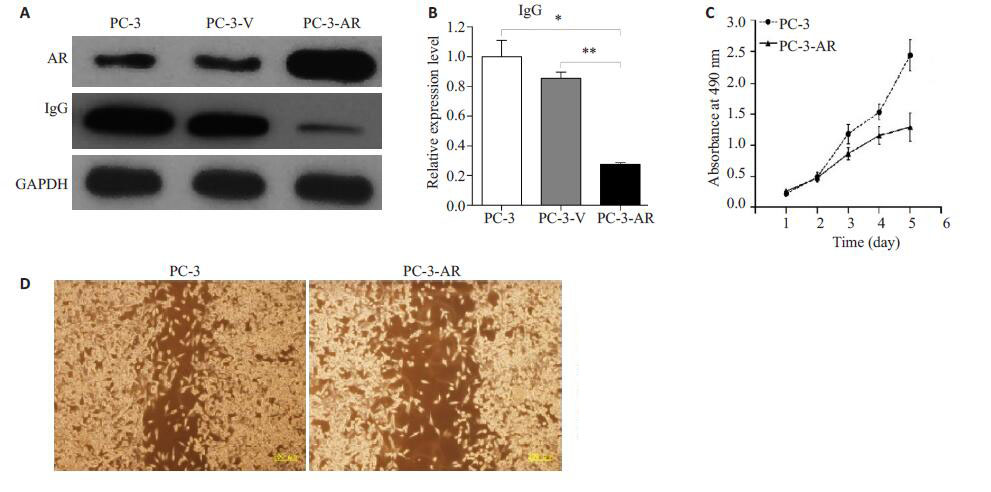
|
图 2 PC-3、PC-3-V、PC-3-AR细胞株AR、IgG蛋白表与IgG mRNA表达及细胞增殖及迁移能力 Figure 2 Expressions of AR and IgG protein (A) and IgG mRNA (B) in PC-3, PC-3-V, and PC-3-AR cells and the proliferation (C) and migration (D) of PC-3 and PC-3-AR cells. *P < 0.01, **P < 0.01. |
采用Western blot方法分别检测LNCap、LNCapsiCon、LNCap-siAR细胞株的AR及IgG蛋白表达(图 3A),LNCap细胞AR蛋白表达量高于LNCap-siAR细胞,差异具有显著性(P<0.01)。LNCap-siAR细胞IgG表达量高于LNCap细胞及LNCap-siCon细胞,差异具有显著性(P<0.01)。Q-PCR检测LNCap、LNCap-siCon、LNCap-siAR的IgG mRNA表达量分别为0.43±0.07、0.38±0.04、1±0.11(图 3B),与LNCap-siAR比较,LNCap、LNCap-siCon表达差异具有显著性(P<0.01)。生长曲线结果显示,LNCap细胞沉默AR基因后,增殖能力显著增强(图 3C)。细胞划痕实验结果显示,LNCap-siAR细胞较LNCap细胞迁移能力增强(图 3D)。
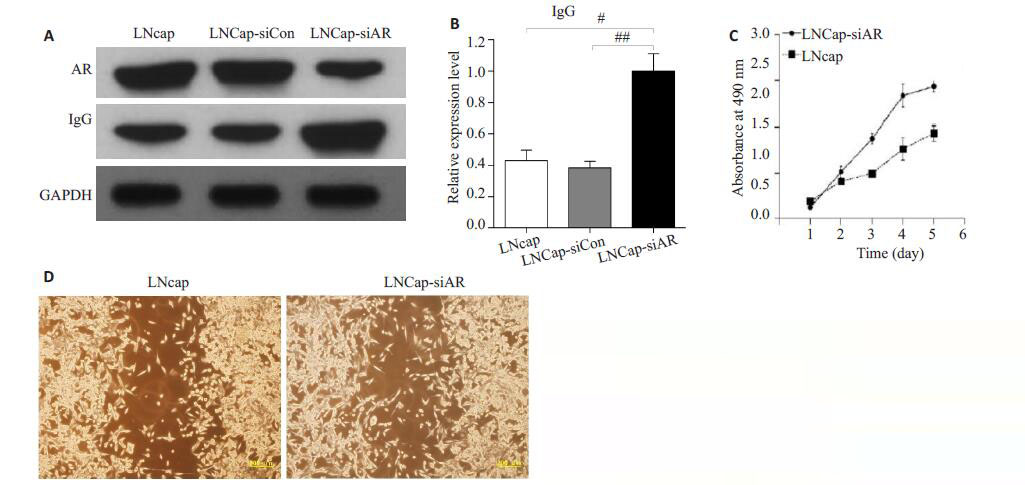
|
图 3 LNCap、LNCap-siCon、LNCap-siAR细胞株的AR、IgG蛋白表达与IgG mRNA表达及细胞增殖、迁移能力 Figure 3 Expressions of AR and IgG protein (A) and IgG mRNA (B) and the proliferation (C) and migration (D) of LNCap, LNCap-siCon, and LNCap-siAR cells. #P < 0.01, ##P < 0.01. |
前列腺癌是男性常见恶性肿瘤。早期前列腺癌可通过手术根治,而对于手术后生化复发和初诊时晚期的前列腺癌目前主要的治疗方法是内分泌治疗,即雄激素剥夺治疗(ADT)。然而ADT的过程中,前列腺癌不可避免的再次发生、进展,出现肿瘤体积增大、多发转移等表现,而此时肿瘤进展与全身雄激素水平无关[9-10],前列腺癌细胞表现更强的增殖及迁移生物学特性,肿瘤恶性程度增加。
在前列腺癌细胞PC-3及LNCap细胞的AR、IgG表达对比中,PC-3细胞较LNCap细胞低表达AR,高表达IgG,提示不同恶性程度前列腺癌细胞株中AR及IgG的表达差异。生长曲线及细胞划痕实验结果提示AR低表达可增强前列腺癌细胞的增殖、迁移能力,AR高表达反而减弱了前列腺癌细胞的增殖、迁移能力,意味着AR的表达可能与前列腺癌恶性程度呈负相关关系。研究表明前列腺癌肿瘤细胞内存在雄激素及合成雄激素受体激动剂的相关酶类[11-12],前列腺癌细胞自身可合成雄激素或AR激动剂,AR通过这些肿瘤自身合成的雄激素或AR激动剂促进肿瘤生长[13]。研究发现对阿比特龙、恩杂鲁胺等ADT药物治疗抵抗的前列腺癌细胞株高表达雄激素受体剪接变异体[14-15]。Antonarakis等[16]发现雄激素受体剪接变异体7为前列腺癌细胞对阿比特龙、恩杂鲁胺抵抗的主要原因。Bryce等[17]认为雄激素受体剪接变异体7为AR在ADT时期对睾酮去势水平耐受的方式,从而对阿比特龙、恩杂鲁胺等ADT药物产生耐药,CRPC仍可继续进展。上述证据表明CRPC期前列腺癌细胞尽管低表达AR,仍可表现出具有更强增殖、迁移能力的生物特性。
经典免疫学说认为免疫球蛋白主要由B淋巴细胞表达、分泌[18]。然而,目前研究发现乳腺癌[19]、口腔癌[20]、尿路上皮癌[21]等上皮来源肿瘤细胞可分泌不同的免疫球蛋白。前期研究发现前列腺癌细胞株中表达免疫球蛋白IgG,IgG的表达量与前列腺癌病理Gleason评分及肿瘤恶性程度呈正相关[8],干扰IgG表达可抑制细胞生长并加速细胞凋亡[22]。Li等[23]发现抑制肿瘤细胞癌源性IgG表达可抑制肿瘤细胞在裸鼠中的生长,同时IgG的表达在一定程度上抑制由表皮生长因子受体抗体所介导的抗体依赖的细胞介导的细胞毒作用效应。Xu等[24]发现通过RNA干扰IgG表达可导致人前列腺癌细胞株PC3放射敏感性增高,使肿瘤对放射治疗更敏感。Zheng等[25]发现抑制癌源性免疫球蛋白功能可促进前列腺癌细胞凋亡、抑制细胞的增殖。上述实验通过不同途径抑制癌源性免疫球蛋白的表达或功能,从而抑制前列腺癌细胞的增殖、促进前列腺癌细胞的凋亡,提示前列腺癌细胞IgG表达的调控可能是多因素、多靶点联合作用的结果,本实验调控前列腺癌细胞株AR表达,发现前列腺癌细胞的IgG表达及增殖、迁移生物特性发生负相关性改变,可能为其中的一个作用点。
本研究表明AR调控IgG蛋白表达呈负相关并与前列腺癌增殖、迁移能力相关。通过上调AR的表达可使前列腺癌细胞低表达IgG,肿瘤恶性程度降低,AR与IgG之间的调节可能成为未来研究治疗前列腺癌的一个靶点。
| [1] | Ito K. Prostate cancer in Asian men[J]. Nat Rev Urol, 2014, 11 (4): 197-212. DOI: 10.1038/nrurol.2014.42. |
| [2] | Chen CD, Welsbie DS, Tran C, et al. Molecular determinants of resistance to antiandrogen therapy[J]. Nat Med, 2004, 10 (1): 33-9. DOI: 10.1038/nm972. |
| [3] | Komaragiri SK, Bostanthirige DH, Morton DJ, et al. ID4 promotes AR expression and blocks tumorigenicity of PC3 prostate cancer cells[J]. Biochem Biophys Res Commun, 2016, 478 (1): 60-6. DOI: 10.1016/j.bbrc.2016.07.092. |
| [4] | Yuan S, Trachtenberg J, Mills GB, et al. Androgen-induced inhibition of cell proliferation in an androgen-insensitive prostate cancer cell line (PC-3) transfected with a human androgen receptor complementary DNA[J]. Cancer Res, 1993, 53 (6): 1304-11. |
| [5] | Bombardelli L, Cavallaro U. Immunoglobulin-like cell adhesion molecules: novel signaling players in epithelial ovarian cancer[J]. Int J Biochem Cell Biol, 2010, 42 (5): 590-4. DOI: 10.1016/j.biocel.2010.01.017. |
| [6] | Qiu XY, Zhu XH, Zhang L, et al. Human epithelial cancers secrete immunoglobulin G with unidentified specificity to promote growth and survival of tumor cells[J]. Cancer Res, 2003, 63 (19): 6488-95. |
| [7] | Zhao YY, Liu YX, Chen ZS, et al. Immunoglobulin G (IgG) expression in human umbilical cord endothelial cells[J]. J Histochem Cytochem, 2011, 59 (5): 474-88. DOI: 10.1369/0022155411400871. |
| [8] | 潘斌, 郑少波, 徐亚文, 等. IgG在前列腺癌组织中的表达及临床意义[J]. 实用医学杂志, 2012, 28 (8): 1312-4. |
| [9] | Nadal R, Tsai HL, Sinibaldi VJ, et al. Prognostic factors for clinical outcomes in patients with metastatic castration resistant prostate cancer treated with sequential novel androgen receptor-directed therapies[J]. Prostate, 2016, 76 (5): 512-20. DOI: 10.1002/pros.v76.5. |
| [10] | Martin SK, Kyprianou N. Exploitation of the androgen receptor to overcome taxane resistance in advanced prostate cancer[J]. Adv Cancer Res, 2015, 127 (11): 123-58. |
| [11] | Culig Z, Hobisch A, Cronauer MV, et al. Androgen receptor activation in prostatic tumor cell lines by insulin-like growth factor-I, keratinocyte growth factor, and epidermal growth factor[J]. Cancer Res, 1994, 54 (20): 5474-8. |
| [12] | Zhu ML, Kyprianou N. Androgen receptor and growth factor signaling cross-talk in prostate cancer cells[J]. Endocr Relat Cancer, 2008, 15 (4): 841-9. DOI: 10.1677/ERC-08-0084. |
| [13] | Shafi AA, Yen AE, Weigel NL. Androgen receptors in hormonedependent and castration-resistant prostate cancer[J]. Pharmacol Ther, 2013, 140 (3): 223-38. DOI: 10.1016/j.pharmthera.2013.07.003. |
| [14] | Li Y, Chan SC, Brand LJ, et al. Androgen receptor splice variants mediate enzalutamide resistance in castration-resistant prostate cancer cell lines[J]. Cancer Res, 2013, 73 (2): 483-9. DOI: 10.1158/0008-5472.CAN-12-3630. |
| [15] | Mostaghel EA, Marck BT, Plymate SR, et al. Resistance to CYP17A1 inhibition with abiraterone in castration-resistant prostate cancer: induction of steroidogenesis and androgen receptor splice variants[J]. Clin Cancer Res, 2011, 17 (18): 5913-25. DOI: 10.1158/1078-0432.CCR-11-0728. |
| [16] | Antonarakis ES, Lu C, Luber B, et al. Androgen receptor splice variant 7 and efficacy of taxane chemotherapy in patients with metastatic Castration-Resistant prostate cancer[J]. JAMA oncol, 2015, 1 (5): 582-91. DOI: 10.1001/jamaoncol.2015.1341. |
| [17] | Bryce AH, Antonarakis ES. Androgen receptor splice variant 7 in castration-resistant prostate cancer: Clinical considerations[J]. Int J Urol, 2016, 23 (8): 646-53. DOI: 10.1111/iju.2016.23.issue-8. |
| [18] | Henderson A, Calame K. Transcriptional regulation during B cell development[J]. Annu Rev Immunol, 1998, 16 (8): 163-200. |
| [19] | Tamura K, Shimizu C, Koizumi F, et al. Correlation of Fc gamma R IIa-H131R and IIIa-V158F polymorphisms and clinical outcome of trastuzumab in both neoadjuvant and metastatic setting in patients with HER-2 positive breast cancer[J]. J Clin Oncol, 2009, 27 (15, S): 1100-9. |
| [20] | Zhu X, Li C, Sun X, et al. Immunoglobulin mRNA and protein expression in human oral epithelial tumor cells[J]. Appl Immunohistochem Mol Morphol, 2008, 16 (3): 232-8. DOI: 10.1097/PAI.0b013e31814c915a. |
| [21] | Liang PY, Li HY, Zhou ZY, et al. Overexpression of immunoglobulin G prompts cell proliferation and inhibits cell apoptosis in human urothelial carcinoma[J]. Tumour Biol, 2013, 34 (3): 1783-91. DOI: 10.1007/s13277-013-0717-z. |
| [22] | Pan B, Zheng SB, Liu CX, et al. Suppression of IGHG1 gene expression by siRNA leads to growth inhibition and apoptosis induction in human prostate cancer cell[J]. Mol Biol Rep, 2013, 40 (1): 27-33. DOI: 10.1007/s11033-012-1944-x. |
| [23] | Li M, Zheng H, Duan Z, et al. Promotion of cell proliferation and inhibition of ADCC by cancerous immunoglobulin expressed in cancer cell lines[J]. Cell Mol Immunol, 2012, 9 (1): 54-61. DOI: 10.1038/cmi.2011.40. |
| [24] | Xu Y, Chen B, Xu K, et al. Effect of IgG gene silencing by RNA interference on radiosensitivity of prostate cancer PC3 cells[J]. J Southern Med Univ, 2015, 35 (3): 397-402. |
| [25] | Zheng H, Li M, Liu H, et al. Immunoglobulin alpha heavy chain derived from human epithelial cancer cells promotes the access of S phase and growth of cancer cells[J]. Cell Biol Int, 2007, 31 (1): 82-7. DOI: 10.1016/j.cellbi.2006.09.009. |
 2017, Vol. 37
2017, Vol. 37

