2. 广州中医药大学第 一附属医院,广东 广州 510405;
3. 广州中医药大学,广东 广州 510006
2. First Affiliated Hospital of Guangzhou University of TCM, Guangzhou 510405, China;
3. Guangzhou University of TCM3, Guangzhou 510006, China
子宫腺肌病是指肌层被在位内膜腺体或间质浸润,伴随周围肌层细胞的代偿性肥大和增生的一种妇科良性肿瘤疾病[1],主要临床表现为痛经、月经过多、不孕等,患病率70%[2],痛经率达77%[3],严重影响广大患者的身心健康。但子宫腺肌病发病机制尚未明确。近年来有研究者认为子宫腺肌病为一种雌激素依赖性疾病[4]。雌激素不仅与其受体(ER)作用后在细胞核内与目标基因的雌激素反应元件结合,启动“基因组效应”诱导靶基因转录发挥相应的生物学效应;还可通过与新型膜受体(GPER-1)结合激活相关细胞信号转导途径而发生快速反应诱导子宫腺肌病的发生发展[5]。芳香化酶(P450arom)是细胞色素P450酶系的一种,通过催化睾酮、雄烯二酮等合成雌激素,直接影响雌激素的表达水平。研究表明[6-8]ER及P450arom在子宫腺肌病中过表达,其与E2之间生物学效应的异常与子宫腺肌病的发病密切相关。但雌激素(E2)、ER、P450arom在人体子宫腺肌病组织中的表达水平及其对子宫腺肌病病灶细胞增殖抑制的影响如何,相关研究报道较少。本研究主要通过临床收集人子宫腺肌病病灶组织及原代培养人子宫腺肌病病灶细胞,从E2、ER及P450arom在子宫腺肌病中的表达以及从激动剂、抑制剂正反两方面阐述E2、ER与子宫腺肌病病灶细胞增殖抑制率的相关性,探讨E2、ER及P450arom在子宫腺肌病中的发病机制。
1 资料和方法 1.1 标本选取 1.1.1 酶联免疫法及免疫组织化学法分别选取2013年1月~2014年7月、2006年1月~2014年6月广州中医药大学第一附属医院住院行全宫切除的子宫腺肌病患者子宫组织、蜡块,取其异位病灶及在位内膜分别检测,半年内未服用激素或类似药物。选同期因宫颈CINⅢ排除子宫病变患者的子宫肌层及内膜组织或蜡块作为对照组,均病理确诊。
1.1.2 子宫腺肌病病灶细胞培养选取2014年9月~2015年1月于广州中医药大学第一附属医院住院行全宫切除的子宫腺肌病患者病灶组织进行体外细胞培养,均病理确诊。
1.2 试剂及仪器 1.2.1 主要试剂人雌二醇(E2)酶联免疫试剂盒:武汉华美公司;鼠单克隆雌激素受体:Novocastra Laboratories Ltd;P450arom:北京博森奥公司;无酚红高糖DMEM:吉诺生物医药公司;无酚红胎牛血清:GEMINI公司;ICI182780(Fulvestrant):Cayman公司;β-雌二醇(E2):sigma公司;Ⅰ型胶原酶:Invitrogen公司;Penicillin-Streptomycin Solution:HyClone公司;胎牛血清、高糖DMEM(1×)、0.25%Trypsin-EDTA:Gibco公司。
1.2.2 主要试剂配制E2:根据相对分子质量272.38,称取适量E2溶于无水乙醇中配成浓度1 g/mL储存液,-20 ℃避光保存。ICI182780:DMSO配制成浓度1×10-3 mol/L储存液,-20 ℃避光保存,临用前室温溶解,DMSO最终浓度小于0.5%。
1.3 方法 1.3.1 酶联免疫法检测子宫腺肌病患者子宫组织匀浆E2表达手术室无菌收集标本,处理步骤严格按Elisa试剂盒说明书进行,测定纪录各孔A值。
1.3.2 免疫组织化学法检测子宫腺肌病患者子宫组织ER、P450的表达蜡块进行切片、烤片、脱蜡。经预实验确定抗体浓度均为1:100,采用超敏二步法进行检测。每组实验均设阴性对照组(PBs代替一抗),以已知阳性片作为阳性对照组。采用MIAS医学图像分析管理系统进行半定量分析,测定阳性目标PU值(阳性单位)。
1.3.3 雌激素激活及剥夺状态下子宫腺肌病病灶细胞增殖抑制率 1.3.3.1 子宫腺肌病病灶细胞原代培养、传代及细胞鉴定标本予胶原酶消化,1%双抗、10%胎牛血清的DMEM进行原代细胞培养,约5~10 d传代1次,第3~7代细胞用于研究。免疫细胞化学法对第1代细胞进行鉴定。
1.3.3.2 雌激素激活状态取生长密集细胞,分别予以下处理:(1)加入1×10-6 mol/L的E2处理72 h;(2)预处理ICI182780 (ER抑制剂,1×10-6 mol/L),24 h后加入1×10-6mol/L的E2培养72 h;以不含血清的高糖DMEM为对照组。上述处理因素每天PBS换液1次。
1.3.3.3 雌激素剥夺状态取生长密集细胞,分别予以下处理:(1)无酚红含10% charcoal-treated胎牛血清的DMEM培养96 h快速剥夺雌激素;(2)按前述剥夺雌激素后,加入1×10-6 mol/L的ICI182780干预24 h,以不含血清的高糖DMEM为对照组,每天PBS换液1次。
1.3.3.4 CCK-8法检测不同处理因素子宫腺肌病病灶细胞增殖抑制率根据预实验,细胞种植密度及反应时间:增殖率为1.875×104/mL、孵育1 h;抑制率为6×105/mL、孵育1 h。根据实验分组加入上述处理因素,各5个复孔,设对照孔(含细胞培养基及CCK-8,不含药物)和空白孔(不含细胞和药物的培养基、CCK-8)。抑制率=(对照孔A值-实验孔A值)/(对照孔A值-空白孔A值)×100%;增殖率=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。
1.4 统计学方法使用SAS9.0软件进行数据处理。首先采用Levene方差齐性检验,若资料满足正态与方差齐性,采用方差分析;当差异有统计学意义时,采用LSD法进行两两比较;若资料不满足方差齐性,采用Wilcoxon评分后,再进行Kruskal-Wallis检验。所有统计结果以P<0.05为差异有统计意义。
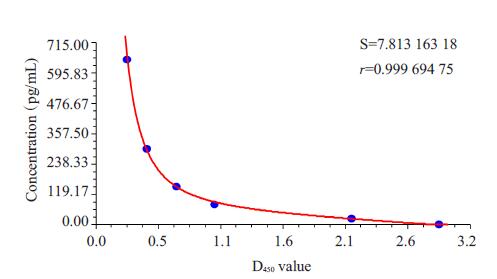
2 结果 2.1 Elisa检测人子宫腺肌病病灶组织匀浆E2表达采用Curve Expert1.3软件拟合标准曲线Heat Capacity Model,r=0.99969475,曲线拟合度高(图 1)。由表 1看出,与正常子宫组相比,子宫腺肌病在位内膜及异位病灶组E2表达水平均明显升高(P<0.05)。
|
图 1 Elisa测子宫腺肌病病灶组织匀浆E2表达水平标准曲线图 Figure 1 Standard curve of E2 concentration for testing E2 expression uterine adenomyosis tissue homogenate by ELISA. |
| 表 1 子宫腺肌病病灶、内膜与正常子宫肌层及内膜E2表达水平比较 Table 1 E2 expression level in adenomyosis ectopic lesions, eutopic endometrium and normal uterine myometrium and endometrium (Mean±SD) |
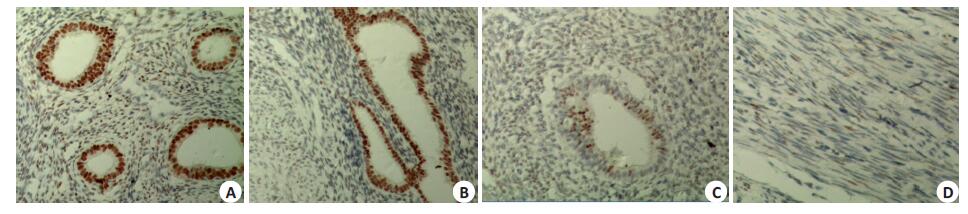
与正常子宫组相比,子宫腺肌病在位内膜及异位病灶组ER表达水平均明显升高(P<0.05,表 2,图 2)。
| 表 2 子宫腺肌病病灶、内膜与正常子宫肌层及内膜ER表达水平比较 Table 2 ER expression level in adenomyosis ectopic lesions, eutopic endometrium and normal uterine myometrium and endometrium (Mean±SD) |
|
图 2 子宫腺肌病病灶、内膜与正常子宫肌层及内膜ER表达水平比较 Figure 2 ER expression level in adenomyosis ectopic lesions, eutopic endometrium and in normal uterine myometrium and endometrium. A: Eutopic endometrium; B: Ectopic lesions; C: Normal endometrium; D: Normal myometrium. |
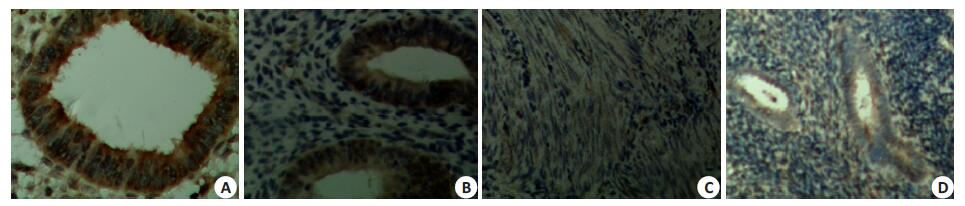
子宫腺肌病异位病灶及在位内膜的腺上皮细胞有P450arom表达,主要定位于胞浆,两者表达水平无明显差异(P>0.05);正常子宫内膜及肌层无芳香化酶表达或弱表达(表 3,图 3)。
| 表 3 子宫腺肌病病灶、内膜与正常子宫肌层及内膜P450arom表达水平比较 Table 3 P450arom expression level in adenomyosis ectopic lesions, eutopic endometrium and normal uterine myometrium and endometrium (Mean±SD) |
|
图 3 子宫腺肌病病灶、内膜与正常子宫肌层及内膜P450arom表达水平比较 Figure 3 P450arom expressions in adenomyosis ectopic lesions, eutopic endometrium and normal uterine myometrium and endometrium. A: Ectopic lesions; B: Eutopic endometrium; C: Normal myometrium; D: Normal endometrium. |
通过CCK-8法观察ER抑制剂(ICI182780)、ER抑制剂+E2激活、雌激素剥夺、雌激素剥夺+ ER抑制剂各组子宫腺肌病病灶细胞的抑制率,结果显示各组抑制率分别是(14±3)%、(12±4)%、(21±7)%、(67±9)%。ER抑制剂组及ER抑制剂+E2两组之间抑制率差异无统计学意义(P>0.05);雌激素剥夺+ER抑制剂组抑制率较雌激素剥夺组明显升高(P<0.05),消除雌激素对细胞的影响后,加入ER抑制剂阻断ER作用,细胞抑制率明显上升(P<0.05)。
2.3.2 CCK-8检测雌激素激活状态子宫腺肌病病灶细胞的增殖率实验表明,所培养的7例子宫腺肌病细胞在雌激素激活状态下,细胞增殖率分别为116.25%、105.5%、109.41%、153.8%、113.7%、106%、114.1%,平均增殖率为(117±17)%。
3 讨论 3.1 E2、ER、P450arom在子宫腺肌病发病机制中的作用子宫腺肌病为一种雌激素依赖性疾病[4],E2及ER在子宫腺肌病组织中明显升高[9-10]。升高的E2不仅可与ER结合启动基因组效应,诱导靶基因转录及相关蛋白合成,高浓度E2还可激活钾离子通道、增加子宫收缩频率及持续时间[3, 11],参与子宫腺肌病的发生发展。P450arom是细胞色素P450酶系里的一种,是E2生物合成过程的限速酶,E2与P450arom之间存在正反馈环[12-13]:P450arom被PGE2激活后局部E2合成增加,E2上升可上调环氧化酶CoX-2,cox-2又可促进PGE2形成。在子宫腺肌病组织中P450arom过表达,下调P450arom水平可抑制子宫腺肌病发展[14-15]。
本研究显示,子宫腺肌病异位病灶、在位内膜中E2、ER、P450arom表达水平较正常子宫肌层、内膜表达水平明显升高;其中子宫腺肌病异位病灶及在位内膜E2、P450arom表达水平无差异;子宫腺肌病异位病灶ER表达水平较其在位内膜表达水平明显升高。研究结果与既往文献研究结果基本相一致。本研究提示P450arom与E2表达水平成正相关,E2与P450arom存在正反馈作用,两者相互循环导致局部E2合成增加;ER在子宫腺肌病组织表达升高,高水平E2与ER相结合进入细胞内启动基因效应,诱导相关靶基因转录及蛋白表达,从而促进子宫腺肌病的发生发展。P450arom及E2的正反馈作用又可使子宫腺肌病在位内膜及异位病灶PGE2、E2、cox-2异常升高,刺激内膜血管生成因子合成,加强内膜的侵袭和再生能力,为子宫腺肌病的发生提供物质基础[16-18]。由于E2及P450arom之间正反馈环使PGE2升高,PGE2可直接刺激神经末梢引起痛经[19-20];另外雌激素激通过使子宫内膜增生、刺激子宫收缩、激活钾离子通道等多种不同途径共同参与子宫腺肌病及痛经的发病过程。
3.2 子宫腺肌病病病灶细胞增殖抑制率的变化雌激素激活及抑制状态的建立,大多予直接干预细胞方式进行,干预浓度国内外文献基本一致,雌二醇及ER抑制剂浓度均为1×10-6 mol/L[21-24]。本研究参考国内外文献基础上,建立雌激素激活与雌激素剥夺两种状态,从激动剂、抑制剂正反两方面阐述雌激素及ER对子宫腺肌病病灶细胞增殖抑制的影响,则更具说服力。
本实验提示各种处理因素对子宫腺肌病病灶细胞增殖均有不同程度抑制作用。ER抑制剂组及ER抑制剂+E2两组之间抑制率无明显差异,说明阻断ER后激活雌激素并不能使细胞抑制率降低,提示雌激素需通过结合雌激素受体发挥促子宫腺肌病病灶细胞增殖作用。雌激素剥夺组与雌激素剥夺+ER抑制剂组均能抑制子宫腺肌病病灶细胞增殖,提示阻断雌激素作用能抑制子宫腺肌病病灶细胞增殖,雌激素对子宫腺肌病病灶细胞有促增殖作用。雌激素剥夺+ER抑制剂组抑制率较雌激素剥夺组明显升高,即消除雌激素对细胞的影响后,加入ER抑制剂阻断ER作用,细胞抑制率明显上升,说明ER除与E2结合发挥生物学效应外,还可通过其他途径促进子宫腺肌病病灶细胞增殖。雌激素激活状态下,子宫腺肌病病灶细胞不同程度地增殖,因此雌激素激活状态能促进子宫腺肌病病灶细胞增殖。
本研究不仅证明子宫腺肌病组织中P450arom、E2、ER表达水平升高,且通过雌激素激活及剥夺状态证实E2、ER可促进子宫腺肌病病灶细胞增殖。因此,我们推断:E2、ER、P450arom在子宫腺肌病组织中均过表达,P450arom诱导E2表达,高水平E2通过与ER结合诱导靶基因转录及相关蛋白表达,促进子宫腺肌病细胞的增殖,参与子宫腺肌病的发生发展。P450arom与E2正反馈之间各种因子表达变化又可能参与子宫腺肌病及痛经的发生发展;E2需与ER结合发挥生物学效应,ER除与E2结合外,可能通过其他途径参与子宫腺肌病的发病机制。但P450arom、E2及ER在子宫腺肌病发病中的具体机制有待更进一步探讨。
| [1] | 丰有吉, 沈铿. 妇产科学:供8年制及7年制临床医学等专业用, 1[M]. 北京: 人民卫生出版社, 2008: 365-6. |
| [2] | Garcia L, Isaacson K. Adenomyosis: review of the literature[J]. J Minim Invasive Gynecol, 2011, 18 (4): 428-37. DOI: 10.1016/j.jmig.2011.04.004. |
| [3] | Yeniel O, Cirpan T, Ulukus M, et al. Adenomyosis: prevalence, risk factors, symptoms and clinical findings[J]. Clin Exp Obstet Gynecol, 2007, 34 (3): 163-7. |
| [4] | Taylor AH, Kalathy V, Habiba M. Estradiol and tamoxifen enhance invasion of endometrial stromal cells in a three-dimensional coculture model of adenomyosis[J]. Fertil Steril, 2014, 101 (1): 288-93. DOI: 10.1016/j.fertnstert.2013.09.042. |
| [5] | Revankar CM, Cimino DF, Sklar LA, et al. A transmembrane intracellular estrogen receptor mediates rapid cell signaling[J]. Science, 2005, 307 (5715): 1625-30. DOI: 10.1126/science.1106943. |
| [6] | Mehasseb MK, Bell SC, Pringle JH, et al. Uterine adenomyosis is associated with ultrastructural features of altered contractility in the inner myometrium[J]. Fertil Steril, 2010, 93 (7): 2130-6. DOI: 10.1016/j.fertnstert.2009.01.097. |
| [7] | Ebert AD, Bartley J, David M, et al. Aromatase inhibitorstheoretical concept and present experiences in the treatment of endometriosis[J]. Zentralbl Gynakol, 2003, 125 (7-8): 247-51. |
| [8] | 曾玉燕, 关永格, 李坤寅. 子宫腺肌病雌激素相关作用机制研究进展[J]. 中国妇幼保健, 2014, 29 (32): 5349-52. |
| [9] | Claudia R, Vanesa A, von WW, et al. Expression of CO-stimulatory molecules, chemokine receptors and proin-flaramatory cytokines in dendritic cells from normal and chronically inflamed rat testis[J]. Mol Hum Reprod, 2007, 13 (12): 853-61. DOI: 10.1093/molehr/gam067. |
| [10] | Korzekwa AJ, Bah MM, Gestwicka M, et al. Adenomyosis in the bovine uterus: correlation between frequency, age, and 17β-estradiol-progesterone equilibrium[J]. Theriogenology, 2013, 79 (1): 165-72. DOI: 10.1016/j.theriogenology.2012.09.023. |
| [11] | Shi J, Jin L, Leng J, et al. [Response of Potassium channels to estrogen and progesterone in the uterine smooth muscle cells of adenomyosis in vitro[J]. Zhonghua Fu Chan Ke Za Zhi, 2015, 50 (11): 843-7. |
| [12] | Yang HJ, Shozu M, Murakami K, et al. Spatially heterogenous expression of aromatase P450 through promoter II is closely correlated with the level of steroidogenic factor-1 transcript in endometrioma tissues[J]. J Clin Endocrinol Metab, 2002, 87 (8): 3745-53. DOI: 10.1210/jcem.87.8.8733. |
| [13] | Attar E, Bulun SE. Aromatase and other steroidogenic genes in endometriosis: translational aspects[J]. Hum Reprod Update, 2005, 12 (1): 49-56. DOI: 10.1093/humupd/dmi034. |
| [14] | Maia H, Haddad C, Pinheiro N, et al. The effect of oral contraceptives on aromatase and Cox-2 expression in the endometrium of patients with idiopathic menorrhagia or adenomyosis[J]. Int J Womens Health, 2013, 5 : 293-9. |
| [15] | Pontis A, D'alterio MN, Pirarba S, et al. Adenomyosis: a systematic review of medical treatment[J]. Gynecol Endocrinol, 2016, 32 (9): 696-700. DOI: 10.1080/09513590.2016.1197200. |
| [16] | 刘勉, 龚艺, 韦锦燕, 等. 前列腺素E2对大鼠巨噬细胞株NR8383合成血管内皮生长因子促进人脐静脉血管内皮细胞成管、迁移的影响[J]. 南方医科大学学报, 2016, 36 (7): 936-40. |
| [17] | 付先芸, 魏绍斌. 子宫腺肌病小鼠血管生成及雌激素效应因子的相互作用机制[J]. 武汉大学学报:医学版, 2015, 36 (6): 883-6. |
| [18] | Hatok J, Zubor P, Galo S, et al. Endometrial aromatase mRNA as a possible screening tool for advanced endometriosis and adenomyosis[J]. Gynecol Endocrinol, 2011, 27 (5): 331-6. DOI: 10.3109/09513590.2010.491925. |
| [19] | Flodgren GM, Crenshaw AG, Alfredson H, et al. Glutamate and prostaglandin E-2 in the trapezius muscle of female subjects with chronic muscle pain and controls determined by microdialysis[J]. Eur J Pain, 2005, 9 (5): 511-5. DOI: 10.1016/j.ejpain.2004.11.004. |
| [20] | Brenner RM, Nayak NR, Slayden OD, et al. Premenstrual and menstrual changes in the macaque and human endometrium: relevance to endometriosis[J]. Ann N YAcad Sci, 2002, 955 : 60-74. DOI: 10.1111/nyas.2002.955.issue-1. |
| [21] | Stewart AJ, Westley BR, May FE. Modulation of the proliferative response of breast Cancer cells to growth factors by oestrogen[J]. Br J Cancer, 1992, 66 : 640-8. DOI: 10.1038/bjc.1992.330. |
| [22] | 王宇全.子宫内膜异位症中EGF-EGFR-ERK1/2信号通路在雌激素调控中的作用及慢病毒介导的EGFR-siRNA治疗意义的研究[D].天津医科大学, 2013. |
| [23] | 何玉琦.雌激素诱导结肠癌细胞凋亡的表观遗传机制研究[D].第三军医大学, 2013. |
 2017, Vol. 37
2017, Vol. 37

