2. 锦州医科大学锦州医科大学 附属第一医院大肠外科,辽宁 锦州 121000
2. Department of Gastrointestinal Surgery, First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China
癌症和自噬的关系近年来被广泛研究[1-2]。越来越多的证据表明,自噬通路调节异常造成了各种类型的肿瘤克隆性扩增和生长[3-7]。结直肠癌是世界范围内最普遍的消化道肿瘤之一,自噬在结直肠癌细胞水平扮演了促生存的功能,自噬加强了结直肠癌细胞的攻击性以及适应促凋亡因素的能力[8]。另外,应对饥饿和抗肿瘤药物时,自噬使结直肠癌细胞免于死亡[9-10]。一系列自噬相关蛋白(Atg 蛋白)参与自噬过程,作为自噬体膜上的标记蛋白——微管相关蛋白1 轻链3(LC3/Atg8)始终稳定地保留在自噬体膜上,因此被用来作为自噬体的标记。酵母Atg6哺乳动物中的同系物Beclin1,在乳腺癌、黑素瘤和卵巢癌中已经被研究过。相比于正常乳腺上皮细胞,Beclin1在乳腺癌细胞中的表达下降[11]。在我们目前的研究当中,相比于正常的无癌组织,Beclin1的表达在结直肠癌组织的mRNA和蛋白水平显著升高。Beclin1是细胞分化、凋亡和自噬过程中起重要作用的多功能蛋白,在许多细胞类型促进自噬[12]。相比之下,下调Beclin1减弱这种现象,但凋亡仍然活跃[13]。已经用胚胎干细胞和人成纤维细胞2FTGH(2F)在试管中进行了有关Beclin1在自噬和凋亡中功能的研究[14],但是Beclin1 在结直肠癌细胞SW620 水平的角色尚无相关文献报道,鉴于这种蛋白的重要性,依赖Beclin1的信号转导途径已经成为肿瘤预防和靶向治疗的研究焦点。本研究通过设计自噬基因Beclin1 mRNA的干扰序列,构建能够在真核细胞中表达发夹状RNA(shRNA)序列的载体,转染SW620后,研究Beclin1 mRNA及蛋白表达的下降程度,和转染细胞应对饥饿、化疗药物作用的生存能力、凋亡率的变化,旨在探讨Beclin1在结直肠癌发展与演进中作用。
1 材料和方法 1.1 材料人结肠癌细胞株SW620 购买于上海细胞库,pSUPER 质粒载体购自Oligoengine,G418,lipofectamine 2000 购自Invivogn,Bgl Ⅱ,EcoR Ⅰ,Hind Ⅱ,T4 DNA 连接酶,Taq DNA 聚合酶,DL2000DNA Marker均为Takara产品;RNA抽提及RT-PCR试剂盒购自Fermentas。蛋白裂解液RIPA购自上海申能博彩公司,BCA蛋白定量试剂盒为美国PIERCE产品。兔抗人Beclin1 多克隆抗体BECN1(产品编号sc-11427),为美国Santa Cruz产品,
1.2 方法通过构建shRNA表达质粒、转染SW620、RT-PCR 检测Beclin1 表达水平等设立了pSUPER-Becl 组和pSUPER-non组与空白对照组。各组施加“血清剥夺0、12、24 h”处理因素后,检测细胞存活能力和凋亡情况;各组施加“依托泊苷0 μg 及5 μg”处理因素后,检测细胞凋亡率;各组施加“星孢菌素0 μmol/L 及2 μmol/L”处理因素后,检测细胞凋亡率;采用MTT比色法检测细胞存活能力、流式细胞仪检测细胞凋亡情况、免疫荧光法检测LC3表达情况、Western blot检测Beclin1蛋白表达情况
1.3 统计学方法统计学处理采用SPSS 13.0统计软件,组间比较采用单因素方差分析,多重比较采用LSD法,多组的两两比较用SNK法,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果 2.1 pSUPER-shRNA重组质粒鉴定对PCR 鉴定的阳性克隆质粒测序结果如下:PSUPER-siRNA,GTAATCTTATAAGTTCTGTATGAGACCACAGATCCCCGATTGAAGACACAGGAGGCTTCAAGAGAGCCTCCTGTGTCTTCAATCTTTTTGGAAAAACTTACGGGTAAATTGTAAGCGTTAATAT PSUPER-non,TAATCTTATAAGTTCTGTATGAGACCACAGATCCCCCGCCGAGCAGAAATAGAACTTCAAGAGAGTTCTATTTCTGCTCGGCGTTTTTGGAAACTTACGGGTAAATTGTAAGCGTTAATAT(划线部分为插人序列),经过比对,质粒中含有目的序列,确证重组质粒构建成功。
2.2 Beclin1在各组中表达情况 2.2.1 Beclin1 基因mRNA水平的表达3组细胞各设3 个复孔,每孔细胞经荧光定量PCR 检测后,得到Beclin1、GAPDH的Ct 值,根据Livak 和Schmittgen 的2-△△CT 公式要求,计算得到2-△△CT 结果如表 1 所示。pSUPER-Becl组Beclin1基因mRNA水平较空白对照组和pSUPER-non组明显降低。pSUPER-Becl和pSUPERnon 组细胞与空白对照组相比对Beclin1 mRNA抑制率分别为:81.05%(P<0.01)和6.19%(P>0.05)。
| 表 1 pSUPER-non/pSUPER-Becl 转染SW620细胞后Beclin1和GAPDH的RT-PCR扩增结果 Table 1 RT-PCR amplification of Beclin1 and GAPDH in SW620 cells transfected by pSUPER-non and pSUPER-Becl |
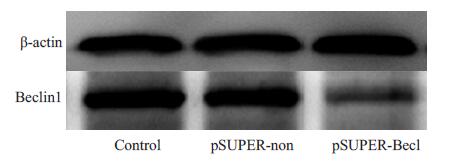
Western blot结果见图 1。空白对照组、pSUPER-non组,pSUPER-Becl组3 组细胞的Beclin1/Actin 的灰度比值分别为0.974±0.016、0.992±0.021、0.474±0.013;方差分析显示,空白对照组、pSUPER-non 组两组蛋白表达无显著性差异(P>0.05),pSUPER-Becl 和空白对照组、pSUPER-non 组相比,Beclin1蛋白表达显著下降(P<0.05)。
|
图 1 转染后Beclin1表达 Figure 1 Expression of Beclin1 in transfected SW620 cells. |
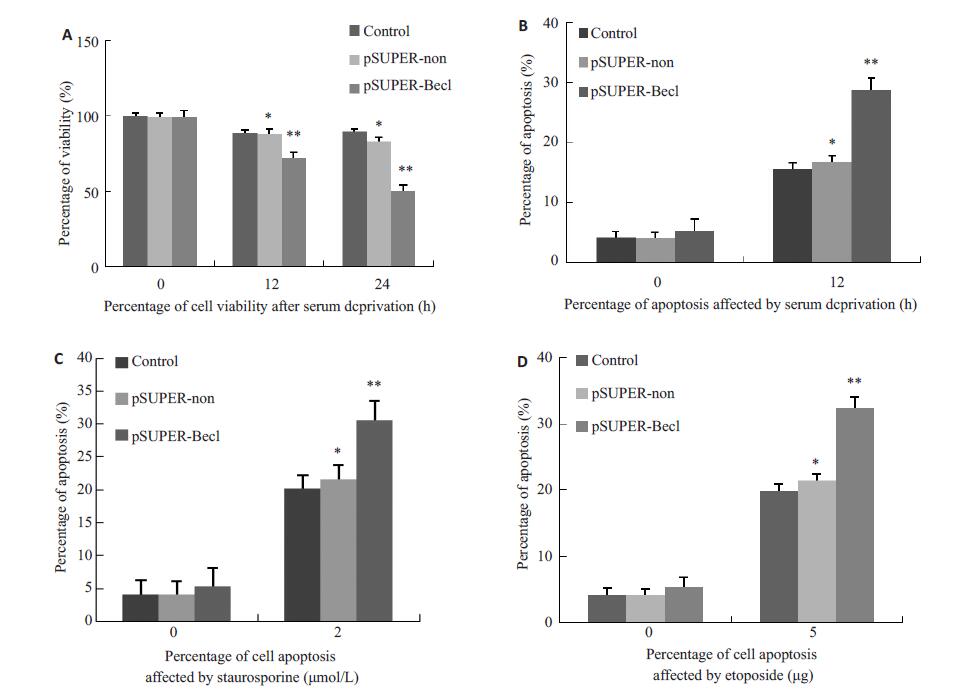
在所有对照组中,血清剥夺(12 h和24 h)轻度降低细胞存活能力。然而,与血清剥夺空白对照组、pSUPER-non组相比,血清剥夺pSUPER-Becl组细胞存活能力显著降低(P<0.05,图 2A)。在血清剥夺24 h后,空白对照组和pSUPER-non组对抗压力诱导凋亡的能力比pSUPER-Becl组更强(P<0.05,图 2B)。星孢菌素处理后,pSUPER-Becl组细胞凋亡最为显著(P<0.05,图 2C)。用依托泊苷处理pSUPER-Becl组细胞得到相似的结果(P<0.05,图 2D)。
|
图 2 Beclin1表达受抑制后结果 Figure 2 Viability and apoptosis of SW620 cells following inhibition of Beclin1 expression. A: The viability of cells in pSUPER-Becl group was significantly reduced after serum deprivation (P<0.05); B: After 24 h of serum deprivation, the apoptotic resistance in control and pSUPER-non groups was stronger than that in pSUPER-Becl group (P<0.05); C: After treatment with staurosporine, the cell apoptosis rate was the highest in pSUPER-Becl group (P<0.05); D: After treatment with etoposide, the cell apoptosis rate was the highest in pSUPER-Becl group (P<0.05). *P>0.05 vs control group **P<0.05 vs control group or pSUPER-non group. |
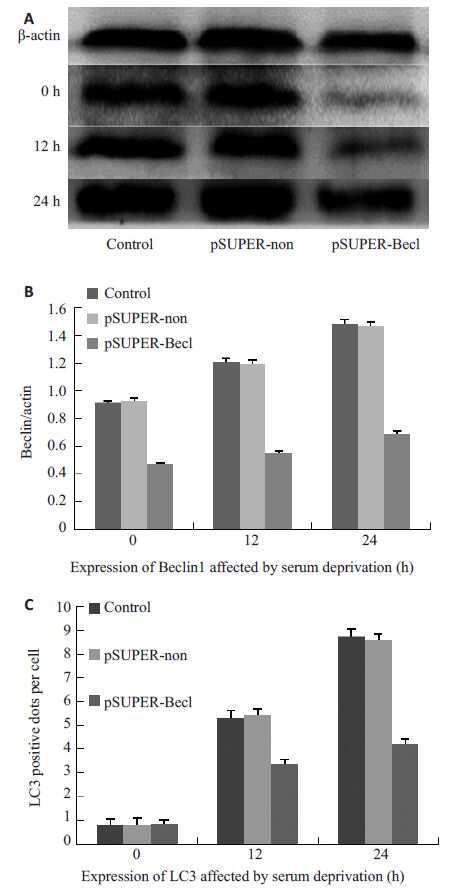
血清剥夺诱导的自噬与Beclin1在SW620中水平上调有关(P<0.05),Beclin1表达受抑制后,血清剥夺诱发自噬作用减弱。Western blot 结果见图 3A。pSUPER-non组与空白对照组细胞中Beclin1的表达随血清剥夺时间的延长呈现上调趋势(P<0.05,图 3B),这也与自噬相关基因LC3的表达变化相一致;与空白对照组、pSUPER-non组相比,pSUPER-Becl组自噬相关基因LC3的表达显著减少(P<0.05,图 3C)。此外,血清剥夺在一定程度上增加pSUPER-Becl 组细胞Beclin1 蛋白的表达。
|
图 3 血清剥夺对Beclin1、LC3的影响 Figure 3 Effects of serum deprivation on Beclin1 and LC3 expression. A: Expression of Beclin1 protein after serum deprivation detected by Western blotting; B: With the extension of serum deprivation time , the expression of Beclin1 in control group and pSUPER-non group increased progressively (P<0.05); C: In control group and pSUPER-non group, the expression of LC3 increased progressively as the time of serum starvation extended (P<0.05); Compared with control group and pSUPER-non group, pSUPER-Becl group showed significantly decreased LC3 expression (P<0.05). |
越来越多调节细胞凋亡和自噬的因素已确定。B淋巴细胞瘤-2是自噬和凋亡抑制剂[15-16],在面临营养压力期间促进结直肠癌细胞生存[17]。Beclin1在一些细胞水平正调控自噬和负调控细胞凋亡。在这项研究中, 我们探究了Beclin1在大肠癌SW620细胞自噬和凋亡中的角色。通过免疫荧光法检测pSUPER-Becl 组、pSUPER-non组及空白对照组血清剥夺后细胞中LC3表达情况及Western blot检测相应细胞中Beclin1表达情况,这些数据提示,血清剥夺诱导的自噬与Beclin1在SW620 中水平上调有关(P<0.05)。这就暗示Beclin1在肿瘤细胞自噬中扮演一个通用的角色。在肿瘤发展与演进过程中,由于高增殖率和血管化不足,肿瘤细胞同样遭受新陈代谢的压力,例如能量和氧供不足,自噬在乏氧和饥饿情况下被激活,它为血管增殖、肿瘤扩增赢得时间[18-20]。通过调控自噬机制可以抑制细胞增殖及新血管形成,这对设计治疗方案来说是有前景的成果。此外,Beclin1在结直肠癌细胞系不仅促进自噬也有能力控制这些细胞在自噬和凋亡之间的切换。我们通过流式细胞仪分析pSUPER-Becl组、pSUPER-non组及阴性对照组分别经血清剥夺、星孢菌素及依托泊苷处理后细胞凋亡率的变化。结果表明:通过shRNA 抑制Beclin1表达使细胞对凋亡更加敏感(P<0.05),这就提示,Beclin1可能是结直肠癌细胞株的一种抗凋亡因子。
尽管在为结直肠癌寻找更加有效治疗方面已结做了很多努力,它的发病率和死亡率在世界范围内仍持续增长。诱导肿瘤细胞死亡是肿瘤治疗的关键点。耐药性的产生是导致治疗失败的主要因素。目前研究发现很多因素影响化疗药物敏感性,在这些因素中,自噬与肿瘤细胞耐药性的关系成为近年来的研究热点[21]。自噬可通过清除受损的线粒体等细胞器,从而保护肿瘤细胞逃避损伤因素诱导的凋亡,提高肿瘤耐药性[22-23]。抑制自噬能够增强c-Myc诱导的淋巴瘤模型的凋亡水平,从而增强烷化剂环磷酰胺的杀伤效果[24]。虽然自噬与凋亡这两种细胞程序性死亡方式在形态、分子机制方面均不同,越来越多的研究提示二者在某些情况下可以相互拮抗或促进[25-27]。我们用shRNA干扰Beclin1基因表达后,分别以星孢菌素和依托泊苷处理SW620 细胞。结果表明,Beclin1表达下降的SW620细胞对星孢菌素或者依托泊苷诱导的凋亡更加敏感,下调Beclin1表达显著增加细胞对化疗药物敏感性。这些结果提示,Beclin1在结直肠癌细胞系中扮演促生存、抗凋亡的角色,它是导致结直肠癌细胞SW620对化疗药物产生耐受的重要机制之一。确定这一点很重要,因为它能提供额外的治疗策略[28]。靶向药物和生物标记的发展推动了个体化治疗,这是肿瘤临床治疗最有效的方式,因此,Beclin1的检测对合理选择有效化疗药物有重要意义。此外,细胞凋亡和自噬的详细调节机制在结直肠癌细胞尚未完全阐明。为进一步探索验证Beclin1在结直肠癌肿瘤生长、生存和耐药性的促生存通路中至关重要的角色,未来在结肠靶向过度表达及Beclin1基因敲除动物模型方面的研究是必需的。
总之,本研究确定了Beclin1 在结直肠癌细胞SW620自噬和凋亡中的角色,证明了Beclin1是通过促进自噬而成为结直肠癌细胞SW620关键的促生存因子之一;反之,沉默Beclin1 基因使结直肠癌细胞SW620更容易呈现凋亡;表明Beclin1在这些细胞的凋亡中是一个重要的负调节因子。Beclin1通过调节细胞自噬活性,在结直肠癌发展与演进中作为一种保护机制,使肿瘤细胞免受到低营养和化疗所致的损伤而持续生存。
| [1] | 汤智平, 关中. 自噬调节与肿瘤治疗相关的研究进展[J]. 中华肿瘤防治杂志, 2013, 20 (6): 477-80. |
| [2] | 刘虹, 邵荣光. 自噬在肿瘤发生与发展过程中的调节作用[J]. 药学学报, 2016, 51 (1): 23-4. |
| [3] | Au AK, Aneja RK, Bay¹r H, et al. Autophagy biomarkers beclin 1 and p62 are increased in cerebrospinal fluid after traumatic brain injury[J]. Neurocrit Care, 2016, 35 (7): 1-8. |
| [4] | White E, Mehnert JM, Chan CS. Autophagy, metabolism, and cancer[J]. Clin Cancer Res, 2015, 21 (22): 5037-46. DOI: 10.1158/1078-0432.CCR-15-0490. |
| [5] | White E. The role for autophagy in cancer[J]. J Clin Invest, 2015, 125 (1): 42-6. DOI: 10.1172/JCI73941. |
| [6] | Lotze MT, Maranchie J, Appleman L. Inhibiting autophagy: a novel approach for the treatment of renal cell carcinoma[J]. Cancer J, 2013, 19 (4): 341-7. DOI: 10.1097/PPO.0b013e31829da0d6. |
| [7] | Pandey S. Autophagy in cervical cancer: an emerging therapeutic target[J]. Asian Pac J Cancer Prev, 2012, 13 (10): 4867-71. DOI: 10.7314/APJCP.2012.13.10.4867. |
| [8] | Kanzawa T, Kondo Y, Ito H, et al. Induction of autophagic cell death in malignant glioma cells by Arsenic trioxide[J]. Cancer Res, 2003, 63 (9): 2103-8. |
| [9] | Peng W, Du T, Zhang Z, et al. Knockdown of autophagy-related gene LC3 enhances the sensitivity of HepG2 cells to epirubicin[J]. Exp Ther Med, 2015, 9 (4): 1271-6. |
| [10] | 许红玲, 张萍. 自噬与肿瘤耐药关系的研究进展[J]. 上海交通大学学报: 医学版, 2016, 36 (6): 934-8. |
| [11] | Liang XH, Jackson S, Seaman M, et al. Induction of autophagy and inhibition of tumorigenesis by beclin 1[J]. Nature, 1999, 402 (6762): 672-6. DOI: 10.1038/45257. |
| [12] | 付俊, 尚海旭, 贾弘禔, 等. Beclin1与自噬及肿瘤的关系[J]. 生理科学进展, 2012, 43 (2): 155-8. |
| [13] | 赵善民, 肖邦, 林丽芳, 等. RNA干扰抑制剂Beclin1基因对裸鼹鼠成纤维细胞增殖与凋亡的影响[J]. 中国实验动物学报, 2015, 23 (6): 557-61. |
| [14] | Zhu J, Chen X, Song Y, et al. Deficit of RACK1 contributes to the spatial memory impairment via upregulating BECLIN1 to induce autophagy[J]. Life Sci, 2016, 151 (8): 115-21. |
| [15] | Strappazzon F, Vietri-Rudan M, Campello S, et al. Mitochondrial BCL-2 inhibits AMBRA1-induced autophagy[J]. EMBO J, 2011, 30 (7): 1195-208. DOI: 10.1038/emboj.2011.49. |
| [16] | Sun ZJ, Zhang L, Hall B, et al. Chemopreventive and chemotherapeutic actions of mTOR inhibitor in genetically defined head and neck squamous cell carcinoma mouse model[J]. Clin Cancer Res, 2012, 18 (19): 5304-13. DOI: 10.1158/1078-0432.CCR-12-1371. |
| [17] | Giatromanolaki A, Koukourakis MI, Harris AL, et al. Prognostic relevance of light chain 3 (LC3A) autophagy patterns in colorectal adenocarcinomas[J]. J Clin Pathol, 2010, 63 (10): 867-72. DOI: 10.1136/jcp.2010.079525. |
| [18] | Xuan F, Huang M, Liu W, et al. Homeobox C9 suppresses Beclin1-mediated autophagy in glioblastoma by directly inhibiting the transcription of death-associated protein kinase 1[J]. Neuro Oncol, 2016, 18 (6): 819-29. DOI: 10.1093/neuonc/nov281. |
| [19] | Zeng M, Wei X, Wu Z, et al. Simulated ischemia/reperfusioninduced p65-Beclin 1-dependent autophagic cell death in human umbilical vein endothelial cells[J]. Sci Rep, 2016, 6 (2): 37448. |
| [20] | Swaminathan G, Zhu W, Plowey ED. BECN1/beclin 1 sorts cellsurface APP/amyloid β precursor protein for lysosomal degradation[J]. Autophagy, 2016, 12 (12): 2404-19. DOI: 10.1080/15548627.2016.1234561. |
| [21] | Troiani T, Martinelli E, Napolitano S, et al. Molecular aspects of resistance to biological and non-biological drugs and strategies to overcome resistance in colorectal cancer[J]. Curr Med Chem, 2014, 21 (14): 1639-53. DOI: 10.2174/09298673113209990224. |
| [22] | Li H, Jin X, Zhang Z, et al. Inhibition of autophagy enhances apoptosis induced by the PI3K/AKT/mTor inhibitor NVP-BEZ235 in renal cell carcinoma cells[J]. Cell Biochem Funct, 2013, 31 (5): 427-33. DOI: 10.1002/cbf.v31.5. |
| [23] | Palumbo S, Comincini S. Autophagy and ionizing radiation in tumors: the "survive or not survive" dilemma[J]. J Cell Physiol, 2013, 228 (1): 1-8. DOI: 10.1002/jcp.24118. |
| [24] | Lei S, Zhang Y, Zhang K, et al. Effects of fluoride on the expression of beclin1 and mTOR in ameloblasts[J]. Cells Tissues Organs, 2015, 200 (6): 405-12. DOI: 10.1159/000441052. |
| [25] | Park SE, Yi HJ, Suh N, et al. Inhibition of EHMT2/G9a epigenetically increases the transcription of Beclin-1 via an increase in ROS and activation of NF-κB[J]. Oncotarget, 2016, 7 (26): 39796-808. |
| [26] | Baek JH, Jung J, Seo J, et al. Bacterial overexpression and denaturing purification of VPS34-Binding domain of beclin 1[J]. J Microbiol Biotechnol, 2016, 26 (10): 1808-16. DOI: 10.4014/jmb.1604.04085. |
| [27] | Fan YJ, Zong WX. The cellular decision between apoptosis and autophagy[J]. Chin J Cancer, 2013, 32 (3): 121-9. |
| [28] | Chen N, Karantza V. Autophagy as a therapeutic target in cancer[J]. Cancer Biol Ther, 2011, 11 (2): 157-68. DOI: 10.4161/cbt.11.2.14622. |
 2017, Vol. 37
2017, Vol. 37

