2. 昆明医科大学第一附属医院 血管外科,云南 昆明 650032;
3. 昆明医科大学第三附属医院,云南 昆明 650051
2. Department of Vascular Surgery, First Affiliated Hospital of Kunming Medical University, Kunming 650032, China;
3. Third Affiliated Hospital of Kunming Medical University, Kunming 650051, China
结肠癌(CRC)是全世界范围内常见的恶性肿瘤,发病率高,治疗难度大,手术切除后2年内复发率达到55%~80%[1]。临床上,经常采用卡培他滨或者与其他化疗药物联合应用来治疗结肠癌。尽管现在可以结合化疗,放疗以及手术切除的方法来治疗结肠癌,但是这对结肠癌的治疗和预后效果仍然存在不佳。因此,探索研究结肠癌的靶向治疗药物是非常有意义的。目前靶向药物已成为治疗结肠癌的新方向,其中作用于血管内皮生长因子/血管内皮生长因子受体(VEGF/VEGFR)的抗血管生成类药物已成为研究热点之一。
阿帕替尼又叫YN968D1,是一种新型的口服抗血管生成药物,在许多固体肿瘤治疗作为肿瘤靶向治疗药物。阿帕替尼是一个可以特异性结合VEGFR-2的小分子,它能抑制VEGF刺激的内皮细胞的迁移和增殖,从而抑制微血管密度[2-3]。研究表明,阿帕替尼是VEGFR-2抑制剂,可以通过靶向抑制VEGFR-2来抑制肿瘤血管的生成[4]。但是阿帕替尼是否还存在激活或抑制另外的信号通路来达到其抑制结肠癌生长的作用,目前对这点的研究报道甚少,这是本研究目的之一。
阿帕替尼能高效且特异性地与VEGFR-2的ATP位点结合,使VEGFR-2无法被激活,阻断下游信号传导[2],达到治疗目的。蛋白酪氨酸激酶激活的主要下游信号途径是MAPK/Erk、PI3K/Akt信号途径,激活这些通路会促进肿瘤细胞增殖,转化,抑制细胞凋亡[5-10]。在肿瘤细胞中酪氨酸激酶的异常激活,导致下游信号通路的活性异常,导致细胞癌变,且在肿瘤细胞的迁移,粘附,肿瘤血管生成等生理过程中发挥重要的作用[3, 11]。目前,对于研究阿帕替尼抑制结肠癌时影响的下游信号通路的研究还没有报道。
本研究以体外细胞实验中观察阿帕替尼对结肠癌细胞增殖的抑制作用,并进一步探讨其作用机制及影响的信号通路,为其应用于结肠癌的治疗提供理论基础,也为后期更为精确的药物联合治疗提供理论支持。
1 材料和方法 1.1 实验材料 1.1.1 细胞株人结肠癌HCT-116细胞株购自武汉大学生命科学学院中国典型培养物保藏中心。
1.1.2 药品与试剂阿帕替尼片(艾坦,江苏恒瑞医药股份有限公司),卡培他滨片由美国罗氏公司提供,PRMI 1640培养基(Hyclone,美国),胎牛血清(Biological Industries,以色列),100 ×青霉素/链霉素混合液(Biological Industries,以色列),0.25%胰蛋白酶消化液(Biological Industries,以色列)。MTT检测试剂盒(Sigma,美国),Annexin V-FITC/PI凋亡检测试剂盒(Bender medsystems,奥地利),DMSO(MP Biomedicals,美国)。TRIzol总RNA提取试剂盒(Invitrogen,美国),cDNA第一链合成试剂盒(Fermentas,立陶宛),SYBR(Thermo Scientific,美国)。细胞全蛋白提取试剂盒(Sigma,美国),兔抗人Bcl-2、兔抗人Bax、兔抗人cleaved-Caspase3、兔抗人Akt、兔抗人pAkt、兔抗人Erk、兔抗人pErk、和兔抗人GAPDH(Proteintech,美国),超敏ECL化学发光检测试剂盒(江苏碧云天生物技术研究所),聚偏乙稀二氟膜(PVDF膜)(Millipore,美国)。盐酸、甲醇、甘氨酸、氯化钠、异丙醇、无水乙醇、氯仿等均为化学分析纯试剂均购于北京鼎国昌盛生物技术有限责任公司。
1.1.3 器材细胞培养瓶25 cm2/75 cm2(Corning,美国),细胞培养板6孔,24孔,96孔(Corning,美国),7300HT Fast Real-Time PCR System(Applied Biosystems,美国),CyFlow space分选型流式细胞仪(PARTEC,德国),垂直凝胶电泳仪及配套设备(BIO-RAD,美国),Chemical XRS+凝胶成像分析系统(BIO-RAD,美国),各种规格的移液器(Eppendorf,德国)。
1.2 实验方法 1.2.1 细胞培养HCT-116细胞以PRMI 1640完全培养基(含10%胎牛血清及1%青霉素/链霉素混合液),于5% CO2培养箱中培养,待细胞长至培养瓶底面积90%左右时传代。弃旧培养基,PBS缓冲液(pH7.2-7.4)漂洗细胞2次,0.25%胰蛋白酶消化2 min,弃去胰酶,加入含胎牛血清的培养基吹打细胞,将细胞悬液传至2个新培养瓶中,加入新鲜PRMI 1640完全培养基继续培养。
1.2.2 MTT细胞增殖检测取对数生长期的HCT-116细胞在超净台内按常规胰酶消化方法制成细胞悬液,接种于96孔板(5000 cells/well)。实验设计9个组:阿帕替尼浓度分别为0、0.5、1、1.5、2 μmol/L、卡培他滨浓度分别为10、25、50、100 mg/mL,每组8孔。每孔接种细胞悬液200 μL。37 ℃、5% CO2培养箱培养24 h后,弃去各孔培养基,各组分别加入含相应浓度阿帕替尼的完全培养基200 μL继续培养48 h。
待阿帕替尼和卡培他滨作用细胞48 h后,往每个细胞培养孔内加入20 μL新配的MTT溶液(5 mg/mL),继续培养4 h。然后除净各孔中的液体,加入150 μL Formazan溶解液,将96孔培养板放入全自动酶标仪,设置水平震摇时间10 min,检测波长570 nm。运行酶标仪,在震摇培养板结束后自动检测每孔的光密度值(A值)。每组取8孔A值的平均值,计算每组的细胞抑制率。用Graphpad软件计算出IC50值。
| $抑制率 = \left( {1 - \frac{{实验组A值}}{{阴性对照组A值}}} \right) \times 100\% $ |
采用Annexin V-FITC/PI双染法检测细胞凋亡情况,取对数生长期的HCT-116细胞,接种于6孔板中,使细胞终浓度为1×106/mL。培养24 h后,实验组分别加入终浓度为0.5、1、1.5、2 μmol/L阿帕替尼,阳性对照组加入终浓度为100 mg/mL的卡培他滨,未加药物组为空白对照组。然后置于5% CO2培养箱中37 ℃培养。在培养48 h后,用胰蛋白酶消化细胞,用预冷PBS洗涤2次,加入100 μL 1×Binding buffer重悬细胞,然后加入AnnexinV/FITC(5 μL)和PI(10 μL)混匀,室温避光孵育15 min,再加入400 μL 1×Binding buffer混匀后,流式细胞仪分析。所有实验均重复3次。
1.2.4 荧光定量PCR 1.2.4.1 引物合成引物由上海生工生物工程股份有限公司合成,引物合成表如下。
1.2.4.2 实时荧光定量PCR实验组分别加入终浓度为0.5、1、1.5、2 μmol/L阿帕替尼,未加药物组为空白对照组。用TRIzol抽提各组细胞总RNA。按照Fermentas逆转录试剂盒说明书配置反应液,合成cDNA反应参数为:65 ℃ 5 min;50 ℃ 30 min;25 ℃ 10 min;85 ℃ 5 min。在Prism 7300HT real-time PCR反应仪(ABI公司)中进行反应,引物见上表。qPCR循环参数为:95 ℃预变性10 min后,随后按95 ℃ 15 s,95 ℃ 60 s进行40个循环;实验以GAPDH基因内参表达水平为对照,以2-△△Ct法分析细胞中相关基因的mRNA表达水平。
1.2.5 Western blot蛋白表达检测 1.2.5.1 细胞总蛋白提取分别收集用浓度为0、0.5、1、1.5、2 μmol/L阿帕替尼处理的细胞,预冷PBS洗涤2次,加入200 μL裂解液(PMSF终浓度1 mmol/L),用枪吹打数下,使裂解液与细胞充分接触,孵育10 min,4 ℃12 000 r/min离心5 min后取上清分装,-80 ℃保存。
1.2.5.2 Western blot取各组蛋白样品与6×样品缓冲液混合后煮沸10 min,每孔100 μg,于10% SDS-聚丙烯酰胺凝胶中电泳,然后按海绵、滤纸、SDS-聚丙烯酰胺凝胶、PVDF膜、滤纸、海绵的顺序准备好转膜夹,放置到转移槽中100 V转移1.5 h。转移完毕后PVDF膜用5% BSA封闭2 h,加入按一定比例稀释好的Bcl-2,Bax,Caspase3,AKT,pAKT,ERK、pERK及内参GapDH一抗,4 ℃孵育过夜。TBST洗涤4次,加入辣根过氧化物酶标记的二抗(1:5000),室温摇床孵育30 min,TBST洗涤后,根据超敏ECL化学发光检测试剂盒说明书配制发光液,并迅速用Chemical XRS+凝胶成像分析系统成像分析。
1.2.6 统计分析采用GraphPad Prism software Version 5.0a(GraphPad Software Inc., 美国)软件进行统计学分析,数据以均数±标准差表示,组间比较采用单因素方差分析(one-way ANOVA,Tukey's post hoc test),P<0.05为差异有统计学意义。
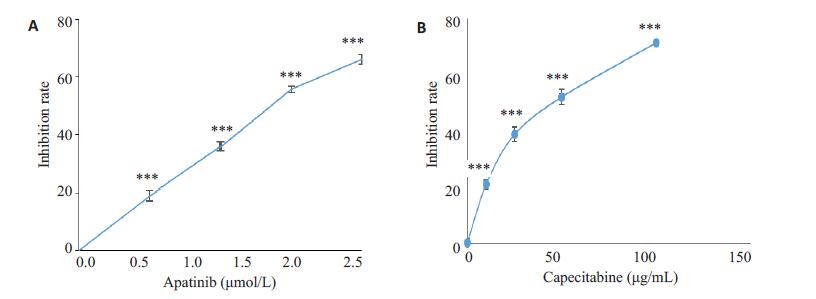
2 结果 2.1 MTT检测阿帕替尼对结肠癌细胞增殖的影响MTT法检测阿帕替尼对HCT-116细胞增殖的抑制作用,不同浓度的卡培他滨(10、25、50、500 mg/mL)为阳性对照,结果显示阿帕替尼对HCT-116细胞有明显的抑制作用,并呈浓度依赖的关系(P<0.001,图 1A),卡培他滨也呈浓度依赖的方式抑制结肠癌细胞增殖(P<0.001,图 1B)。阿帕替尼对HCT-116细胞株作用的半数抑制浓度(IC50值)为1.335 μmol/L。结果表明,阿帕替尼与卡培他滨相似,都可以显著地抑制结肠癌细胞增殖。
|
图 1 阿帕替尼和卡培他滨对HCT-116细胞增殖的影响 Figure 1 Effect of apatinib (A) and capecitabine (B) at different concentrations on the proliferation of HCT-116 cells (MTT assay). ***P < 0.001 vs 0 mol/L. |
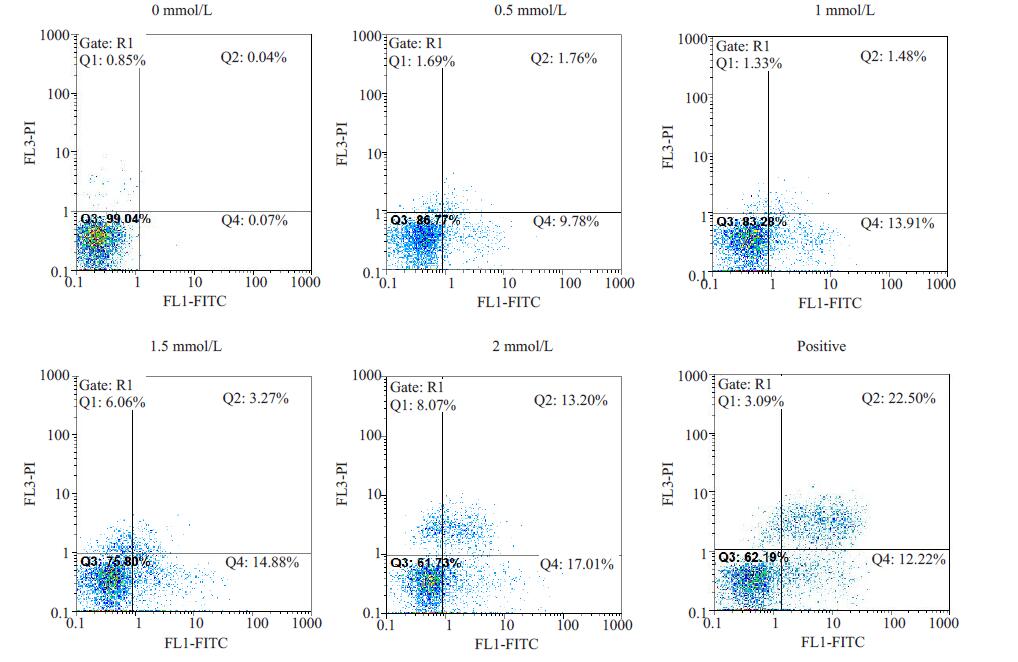
HCT-116细胞分别经不同浓度阿帕替尼和100mg/mL的卡培他滨处理48 h后,通过Annexin V-FITC/PI法测定其凋亡率,结果如图 2所示。当阿帕替尼浓度为0.5 μmol/L时,凋亡率(11.54±0.14)%,与对照组凋亡率(0.11±0.21)%相比,差异及其显著(P<0.01),阿帕替尼浓度为1 μmol/L时,凋亡率为(15.39±0.32)%,阿帕替尼为1.5 μmol/L时,凋亡率达(18.15±0.24)%,阿帕替尼为2 μmol/L时,凋亡率达(30.21±0.31)%,阳性对照卡培他滨组的凋亡率为(34.72±0.56)%。统计分析凋亡结果可见,阿帕替尼浓度为0~2 μmol/L时,随着浓度的增加,HCT-116细胞凋亡率也随之增高,表明这个浓度区间中,阿帕替尼有显著的诱导结肠癌细胞凋亡的作用,其诱导作用呈浓度依赖性(图 2)。
|
图 2 阿帕替尼对HCT-116细胞凋亡的影响 Figure 2 Effect of apatinib on apoptosis of HCT-116 cells analyzed by flow cytometry. |
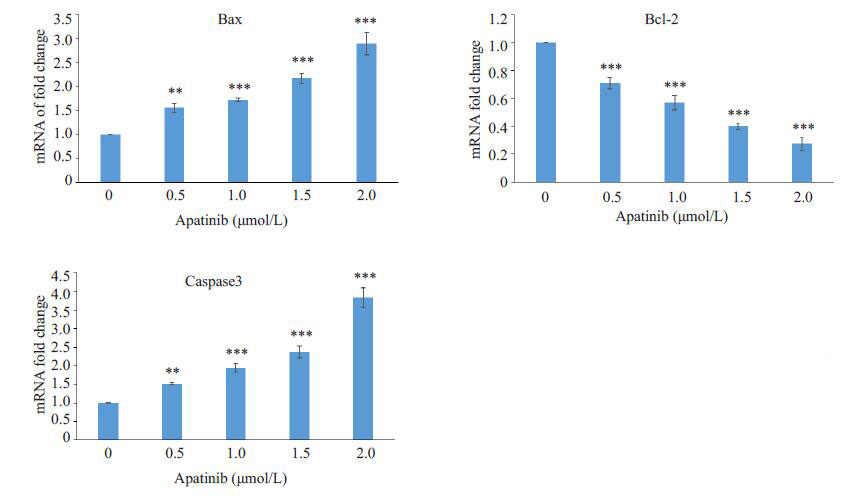
实时荧光定量PCR和Western blot结果显示,不同浓度的阿帕替尼组中的促凋亡蛋白Bax的表达量明显高于对照组(0 mmol/L组)表达量(P<0.01);凋亡关键蛋白酶Caspase3的表达水平也明显高于对照组(0 mmol/L组)表达水平(P<0.01);而抗凋亡蛋白Bcl-2的表达水平显著低于对照组(0 mmol/L组)表达水平(P<0.001,图 3,4)。
|
图 3 不同浓度阿帕替尼组Bcl-2,Bax,Caspase3基因mRNA相对表达量差异 Figure 3 Effect of apatinib on mRNA expressions of bcl-2, bax and caspase-3 detected by realtime PCR. **P < 0.01, ***P < 0.001 vs 0 mol/L. |

|
图 4 阿帕替尼对HCT-116细胞Bcl-2、Bax、Caspase3蛋白表达量的影响 Figure 4 Effect of apatinib on expressions of Bcl-2, Bax and caspase-3 proteins in HCT-116 cells detected with Western blotting. |
为了进一步探究阿帕替尼抑制HCT-116细胞增殖、诱导其凋亡是否与其与Erk1/2和Akt信号通路有关,我们用Western blot检测了经不同浓度阿帕替尼处理后的HCT-116细胞中p-Akt,Akt,p-Erk1/2和Erk1/2蛋白表达情况。结果显示,随着阿帕替尼浓度的增加,pAkt及pErk1/2表达降低(图 4),而Akt及Erk1/2表达量不变,即在蛋白总表达量不变的情况下,Akt及Erk1/2蛋白的磷酸化水平随着阿帕替尼浓度的提高而降低,可见阿帕替尼阻断了Akt和Erk1/2蛋白磷酸化,下调了MAPK/Erk和PI3K/Akt信号通路的表达。
3 讨论结肠癌是消化道最常见的恶性肿瘤之一,但是迄今为止尚无有效诊断靶标进行早期筛查。目前化学药物治疗在结肠癌的临床治疗中仍占主要地位,常用的有卡培他滨、奥沙利铂、氟尿嘧啶、伊立替康等。传统化学药物由于缺乏靶向性,在治疗中往往会对正常组织细胞造成损害,产生严重的毒副作用。此外,耐药性的普遍存在也严重制约了化学药物的疗效。因此,在分子水平上深入探索结肠癌的成因及发展机制,开发基于肿瘤特异性靶蛋白及信号通路的靶向药物,已成为现阶段结肠癌药物治疗研究的热点。阿帕替尼对胃癌有抑制作用[12],对白血病HL-60细胞株冶有明显抑制作用[13],并且可以联合化疗药物显著抑制白血病细胞[14],但是对于阿帕替尼在结肠癌中的研究还比较少。
阿帕替尼在细胞内的作用机制尚未完全清楚,其联合作用靶点或者辅助作用靶点也尚未明确。阿帕替尼作为新型酪氨酸激酶抑制剂,Ⅰ/Ⅱ期临床试验显示其对结直肠癌有一定的疗效,文中结果显示,阿帕替尼对结肠癌细胞HCT-116有显著的抑制作用,这与临床试验结果是相符合的。
本次研究我们通过MTT实验和流式细胞仪检测首次观察到阿帕替尼在体外对结肠癌细胞株HCT-116的生长有明显的抑制作用,并能显著诱导细胞凋亡,且抑制率和凋亡率与阿帕替尼的浓度呈剂量依赖的关系(图 1和2)。关于阿帕替尼药效的研究很多,单药在肿瘤移植模型中显示了较强的抗肿瘤活性[15],Ⅱ/Ⅲ期临床试验显示其对胃癌、肝癌、非小细胞肺癌等均有较好的疗效[16-18],Ⅰ/Ⅱ期临床试验显示其对结直肠癌也有一定的疗效,是一种极具潜力的靶向药物,但是作用于结肠癌体外细胞株的研究尚缺乏,本实验第1次在细胞水平研究了阿帕替尼对结肠癌细胞HCT-116的影响。卡培他滨是新一代的氟尿嘧啶口服剂,可以优先在肿瘤细胞中转化成5氟尿嘧啶从而发挥抗肿瘤的作用[19-20]。本文中,以卡培他滨为阳性对照,发现阿帕替尼和卡培他滨对结肠癌细胞有着相同的抑制效果,这就更加准确地肯定了阿帕替尼在结肠癌细胞中的作用。
肿瘤的生长增殖依赖很多信号通路的激活,一些肿瘤的生长与蛋白酪氨酸激酶相关信号通路有着重要的联系。MAPK/Erk、PI3K/Akt信号途径是蛋白酪氨酸激酶激活的主要下游信号途径,这两个通路的激活会促进肿瘤细胞增殖,迁移和转化,从而抑制细胞凋亡。例如,某些药物可以通过抑制MAPK/Erk和PI3K/Akt信号通路来抑制乳腺癌细胞的增殖转化[21]。研究表明,MAPK/Erk和PI3K/Akt信号通路在结肠癌中处于高表达的激活状态[22]。为了进一步探究阿帕替尼对MAPK/Erk和PI3K/Akt下游相关信号通路的作用,如何影响这些信号通路来抑制结肠癌细胞生长作用的,本文还进行了Akt和Erk两个信号通路的变化验证。本研究显示,经阿帕替尼处理后,两个信号通路蛋白pAkt和pEek1/2的表达量均降低了,且变化呈浓度依赖性,这说明阿帕替尼抑制了MAPK/Erk和PI3K/Akt信号通路活性。这暗示了,阿帕替尼可能是通过抑制MAPK/Erk和PI3K/Akt信号通路的激活来达到抑制结肠癌细胞增殖,诱导结肠癌细胞凋亡的目的。Shebaby等[23]发现,一种胡萝卜成分可以通过抑制MAPK/Erk和PI3K/Akt信号通路来抑制结肠癌HT-29细胞的增殖,并诱导其凋亡。本实验与此相似,阿帕替尼可能通过抑制MAPK/Erk和PI3K/Akt信号通路来抑制结肠癌HCT-116细胞的增殖,并诱导其凋亡。
综上所述,我们首次发现阿帕替尼能呈浓度依赖的方式在体外有效地抑制结肠癌细胞HCT-116的生长,诱导结肠癌细胞HCT-116凋亡,并能显著地抑制MAPK/Erk和PI3K/Akt信号通路相关蛋白p-ERK和p-AKT的激活。这为结肠癌的分子靶向治疗提供了一定的研究基础,也为以后阿帕替尼结合其他药物的联合治疗提供了理论基础。总之,阿帕替尼在结肠癌中的作用机制值得进一步深入研究。
| [1] | Docherty JG, Mcgregor JR, O'dwyer PJ, et al. Local recurrence of colorectal cancer: the problem, mechanisms management and adjuvant therapy[J]. Br J Surg, 1994, 81 (7): 1082. |
| [2] | Tian S, Quan H, Xie C, et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J]. Cancer Sci, 2011, 102 (7): 1374-80. DOI: 10.1111/cas.2011.102.issue-7. |
| [3] | Li J, Zhao X, Chen L, et al. Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J]. BMC Cancer, 2010, 10 : 529. DOI: 10.1186/1471-2407-10-529. |
| [4] | Zhang HJ. Apatinib for molecular targeted therapy in tumor[J]. Drug Des Devel Ther, 2015, 9 : 6075-81. |
| [5] | Zhu XF, Liu ZC, Zeng YX. Tyrosine kinase receptor-mediated signal transduction and cancer treatment[J]. Yao Xue Xue Bao, 2002, 37 (3): 229-34. |
| [6] | Ferrer I, Planas AM. Signaling of cell death and cell survival following focal cerebral ischemia: Life and death struggle in the penumbra[J]. J Neuropathol Exp Neurol, 2003, 62 (4): 329-39. DOI: 10.1093/jnen/62.4.329. |
| [7] | Friguls B, Petegnief V, Justicia C, et al. Activation of ERK and Akt signaling in focal cerebral ischemia: modulation by TGF-alpha and involvement of NMDA receptor[J]. Neurobiol Dis, 2002, 11 (3): 443-56. DOI: 10.1006/nbdi.2002.0553. |
| [8] | Darling CE, Jiang R, Maynard M, et al. Postconditioning via stuttering reperfusion limits myocardial infarct size in rabbit hearts: role of ERK1/2[J]. Am J Physiol Heart Circ Physiol, 2005, 289 (4): H1618-26. DOI: 10.1152/ajpheart.00055.2005. |
| [9] | Philipp SD, Downey JM, Cohen MV, et al. Postcoriditioriing must be initiated in less than iminute following reperfusion and is dependent on adenosine receptors and PI-3 kinase[J]. Circulation, 2004, 110 : 111-68. |
| [10] | Yang XM, Philipp S, Downey JM, et al. Postconditioning's protection is not dependent on circulating blood factors or cells but involves adenosine receptors and requires PI3-kinase and guanylyl cyclase activation[J]. Basic Res Cardiol, 2005, 100 (1): 57-63. DOI: 10.1007/s00395-004-0498-4. |
| [11] | 茆勇军, 李海泓, 李剑峰, 等. 蛋白酪氨酸激酶信号转导途径与抗肿瘤药物[J]. 药学学报, 2008, 43 (4): 323-34. |
| [12] | Geng R, Li J. Apatinib for the treatment of gastric cancer[J]. Expert Opin Pharmacother, 2015, 16 (1): 117-22. DOI: 10.1517/14656566.2015.981526. |
| [13] | 梁树, 童秀珍, 符立悟. 小分子酪氨酸激酶抑制剂Apatinib对白血病HL-60细胞株抑制增殖作用及机制[J]. 南方医科大学学报, 2011, 31 (5): 871-4. |
| [14] | Tong XZ, Wang BF, Liang S, et al. Apatinib (YN968D1) enhances the efficacy of conventional chemotherapeutical drugs in side population cells and ABCB1-overexpressing leukemia cells[J]. Biochem Pharmacol, 2012, 83 (5): 586-97. DOI: 10.1016/j.bcp.2011.12.007. |
| [15] | Chen P, Iruela-Arispe L, Lou L, et al. VEGFr inhibitor YN968D1 xenograft dose response studies against human colon Cancer Ls174t and HT29[J]. Proc Amer Assoc Cancer Res, 2006, 47 (9): 1764-9. |
| [16] | Zhang L, Shi MQ, Huang C, et al. A phase II, multicenter, placebocontrolled trial of apatinib in patients with advanced nonsquamous non-small cell lung Cancer (NSCLC) after two previous treatment regimens[J]. J Clin Oncol, 2012, 30 (Suppl): 7548. |
| [17] | Qin SK. Phase III study of apatinib in advanced gastric Cancer: A randomized, double-blind, placebo-controlled trial[J]. J Clin Oncol, 2014, 32 (Suppl): 4003. |
| [18] | Qin SK. Apatinib in Chinese patients with advanced hepatocellular carcinoma: A phase II randomized, open-label trial[J]. J Clin Oncol, 2014, 32 (Suppl): 17-20. |
| [19] | Comella P, Gambardella A, Farris A, et al. A tailored regimen including capecitabine and oxaliplatin for treating elderly patients with metastatic colorectal carcinoma southern italy cooperative oncology group trial 0108[J]. Crit Rev Oncol Hematol, 2005, 53 (2): 133-9. DOI: 10.1016/j.critrevonc.2004.10.008. |
| [20] | 王曙光, 张东伟. 卡培他滨单药治疗老年晚期结肠癌临床观察[J]. 安徽医学, 2009, 30 (10): 1166-7. |
| [21] | Machado VA, Peixoto D, Queiroz MJ, et al. Antiangiogenic 1-Aryl-3-[3-(thieno[3, 2-b]pyridin-7-ylthio) phenyl]ureas Inhibit MCF-7 and MDA-MB-231 human breast cancer cell lines through PI3K/ Akt and MAPK/Erk pathways[J]. J Cell Biochem, 2016, 117 (12): 2791-9. DOI: 10.1002/jcb.v117.12. |
| [22] | Setia S, Nehru B, Sanyal SN. Upregulation of MAPK/Erk and PI3K/Akt pathways in ulcerative colitis-associated colon cancer[J]. Biomed Pharmacother, 2014, 68 (8): 1023-9. DOI: 10.1016/j.biopha.2014.09.006. |
| [23] | Shebaby WN, Bodman-Smith KB, Mansour A, et al. Daucus carota pentane-based fractions suppress proliferation and induce apoptosis in human colon adenocarcinoma HT-29 cells by inhibiting the MAPK and PI3K pathways[J]. J Med Food, 2015, 18 (7): 745-52. DOI: 10.1089/jmf.2014.3225. |
 2017, Vol. 37
2017, Vol. 37

