2. 中国科学院理化技术研究所,北京100190
2. Technical Institute of Physics and Chemistry, Beijing 100190, China
牙周病是人类口腔疾病中的常见病和多发病,容易引起牙龈、牙周膜及牙槽骨等组织的破坏[1],其发病可累及所有个体和牙齿,且发病率与年龄呈正比[2]。如何消除牙周组织的局部炎症、阻止附着丧失,并促进牙周组织的再生是治疗牙周病的有效途径和最终目标,这也是近年来是国内外学者研究的热点[3]。传统的牙周治疗能够有效控制和延缓疾病的进一步发展,但无法完全修复已丧失的牙周组织,近年来的研究发现干细胞在维持正常的牙周组织更新和恢复天然牙齿的生理功能中发挥重要的作用,因而干细胞是恢复已经丧失的牙周组织的关键因素之一[4-5]。
牙周膜是一种特殊的、富含血管的纤维结缔组织,它使牙齿被稳固的固定在牙槽窝中。2004年,Seo等[6]利用单细胞克隆技术首次证实了牙周膜干细胞(PDLSC)的存在,发现其在特定的培养条件下可分化成为胶原形成细胞、成牙本质细胞和成脂细胞。目前,多种成体干细胞已被应用于牙周再生医学,其中骨髓间充质干细胞和牙周膜干细胞被认为是较理想的种子细胞[7]。以往关于年龄对干细胞生物学特性的影响主要集中在大鼠及小鼠的骨髓间充质干细胞[8-9],关于人牙周膜干细胞的研究较少[10-11]。牙周膜干细胞是来源于牙周组织的成体干细胞,可来源于牙根部或牙槽窝内的牙周膜组织,与牙周组织关系密切,其不仅在牙周病的治疗、种植体周围软硬组织缺损的修复过程中发挥重要作用,同时参与正畸牙齿移动中的骨改建[12]。与骨髓间充质干细胞相比,牙周膜干细胞成骨分化能力较弱,增殖能力与克隆形成能力较强[13],将二者构建为生物工程膜片移植后,牙周膜干细胞膜片性能更为稳定并具有更强的增殖能力[14],因此,牙周膜干细胞成为口腔组织修复再生的理想种子细胞。但年龄因素对其生物学特性的影响仍有待探索,这些影响有可能对最终结果造成显著的影响,原因在于增龄可负向调控组织的再生潜力。了解年龄因素对PDLSC增殖、分化能力的影响,有助于我们了解微观领域中增龄对牙周组织生长发育的影响及牙周组织在增龄过程中的变化,进一步了解并研究其机制,有助于未来老年牙周病的防治中抑制年龄因素引起的牙周病病情加重,并促进牙周组织年轻化进而促进牙周组织再生。基于此,本研究通过不同年龄阶段智齿中PDLSC的分离、培养和对比分析,观察年龄因素因素对PDLSC 的生物学特性的影响。
1 材料和方法 1.1 材料胎牛血清,α-MEM 培养基,Ⅰ型胶原(Gibco BRL);0.25%胰蛋白酶(Sigma);青链霉素(Gibco BRL);Western及IP裂解液,BCA蛋白浓度测定试剂盒(碧云天);ALP 抗体(Abcam);OCN 抗体(Abcam);β-Actin,羊抗兔IgG(中杉金桥),油红O(Sigma),茜素红(25海生工),β-半乳糖苷酶染色试剂盒进行(碧云天)地塞米松(Sigma)、β-甘油磷酸钠(Sigma)、抗坏血酸(Sigma)、L-谷氨酰胺(Gibco)、IBMX(百灵威)、胰岛素(Sigma)、吲哚美辛(Sigma)。
1.2 样本收集收集因治疗需要拔除的无牙体牙髓疾病的健康第3 磨牙。2 组病例资料情况:A 组(年龄18~20 岁,男3例,女3例),B 组(年龄45~50岁,男3例,女3例)所有纳入个体均无系统性疾病,无家族遗传疾病史及已知的可以影响牙周状况的疾病,无吸烟史,近6个月无服药史。所有牙齿均无龋坏,无牙周袋,均完整拔出且牙根完整,项目在患者知情同意的条件下进行,经医院伦理委员会论证批准。
1.3 牙周膜干细胞的分离培养分离培养遵循本实验室前期实验步骤[9],超净工作台内将获取的第三磨牙用PBS液冲洗5~7次后,用冠根单向刮取根中1/3 区域的牙周膜组织,修剪组织块为1 mm3大小,I型胶原酶37 ℃培养箱消化15 min后,离心管内的组织离心800 r/min。弃上清后重悬并放于6孔板中(含15%胎牛血清、100 μm/L抗坏血酸、0.292 mg/mL谷氨酰胺、100 units/mL青霉素/链霉素的α-MEM培养基)。在37 ℃、5% CO2培养箱中培养5~8 d,每2~3 d半量换液1次。直至有细胞从组织块边缘爬出并生长汇合达80%时用胰酶/EDTA(0.25/0.1,pH=6.4)消化传代,标记为第1代。取2~3代细胞进行实验。采用有限稀释法克隆化培养分离牙周膜干细胞,鉴定方法同前期实验[9]。
1.4 MTT 法检测细胞生长曲线将多克隆来源的P2代PDLSC制成单细胞悬液,反复吹打使细胞充分分散,以5×103/mL 的密度接种于96 孔板中,每组设4 个副孔,每孔加180 μL含10% 胎牛血清的α-MEM 培养液,每隔3 d换液1次。每孔加入5 mg/mL的MTT溶液20 μL,在5% CO2培养箱中孵育4 h 后,吸除培养液,加入150 μL 二甲基亚砜,震荡10 min 后,在波长490 nm 时,用酶联免疫检测仪检测吸光(A)值。本实验进行3次重复。
1.5 成骨诱导实验将多克隆来源的P3 代PDLSC制成单细胞悬液,以5×104/mL的密度接种于6 孔板中,以含10%胎牛血清的α-MEM培养基培养24 h后,待细胞伸展至60%~70%汇合后换成骨诱导液(含l0 mmol/L β-甘油磷酸钠,50 μg/mL维生素C, 1×10-8 mol/L 地塞米松、10% FBS的α-MEM培养液)连续培养,每隔3 d换液1次,镜下观察细胞复层生长并出现圆形结节,继续培养至21 d。镜下观测到细胞聚集并出现钙化结节时,弃矿化诱导液,PBS冲洗3遍,4%多聚甲醛固定30 min,茜素红染色。PBS 冲洗3次后,在倒置相差显微镜下进行常规观察及照相。
1.6 成脂诱导实验将多克隆来源的P3代PDLSC制成单细胞悬液,以5×104个/mL的密度接种于6孔板中,以含10%胎牛血清的α-MEM培养基培养24 h后,待细胞伸展至85%左右汇合时换成脂诱导液(含1 μmol/L DEC, 0.5 mmol/L IBMX, 10 rng/L BPE, 100 mmo1/L Indomethacin, 10% FBS的α-MEM培养液)连续培养,每隔3 d换液1次,诱导14 d。4%多聚甲醛固定30 min,油红O染色。PBS 冲洗3次后,在倒置相差显微镜下进行常规观察及照相。
1.7 SA-βG染色将多克隆来源的P2代PDLSC制成单细胞悬液,以5×104/mL的密度接种于6孔板中,以含10%胎牛血清的α-MEM培养基培养至细胞融合达50%。衰老β-半乳糖苷酶染色试剂盒(碧云天)中的β-半乳糖苷酶固定剂固定10 min,PBS洗涤3次(每次3 min)后,用新鲜制备的β-半乳糖苷酶的染色工作液对细胞进行染色,37 ℃放置12 h后随机选择10个微观领域的阳性染色细胞计数。
1.8 碱性磷酸酶(ALP)活性分析将多克隆来源的P3代PDLSC制成单细胞悬液,以2.5×104/mL的密度接种于12孔板中,每组设4个副孔,以含10%胎牛血清的α-MEM培养基培养24 h后,待细胞伸展至60%~70%汇合后换成骨诱导液(含l0 mmol/L β-甘油磷酸钠,50 μg/mL维生素C, 1 ×10-8 mol/L地塞米松、10% FBS 的α-MEM培养液)每隔3 d换液1次,连续培养7 d,4%多聚甲醛固定后,用碱性磷酸酶显色试剂盒检测ALP活性(碧云天)。实验进行了3次重复。
1.9 Western blotting检测细胞中的蛋白表达采用细胞裂解液试剂盒分别提取A、B两组对照组及成骨诱导7 d的PDLSC总蛋白,测定蛋白样本浓度后制备蛋白样品。分别配置10%的分离胶、6%的浓缩胶以及l×SDS电泳液,根据蛋白定量的结果进行蛋白上样,电压调至80 V,电泳20 min ,待溴酚蓝进入分离胶后电压调至120 V,电泳60 min。随后在转移电泳槽(200 mA,2 h)中将凝胶中的蛋白转至聚偏氟乙烯(Polyvinyl fluoride, PVDF)膜。随后用TBST配制的含有5%脱脂奶粉的封闭缓冲液将PVDF 膜封闭2 h,PVDF 膜封闭一抗OCN(1∶1000稀释)、ALP(1∶1000稀释),以β-actin(1∶1000稀释)为内参,4 ℃过夜。次日将封有一抗的PVDF膜取出,复温lh 后TBST洗膜,每次5 min,共计3次。按说明书分别加入相应浓度的羊抗兔二抗(1∶800稀释),在室温条件下封闭2 h。用TBST洗脱二抗,每次10 min,共计3次。漂洗PVDF膜后加入电化学发光底物发光显色试剂盒显色,蛋白凝胶成像系统照相观察。采用Image J对WB检测A、B组PDLSC成骨分化过程中成骨蛋白OCN及ALP水平灰度分析。
1.10 统计学分析采用SPSS 16.0统计软件进行相关数据分析,计量数据以均数±标准差表示,两独立样本均数比较采用t检验,检验水准α=0.05,P值进行Bonferroni校正。
2 结果 2.1 牙周膜干细胞的分离培养实验采用酶解组织块法培养原代细胞,在倒置显微镜下观察,1周左右PDLSC可以游离出组织块。但是两组原代细胞汇合成片时间不同,与A组相比,B组汇合成片的时间更长。细胞形态多为长梭形,A组细胞比B组PDLSC的纺锤体形态更明显,有文献报道年轻供体的骨髓间充质干细胞比高龄供体的纺锤体形态更明显[10-11],本实验与其结果相符(图 1)。

|
图 1 A、B组PDLSC细胞形态 Figure 1 Cell morphology of PDLSCs in culture (Original magnification: × 10). A: Primary PDLSCs in group A; B: First passage of PDLSCs in group A; C: Primary PDLSCs in group B; D: First passage of PDLSCs in group B. |
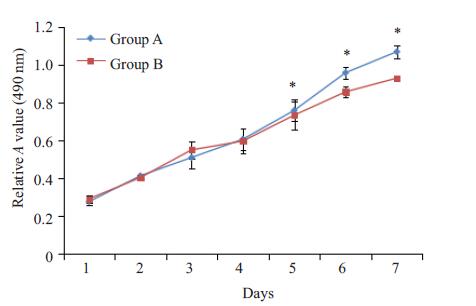
α-MEM培养基培养PDLSC一周后,MTT 法检测PDLSC增殖曲线,结果显示A、B 2个实验组均表现出较强的增殖能力,但相比A组,B组细胞增殖较缓慢,从第5天开始,2个实验组出现显著的统计学差异(图 2)。
|
图 2 A、B组PDLSC生长曲线 Figure 2 Growth curve of PDLSCs in group Aand group B.*P<0.05 vs Group B. |
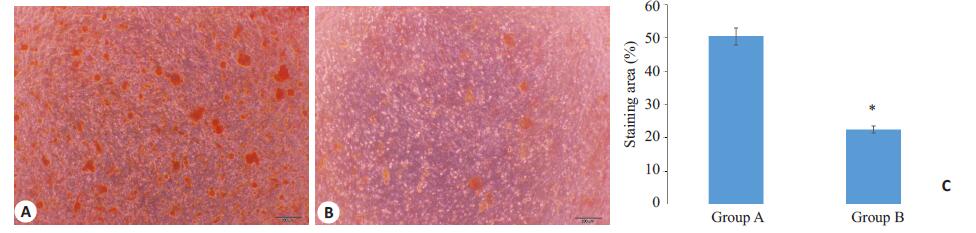
成骨诱导条件下2 个实验组均表现出显著的成骨分化潜力,诱导3 周时孔板底部均出现肉眼可见的矿化结节,并逐渐增大。茜素红染色后2 组细胞均可见明显的红色矿化结节,但A组矿化结节的数量和总面积均多于B组,显示成骨分化能力随年龄增加而降低(图 3)。
|
图 3 A、B组PDLSC成骨诱导21 d茜素红染色 Figure 3 Alizarin red staining of PDLSCs in groups Aand B after 21 days of osteogenic induction (Scale bar: 200 μm). A: PDLSCs in group A; B: PDLSCs in group B; C: Quantitative analysis of mineralized nodules in the PDLSCs in the two groups (*P<0.05 vs Group A). |
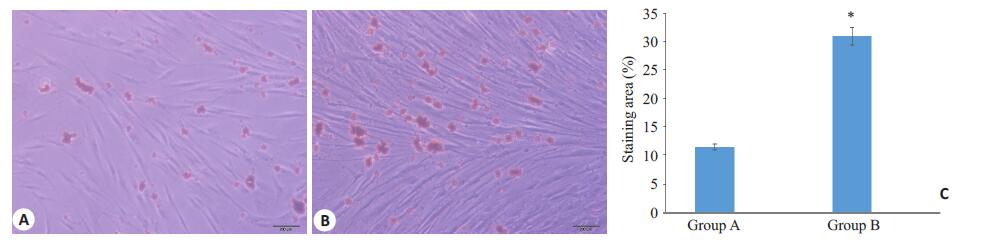
成脂诱导条件下2个实验组均表现出显著的成脂分化潜力,诱导过程中逐渐可见细胞形态发生改变,较培养初期更为饱满,诱导2周时油红O染色后可见两组PDLSC胞浆内均有大量脂滴形成,但A组脂滴数量和总面积均少于B组,显示成脂分化能力随年龄增加而增强(图 4)。
|
图 4 A、B组PDLSC成脂诱导14 d油红O染色 Figure 4 PDLSCs in group A and B after 14 days of adipogenic induction (oil red O staining, scale bar: 200 μm). A: PDLSCs in group A; B: PDLSCs in group B; C: Quantitative analysis of lipid droplets in PDLSCs in the two groups (*P<0.05 vs Group A). |
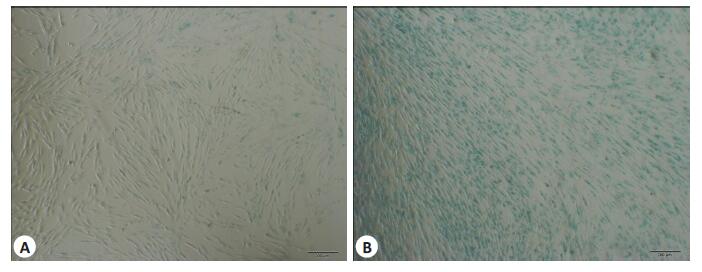
含10%胎牛血清的α-MEM培养基培养至PDLSC融合达50%后进行染色。2个实验组均可见PDLSC被染色,浅绿色为阳性,可将其视为细胞在体内的年龄相关的标志,A组只有极少数细胞染色阳性,B组细胞染色阳性数目较多,阳性率高于A组(图 5)。
|
图 5 A、B组PDLSC体外SA-βG衰老检测 Figure 5 Senescence-associated β-galactosidase (SA-βG) staining (blue) of the PDLSCs in groups A and B (Scale bar: 200 μm). |
成骨诱导1 周后2 个实验组均表现出成骨分化能力,碱性磷酸酶(ALP))染色后2 组细胞均可见染色明显,但肉眼与镜下均显示A组染色的PDLSC 数量和总面积均多于B组,ALP活性显示随年龄增加而降低(图 6)。

|
图 6 PDLSC成骨诱导7 d后ALP染色结果 Figure 6 Alkaline phosphatase (ALP) activity in PDLSCs in groups A and B after a 7-day induction for osteogenic differentiation. A: PDLSCs in group A; B: PDLSCs in group B; C: Analysis of ALP activity (*P<0.05 vs Group A). a1, b1: Macroscopic observation; a2, b2: Microscopy observation (×10). |
在常规培养7 d后,A、B两组PDLSC中OCN以及ALP的表达水平A组高于B组,显示出年龄相关的下降,而成骨诱导培养7 d后二者的表达量均显著增高,且A组明显高于B组,显示出年龄相关的显著下降(图 7)。
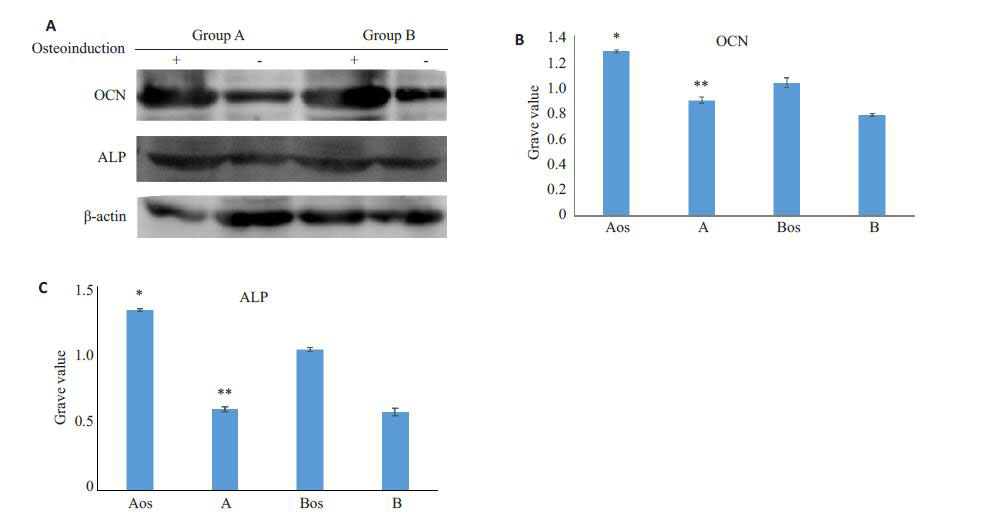
|
图 7 两组PDLSC 成骨诱导7 d 后Westernblotting 检测OCN、ALP及其水平灰度分析 Figure 7 OCN and ALP expressions detected by Western blotting in PDLSCs in groups A and B after 7 days of osteogenic induction. A: Western blotting for OCN and ALP expressions in induced (+ ) and control (-) PDLSCs; B, C: Quantitative analysis of OCN and ALP in induced (Aos and Bos) and control (A, B) PDLSCs. *P<0.05 vs group Aos, **P<0.05 vs group B. |
衰老是指机体各器官在功能上普遍的,逐渐降低的过程,是自然界生命过程的必然规律。干细胞在机体中处于一种平衡状态,但是随年龄的增长,干细胞的功能受到一定影响,其平衡遭到破坏。机体衰老过程中,间充质干细胞的自我调节机制发生改变,从而使其某些生物学性状不再稳定,主要表现为自身抵抗力的降低及其对外界环境刺激的反应能力的降低,从而诱发疾病的易感性,最终引起死亡[12-15]。
牙周炎是一种感染性和炎症性口腔疾病,导致牙周组织破坏,是牙齿脱落的主要原因。有研究表明衰老过程中牙龈局部组织的抗炎、抗感染能力和修复愈合能力均有所下降。此外,衰老被认为与牙周炎的严重程度和患病率增加密切相关,但潜在的机制仍基本未知[16]。牙周再生治疗的目的是恢复牙齿生理功能,重建包括牙槽骨、牙周膜和牙骨质在内的牙周组织。随着年龄增长,牙周膜组织的再生能力有所下降,其再生能力取决于少量在牙周膜中保持增殖和分化潜力的祖细胞。事实表明,牙周膜祖/干细胞可分化成为多种细胞,如成纤维细胞、成骨细胞和成牙骨质细胞等,从而决定了牙周膜细胞是再生功能性牙周组织的理想细胞[17],并在体内和体外实验中得到广泛证实[18-19]。此外,牙周膜干细胞易于获取,其获取不会对患者造成任何疼痛和不适,从患者拔除的离体牙中即可获得,不受道德及伦理的约束。因此本研究将牙周膜干细胞作为研究对象,我们收集了不同年龄患者的离体牙样本,并成功获取了不同年龄来源的牙周膜干细胞。
以往关于干细胞增殖分化能力的增龄性变化主要集中在大鼠及小鼠的骨髓间充质干细胞[8-9],关于人牙周膜干细胞研究的内容较少[10-11]。针对大鼠及小鼠骨髓间充质干细胞生物学特性的增龄性变化与我们的研究内容相似,与骨髓间充质干细胞相比,牙周膜干细胞与其组织来源不同,人牙周膜干细胞是来源于人体牙周膜组织的成体干细胞,具有更强的增殖能力,其克隆形成能力也高于骨髓间充质干细胞,用二者分别构建组织工程化膜片,显示与骨髓间充质干细胞相比,牙周膜干细胞的基质分泌量及其分布更为迅速、均匀,因而其膜片更致密,极性化也更明显[13]。将二者的干细胞膜片移植至裸鼠皮下后,牙周膜干细胞膜片中细胞数量增殖明显,而骨髓间充质干细胞数量逐渐下降[14]。此外,牙周膜干细胞来源于牙周膜组织,具有更强的分化为成牙骨质及牙槽骨的特点[6]。因而与骨髓间充质干细胞相比,无论是在牙周病患者缺失组织的修复再生还是在组织工程化牙周膜的构建过程中,牙周膜更具优势,对临床牙周疾病的治疗更具有指导意义。先前关于人牙周膜干细胞生物学特性的增龄性变化的研究内容中[10-11],其年龄范围分布较广,年龄段之间差异较小,而本研究中,关于年龄的分组较为集中,因而对不同年龄段的生物学特性研究也更为准确。体外培养条件下可检测到衰老细胞的SA-β-gal的活性,本研究中我们通过β-半乳糖苷酶染色对两组细胞的衰老程度进行了鉴定,与来自年轻人的牙齿相比,增龄组分离的细胞革兰氏阳性细胞的百分比更高,表明该标记与年龄相关[22-23],进一步确定了两组细胞年龄阶段的差异。此外,先前关于其增龄性变化的研究大多数集中在基因层面,关于人牙周膜干细胞基因层面的研究多在于对干细胞标志物Oct-4表达水平的测定,显示出年龄相关的下降[11],而关于成骨分化能力方面大多进行基因层次检测,未进行相关蛋白检测,我们通过Western blotting从蛋白水平对成骨相关蛋白OCN和ALP进行检测,从而检测年龄因素对牙周膜干细胞成骨分化能力的影响。此外,基因只能显示转录水平,其行使功能主要为蛋白发生功能,而蛋白检查更为稳定。
衰老标记的骨髓间充质干细胞在形态变化上经常显示放大的,扁平的形态。先前也有研究指出,年轻供体的骨髓间充质干细胞比高龄供体的纺锤体形态更明显[10-11, 20]。本实验中A组细胞比B组PDLSC的纺锤体形态更明显,干细胞治疗是组织工程和再生医学领域的热点,通过生物活性因子、干细胞疗法等新的生物学方法进行牙周组织再生已被广泛关注。牙周组织结构复杂,利用自体干细胞进行牙周治疗是时下的研究热点,但基本上所有相关的新疗法仍在试验过程中[23]。体内老化会损害牙周组织愈合过程[24],我们的研究结果证实增龄因素对PDLSC增殖、分化能力造成明显影响。对年轻供体与老年供体来源的牙周膜组织进行分离培养,体外有限稀释法单克隆培养均出现细胞克隆,二者均表现出自我更新能力,显示不同年龄的供体中均能分离出PDLSC。PDLSC的增殖曲线一般为倒S型,本研究中通过MTT法对其增殖能力进行检测,发现前四天两个实验组的增殖能力无明显差异,从第5天开始,年轻组来源的牙周膜干细胞增殖能力明显开始高于年老组,二者的增殖能力差异有统计学意义,与本小组前期的研究结果一致[9],此外,有学者通过细胞周期来检测牙周膜干细胞的增殖能力,发现4 d后其增殖能力出现差异,本文结果与其相符[25]。显示牙周膜干细胞增殖能力随年龄增加而降低,这意味着其再生能力也可能随着年龄的增长而减弱。除了供体年龄对牙周膜干细胞增殖能力的影响外,我们研究了其对牙周膜干细胞成骨及成脂分化能力的影响。对牙周膜干细胞进行成骨诱导后我们通过茜素红染色及ALP染色法对其成骨分化能力进行检测,此外我们还通过Western blotting 对成骨相关蛋白OCN及ALP进行了检测,以上结果均证实随着年龄的增长,PDLSC成骨分化能力下降;成脂诱导后通过油红O对其进行染色,发现脂质空泡的面积与数量均随着年龄增加而增多,提示成脂分化能力随年龄增加而增强。这意味着随着年龄增长,干细胞性能伴有一定程度的损伤与丢失,同时也提示增龄会导致成骨细胞的活性下降,体内牙骨质与相关牙周组织的形成能力均有所降低,这也从另一方面解释了为何老年患者牙周病治疗效果欠佳,并且年龄相关的成骨分化能力下降可能对年老牙周膜干细胞未来在干细胞治疗和牙周组织工程中的应用有一定不利的影响, 影响其多能性在组织工程应用中的发挥。此外,大量实验表明,微环境能够影响间充质干细胞的生物学功能[26-27],研究表明[25],可以通过调节细胞培养的外在微环境而改善再生能力受损的老年牙周膜干细胞的部分功能。将来源于年轻供体PDLSC的条件培养液作用于年老供体的PDLSC后,能够恢复年老PDLSC在体内形成牙周组织结构的能力,而老年供体PDLSC的条件培养基则抑制年轻供体PDLSC的再生能力[25]。这一结果不仅表明年龄因素可对PDLSC生物学特性产生不同的影响,而且证实利用微环境模拟年轻供体的条件能够重新给予年老PDLSC组织再生的能力,对防治与年龄因素相关的牙周病或牙周缺损的再生治疗有重大意义。此外,以上结果也提示我们,在临床转化医学研究中,如果作为牙周组织工程的种子细胞,利用自体PDLSC治疗牙周疾病,研究初期应该尽量避免纳入老年患者,应从年轻患者中获取以确保干细胞的良好生物学特性。
增龄过程中牙周膜干细胞数量减少,增殖、分化能力下降。从理论上说,两个方面的老化可能会影响以干细胞为基础的组织再生。作为内在的(遗传和表观遗传)的变化,如干细胞群数量的变化,质量变化(分化/再生能力)对其有一定的影响,而改变干细胞的生物学活性的微环境(例如生长因子和激素)的变化发挥同样重要的作用。牙周膜干细胞参与牙槽骨的骨改建过程,在其成骨与破骨过程中均可发挥作用[12],后续关于年龄对其成骨及破骨分化能力的研究并确定其机制具有重要意义,因为这一过程的逆转可以延缓增龄的影响,并促进再生。
| [1] | Zuba-Surma EK, Kucia M, Ratajczak J, et al. "Small stem cells" in adult tissues: very small embryonic-like stem cells stand up[J]. Cytometry A, 2009, 75 (1): 4-13. |
| [2] | Salvi G, Lawrence HP, Offenbacher S, et a1. Influence of risk factors on the pathogenesis of periodontitis[J]. Periodontol 2000, 1997, 14 (1): 173-201. DOI: 10.1111/prd.1997.14.issue-1. |
| [3] | Chong LY, Chien LY, Chung MC, et al. Controlling the proliferation and differentiation stages to initiate periodontal regeneration[J]. Connect Tissue Res, 2013, 54 (2): 101-7. DOI: 10.3109/03008207.2012.751985. |
| [4] | Chen FM, Sun HH, Lu H, et al. Stem cell-delivery therapeutics for periodontal tissue regeneration[J]. Biomaterials, 2012, 33 (27): 6320-44. DOI: 10.1016/j.biomaterials.2012.05.048. |
| [5] | Cuenca-López MD, Zamora-Navas P, García-Herrera JM, et al. Adult stem cells applied to tissue engineering and regenerative medicine[J]. Cell Mol Biol (Noisy-le-grand), 2008, 54 (1): 40-51. |
| [6] | Seo BM, Miura M, Gronthos S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet, 2004, 364 (9429): 149-55. DOI: 10.1016/S0140-6736(04)16627-0. |
| [7] | Jäger A, Götz W, Lossdörfer S, et al. Localization of SOST/ sclerostin in cementocytes in vivo and in mineralizing periodontal ligament cells in vitro[J]. J Periodontal Res, 2010, 45 (2): 246-54. DOI: 10.1111/jre.2010.45.issue-2. |
| [8] | Feng F, Akiyama K, Liu Y, et al. Utility of PDL progenitors for in vivo tissue regeneration: a report of 3 cases[J]. Oral Dis, 2010, 16 (1): 20-8. DOI: 10.1111/odi.2009.16.issue-1. |
| [9] | Liu N, Shi S, Deng M, et al. High levels of beta-catenin signaling reduce osteogenic differentiation of stem cells in inflammatory microenvironments through inhibition of the noncanonical Wnt pathway[J]. J Bone Miner Res, 2011, 26 (9): 2082-95. DOI: 10.1002/jbmr.440. |
| [10] | Bonab M, Alimoghaddam K, Talebian F, et al. Aging of mesenchymal stem cell in vitro[J]. BMC Cell Biol, 2006, 7 : 14. DOI: 10.1186/1471-2121-7-14. |
| [11] | Baxter MA, Wynn RF, Jowitt SN, et al. Study of telomere length reveals rapid aging of human marrow stromal cells following in vitro expansion[J]. Stem Cells, 2004, 22 (5): 675-82. DOI: 10.1634/stemcells.22-5-675. |
| [12] | Zhang J, An Y, Gao LN, et al. The effect of aging on the pluripotential capacity and regenerative potential of human periodontal ligament stem cells[J]. Biomaterials, 2012, 33 (29): 6974-86. DOI: 10.1016/j.biomaterials.2012.06.032. |
| [13] | Sheydina A, Riordon DR, Boheler KR. Molecular mechanisms of cardiomyocyte aging[J]. Clin Sci ( Lond), 2011, 121 (8): 315-29. DOI: 10.1042/CS20110115. |
| [14] | Kolb B, Gibb R. Brain plasticity and behaviour in the developing brain[J]. J Can Acad Child Adolesc Psychiatry, 2011, 20 (4): 265-76. |
| [15] | Kosar M, Bartkova J, Hubackova S, et al. Senescence-associated heterochromatin foci are dispensable for cellular senescence, occur in a cell type and insult-dependent manner and follow expression of p16( ink4a)[J]. Cell Cycle, 2011, 10 (3): 457-68. DOI: 10.4161/cc.10.3.14707. |
| [16] | Hajishengallis G. Aging and its impact on innate immunity and inflammation: implications for periodontitis[J]. J Oral Biosci, 2014, 56 (1): 30-7. DOI: 10.1016/j.job.2013.09.001. |
| [17] | Yu N, Prodanov Y, te Riet J, et al. Regulation of periodontal ligament cell behavior by cyclic mechanical loading and substrate nanotexture[J]. J Periodontol, 2013, 84 (10): 1504-13. DOI: 10.1902/jop.2012.120513. |
| [18] | Roguljic H, Matthews BG, Yang W, et al. In vivo identification of periodontal progenitor cells[J]. J Dent Res, 2013, 92 (8): 709-15. DOI: 10.1177/0022034513493434. |
| [19] | Gombold J, Karakasidis S, Niksa P, et al. Systematic evaluation of in vitro and in vivo adventitious virus assays for the detection of viral contamination of cell banks and biological products[J]. Vaccine, 2014, 32 (24): 2916-26. DOI: 10.1016/j.vaccine.2014.02.021. |
| [20] | Wu RX, Bi CS, Yu Y, et al. Age-related decline in the matrix contents and functional properties of human periodontal ligament stem cell sheets[J]. Acta Biomater, 2015, 22 : 70-82. DOI: 10.1016/j.actbio.2015.04.024. |
| [21] | Fehrer C, Lepperdinger G. Mesenchymal stem cell aging[J]. Exp Gerontol, 2005, 40 (12): 926-30. DOI: 10.1016/j.exger.2005.07.006. |
| [22] | Sethe S, Scutt A, Stolzing A. Aging of mesenchymal stem cells[J]. Ageing Res Rev, 2006, 5 (1): 91-116. DOI: 10.1016/j.arr.2005.10.001. |
| [23] | Monsarrat P, Vergnes JN, Nabet C, et al. Concise review: mesenchymal stromal cells used for periodontal regeneration: a systematic review[J]. Stem Cells Transl Med, 2014, 3 (6): 768-74. DOI: 10.5966/sctm.2013-0183. |
| [24] | Benatti BB, Neto JB, Casati MZ, et al. Periodontal healing may be affected by aging: a histologic study in rats[J]. J Periodontal Res, 2006, 41 (4): 329-33. DOI: 10.1111/jre.2006.41.issue-4. |
| [25] | Zheng W, Wang S, Ma D, et al. Loss of proliferation and differentiation capacity of aged human periodontal ligament stem cells and rejuvenation by exposure to the young extrinsic environment[J]. Tissue Eng Part A, 2009, 15 (9): 2363-71. DOI: 10.1089/ten.tea.2008.0562. |
| [26] | Lee J, Abdeen AA, Kilian KA. Rewiring mesenchymal stem cell lineage specification by switching the biophysical microenvironment[J]. Sci Rep, 2014, 4 : 5188. |
| [27] | Huang YC, Leung VY, Lu WW, et al. The effects of microenvironment in mesenchymal stem cell-based regeneration of intervertebral disc[J]. Spine J, 2013, 13 (3): 352-62. DOI: 10.1016/j.spinee.2012.12.005. |
 2017, Vol. 37
2017, Vol. 37

