2. 香港大学公 共卫生学院
2. School of Public Health The University of Hong Kong
近年来,肺癌在全世界发病率均迅速上升,在2012年全球肿瘤统计中,其肺癌新发病例达182 万,占所有肿瘤病例的12.9%;其中因肺癌死亡的病例达到159万,占全部肿瘤死亡病例的19.4%[1] 。同样,肺癌也是我国发病率及死亡率最高的恶性肿瘤,2015 年肺癌新发病例及死亡病例分别是73 万和61万[2] 。
云南宣威地区系肺癌高发地区,室内燃煤污染为云南宣威肺癌的致癌主要原因,李继华等通过对宣威地区室内燃煤排放物中的多环芳烃类化合物与宣威肺癌发病关系的研究,发现两者存在明显的因果关系,并且室内烟煤污染致使患肺癌风险升高7.7 倍[3] 。
在肺癌的研究中,吸烟一度被认为是决定因素,但是全球的肺癌数据提示25%肺癌患者与吸烟因素无关(男性:15%,女性53%)[4-5] 。宣威地区肺腺癌远高于鳞癌发病率,较为符合非吸烟肺癌研究,是单一影响因素研究比较理想的肺癌模型,宣威肺癌有明显的区域聚集性等流行病学特征,可能存在特别的肺癌形成机制[6-7] 。
目前研究发现许多微小RNA都与肺癌相关,微小RNA(microRNA),是内源性基因编码的非编码RNA,长度仅22-24nt,主要通过对靶mRNA干扰,调控下游信号通路,实现对肺癌细胞的增殖、凋亡、侵袭以及转移等生物学功能的影响,在肺癌形成及发展中发挥着非常重要作用[8-12] 。在课题组前期研究工作中[13] ,对宣威地区肺癌2组标本(腺癌,鳞癌)进行microRNA芯片检测,发现在腺癌中miR-501-5P 表达与鳞癌比较呈上调(>2倍)。进行real-time-PCR对20例宣威地区的非吸烟女性肺癌癌标本进行验证发现:微小RNA 501-5p(miR-501-5p)出现稳定高表达(P<0.05)。随后在对Bease-2B细胞使用烟尘分离出的二氧化硅刺激后,也发现miR-501-5p 在Bease-2B细胞出现上调。结合课题组前期研究结果:宣威肺癌的发生与当地燃煤(含较高的纳米二氧化硅)普遍使用有着重要联系,并miR-501-5P 的体外细胞实验,芯片结果及肺癌组织qPCR检测结果,提示miR-501-5p可能与宣威地区肺腺癌的发生发展相关。
但是对于miR-501-5P是否仅在宣威地区非吸烟女性肺癌患者中呈高表达,与宣威肺癌患者临床之间是否存在必然联系,这些问题目前还不清楚。因而,本研究将通过对24 例宣威地区肺腺癌配对标本进行microRNA芯片检测,并进行QPCR检测其miR-501-5P的表达情况,分析miR-501-5p与年龄、性别、肺癌分期及术前血清CEA的关系,为miR-501-5P作为宣威地区肺腺癌临床诊断、治疗和预后的生物学标志物的研究提供实验依据。
1 对象和方法 1.1 研究对象24例手术标本均来自本院胸心外科(2014 年3 月~2014 年8 月)。所有标本均符合:无吸烟史,3代内居住在宣威地区肺腺癌高发区域,无其他恶性肿瘤病史,均为第1次诊断及治疗,无放化疗治疗史,具体临床病理资料,病理确诊。标本切取原则:瘤体的中央区域和正常肺组织(距离瘤体边界>5 cm),无炎症等病理学表现。所有的手术标本在切除后,均剪切为小于5 mm的颗粒状,存放于RNA-later液冻存管中,置液氮罐临时存储,后转入置-80 ℃冰箱。CEA值均来自于云南省肿瘤医院检验科的术前静脉血临床检测(CLIA法)。患者肺癌分期均根据术中所见实体肿瘤大小及术后淋巴结病检转移情况,按照人卫版内科学第8版分期标准进行。所有患者均以签署知情同意书。本实验流程得到伦理委员会批准。
1.2 方法(1)总RNA提取及质控:研磨及匀浆:在液氮中研磨组织。使用设备:BioPμLverizer,mini Bead beater-16,Bioruptor,Branson Digital Sonifier。
RNA提取:使用TRIzol® Reagent (Invitrogen lifetechnologies) 提取总RNA。
质量控制:使用Nanodrop,Agilent 2100评估RNA的浓度及纯度。存-80 ℃冰箱备用。
(2)microRNAs芯片检测:芯片标记:进行Hy3TM,Hy5TM 荧光标签标记,miRCURYTM Array PowerLabeling kit(Cat #208032-A, Exiqon)。
芯片杂交:在Agilent Hybridization Oven,MAUIHybridization System 使用(2 × Hybridization buffer,Phalanx Hyb. Assembly)进行杂交。简要过程:95 ℃孵育2 min,孵育过程需避光;孵育后冰上放置2 min,置95 ℃热水加温,50 ℃风干,置95 ℃热水再次加温,短时56 ℃烘干箱并置于摇床上,2 r/min过夜。
microRNAs芯片检测和分析:使用miRCURYTMArray, Wash buffer kit(Cat #208021, Exiqon)洗片,使用Axon GenePix 4000B 进行数据采集,使用软件GenePix pro V6.0进行数据分析。
(3)qPCR验证:①宣威肺癌样本的micro RNA提取:对24 个样本进行microRNA 提取,按照miRcutemiRNA Isolation Kit(DP501)说明书提取miRNA(20~200nt),抽提的microRNA A260/A280均在1.8-2.1之间,说明microRNA纯度较好,可用于反转录反应(cDNA合成);②反转录及加尾成cDNA:根据紫外分光光度仪测定microRNA的浓度,进行cDNA第一链合成及加尾,采用天根试剂盒miRcute miRNA First-StrandcDNASynthesis Kit(KR201),第1 步:miRNA 3' 末端进行加Poly(A)处理。Total RNA 1.0 μg根据浓度计算加入的体积(μL),10×Poly(A)Polymerase Buffer 2 μL,E.coli Poly(A)Polymerase(5 U/μL)0.4 μL,5xrATPSolution 4 μL,RNase-Free ddH2O补水至20 μL。冰上配制并短暂离心后,进行37 ℃反应60 min。第2步:对Poly(A)修饰的miRNA进行逆转录反应,Poly(A)反应液2 μL,10 × RT Buffer 2 μL,10 × RT Primer 2 μL,RNasin(40 U/μL)1 μL,Quant RTase 0.5 μL,Super PuredNTPs(2.5 mmol/L each)1 μL,RNase-Free ddH2O11.5 μL,冰上操作,短暂离心后在37 ℃反应60 min。将其置于-20 ℃保存;③miRNA 501-5P在宣威肺癌标本表达的Q-PCR 验证:我们对24 对宣威肺癌标本进行Q-PCR验证,miRNA 501-5P引物为天根公司提供,其序列:3'-AUCCUUUGUCCCUGGGUGAGA-5',以U6SnRNA 作为内部参照。验证使用试剂盒为天根miRcute miRNA Qpcr detection kit(SYBR Green)(FP401)。本实验使用ABI(7500)荧光定量PCR仪,20 μL体系,加入合成cDNA 2 μL,2xmiRctue miRNAPremix(含SYBR,含ROX)10 μL,miRNA 501-5P 引物(10 μmol/L)0.4 μL,Reverse Primer(10 μmol/L)0.4 μL,50Xrox Reference Dye 1.6 μL,ddhH2O 5.6 μL。冰上操作,在96 孔PCR板进行离心后上机,反应条件:94 ℃20 s,60 ℃ 30 s,40 次循环。qPCR所得Ct 值,均以U6SnRNA作为内参,使用相对定量方法统计。△△CT表示样本中miR-501-5P的反应次数减除内参U6后的值,用2-△△CT值表示miR-501-5p 表达倍数(肺癌组织 vs 正常组织)。
1.3 统计学分析用SPSS 19.0 统计软件,对进行miR-501-5P在宣威肺腺癌组织与正常肺组织表达水平统计学分析及上/下调倍数分析,并对miR-501-5p与临床特征因素进行χ2检验及多重回归分析,P<0.05 为差异有统计学意义。
2 结果 2.1 RNA质量控制本实验采用Trizol 法提取组织总RNA。使用紫外分光光度(UV-Vis)测A 值并进行定量检测。A260/280 范围为1.8~2.0。进行1%琼脂糖电泳,抽提RNA均符合microRNAs芯片要求(图 1)。
|
图 1 总RNA琼脂糖电泳图 Figure 1 RNA Integrity and gDNA contamination test by denaturing agarose gel electrophoresis. |
芯片结果数据利用GenePix pro V6.0进行原始数据分析软件进行分析。发现与正常肺组织相比,miR-501-5p-5p呈明显上调(P<0.05),24例宣威肺腺癌microRNA芯片聚类分析(图 2)。
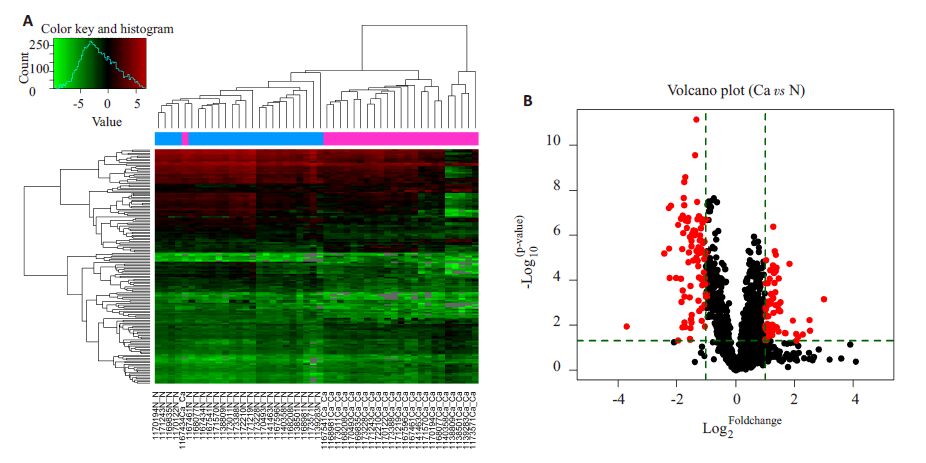
|
图 2 宣威地区肺腺癌差异microRNAs层次聚类分析 Figure 2 Heat map and hierarchical clustering (A) and volcano plot (B) of differential miRNA profiles in lung adenocarcinoma in Xuanwei area. A: The relative expression values are depicted according to the color scale. Red indicates up-regulation; green indicates down-regulation; B: Red dot represents a statistically significant difference in the expression of microRNAs (P<0.05). |
对miR-501-5p-5p进行24组标本芯片表达量的归一化后进行计量。使用log2转换样本芯片扫描信号值的方法使其归一化后计量miR-501-5p 的表达量(图 3)。正常组织和肺癌组织miR-501-5p 表达量的均数±标准差分别为0.454±0.323和1.439±2.004,两者差异具有显著统计学意义(t=-2.449,P<0.05)。
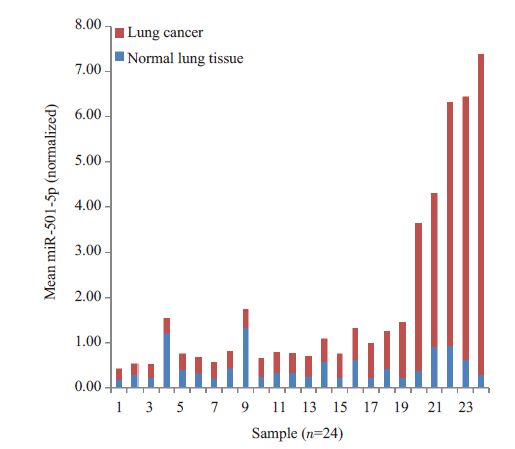
|
图 3 miR-501-5p 在癌组织和相应肺组织样本的表达量比较 Figure 3 Comparison of miR-501-5p expression between tumor and adjacent tissues. Data presented are fold changes vs normal tissue (mean 3.168 848; P=0.022 376, FDR: 0.071 395). |
qPCR结果:miR-501-5p在宣威肺癌中的ΔCt值为3.309±3.456,在正常肺组织中为5.085±2.828(ΔCt值表示miR-501-5p在组织中的相对表达量)。宣威肺癌中的miR-501-5p表达明显高于配对正常肺组织,有统计学意义(t=-4.419,P<0.01)。2-△△CT表示miR-501-5p 在肿瘤组织中表达量相对于正常组织的倍数,倍数>2的有16例,与芯片结果一致(图 4)。
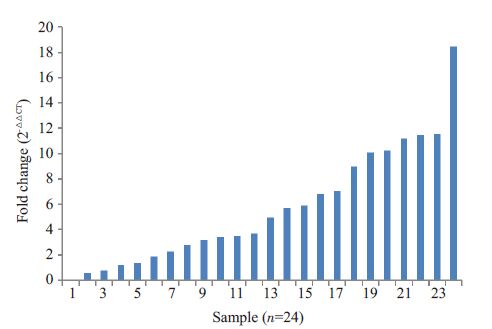
|
图 4 宣威肺癌中miR-501-5p表达倍数 Figure 4 Expression level of miR-501-5p in lung cancer tissues relative to normal tissue in Xuanwei area. The mean fold change was 5.702±4.626. |
使用miR-501-5p芯片数据归一值分别与性别,年龄,肺癌分期,分型及血清CEA进行方差分析(表 1)。
| 表 1 miR-501-5p与临床特征方差分析统计表 Table 1 Association of miR-501-5p expression with clinicopathological characteristics of the patients |
对miR-501-5p基因进行多重线性回归分析所得回归方程Y=0.022X1+1.125X2+0.022X3-0.578(X1代表年龄,X2代表CEA值,X3代表肿瘤分期)(F值10.835,P<0.05),回归方程成立。从偏回归系数的符号来看,年龄分组,CEA及肿瘤分期均为正,说明年龄越大,CEA值越高,肿瘤分期越高,miR-501-5p表达越高。
3 讨论mirRNAs大小为19-24个核苷酸、因为是不编码蛋白质的单链RNA,在早期被视为“噪音”,其作用是与靶mRNA的3'非翻译区(3'UTR)进行结合(完全或不完全),阻止靶mRNA的翻译和(或)直接破坏其稳定性,导致其功能丧失,最终影响细胞的生物学功能[14-15] 。microRNAs控制着几乎所有与细胞分化、增殖和细胞凋亡相关的生物学过程,并参与肿瘤发生等多种病理、生理过程[16-18] 。研究发现在人类肿瘤中有很多的microRNAs出现异常表达(上/下调),与促/抑癌密切相关,在肿瘤的病理进程中扮演重要角色[19] 。在肺癌的研究中也发现microRNA有促癌或者抑癌作用[20-22] 。
目前microRNA的研究方法较多使用microRNAs芯片检测,这一高通量检测技术使microRNA的研究更为快捷,准确。在本研究中,首先对24对宣威地区肺腺癌标本进行微阵列microRNAs芯片检测,在使用标准质量控制的基础上,对芯片数据分析和配对宣威肺癌配对样本QPCR验证得出:miR-501-5p 在宣威地区肺腺癌标本中呈明显上调(P<0.01)。miR-501-5P 序列:aauccuuugucccugggugaga。其前体miR-501发现及命名于2005 年[23] ,miR-501 的研究主要在乙型病毒性肝炎[24] ,而后我国学者发现汉族肝癌患者发现MiR-501呈明显高表达[25] 。
对于miR-501-5P 研究,在肺癌方面未见文献报道。但在对胃癌细胞株(SGC-7901/5-FU耐药细胞株, 亲本细胞株SGC-7901)进行microRNAs芯片检测,发现miR-501-5p呈2倍以上的上调表达[26] 。同样的结果出现在肝癌研究中,Huang等通过对已发表的微阵列的高通量数据(NCBI/ GEO/GSE36915)进行深度分析发现miR-501-5p 呈高表达[27] 。我们对miR-501-5P 表达量的检测与目前在肝癌和胃癌细胞系研究结果一致,miR-501-5p表达量均明显升高,说明miR-501-5P可能在恶性肿瘤中存在广泛的高表达,提示miR-501-5p可能在宣威肺癌发生发展中起重要作用。
随后,我们对miR-501-5p与患者年龄、性别,TNM分期、术前CEA值的临床特征进行统计分析,其结果发现miR-501-5p 的表达量与患者年龄TNM分期、术前CEA值均有统计学差异(P<0.05),我们进行多重线性回归分析,其结果显示:年龄、肿瘤分期及术前CEA值均对miR-501-5p表达量有显著影响,并且miR-501-5p表达量与CEA值、年龄与肺癌分期均呈正相关。任开明等[28] 通过对腺癌患者血清CEA与肿瘤分期的相关性分析,发现肺腺癌分期越高,其血清CEA越高;这个结果与在肾癌的研究也相近,miR-501-5P的表达量与肾癌患者预后关系密切,其表达量越高,预后越差[29] 。
对于miR-501-5P 对肿瘤生物学功能的影响,Huang等在肝癌的研究发现,通过上调miR-501-5p 直接抑制靶基因CYLD的表达,并导致其下游基因C-myc和Cyclin D1的表达量升高,从而增强肝癌细胞的增殖能力[27] 。miR-501-5p不仅在肝癌细胞进行过表达后可以直接影响其生物学功能;在肾癌的研究中也有相似的结果, 下调miR-501-5p后,可以明显出现P53通路的激活, 并抑制mTOR,诱导肾癌细胞出现凋亡[29] 。这些研究同时也印证了同一条microRNA可以在不同肿瘤中调节不同靶基因,作为致癌/抑癌基因影响着癌症的演化。并且在对肝癌与肾癌的体外实验研究中发现上/下调miR-501-5P后,明显影响肝癌细胞,肾癌细胞的生物学功能,出现增殖/凋亡的改变,提示miR-501-5P在肝癌, 肾癌中扮演致癌基因的角色,可能在宣威肺癌中也起着相同作用,为miR-501-5P在肺癌细胞系的研究提供了理论依据。
我们在进行相关性分析发现,miR-501-5p与患者性别并无统计学差异(P=0.073),表明miR-501-5P不仅在宣威地区非吸烟女性肺腺患者出现高表达,而且在宣威地区男性肺腺癌患者同样出现高表达;为后续研究miR-501-5p在宣威地区肺腺癌患者血液,痰液中表达量提供依据;同时也为深入研究miR-501-5p在宣威地区肺腺癌发生发展中的生物学作用机制及宣威地区肺腺癌临床诊断、治疗和预后的生物学标志物的筛选提供参考。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136 (5): E359-86. DOI: 10.1002/ijc.29210. |
| [2] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66 (2): 115-32. DOI: 10.3322/caac.21338. |
| [3] | 李继华, 何俊, 唐锐, 等. 宣威肺癌分子流行病学研究:煤种、基因型与肺癌风险[J]. 中国肺癌杂志, 2015, 18 (1): 16-22. |
| [4] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2): 69-90. DOI: 10.3322/caac.v61:2. |
| [5] | Parkin DM, Pisani P, Ferlay J. Global cancer statistics[J]. CA Cancer J Clin, 1999, 49 (1): 33-64. DOI: 10.3322/canjclin.49.1.33. |
| [6] | 赵敏, 周永春, 张锦平, 等. 云南省宣威地区1256例肺癌患者特征分析[J]. 现代预防医学, 2016, 43 (6): 1146-52. |
| [7] | 李继华. 滇东地区肺癌流行病学[J] . 第十六届中国科协年会——分3 环境污染及职业暴露与人类癌症学术研讨会论文集, 2014, 5. |
| [8] | Li S, Gao M, Li Z, et al. Role of microRNAs in the metastasis of non-small cell lung cancer[J]. Front Biosci (Landmark Ed), 2016, 21 : 998-1005. DOI: 10.2741/4436. |
| [9] | Wang G, Wang W, Gao W, et al. Two functional polymorphisms in microRNAs and lung cancer risk: a meta-analysis[J]. Tumour Biol, 2014, 35 (3): 2693-9. DOI: 10.1007/s13277-013-1355-1. |
| [10] | Joshi P, Middleton J, Jeon YJ, et al. MicroRNAs in lung cancer[J]. World J Methodol, 2014, 4 (2): 59-72. DOI: 10.5662/wjm.v4.i2.59. |
| [11] | Guz M, Riveromüller A, Okoń E, et al. MicroRNAs-Role in Lung Cancer[J]. Dis Markers, 2014, 2014 : 218169. |
| [12] | Kang SM, Lee HJ. MicroRNAs in human lung cancer[J]. Exp Biol Med, 2014, 239 (11): 1505-13. DOI: 10.1177/1535370214533887. |
| [13] | 李光剑. 燃煤中自然产出的二氧化硅与宣威地区农村女性肺癌的关系及致癌机制探索[D] . 昆明: 昆明医科大学, 2013. |
| [14] | Melo SA, Ropero S, Moutinho C, et al. A TARBP2 mutation in human cancer impairs microRNAs processing and DICER1 function[J]. Nat Genet, 2009, 41 (3): 365-70. DOI: 10.1038/ng.317. |
| [15] | Mohr AM, Mott JL. Overview of MicroRNA biology[J]. Semin Liver Dis, 2015, 35 (1): 3-11. DOI: 10.1055/s-00000069. |
| [16] | Iorio MV, Croce CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review[J]. EMBO Mol Med, 2012, 4 (3): 143-59. DOI: 10.1002/emmm.201100209. |
| [17] | Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136 (2): 215-33. DOI: 10.1016/j.cell.2009.01.002. |
| [18] | Pichler M, Calin GA. MicroRNAs in cancer: from developmental genes in worms to their clinical application in patients[J]. Br J Cancer, 2015, 113 (4): 569-73. DOI: 10.1038/bjc.2015.253. |
| [19] | Calin GA, Croce CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006, 6 (11): 857-66. DOI: 10.1038/nrc1997. |
| [20] | Othman N, Naqoor NH. The role of microRNAs in the regulation of apoptosis in lung cancer and its application in cancer treatment[J]. Biomed Res Int, 2014, 2014 : 318030. |
| [21] | Wang N, Liang H, Zhou Y, et al. miR-203 suppresses the proliferation and migration and promotes the apoptosis of lung cancer cells by targeting SRC[J]. PLoS One, 2014, 9 (8): e105570. DOI: 10.1371/journal.pone.0105570. |
| [22] | Chen DH, Sun YT, Yuan Y, et al. miR-100 induces Epithelial- Mesenchymal transition but suppresses tumorigenesis, migration and invasion[J]. PLoS Genet, 2014, 10 (2): 163-70. |
| [23] | Bentwich I, Avniel A, Karov Y, et al. Identification of hundreds of conserved and nonconserved human microRNAs[J]. Nat Genet, 2005, 37 (7): 766-70. DOI: 10.1038/ng1590. |
| [24] | Jin J, Tang SH, Xia L, et al. MicroRNA-501 promotes HBV replication by targeting HBXIP[J]. Biochem Biophys Res Commun, 2013, 430 (4): 1228-33. DOI: 10.1016/j.bbrc.2012.12.071. |
| [25] | Liu Y, Chai Y, Zhang J, et al. A function variant at miR-501 alters susceptibility to hepatocellular carcinoma in a Chinese Han population[J]. Cell Physiol Biochem, 2016, 38 (6): 2500-8. DOI: 10.1159/000445600. |
| [26] | 王燕. SGC-7901/5-FU人胃癌耐药细胞株的建立及基因芯片检测亲本和耐药细胞株的micro-RNA表达谱[D] . 上海: 复旦大学, 2012. |
| [27] | Huang DH, Wang GY, Zhang JW, et al. MiR-501-5p regulates CYLD expression and promotes cell proliferation in human hepatocellular carcinoma[J]. Jpn J Clin Oncol, 2015, 45 (8): 738-44. DOI: 10.1093/jjco/hyv063. |
| [28] | 任开明, 石文君. 血清CEA水平与肺腺癌TNM分期、治疗方法及生存率的相关性分析[J]. 山东医药, 2011, 51 (42): 73-4. |
| [29] | Mangolini A, Bonon A, Volinia S, et al. Differential expression of microRNA 501-5p affects the aggressiveness of clear cell renal carcinoma[J]. FEBS Open Bio, 2014, 4 : 952-65. DOI: 10.1016/j.fob.2014.10.016. |
 2017, Vol. 37
2017, Vol. 37

